2023-2024学年高中化学人教版2019选择性必修2课后习题第二章 分子结构与性质第一节 第一课时 共价键(含答案)
文档属性
| 名称 | 2023-2024学年高中化学人教版2019选择性必修2课后习题第二章 分子结构与性质第一节 第一课时 共价键(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 297.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 00:00:00 | ||
图片预览


文档简介
第二章 分子结构与性质
第一节 共价键
第一课时 共价键
必备知识基础练
1.下列关于共价键的说法正确的是( )
A.共价键只存在于共价化合物中
B.只含有共价键的物质一定是共价化合物
C.非金属元素的原子只能通过共价键形成共价分子
D.离子化合物中既可能含有极性键也可能含有非极性键
2.H2O分子中每个O原子结合2个H原子的根本原因是( )
A.共价键的方向性
B.共价键的键长
C.共价键的键角
D.共价键的饱和性
3.下列分子中,只有σ键没有π键的是( )
A.CH4 B.N2
C.CH2CH2 D.CH≡CH
4.关于乙醇分子的下列说法正确的是( )
A.一个分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.一个分子中含有1个π键
5.下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构相似,这是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
6.(2021·山东济宁高二检测)下列分子的结构式与共价键的饱和性不相符的是( )
A.H2O2(过氧化氢):H—OO—H
B.N2H4(肼):
C.C2H5SH(乙硫醇):
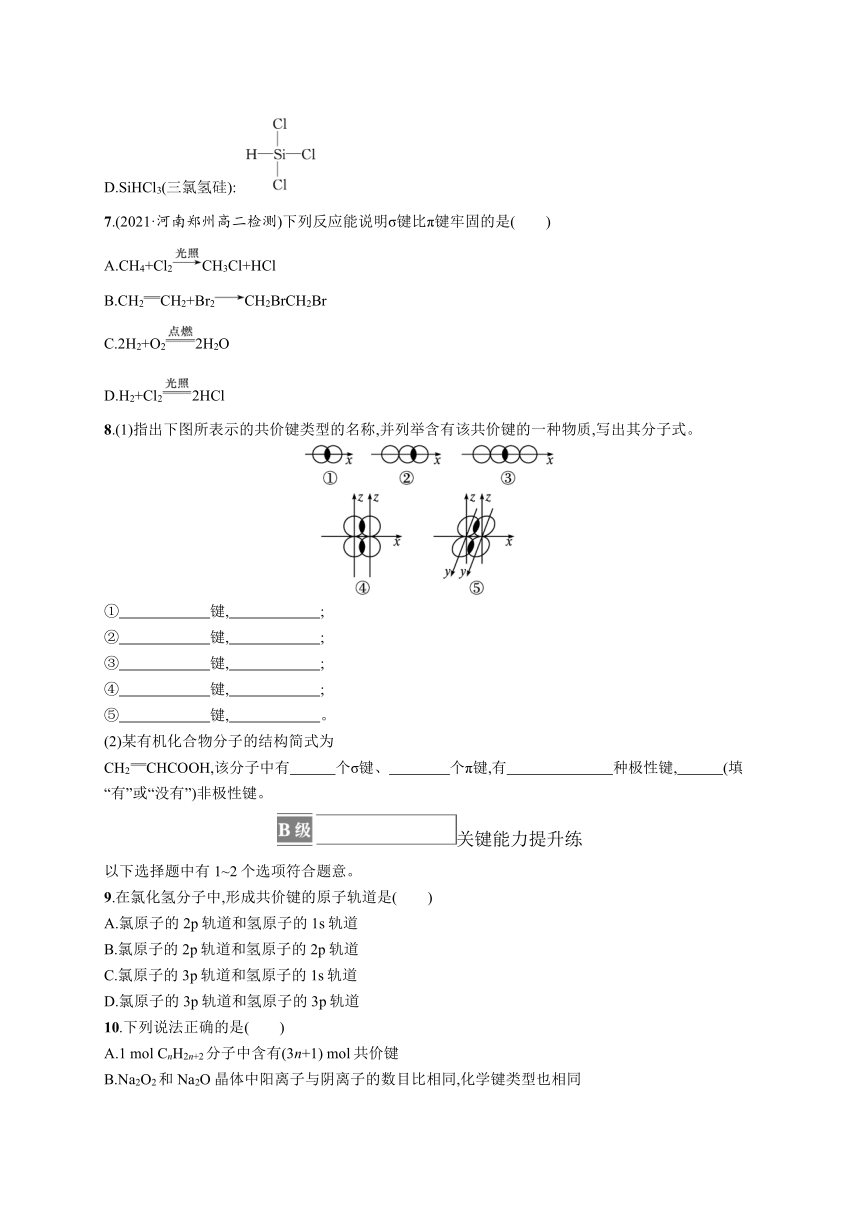
D.SiHCl3(三氯氢硅):
7.(2021·河南郑州高二检测)下列反应能说明σ键比π键牢固的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH2CH2+Br2CH2BrCH2Br
C.2H2+O22H2O
D.H2+Cl22HCl
8.(1)指出下图所表示的共价键类型的名称,并列举含有该共价键的一种物质,写出其分子式。
① 键, ;
② 键, ;
③ 键, ;
④ 键, ;
⑤ 键, 。
(2)某有机化合物分子的结构简式为
CH2CHCOOH,该分子中有 个σ键、 个π键,有 种极性键, (填“有”或“没有”)非极性键。
关键能力提升练
以下选择题中有1~2个选项符合题意。
9.在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
10.下列说法正确的是( )
A.1 mol CnH2n+2分子中含有(3n+1) mol共价键
B.Na2O2和Na2O晶体中阳离子与阴离子的数目比相同,化学键类型也相同
C.只含有非金属元素的化合物不一定只有共价键
D.电负性之差小于1.7的两种元素的原子间一定形成共价键
11.下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
12.(2021·天津高二检测)在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A.只有一个σ键
B.只有一个π键
C.一个σ键,一个π键
D.一个σ键,两个π键
13.分析下列化学式中画有横线的元素,选出符合要求的物质填空(填字母)。
A.NH3 B.H2O C.HCl D.CH4
E.C2H6 F.N2
(1)所有的价层电子都参与形成共价键的是 ;
(2)只有一个价层电子参与形成共价键的是 ;
(3)最外层有未参与成键的电子对的是 ;
(4)既有σ键又有π键的是 。
14.(1)判断1 mol下列含碳化合物中σ键的数目。
①CO2 ;
②乙醛 ;
③CH3COOH ;
④CO(NH2)2 。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为 。HCN分子中σ键与π键数目之比为 。
(3)C、H元素形成的某化合物分子中共有16个电子,该分子中σ键与π键的个数比为 。
学科素养拔高练
15.(2021·深圳高二检测)X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)Y2分子中存在的σ键和π键个数之比为 。
(2)元素X的一种氧化物XO和XY-与Y2结构相似,XO分子内σ键与π键个数之比为 。X、Y与氢元素形成的一种化合物HXY分子中σ键与π键数目之比为 。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式: 。
(4)W基态原子的价层电子排布式为 。
(5)元素X的一种单质是一种由单层X原子构成的平面结构新型材料,如图,1号X与相邻X形成σ键的个数为 。
参考答案
第二章 分子结构与性质
第一节 共价键
第一课时 共价键
1.D
2.D O原子最外层有6个电子,可得到2个电子形成8电子稳定结构;H原子最外层有1个电子,只能形成2电子稳定结构,则每个O原子结合2个H原子与共价键的饱和性有关。
3.A 4.C
5.C s轨道是球形对称,所以s-s σ键无方向性,其他所有的共价键都有方向性。共价键的饱和性决定组成分子的原子间的数量关系,共价键的方向性决定分子的空间结构。
6.A 由共价键的饱和性可知,C、Si均形成4个共价键,H形成1个共价键,N形成3个共价键,O、S均形成2个共价键,Cl形成1个共价键。A项中O原子间是双键,且每个氧原子与1个氢原子再形成1个单键,即每个氧原子形成3个共价键,与其饱和性不相符。
7.B 碳碳双键由一个σ键和一个π键组成,CH2CH2发生加成反应时π键断裂,说明σ键比π键牢固。
8.答案 (1)①s-s σ H2 ②s-p σ HCl ③p-p σ Cl2
④pz-pzπ N2 ⑤py-pyπ N2 (2)8 2 4 有
解析 (2)分子中有3个C—H σ键、2个C—C σ键、2个C—O σ键、1个O—H σ键;CC和CO中分别有1个π键;有C—H、CO、C—O、O—H 4种极性键;含有CC、C—C非极性键。
9.C 基态H原子和基态Cl原子的轨道表示式分别为和,由此可以看出,H原子的1s轨道和Cl原子的3p轨道上各有一个未成对电子,故两者在形成氯化氢分子时,形成共价键的原子轨道是氯原子的3p轨道和氢原子的1s轨道。
10.AC 烷烃分子中只有C—C和C—H,1个CnH2n+2分子中含有(n-1)个C—C和(2n+2)个C—H,A项正确;Na2O2和Na2O中Na+与、Na+与O2-数目比均为2∶1,但Na2O2中有非极性键而Na2O中无共价键,B项不正确;NH4Cl等铵盐中含有离子键,C项正确;电负性之差小于1.7的Na与H、K与H等均形成离子键,D项不正确。
11.D 共价键形成时,原子轨道首先以“头碰头”的方式重叠形成σ键,然后才可能以“肩并肩”的方式重叠形成π键,故B、C正确,D错误;从原子轨道重叠程度看,π键的重叠程度比σ键的重叠程度小,故π键的稳定性比σ键小,易被破坏,是化学反应的积极参与者,A正确。
12.C 由题给条件所有原子均符合8电子稳定结构可知,其结构式应为F—NN—F,则两个氮原子之间为氮氮双键,即一个σ键、一个π键。
13.答案 (1)D、E (2)C (3)A、B、C、F (4)F
解析 NH3分子中N与3个H形成3个σ键,还有一对未成键电子;H2O分子中O与2个H形成2个σ键,还有两对未成键电子;HCl分子中Cl与1个H形成1个σ键,还有三对未成键电子;CH4分子中C与4个H形成4个σ键,碳原子的4个价电子全部参与成键;C2H6分子中C分别与3个H及另1个C形成4个σ键,碳原子的4个价电子都参与成键;N2分子中两个N原子之间形成1个σ键、2个π键,还各有一对未成键电子。
14.答案 (1)①2NA(或1.204×1024) ②6NA(或3.612×1024) ③7NA(或4.214×1024) ④7NA(或4.214×1024) (2)1∶2 1∶1 (3)5∶1
解析 (1)4种化合物的结构简式或结构式分别为OCO、、、,双键中有一个σ键和一个π键,单键全部是σ键。
(2)N2的结构式为N≡N,推知CO结构式为C≡O,含有1个σ键、2个π键;CN-结构式为[C≡N]-,HCN分子结构式为H—C≡N,HCN分子中σ键与π键均为2个。
(3)设分子式为CmHn,则6m+n=16,解之得m=2,n=4,即C2H4,结构式为。单键为σ键,双键有1个σ键和1个π键,所以一个C2H4分子中共含有5个σ键和1个π键。
15.答案 (1)1∶2 (2)1∶2 1∶1
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(4)3d64s2 (5)3
解析 X、Y、Z、W分别为C、N、S、Fe。(1)N2中有N≡N键,其中有1个σ键、2个π键。(2)元素X的一种氧化物CO和CN-与N2结构相似,推知CO的结构式为C≡O,含有1个σ键、2个π键;CN-的结构式为[C≡N]-,HCN的结构式为H—C≡N,HCN中σ键与π键均为2个。(3)C与浓硫酸加热时反应生成CO2、SO2和H2O。(4)铁的原子序数为26,其基态原子的价层电子排布式为3d64s2。(5)由题图可看出每个碳原子能与三个碳原子形成单键,故能形成3个σ键。
第一节 共价键
第一课时 共价键
必备知识基础练
1.下列关于共价键的说法正确的是( )
A.共价键只存在于共价化合物中
B.只含有共价键的物质一定是共价化合物
C.非金属元素的原子只能通过共价键形成共价分子
D.离子化合物中既可能含有极性键也可能含有非极性键
2.H2O分子中每个O原子结合2个H原子的根本原因是( )
A.共价键的方向性
B.共价键的键长
C.共价键的键角
D.共价键的饱和性
3.下列分子中,只有σ键没有π键的是( )
A.CH4 B.N2
C.CH2CH2 D.CH≡CH
4.关于乙醇分子的下列说法正确的是( )
A.一个分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.一个分子中含有1个π键
5.下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构相似,这是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
6.(2021·山东济宁高二检测)下列分子的结构式与共价键的饱和性不相符的是( )
A.H2O2(过氧化氢):H—OO—H
B.N2H4(肼):
C.C2H5SH(乙硫醇):
D.SiHCl3(三氯氢硅):
7.(2021·河南郑州高二检测)下列反应能说明σ键比π键牢固的是( )
A.CH4+Cl2CH3Cl+HCl
B.CH2CH2+Br2CH2BrCH2Br
C.2H2+O22H2O
D.H2+Cl22HCl
8.(1)指出下图所表示的共价键类型的名称,并列举含有该共价键的一种物质,写出其分子式。
① 键, ;
② 键, ;
③ 键, ;
④ 键, ;
⑤ 键, 。
(2)某有机化合物分子的结构简式为
CH2CHCOOH,该分子中有 个σ键、 个π键,有 种极性键, (填“有”或“没有”)非极性键。
关键能力提升练
以下选择题中有1~2个选项符合题意。
9.在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
10.下列说法正确的是( )
A.1 mol CnH2n+2分子中含有(3n+1) mol共价键
B.Na2O2和Na2O晶体中阳离子与阴离子的数目比相同,化学键类型也相同
C.只含有非金属元素的化合物不一定只有共价键
D.电负性之差小于1.7的两种元素的原子间一定形成共价键
11.下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
12.(2021·天津高二检测)在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A.只有一个σ键
B.只有一个π键
C.一个σ键,一个π键
D.一个σ键,两个π键
13.分析下列化学式中画有横线的元素,选出符合要求的物质填空(填字母)。
A.NH3 B.H2O C.HCl D.CH4
E.C2H6 F.N2
(1)所有的价层电子都参与形成共价键的是 ;
(2)只有一个价层电子参与形成共价键的是 ;
(3)最外层有未参与成键的电子对的是 ;
(4)既有σ键又有π键的是 。
14.(1)判断1 mol下列含碳化合物中σ键的数目。
①CO2 ;
②乙醛 ;
③CH3COOH ;
④CO(NH2)2 。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为 。HCN分子中σ键与π键数目之比为 。
(3)C、H元素形成的某化合物分子中共有16个电子,该分子中σ键与π键的个数比为 。
学科素养拔高练
15.(2021·深圳高二检测)X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)Y2分子中存在的σ键和π键个数之比为 。
(2)元素X的一种氧化物XO和XY-与Y2结构相似,XO分子内σ键与π键个数之比为 。X、Y与氢元素形成的一种化合物HXY分子中σ键与π键数目之比为 。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式: 。
(4)W基态原子的价层电子排布式为 。
(5)元素X的一种单质是一种由单层X原子构成的平面结构新型材料,如图,1号X与相邻X形成σ键的个数为 。
参考答案
第二章 分子结构与性质
第一节 共价键
第一课时 共价键
1.D
2.D O原子最外层有6个电子,可得到2个电子形成8电子稳定结构;H原子最外层有1个电子,只能形成2电子稳定结构,则每个O原子结合2个H原子与共价键的饱和性有关。
3.A 4.C
5.C s轨道是球形对称,所以s-s σ键无方向性,其他所有的共价键都有方向性。共价键的饱和性决定组成分子的原子间的数量关系,共价键的方向性决定分子的空间结构。
6.A 由共价键的饱和性可知,C、Si均形成4个共价键,H形成1个共价键,N形成3个共价键,O、S均形成2个共价键,Cl形成1个共价键。A项中O原子间是双键,且每个氧原子与1个氢原子再形成1个单键,即每个氧原子形成3个共价键,与其饱和性不相符。
7.B 碳碳双键由一个σ键和一个π键组成,CH2CH2发生加成反应时π键断裂,说明σ键比π键牢固。
8.答案 (1)①s-s σ H2 ②s-p σ HCl ③p-p σ Cl2
④pz-pzπ N2 ⑤py-pyπ N2 (2)8 2 4 有
解析 (2)分子中有3个C—H σ键、2个C—C σ键、2个C—O σ键、1个O—H σ键;CC和CO中分别有1个π键;有C—H、CO、C—O、O—H 4种极性键;含有CC、C—C非极性键。
9.C 基态H原子和基态Cl原子的轨道表示式分别为和,由此可以看出,H原子的1s轨道和Cl原子的3p轨道上各有一个未成对电子,故两者在形成氯化氢分子时,形成共价键的原子轨道是氯原子的3p轨道和氢原子的1s轨道。
10.AC 烷烃分子中只有C—C和C—H,1个CnH2n+2分子中含有(n-1)个C—C和(2n+2)个C—H,A项正确;Na2O2和Na2O中Na+与、Na+与O2-数目比均为2∶1,但Na2O2中有非极性键而Na2O中无共价键,B项不正确;NH4Cl等铵盐中含有离子键,C项正确;电负性之差小于1.7的Na与H、K与H等均形成离子键,D项不正确。
11.D 共价键形成时,原子轨道首先以“头碰头”的方式重叠形成σ键,然后才可能以“肩并肩”的方式重叠形成π键,故B、C正确,D错误;从原子轨道重叠程度看,π键的重叠程度比σ键的重叠程度小,故π键的稳定性比σ键小,易被破坏,是化学反应的积极参与者,A正确。
12.C 由题给条件所有原子均符合8电子稳定结构可知,其结构式应为F—NN—F,则两个氮原子之间为氮氮双键,即一个σ键、一个π键。
13.答案 (1)D、E (2)C (3)A、B、C、F (4)F
解析 NH3分子中N与3个H形成3个σ键,还有一对未成键电子;H2O分子中O与2个H形成2个σ键,还有两对未成键电子;HCl分子中Cl与1个H形成1个σ键,还有三对未成键电子;CH4分子中C与4个H形成4个σ键,碳原子的4个价电子全部参与成键;C2H6分子中C分别与3个H及另1个C形成4个σ键,碳原子的4个价电子都参与成键;N2分子中两个N原子之间形成1个σ键、2个π键,还各有一对未成键电子。
14.答案 (1)①2NA(或1.204×1024) ②6NA(或3.612×1024) ③7NA(或4.214×1024) ④7NA(或4.214×1024) (2)1∶2 1∶1 (3)5∶1
解析 (1)4种化合物的结构简式或结构式分别为OCO、、、,双键中有一个σ键和一个π键,单键全部是σ键。
(2)N2的结构式为N≡N,推知CO结构式为C≡O,含有1个σ键、2个π键;CN-结构式为[C≡N]-,HCN分子结构式为H—C≡N,HCN分子中σ键与π键均为2个。
(3)设分子式为CmHn,则6m+n=16,解之得m=2,n=4,即C2H4,结构式为。单键为σ键,双键有1个σ键和1个π键,所以一个C2H4分子中共含有5个σ键和1个π键。
15.答案 (1)1∶2 (2)1∶2 1∶1
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(4)3d64s2 (5)3
解析 X、Y、Z、W分别为C、N、S、Fe。(1)N2中有N≡N键,其中有1个σ键、2个π键。(2)元素X的一种氧化物CO和CN-与N2结构相似,推知CO的结构式为C≡O,含有1个σ键、2个π键;CN-的结构式为[C≡N]-,HCN的结构式为H—C≡N,HCN中σ键与π键均为2个。(3)C与浓硫酸加热时反应生成CO2、SO2和H2O。(4)铁的原子序数为26,其基态原子的价层电子排布式为3d64s2。(5)由题图可看出每个碳原子能与三个碳原子形成单键,故能形成3个σ键。
