1.2物质的化学计量(教案)(表格式)——高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.2物质的化学计量(教案)(表格式)——高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 521.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 15:48:11 | ||
图片预览


文档简介
课题: 1.2 物质的化学计量(一)
教学目的要求: 1.掌握物质的量的概念及单位、阿伏加德罗常数的概念及单位。2.知道摩尔质量的概念及单位。3.学会以物质的量为中心的计算方法。
教学重点: 物质的量、气体摩尔体积
教学难点: 构建物质的量的概念、气体摩尔体积
教 学 过 程 教师活动 学生活动
【课前回顾】 旧知巩固 提问学生 回顾旧知 思考回答
教 学 过 程 教师活动 学生活动
【导入】 有人拎着一袋子硬币去银行存钱,一个个地数真会数到手抽筋。你们有什么方法帮他快速数硬币吗? ——数100个,称重;量20个高度,称重...... 【新授】 计算结果:都是6.02×1023 大量实验证明,约6.02×1023个粒子的质量在以克为单位时,数值上等于该粒子的相对原子质量或相对分子质量。 物质的量 (一)物质的量的概念及表示 1.概念:是表示一定数目的微粒的集合体的物理量,用符号n表示;物质的量是七大基本物理量之一。 2.常用单位是摩尔(简称摩),符号mol。 标准:以0.012kg12C中所含的原子数目为标准 3.意义:它可以把物质的质量、 体积等宏观量与原子、分子或离子等微观粒子的数量联系起来。 引导思考 提问 概念讲解 板书 阅读P16 [学科提炼] 思考回答 建构模型 阅读P9 计算 温故知新 学生笔记
教 学 过 程 教师活动 学生活动
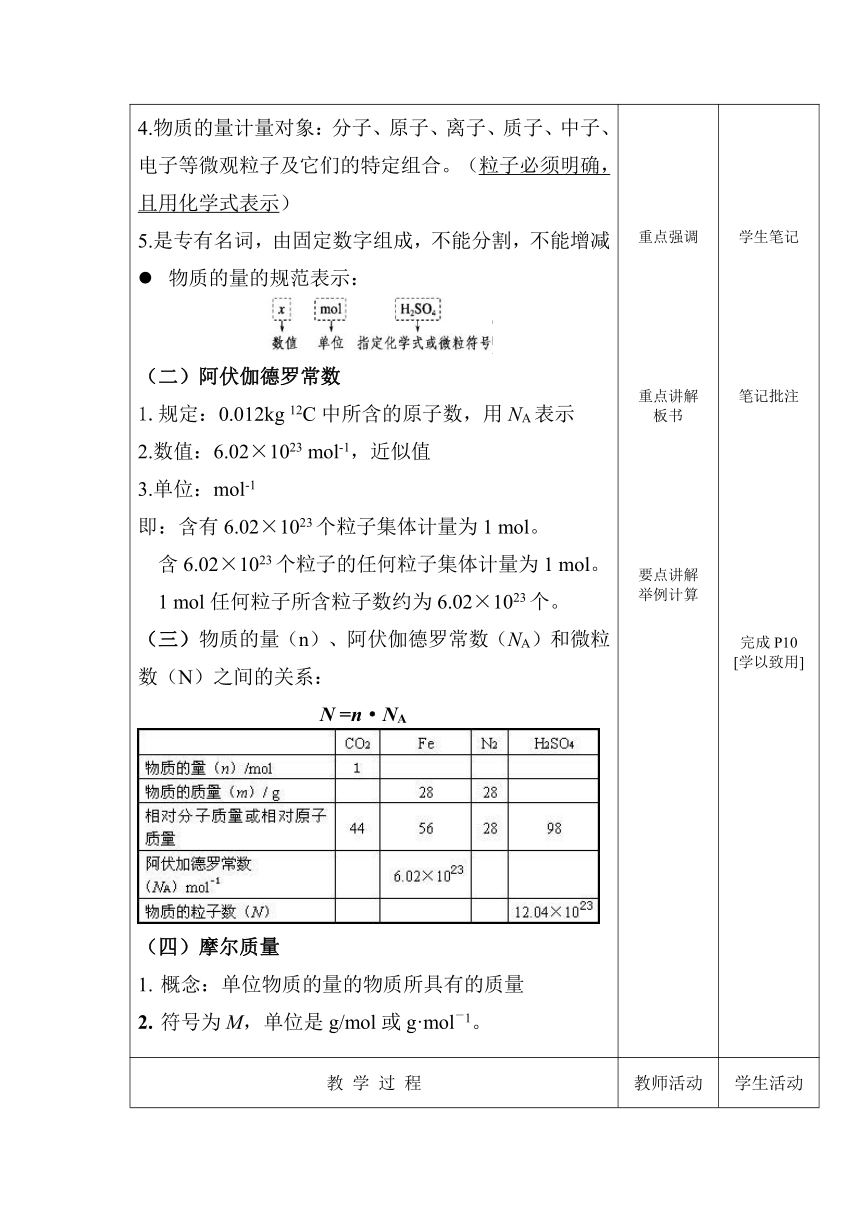
4.物质的量计量对象:分子、原子、离子、质子、中子、电子等微观粒子及它们的特定组合。 (粒子必须明确,且用化学式表示) 5.是专有名词,由固定数字组成,不能分割,不能增减 物质的量的规范表示: (二)阿伏伽德罗常数 1.规定:0.012kg 12C中所含的原子数,用NA表示 2.数值:6.02×1023 mol-1,近似值 3.单位:mol-1 即:含有6.02×1023个粒子集体计量为1 mol。 含6.02×1023个粒子的任何粒子集体计量为1 mol。 1 mol任何粒子所含粒子数约为6.02×1023个。 物质的量(n)、阿伏伽德罗常数(NA)和微粒数(N)之间的关系: N =n·NA 摩尔质量 概念:单位物质的量的物质所具有的质量 符号为M,单位是g/mol或g·mol-1。 重点强调 重点讲解 板书 要点讲解 举例计算 学生笔记 笔记批注 完成P10 [学以致用]
教 学 过 程 教师活动 学生活动
n、m、M之间的关系:M= 当物质的质量以克为单位时,其在数值上与该粒子的相对原子质量或相对分子质量相等。 (五)化学方程式中反应物和生成物的之间物质的量的关系 1.化学方程式中化学计量数的含义: (1)表示反应物和生成物之间的微粒的数量关系。 (2)表示反应物和生成物之间的物质的量关系。 2.物质的量在化学方程式计算中的应用 以H2与O2反应生成H2O为例: (1)2molH2和1molO2在点燃条件下完全反应,生成2molH2O。 (2)质量 4g 32g 36g 物质的量2mol 1mol 2mol 3.结论: 化学方程式中,各物质的化学计量数之比 = 相应物质的微粒数之比 = 物质的量之比。 4.应用: 根据化学方程式中物质的化学计量数之比等于相 P11例题 讲解 要点强调 板书 要点总结 板书 完成P11 [学以致用] 思考P12 [交流讨论] 记录笔记
教 学 过 程 教师活动 学生活动
应物质的物质的量之比,可以列比例式计算各反应物或生成物的物质的量。 (1)n=(n表示物质的量,N表示粒子数)。 NA的单位是mol-1,NA的近似值为6.02×1023 mol-1。(2)M=(M为摩尔质量,m为物质的质量)。 若M的单位是g·mol-1时,则m的单位是g。 (3)由关系式n=和n=可得:=。 气体摩尔体积 通常状况下,1 mol水的体积为18 mL。当将水加热到100 ℃时,水蒸气的体积为3.06×104 mL,约是通常状况时的1 700倍。 1、决定1 mol物质体积大小的因素主要有两个方面:粒子半径和粒子间距离。 对于1 mol气体,粒子间距较大,决定物质体积大小的主要因素是粒子间的距离,而不同气体在一定温度和压强下,分子间的距离可以看作是相等的,所以 1 mol任何气体的体积基本相同。 结论:相同条件下,1 mol 气体的体积主要决定于分子间的距离。 气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义。 标准状况下气体的摩尔体积为22.4 L/mol P12交流 讨论 板书 引导学生 找规律 要点讲解 公式讲解 讲解P14 例题 P12 [交流讨论1] 记录笔记 回答P12 [交流讨论2] 阅读P13 表1-3 计算P13 [交流讨论] 阅读P14
教 学 过 程 教师活动 学生活动
气体体积V= n·Vm 阿伏加德罗定律 1.阿伏加德罗定律的内容 相同的温度和压强下,粒子数相同的任何气体都具有相同的体积,也可以说,在相同的温度和压强下、相同体积的任何气体都含有相同数目的粒子。 2.适用范围 阿伏加德罗定律适用于任何气体,包括混合气体。 【总结】 【作业】 适当拓展 课堂总结 作业布置 笔记记录 作业记录
板书设计 1.2物质的化学计量 一、物质的量 二、气体摩尔体积 1.概念、单位 4.N =n·NA 1.V= n·Vm 2.表示、对象 5.摩尔质量 2.阿伏伽德罗定律 3.阿伏伽德罗常数NA 6.化学计量数
教学课后小结
教学目的要求: 1.掌握物质的量的概念及单位、阿伏加德罗常数的概念及单位。2.知道摩尔质量的概念及单位。3.学会以物质的量为中心的计算方法。
教学重点: 物质的量、气体摩尔体积
教学难点: 构建物质的量的概念、气体摩尔体积
教 学 过 程 教师活动 学生活动
【课前回顾】 旧知巩固 提问学生 回顾旧知 思考回答
教 学 过 程 教师活动 学生活动
【导入】 有人拎着一袋子硬币去银行存钱,一个个地数真会数到手抽筋。你们有什么方法帮他快速数硬币吗? ——数100个,称重;量20个高度,称重...... 【新授】 计算结果:都是6.02×1023 大量实验证明,约6.02×1023个粒子的质量在以克为单位时,数值上等于该粒子的相对原子质量或相对分子质量。 物质的量 (一)物质的量的概念及表示 1.概念:是表示一定数目的微粒的集合体的物理量,用符号n表示;物质的量是七大基本物理量之一。 2.常用单位是摩尔(简称摩),符号mol。 标准:以0.012kg12C中所含的原子数目为标准 3.意义:它可以把物质的质量、 体积等宏观量与原子、分子或离子等微观粒子的数量联系起来。 引导思考 提问 概念讲解 板书 阅读P16 [学科提炼] 思考回答 建构模型 阅读P9 计算 温故知新 学生笔记
教 学 过 程 教师活动 学生活动
4.物质的量计量对象:分子、原子、离子、质子、中子、电子等微观粒子及它们的特定组合。 (粒子必须明确,且用化学式表示) 5.是专有名词,由固定数字组成,不能分割,不能增减 物质的量的规范表示: (二)阿伏伽德罗常数 1.规定:0.012kg 12C中所含的原子数,用NA表示 2.数值:6.02×1023 mol-1,近似值 3.单位:mol-1 即:含有6.02×1023个粒子集体计量为1 mol。 含6.02×1023个粒子的任何粒子集体计量为1 mol。 1 mol任何粒子所含粒子数约为6.02×1023个。 物质的量(n)、阿伏伽德罗常数(NA)和微粒数(N)之间的关系: N =n·NA 摩尔质量 概念:单位物质的量的物质所具有的质量 符号为M,单位是g/mol或g·mol-1。 重点强调 重点讲解 板书 要点讲解 举例计算 学生笔记 笔记批注 完成P10 [学以致用]
教 学 过 程 教师活动 学生活动
n、m、M之间的关系:M= 当物质的质量以克为单位时,其在数值上与该粒子的相对原子质量或相对分子质量相等。 (五)化学方程式中反应物和生成物的之间物质的量的关系 1.化学方程式中化学计量数的含义: (1)表示反应物和生成物之间的微粒的数量关系。 (2)表示反应物和生成物之间的物质的量关系。 2.物质的量在化学方程式计算中的应用 以H2与O2反应生成H2O为例: (1)2molH2和1molO2在点燃条件下完全反应,生成2molH2O。 (2)质量 4g 32g 36g 物质的量2mol 1mol 2mol 3.结论: 化学方程式中,各物质的化学计量数之比 = 相应物质的微粒数之比 = 物质的量之比。 4.应用: 根据化学方程式中物质的化学计量数之比等于相 P11例题 讲解 要点强调 板书 要点总结 板书 完成P11 [学以致用] 思考P12 [交流讨论] 记录笔记
教 学 过 程 教师活动 学生活动
应物质的物质的量之比,可以列比例式计算各反应物或生成物的物质的量。 (1)n=(n表示物质的量,N表示粒子数)。 NA的单位是mol-1,NA的近似值为6.02×1023 mol-1。(2)M=(M为摩尔质量,m为物质的质量)。 若M的单位是g·mol-1时,则m的单位是g。 (3)由关系式n=和n=可得:=。 气体摩尔体积 通常状况下,1 mol水的体积为18 mL。当将水加热到100 ℃时,水蒸气的体积为3.06×104 mL,约是通常状况时的1 700倍。 1、决定1 mol物质体积大小的因素主要有两个方面:粒子半径和粒子间距离。 对于1 mol气体,粒子间距较大,决定物质体积大小的主要因素是粒子间的距离,而不同气体在一定温度和压强下,分子间的距离可以看作是相等的,所以 1 mol任何气体的体积基本相同。 结论:相同条件下,1 mol 气体的体积主要决定于分子间的距离。 气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义。 标准状况下气体的摩尔体积为22.4 L/mol P12交流 讨论 板书 引导学生 找规律 要点讲解 公式讲解 讲解P14 例题 P12 [交流讨论1] 记录笔记 回答P12 [交流讨论2] 阅读P13 表1-3 计算P13 [交流讨论] 阅读P14
教 学 过 程 教师活动 学生活动
气体体积V= n·Vm 阿伏加德罗定律 1.阿伏加德罗定律的内容 相同的温度和压强下,粒子数相同的任何气体都具有相同的体积,也可以说,在相同的温度和压强下、相同体积的任何气体都含有相同数目的粒子。 2.适用范围 阿伏加德罗定律适用于任何气体,包括混合气体。 【总结】 【作业】 适当拓展 课堂总结 作业布置 笔记记录 作业记录
板书设计 1.2物质的化学计量 一、物质的量 二、气体摩尔体积 1.概念、单位 4.N =n·NA 1.V= n·Vm 2.表示、对象 5.摩尔质量 2.阿伏伽德罗定律 3.阿伏伽德罗常数NA 6.化学计量数
教学课后小结
