2.2.2配制一定物质的量浓度溶液(教学课件)(共31张PPT)——上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.2.2配制一定物质的量浓度溶液(教学课件)(共31张PPT)——上学期高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 15:53:18 | ||
图片预览











文档简介
(共31张PPT)
专题2 研究物质的基本方法
第二单元 溶液组成的定量研究
1
第二课时 配制一定物质的量浓度溶液
[学习目标]
1.掌握配制一定物质的量浓度溶液实验的基础知识和基本技能,加深对物质的量浓度概念的理解。
2.学会进行误差分析,养成严谨求实的科学态度和独立思考的能力。
[重难点]
配制一定物质的量浓度溶液、误差分析
3
怎样配制100mL 0.1mol/L 的Na2CO3溶液
思考:配制过程中如何得到100mL溶液?需要用到哪种仪器?
溶液体积不等于溶剂体积
思考:100mL是溶液的体积,溶液体积和溶剂体积相等么?
容量瓶
温度
规格
50 mL、100 mL、250 mL、500 mL、1 000 mL
二:认识容量瓶
检漏程序: 加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
使用前要检验容量瓶是否漏水。
二:认识容量瓶
※容量瓶是配制一定物质的量浓度溶液的专用仪器。
※使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
配制450 mL 0.1 mol·L-1的NaCl溶液,
需选择 。
500 mL容量瓶
配制500 mL 0.1 mol·L-1的NaCl溶液需要的玻璃仪器除烧杯、玻璃棒外,还需要的是________________。
书写容量瓶时一定要标明规格
500 mL容量瓶
选择容量瓶应遵循“大而近”的原则
二:认识容量瓶
仪器:
100mL 容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平、药匙
三、配制100mL 0.1mol/L 的Na2CO3溶液
0.01 mol
1.06
托盘天平
药匙
三、配制100mL 0.1mol/L 的Na2CO3溶液
步骤:
称量:若用托盘天平称量需称量Na2CO3固体1.1g;
若用电子天平称量需称量1.06g;
若用分析天平称量需称量1.0600g
变式:若要配制480 mL 0.100 mol·L-1 的Na2CO3溶液,
所需碳酸钠固体的质量为?
500 mL容量瓶
思考:如何称量NaOH固体?
需要将NaOH固体放在烧杯(因为NaOH固体具有潮解性)
玻璃棒
烧杯
玻璃棒作用:搅拌,加速溶解
若未冷却至室温,溶液的体积膨胀,冷却后溶液的体积小于刻度线所标注的体积,则会使所配溶液浓度偏大
思考:若未冷却至室温,会有什么影响?
100 mL容量瓶
玻璃棒
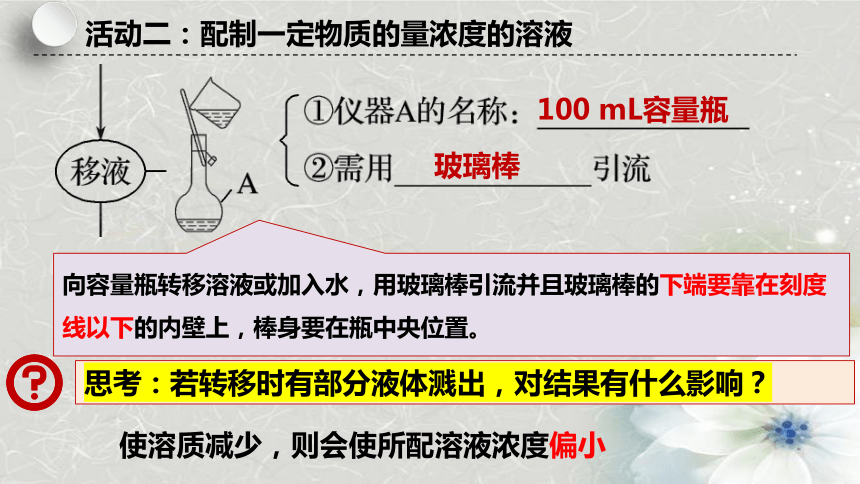
使溶质减少,则会使所配溶液浓度偏小
思考:若转移时有部分液体溅出,对结果有什么影响?
活动二:配制一定物质的量浓度的溶液
向容量瓶转移溶液或加入水,用玻璃棒引流并且玻璃棒的下端要靠在刻度线以下的内壁上,棒身要在瓶中央位置。
2~3
容量瓶
若不用蒸馏水洗涤,容量瓶中的溶质就会减少,导致所配溶液中溶质的浓度会偏小。
活动二:配制一定物质的量浓度的溶液
思考:若不用蒸馏水洗涤,对结果有什么影响?
1~2 cm
凹液面
与刻度线相切
能用胶头滴管把多余的液体吸出吗?
重新配制!
若是用滴管吸出,使溶质减少,则会使所配溶液浓度偏小
活动二:配制一定物质的量浓度的溶液
思考:若定容时不小心液面超过了刻度线,怎么办??
振荡后液面低,是因为在瓶塞处留有溶液。若继续加水至刻度,使加水量多,则会使溶液浓度偏小。
活动二:配制一定物质的量浓度的溶液
思考:定容后,液面低于刻度线,为什么?能否再加水?
计算
溶解、冷却
洗涤
转移
定容
摇匀
称量
装瓶、贴标签
三、配制100mL 0.1mol/L 的Na2CO3溶液
思考:如果用18mol/L 的浓硫酸配制成250mL 1 mol/L 稀硫酸,操作有何不同
如何稀释浓硫酸?
四、误差分析
根据:
n
V
c
m
MV
m、V决定误差大小
在配制溶液的过程中,由于操作失误或者仪器有所破损都会引起溶液浓度出现误差。
操作步骤 引起误差的原因 对结果的影响
m V c
称 取 计算结果为5.85 g,实际称取5.9 g -
砝码生锈或粘有其他物质 -
需要使用游码且药品、砝码位置颠倒 -
称量易潮解物质(如NaOH)时使用滤纸 -
称量易潮解物质(如NaOH)时动作缓慢 -
用量筒量取浓溶液时仰视 -
用量筒量取浓溶液时俯视 -
将量取液体所用量筒洗涤,并将洗涤液注入容量瓶中 -
偏大
偏高
偏大
偏高
偏小
偏低
偏小
偏低
偏小
偏低
偏大
偏高
偏小
偏低
偏大
偏高
量取误差用浓溶液配制稀溶液,计算出浓溶液的体积(设为V)后用量筒量取。
若量取时俯视,则所取溶液的体积(设为V′)偏小,溶液浓度偏低;
若量取时仰视,则则所取溶液的体积(设为V′)偏大,溶液浓度偏高。
操作步骤 引起误差的原因 对结果的影响
m V c
溶解 不慎将溶液溅到烧杯外面 -
冷却(恢复)、转移 溶解放热,未冷却到室温就转移到容量瓶中 -
溶解吸热,未恢复到室温就转移到容量瓶中 -
转移前,发现容量瓶内有少量的蒸馏水 - -
转移时有少量溶液流到容量瓶外 -
洗涤 未洗涤或只洗涤了1次烧杯和玻璃棒 -
偏小
偏低
偏小
偏高
偏大
偏低
无影响
偏小
偏低
偏小
偏低
操作 步骤 引起误差的原因 对结果的影响
m V c
定容 定容时仰视 -
定容时俯视 -
定容时液面超过刻度线,立即用吸管吸出 -
定容摇匀后溶液的凹液面低于刻度线,又加水至刻度线 -
定容结束时,液面最高点与刻度线处于同一水平面上 -
偏大
偏低
偏小
偏高
偏小
偏低
偏大
偏低
偏小
偏高
定容时俯视、仰视造成的误差
导致加蒸馏水的量偏少,则所配制溶液浓度偏高。
导致加蒸馏水的量偏少,则所配制溶液浓度偏高。
任何的操作失误后只能重新配制,没有任何补救的方法!
注 意
容量瓶使用前未烘干
无影响!
摇匀后发现液面低于刻度线
配好的溶液转入试剂瓶时,不慎溅出
无影响!
无影响!
砝码放在左盘,未使用游码
无影响!
四、误差分析
延时符
课堂小结
01
02
一定物质的量浓度溶液的配置步骤及误差分析
1、下列关于1L 0.1mol/L CuSO4溶液配制的说法中正确的( )
A、称取25 g胆矾溶于 1 L水中配制而成
B、称取16 g胆矾溶于水配制成 1 L溶液
C、称取16 g CuSO4溶于水配制成 1 L溶液
D、称取25 g CuSO4溶于 1 L水中配制而成
C
通过计算可知需称取 16 g CuSO4 或 25 g 胆矾( CuSO4 · 5H2O),
要配制的是 1 L溶液,而不是将固体溶解在1 L水中,
课堂检测
2.实验室欲用氢氧化钠固体配制1.0mol·L-1的氢氧化钠溶液240mL:
(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、 。
(2)计算实验需要称量氢氧化钠的质量为: g。
(3)使用容量瓶前必须进行的一步操作是 。
250mL容量瓶、玻璃棒
10.0
检查容量瓶是否漏液
课堂检测
A
3.用容量瓶配制溶液时,下列操作会导致所得溶液浓度偏低的是 ( )
①配制中未用蒸馏水洗涤烧杯和玻璃棒
②定容时俯视容量瓶刻度线
③稀释后未冷却至室温即转移至容量瓶
④摇匀后发现液面低于刻度线再加水
A.①④ B.②③ C.①② D.②④
课堂检测
A
4.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是 ( )
A.称量NaCl固体时砝码上有杂质
B.没有洗涤溶解NaCl固体的烧杯和玻璃棒
C.定容时加水加多了,用滴管吸出溶液至刻度线
D.定容时仰视刻度线
课堂检测
专题2 研究物质的基本方法
第二单元 溶液组成的定量研究
1
第二课时 配制一定物质的量浓度溶液
[学习目标]
1.掌握配制一定物质的量浓度溶液实验的基础知识和基本技能,加深对物质的量浓度概念的理解。
2.学会进行误差分析,养成严谨求实的科学态度和独立思考的能力。
[重难点]
配制一定物质的量浓度溶液、误差分析
3
怎样配制100mL 0.1mol/L 的Na2CO3溶液
思考:配制过程中如何得到100mL溶液?需要用到哪种仪器?
溶液体积不等于溶剂体积
思考:100mL是溶液的体积,溶液体积和溶剂体积相等么?
容量瓶
温度
规格
50 mL、100 mL、250 mL、500 mL、1 000 mL
二:认识容量瓶
检漏程序: 加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
使用前要检验容量瓶是否漏水。
二:认识容量瓶
※容量瓶是配制一定物质的量浓度溶液的专用仪器。
※使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
配制450 mL 0.1 mol·L-1的NaCl溶液,
需选择 。
500 mL容量瓶
配制500 mL 0.1 mol·L-1的NaCl溶液需要的玻璃仪器除烧杯、玻璃棒外,还需要的是________________。
书写容量瓶时一定要标明规格
500 mL容量瓶
选择容量瓶应遵循“大而近”的原则
二:认识容量瓶
仪器:
100mL 容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平、药匙
三、配制100mL 0.1mol/L 的Na2CO3溶液
0.01 mol
1.06
托盘天平
药匙
三、配制100mL 0.1mol/L 的Na2CO3溶液
步骤:
称量:若用托盘天平称量需称量Na2CO3固体1.1g;
若用电子天平称量需称量1.06g;
若用分析天平称量需称量1.0600g
变式:若要配制480 mL 0.100 mol·L-1 的Na2CO3溶液,
所需碳酸钠固体的质量为?
500 mL容量瓶
思考:如何称量NaOH固体?
需要将NaOH固体放在烧杯(因为NaOH固体具有潮解性)
玻璃棒
烧杯
玻璃棒作用:搅拌,加速溶解
若未冷却至室温,溶液的体积膨胀,冷却后溶液的体积小于刻度线所标注的体积,则会使所配溶液浓度偏大
思考:若未冷却至室温,会有什么影响?
100 mL容量瓶
玻璃棒
使溶质减少,则会使所配溶液浓度偏小
思考:若转移时有部分液体溅出,对结果有什么影响?
活动二:配制一定物质的量浓度的溶液
向容量瓶转移溶液或加入水,用玻璃棒引流并且玻璃棒的下端要靠在刻度线以下的内壁上,棒身要在瓶中央位置。
2~3
容量瓶
若不用蒸馏水洗涤,容量瓶中的溶质就会减少,导致所配溶液中溶质的浓度会偏小。
活动二:配制一定物质的量浓度的溶液
思考:若不用蒸馏水洗涤,对结果有什么影响?
1~2 cm
凹液面
与刻度线相切
能用胶头滴管把多余的液体吸出吗?
重新配制!
若是用滴管吸出,使溶质减少,则会使所配溶液浓度偏小
活动二:配制一定物质的量浓度的溶液
思考:若定容时不小心液面超过了刻度线,怎么办??
振荡后液面低,是因为在瓶塞处留有溶液。若继续加水至刻度,使加水量多,则会使溶液浓度偏小。
活动二:配制一定物质的量浓度的溶液
思考:定容后,液面低于刻度线,为什么?能否再加水?
计算
溶解、冷却
洗涤
转移
定容
摇匀
称量
装瓶、贴标签
三、配制100mL 0.1mol/L 的Na2CO3溶液
思考:如果用18mol/L 的浓硫酸配制成250mL 1 mol/L 稀硫酸,操作有何不同
如何稀释浓硫酸?
四、误差分析
根据:
n
V
c
m
MV
m、V决定误差大小
在配制溶液的过程中,由于操作失误或者仪器有所破损都会引起溶液浓度出现误差。
操作步骤 引起误差的原因 对结果的影响
m V c
称 取 计算结果为5.85 g,实际称取5.9 g -
砝码生锈或粘有其他物质 -
需要使用游码且药品、砝码位置颠倒 -
称量易潮解物质(如NaOH)时使用滤纸 -
称量易潮解物质(如NaOH)时动作缓慢 -
用量筒量取浓溶液时仰视 -
用量筒量取浓溶液时俯视 -
将量取液体所用量筒洗涤,并将洗涤液注入容量瓶中 -
偏大
偏高
偏大
偏高
偏小
偏低
偏小
偏低
偏小
偏低
偏大
偏高
偏小
偏低
偏大
偏高
量取误差用浓溶液配制稀溶液,计算出浓溶液的体积(设为V)后用量筒量取。
若量取时俯视,则所取溶液的体积(设为V′)偏小,溶液浓度偏低;
若量取时仰视,则则所取溶液的体积(设为V′)偏大,溶液浓度偏高。
操作步骤 引起误差的原因 对结果的影响
m V c
溶解 不慎将溶液溅到烧杯外面 -
冷却(恢复)、转移 溶解放热,未冷却到室温就转移到容量瓶中 -
溶解吸热,未恢复到室温就转移到容量瓶中 -
转移前,发现容量瓶内有少量的蒸馏水 - -
转移时有少量溶液流到容量瓶外 -
洗涤 未洗涤或只洗涤了1次烧杯和玻璃棒 -
偏小
偏低
偏小
偏高
偏大
偏低
无影响
偏小
偏低
偏小
偏低
操作 步骤 引起误差的原因 对结果的影响
m V c
定容 定容时仰视 -
定容时俯视 -
定容时液面超过刻度线,立即用吸管吸出 -
定容摇匀后溶液的凹液面低于刻度线,又加水至刻度线 -
定容结束时,液面最高点与刻度线处于同一水平面上 -
偏大
偏低
偏小
偏高
偏小
偏低
偏大
偏低
偏小
偏高
定容时俯视、仰视造成的误差
导致加蒸馏水的量偏少,则所配制溶液浓度偏高。
导致加蒸馏水的量偏少,则所配制溶液浓度偏高。
任何的操作失误后只能重新配制,没有任何补救的方法!
注 意
容量瓶使用前未烘干
无影响!
摇匀后发现液面低于刻度线
配好的溶液转入试剂瓶时,不慎溅出
无影响!
无影响!
砝码放在左盘,未使用游码
无影响!
四、误差分析
延时符
课堂小结
01
02
一定物质的量浓度溶液的配置步骤及误差分析
1、下列关于1L 0.1mol/L CuSO4溶液配制的说法中正确的( )
A、称取25 g胆矾溶于 1 L水中配制而成
B、称取16 g胆矾溶于水配制成 1 L溶液
C、称取16 g CuSO4溶于水配制成 1 L溶液
D、称取25 g CuSO4溶于 1 L水中配制而成
C
通过计算可知需称取 16 g CuSO4 或 25 g 胆矾( CuSO4 · 5H2O),
要配制的是 1 L溶液,而不是将固体溶解在1 L水中,
课堂检测
2.实验室欲用氢氧化钠固体配制1.0mol·L-1的氢氧化钠溶液240mL:
(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、 。
(2)计算实验需要称量氢氧化钠的质量为: g。
(3)使用容量瓶前必须进行的一步操作是 。
250mL容量瓶、玻璃棒
10.0
检查容量瓶是否漏液
课堂检测
A
3.用容量瓶配制溶液时,下列操作会导致所得溶液浓度偏低的是 ( )
①配制中未用蒸馏水洗涤烧杯和玻璃棒
②定容时俯视容量瓶刻度线
③稀释后未冷却至室温即转移至容量瓶
④摇匀后发现液面低于刻度线再加水
A.①④ B.②③ C.①② D.②④
课堂检测
A
4.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是 ( )
A.称量NaCl固体时砝码上有杂质
B.没有洗涤溶解NaCl固体的烧杯和玻璃棒
C.定容时加水加多了,用滴管吸出溶液至刻度线
D.定容时仰视刻度线
课堂检测
