3.1氯气及氯的化合物(二)氧化还原(教案)(表格式)——高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1氯气及氯的化合物(二)氧化还原(教案)(表格式)——高一上学期化学苏教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 88.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 15:57:08 | ||
图片预览



文档简介
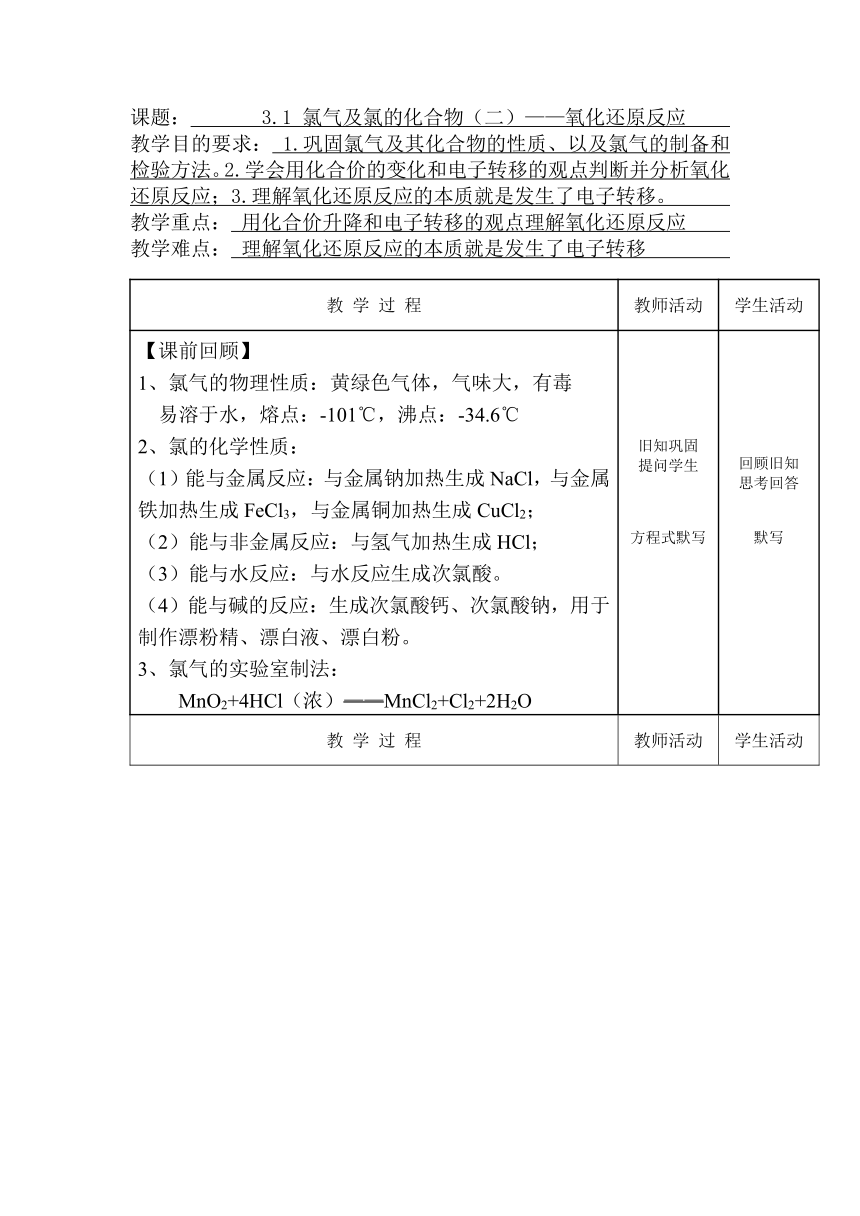
课题: 3.1 氯气及氯的化合物(二)——氧化还原反应
教学目的要求: 1.巩固氯气及其化合物的性质、以及氯气的制备和检验方法。2.学会用化合价的变化和电子转移的观点判断并分析氧化还原反应;3.理解氧化还原反应的本质就是发生了电子转移。
教学重点: 用化合价升降和电子转移的观点理解氧化还原反应
教学难点: 理解氧化还原反应的本质就是发生了电子转移
教 学 过 程 教师活动 学生活动
【课前回顾】 1、氯气的物理性质:黄绿色气体,气味大,有毒 易溶于水,熔点:-101℃,沸点:-34.6℃ 2、氯的化学性质: (1)能与金属反应:与金属钠加热生成NaCl,与金属铁加热生成FeCl3,与金属铜加热生成CuCl2; (2)能与非金属反应:与氢气加热生成HCl; (3)能与水反应:与水反应生成次氯酸。 (4)能与碱的反应:生成次氯酸钙、次氯酸钠,用于制作漂粉精、漂白液、漂白粉。 3、氯气的实验室制法: MnO2+4HCl(浓)——MnCl2+Cl2+2H2O 旧知巩固 提问学生 方程式默写 回顾旧知 思考回答 默写
教 学 过 程 教师活动 学生活动
氯离子的检验:对于可溶性氯化物中的氯离子,可以用AgNO3溶液和稀硝酸进行检验。 【导入】 回顾下什么是氧化还原反应?如何判断一个反应是否为氧化还原反应?四大基本反应类型和氧化还原反应的关系是什么呢? 【新授】 氧化还原反应 1.概念:有元素化合价变化的反应 氧化反应:物质跟氧发生的化学反应/元素化合价升高的反应 2Cu +O2==2CuO 还原反应:物质失去氧的化学反应/元素化合价降低的反应 CuO+H2==H2O+Cu 2.氧化还原反应的判断依据-----有元素化合价变化 [思考]为什么氧化还原反应前后元素的化合价发生变化?其本质原因是什么呢? (1)以2Na +Cl2==2NaCl为例 [分析]:该反应前后化合价发生了变化,是个氧化还原反应:钠原子最外层有一个电子,在反应中易失去一个电子,成为稳定的钠离子;而氯原子最外层有7个电子,反应中易得到一个电子,成为稳定的氯离子,钠离子和氯离子通过静电作用形成化合物氯化钠。在这个过程中电子通过失与得由钠原子转移到氯原子。 在形成离子化合物时,某元素的原子失去电子,则使元素化合价升高;某元素的原子得到电子,则此 引导思考 提问 重点讲解 板书 分析讲解 回忆旧知 思考 记录笔记 思考
教 学 过 程 教师活动 学生活动
元素化合价降低,因而得失电子会使元素化合价发生变化。 电子由一种元素的原子转移到另一种元素的原子,带负电荷电子的移动使电路中产生了电流,电流计指针发生了偏转,有关原理将在后面继续学习。 失电子总数=化合价升高总数 ==得电子总数==化合价降低总数 (得失电子数守恒) 以H2 +Cl2===2HCl为例 [分析]:在该反应中,由于生成物氯化氢是共价化合物,在反应过程中,哪一种元素的原子都没有失去或完全得到电子,它们之间只有共用电子对的偏移,且共用电子对偏离于氢原子,而偏向于氯原子,因此氢原子由0价升高到+1价被氧化,氯元素从0价降低到-1价,被还原。所以,共用电子对的偏移也可以使元素化合价发生变化。 3.实质:电子的转移(电子的得失或共用电子对的偏移) [小结] 得氧失氧观点化合价升降观点电子转移观点氧化反应得到氧的反应化合价升高的反应失去电子 的反应还原反应失去氧的反应化合价降低的反应得到电子 的反应氧化还原关系得氧失氧 同时发生化合价升降同时 发生(且升降总数相等)得失电子同时发生(且得失电子总数相等)氧化还原反应有氧得失 的反应有化合价升降 的反应有电子转移 的反应
口诀:升失氧化还原剂,降得还原氧化剂 化合价升高,失电子,被氧化——还原剂 化合价降低,得电子,被还原——氧化剂 重点总结 板书 分析讲解 重点小结 板书 记录笔记 思考总结 笔记记录 背诵
教 学 过 程 教师活动 学生活动
二、氧化剂和还原剂 1.氧化剂和还原剂(反应物) (1)氧化剂:化合价降低、得电子(或电子对偏向)的物质——具有氧化性(被还原,发生还原反应) (2)还原剂:化合价升高、失电子(或电子对偏离)的物质——具有还原性(被氧化,发生氧化反应) (3)氧化产物:还原剂被氧化后的生成物 (4)还原产物:氧化剂被还原后的生成物 2.氧化还原反应中电子转移的表示方法 (1)双线桥法---表示电子得失结果 步骤:①先标化合价,双线桥从左指向右连接不同价态的同种元素。 ②线上标明电子得失数。 氧化剂 + 还原剂 == 还原产物 + 氧化产物 (2)单线桥——表示电子转移情况 步骤:①单箭号(在反应物之间); ②箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素; ③只标转移电子总数,不标得与失(氧化剂得电总数等于还原剂失电子总数)。 概念讲解 板书 重点讲解 举例说明 板书演示 讲解要点 板书 记录笔记 笔记 观察思考
教 学 过 程 教师活动 学生活动
[课堂小练]判断下列反应属于哪种基本反应类型?是否属于氧化还原反应? 1.2Na+Cl2==2NaCl 2.Fe+CuSO4==FeSO4+Cu 3.2HgO==2Hg+O2↑ NH4NO3==N2O↑+2H2O 5.CaO+H2O==CaCO3 6.3Fe+2O2==Fe3O4 7.BaCl2+H2SO4==BaSO4↓+2HCl 8.CaCO3==CaO+CO2↑ 9. Cl2+2NaOH===NaCl+NaClO+H2O 10. 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 属于氧化还原反应的有1、2、3、4、6、9、10;非氧化还原反应有:5、7、8;化合反应:1、5、6;分解反应:3、4、8;置换反应:2;复分解反应:7。 请总结四种基本反应类型与氧化还原反应的关系。 3.氧化还原反应与四种基本反应类型的关系 (1)置换反应一定属于氧化还原反应 (2)复分解反应一定不属于氧化还原反应 (3)化合反应和分解反应有些属于氧化还原反应,有些不属于氧化还原反应。 4.常见的氧化剂与还原剂 常见的氧化剂 (1)活泼的非金属单质:O2 、Cl2 、Br2。 (2)含高价金属阳离子的化合物:FeCl3。 提问回顾 分析讲解 提问回顾 板书 要点讲解 思考回答 思考总结 记录笔记
教 学 过 程 教师活动 学生活动
(3)含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2。 常见的还原剂 (1)活泼或较活泼的金属:K、Ca、Na、Al、Mg、Zn(按金属活动性顺序,还原性递减)。 (2)含低价金属阳离子的化合物:Fe2+。 (3)某些非金属单质:C、H2。 (4)含有较低化合价元素的化合物:HCl、H2S、HI。 【总结】 氧化还原反应和日常生产、生活密切相关,它对我们既有贡献又有害处,如酿酒、燃料燃烧都是利用氧还反应,但铁生锈、易燃物自然等也是氧还反应。在学习了化学后就可以充分去避免氧还反应的危害,最大限度的利用它来为人类服务。 【作业】 重点讲解 板书 课堂总结 作业布置 记录笔记 记录作业
板书设计 3.1氧化还原反应 氧化还原反应 二、氧化剂与还原剂 1、概念 1、概念 2、判断依据 2、表示方法 3、实质 3、常见的氧化剂与还原剂
教学课后小结
教学目的要求: 1.巩固氯气及其化合物的性质、以及氯气的制备和检验方法。2.学会用化合价的变化和电子转移的观点判断并分析氧化还原反应;3.理解氧化还原反应的本质就是发生了电子转移。
教学重点: 用化合价升降和电子转移的观点理解氧化还原反应
教学难点: 理解氧化还原反应的本质就是发生了电子转移
教 学 过 程 教师活动 学生活动
【课前回顾】 1、氯气的物理性质:黄绿色气体,气味大,有毒 易溶于水,熔点:-101℃,沸点:-34.6℃ 2、氯的化学性质: (1)能与金属反应:与金属钠加热生成NaCl,与金属铁加热生成FeCl3,与金属铜加热生成CuCl2; (2)能与非金属反应:与氢气加热生成HCl; (3)能与水反应:与水反应生成次氯酸。 (4)能与碱的反应:生成次氯酸钙、次氯酸钠,用于制作漂粉精、漂白液、漂白粉。 3、氯气的实验室制法: MnO2+4HCl(浓)——MnCl2+Cl2+2H2O 旧知巩固 提问学生 方程式默写 回顾旧知 思考回答 默写
教 学 过 程 教师活动 学生活动
氯离子的检验:对于可溶性氯化物中的氯离子,可以用AgNO3溶液和稀硝酸进行检验。 【导入】 回顾下什么是氧化还原反应?如何判断一个反应是否为氧化还原反应?四大基本反应类型和氧化还原反应的关系是什么呢? 【新授】 氧化还原反应 1.概念:有元素化合价变化的反应 氧化反应:物质跟氧发生的化学反应/元素化合价升高的反应 2Cu +O2==2CuO 还原反应:物质失去氧的化学反应/元素化合价降低的反应 CuO+H2==H2O+Cu 2.氧化还原反应的判断依据-----有元素化合价变化 [思考]为什么氧化还原反应前后元素的化合价发生变化?其本质原因是什么呢? (1)以2Na +Cl2==2NaCl为例 [分析]:该反应前后化合价发生了变化,是个氧化还原反应:钠原子最外层有一个电子,在反应中易失去一个电子,成为稳定的钠离子;而氯原子最外层有7个电子,反应中易得到一个电子,成为稳定的氯离子,钠离子和氯离子通过静电作用形成化合物氯化钠。在这个过程中电子通过失与得由钠原子转移到氯原子。 在形成离子化合物时,某元素的原子失去电子,则使元素化合价升高;某元素的原子得到电子,则此 引导思考 提问 重点讲解 板书 分析讲解 回忆旧知 思考 记录笔记 思考
教 学 过 程 教师活动 学生活动
元素化合价降低,因而得失电子会使元素化合价发生变化。 电子由一种元素的原子转移到另一种元素的原子,带负电荷电子的移动使电路中产生了电流,电流计指针发生了偏转,有关原理将在后面继续学习。 失电子总数=化合价升高总数 ==得电子总数==化合价降低总数 (得失电子数守恒) 以H2 +Cl2===2HCl为例 [分析]:在该反应中,由于生成物氯化氢是共价化合物,在反应过程中,哪一种元素的原子都没有失去或完全得到电子,它们之间只有共用电子对的偏移,且共用电子对偏离于氢原子,而偏向于氯原子,因此氢原子由0价升高到+1价被氧化,氯元素从0价降低到-1价,被还原。所以,共用电子对的偏移也可以使元素化合价发生变化。 3.实质:电子的转移(电子的得失或共用电子对的偏移) [小结] 得氧失氧观点化合价升降观点电子转移观点氧化反应得到氧的反应化合价升高的反应失去电子 的反应还原反应失去氧的反应化合价降低的反应得到电子 的反应氧化还原关系得氧失氧 同时发生化合价升降同时 发生(且升降总数相等)得失电子同时发生(且得失电子总数相等)氧化还原反应有氧得失 的反应有化合价升降 的反应有电子转移 的反应
口诀:升失氧化还原剂,降得还原氧化剂 化合价升高,失电子,被氧化——还原剂 化合价降低,得电子,被还原——氧化剂 重点总结 板书 分析讲解 重点小结 板书 记录笔记 思考总结 笔记记录 背诵
教 学 过 程 教师活动 学生活动
二、氧化剂和还原剂 1.氧化剂和还原剂(反应物) (1)氧化剂:化合价降低、得电子(或电子对偏向)的物质——具有氧化性(被还原,发生还原反应) (2)还原剂:化合价升高、失电子(或电子对偏离)的物质——具有还原性(被氧化,发生氧化反应) (3)氧化产物:还原剂被氧化后的生成物 (4)还原产物:氧化剂被还原后的生成物 2.氧化还原反应中电子转移的表示方法 (1)双线桥法---表示电子得失结果 步骤:①先标化合价,双线桥从左指向右连接不同价态的同种元素。 ②线上标明电子得失数。 氧化剂 + 还原剂 == 还原产物 + 氧化产物 (2)单线桥——表示电子转移情况 步骤:①单箭号(在反应物之间); ②箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素; ③只标转移电子总数,不标得与失(氧化剂得电总数等于还原剂失电子总数)。 概念讲解 板书 重点讲解 举例说明 板书演示 讲解要点 板书 记录笔记 笔记 观察思考
教 学 过 程 教师活动 学生活动
[课堂小练]判断下列反应属于哪种基本反应类型?是否属于氧化还原反应? 1.2Na+Cl2==2NaCl 2.Fe+CuSO4==FeSO4+Cu 3.2HgO==2Hg+O2↑ NH4NO3==N2O↑+2H2O 5.CaO+H2O==CaCO3 6.3Fe+2O2==Fe3O4 7.BaCl2+H2SO4==BaSO4↓+2HCl 8.CaCO3==CaO+CO2↑ 9. Cl2+2NaOH===NaCl+NaClO+H2O 10. 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 属于氧化还原反应的有1、2、3、4、6、9、10;非氧化还原反应有:5、7、8;化合反应:1、5、6;分解反应:3、4、8;置换反应:2;复分解反应:7。 请总结四种基本反应类型与氧化还原反应的关系。 3.氧化还原反应与四种基本反应类型的关系 (1)置换反应一定属于氧化还原反应 (2)复分解反应一定不属于氧化还原反应 (3)化合反应和分解反应有些属于氧化还原反应,有些不属于氧化还原反应。 4.常见的氧化剂与还原剂 常见的氧化剂 (1)活泼的非金属单质:O2 、Cl2 、Br2。 (2)含高价金属阳离子的化合物:FeCl3。 提问回顾 分析讲解 提问回顾 板书 要点讲解 思考回答 思考总结 记录笔记
教 学 过 程 教师活动 学生活动
(3)含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2。 常见的还原剂 (1)活泼或较活泼的金属:K、Ca、Na、Al、Mg、Zn(按金属活动性顺序,还原性递减)。 (2)含低价金属阳离子的化合物:Fe2+。 (3)某些非金属单质:C、H2。 (4)含有较低化合价元素的化合物:HCl、H2S、HI。 【总结】 氧化还原反应和日常生产、生活密切相关,它对我们既有贡献又有害处,如酿酒、燃料燃烧都是利用氧还反应,但铁生锈、易燃物自然等也是氧还反应。在学习了化学后就可以充分去避免氧还反应的危害,最大限度的利用它来为人类服务。 【作业】 重点讲解 板书 课堂总结 作业布置 记录笔记 记录作业
板书设计 3.1氧化还原反应 氧化还原反应 二、氧化剂与还原剂 1、概念 1、概念 2、判断依据 2、表示方法 3、实质 3、常见的氧化剂与还原剂
教学课后小结
