化学人教版(2019)选择性必修1 4.3金属的腐蚀与防护(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.3金属的腐蚀与防护(共34张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 16:34:25 | ||
图片预览











文档简介
(共34张PPT)
第四章 化学反应与电能
第三节 金属的防护与腐蚀
金属的腐蚀在生活中非常普遍
【阅读课本】P111-112回答以下问题:
1. 什么是金属腐蚀?其本质是什么?
2. 金属的腐蚀可分为哪两类,两者有何不同?
一、金属的电化学腐蚀
金属腐蚀是金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象
实质:金属M-ne-→Mn+(氧化反应)
化学腐蚀
电化学腐蚀
金属与其表面接触的一些物质(O2、SO2、Cl2)直接反应而引起的腐蚀
不纯的金属与电解质溶液接触时发生原电池反应,比较活泼的金属发生氧化还原反应而被腐蚀
化学腐蚀 电化学腐蚀
条件
现象
本质
影响 因素
联系 金属与其表面接触的一些物质(O2、SO2、Cl2)直接反应
不纯的金属与电解质溶液接触时发生原电池反应
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
化学腐蚀与电化学腐蚀的比较
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
【阅读课本】P111-112回答以下问题:
3. 电化学腐蚀(以钢铁腐蚀为例)可分为哪些种类?它们的区别在哪里?
一、金属的电化学腐蚀
析氢腐蚀和吸氧腐蚀
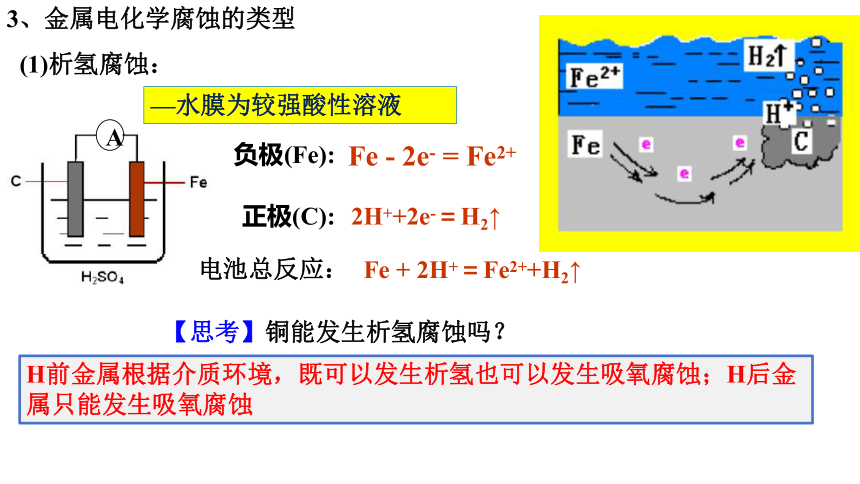
3、金属电化学腐蚀的类型
(1)析氢腐蚀:
A
—水膜为较强酸性溶液
H前金属根据介质环境,既可以发生析氢也可以发生吸氧腐蚀;H后金属只能发生吸氧腐蚀
【思考】铜能发生析氢腐蚀吗?
负极(Fe):
正极(C):
Fe - 2e- = Fe2+
2H++2e-=H2↑
Fe + 2H+=Fe2++H2↑
电池总反应:
(2) 吸氧腐蚀
——水膜呈弱酸性或中性溶液
Fe - 2e- = Fe2+
负极(Fe):
正极(C):
2H2O + O2+ 4e-=4OH-
电池总反应:
进一步:
2Fe+ O2+2H2O =2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3 = Fe2O3·xH2O + (3-x)H2O
学以致用 提升关键能力 校本P141
1.某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。对该条件下铁
制品发生电化学腐蚀的叙述正确的是 ( )
A.该电化学腐蚀是析氢腐蚀
B.正极反应式:C.原电池反应减缓了铁制品的腐蚀
D.负极反应式:<
A
【实验4-3】(1)将经过酸洗除锈的铁钉用饱和食盐水浸泡一下如下图所示具支试管中,几分钟后,观察到导管中水柱的变化,解释引起这种变化的原因
实验现象
实验结论
装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀腐蚀
导管中有水柱上升(消耗气体),铁钉表面有铁锈生成
装置中进一步反应:
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3 2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O(脱水)
铁锈主要成分Fe2O3·xH2O
实验现象
实验结论
盐酸浸泡过的铁钉
装置中铁、碳和盐酸构成原电池,
铁钉发生析氢腐蚀腐蚀
导管中有水柱下降(生成气体),铁钉表面有铁锈生成
【实验4-3】变式:将经过酸洗除锈的铁钉用盐酸浸泡一下如下图所示具支试管中,几分钟后,观察到导管中水柱的变化,解释引起这种变化的原因
校本P141
2.如图,小试管内为红墨水,具支试管内盛有的雨水和生铁片。实
验观察到开始时导管内液面下降,一段时间后导管内液面回升,略高于小
试管内液面。下列说法正确的是( )
A.生铁片中的碳是原电池的负极,发生氧化反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.液面回升时,碳电极反应式为>
D.具支试管中溶液酸性增强
C
校本P144
5.(2023·三明高二月考)钢铁很容易因生锈而被腐蚀。
Ⅰ.如图装置中形管内为红墨水、试管内分别盛
有氯化铵溶液和食盐水中的一种,各加入生铁块,放置一
段时间均被腐蚀,这两种腐蚀都属于________腐蚀。
电化学
(1)红墨水柱两边的液面变为左低右高,则___(填“”或“ ”)试管内
盛有食盐水。
(2)试管中铁发生的是______腐蚀。
吸氧
实验现象
实验解释
①试管中产生气泡速率比②试管中大
【实验4-3】(2)取两支试管,分别放入两颗锌粒和的体积等浓度的稀盐酸,观察现象。然后,向一只试管中滴加1~2滴硫酸铜溶液,在观察现象。解释产生不同现象的原因。
与反应生成、和稀盐酸
构成原电池,发生电化学腐蚀,产生气泡的
速率更大
判断金属腐蚀快慢的规律
1、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀> 防腐措施的腐蚀
2、对同一种金属来说,腐蚀的快慢:
3、活泼性不同的两金属,活泼性差别越大,腐蚀越快。
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
4、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
1.下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是____________。
④>②>①>③
电解原理引起的腐蚀
>原电池原理引起的腐蚀
>有防护措施的腐蚀
>化学腐蚀
校本P143
【自我诊断】校本P141
(1)无论化学腐蚀还是电化学腐蚀,都是金属失电子被氧化的过程( )
√
(2)因为普遍存在,所以钢铁的腐蚀以析氢腐蚀为主( )
×
(3)铜在酸性条件下也可以发生析氢腐蚀( )
×
(4)钢铁发生电化学腐蚀的负极反应式为( )
×
(5)钢铁的析氢腐蚀和吸氧腐蚀的区别在于前者有生成,后者有
加( )
√
(6)纯铁不易腐蚀,生铁易腐蚀,是因为生铁中含碳,能形成原电池,
发生电化学腐蚀( )
√
校本P141
3.是海洋大气环境中金属表面的主要
固体沉积物之一,颗粒落在金属表面
上,具有很强的吸湿性,促进了金属的腐
蚀。下图为碳钢基体在大气环境中
A.腐蚀过程中为负极,发生氧化反应
B.正极反应式为
C.对腐蚀反应起催化作用
D.随着锈层不断增厚,腐蚀速率增大
发生电化学腐蚀的原理示意图。下列说法不正确的是( )
D
二、金属的防护
(一)目的:防止金属被氧化
(二)依据:依据金属腐蚀的化学反应原理和腐蚀类型来确定金属防护的方法
(三)金属防护的方法
1、改变金属材料的组成
2、在金属表面覆盖保护层
3、电化学保护法
1、改变金属材料的组成
在金属中添加其他金属或非金属可以制成性能优异的合金。
例如,不锈钢、钛合金等。
2、在金属表面覆盖保护层(覆盖致密的保护层)
(1)非金属保护层:①喷涂漆;②涂油脂;③覆盖搪瓷、塑料
(2)金属保护层:电镀(在钢铁表面形成铬等耐腐蚀性较强的金属镀层)
搪瓷(táng cí),是将无机玻璃质材料通过熔融凝于基体金属上并与金属牢固结合在一起的一种复合材料。
2、在金属表面覆盖保护层(覆盖致密的保护层)
发蓝是钢铁零件表面处理的一种防腐蚀的工艺。其原理就是在钢铁表面生成一定厚度和强度的致密的氧化层,成分主要是Fe3O4
(4)钝化处理
(3)发蓝处理(致密的Fe3O4膜);
利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。另外,采用离子注入、表面渗镀等方式在金属表面也可以形成稳定的钝化膜。
3、电化学防护法
原理:原电池原理
(1)牺牲阳极法
要求:活泼性强的金属作负极,被保护金属作正极。
★牺牲阳极法的实验探究
教材P114 【实验4-4】(1)以Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液做电解质溶液,按图链接装置。观察电流表指针变化,以及两烧杯中电极附近发生的现象。过一段时间,用胶头滴管从电极区域取少量溶液于试管中,再向试管中滴入2滴(铁氰化钾)溶液,观察试管中溶液颜色的变化。
实验现象 电流表 阳极(负极区) 阴极(正极区)
______________ __________ ____气泡产生,____
蓝色沉淀生成
有关反应 - _________________ __________________
指针发生偏转
逐渐溶解
有
无
实验结论:锌片、铁片酸化的氯化钠溶液构成原电池,锌失电子,被腐蚀,铁被保护。
教材P114【实验4-4】(2)将1g的琼脂加入250ml烧杯中,再加入50ml饱和
食盐水 和150ml水。搅拌、加热煮沸,是琼脂溶解。稍冷后,趁热吧琼脂
溶液分别倒入两个培养皿中各滴入滴酚酞溶液和溶液,混
合均匀。取两个长的铁钉,用砂纸擦光。将裹有锌皮的铁钉放入a
培养皿,缠有铜丝的铁钉放入 培养皿。
(a) (b)
实验现象 铁钉周围______ 铁钉周围生成__________,铜丝周
围______
有关反应
实验结论 变红
蓝色沉淀
变红
;
,;
<
(a) (b)
铁作为负极时易被腐蚀,作为正极时未被腐蚀
白铁皮:锌比铁活泼,破损时与水膜构成原电池时,锌作负极失电子被氧化而腐蚀,铁作正极被保护。
马口铁:铁比锡活泼,破损时与水膜构成原电池时,铁作负极失电子被氧化而易腐蚀。
教材P112
要求:被保护的金属与外接电源负极相连作阴极。
(2)外加电流法
原理:电解池原理
教材P112
牺牲阳极法:
外加电流法:
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,惰性电极和金属均可作辅助阳极,但最好选用惰性电极,本身不被腐蚀而消耗)
一般而言,外加电流法比牺牲阳极法保护效果更好。
学以致用 提升关键能力校本P143
1.下列有关金属铁的腐蚀与防护,说法正确的是( )
A.在钢铁表面进行发蓝处理,生成四氧化三铁薄膜保护金属
B.在铁表面覆盖保护层,若保护层破损后,就完全失去了对铁的保护作用
C.铁与电源正极连接可实现电化学保护
D.阳极氧化处理铝制品生成致密的保护膜属于电化学保护法
A
校本P143
1.(2023·绵阳南山中学高二阶段练习)下列关于金属的腐蚀和防护说法不正
确的是( )
A.一般情况下,金属主要发生吸氧腐蚀
B.在轮船的船体上镶嵌锌块属于外加电流法
C.白铁(镀锌铁)镀层破损后不会导致铁迅速锈蚀
D.家用菜刀切完咸菜后应冲洗干净并擦干水渍
B
校本P143
2.相同材质的铁在下图中的各情形下最不易被腐蚀的是( )
A.&1& B. C.&3& D.&4&
C
校本P143
2.下列对如图所示的实验装置的判断错误的是( )
A.若为碳棒,开关置于处可减缓铁的腐蚀
B.若 为锌棒,开关置于 或处均可减缓铁的腐蚀
C.若为锌棒,开关置于处时,为牺牲阳极法
D.若为碳棒,开关置于处时,铁电极上发生的反应
为
D
校本P143
3.国产航母山东舰已经列装服役,它是
采用模块制造然后焊接组装而成的,对
焊接有着极高的要求。实验室模拟在海
水环境和河水环境下对焊接金属材料使
A.图示的金属腐蚀情况说明了的金属活动性强于
B.由图示可以看出甲是在海水环境下的腐蚀情况,乙是在河水环境下的腐
蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
用的影响(如图甲、乙)。下列相关描述正确的是( )
D
第四章 化学反应与电能
第三节 金属的防护与腐蚀
金属的腐蚀在生活中非常普遍
【阅读课本】P111-112回答以下问题:
1. 什么是金属腐蚀?其本质是什么?
2. 金属的腐蚀可分为哪两类,两者有何不同?
一、金属的电化学腐蚀
金属腐蚀是金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象
实质:金属M-ne-→Mn+(氧化反应)
化学腐蚀
电化学腐蚀
金属与其表面接触的一些物质(O2、SO2、Cl2)直接反应而引起的腐蚀
不纯的金属与电解质溶液接触时发生原电池反应,比较活泼的金属发生氧化还原反应而被腐蚀
化学腐蚀 电化学腐蚀
条件
现象
本质
影响 因素
联系 金属与其表面接触的一些物质(O2、SO2、Cl2)直接反应
不纯的金属与电解质溶液接触时发生原电池反应
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
化学腐蚀与电化学腐蚀的比较
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
【阅读课本】P111-112回答以下问题:
3. 电化学腐蚀(以钢铁腐蚀为例)可分为哪些种类?它们的区别在哪里?
一、金属的电化学腐蚀
析氢腐蚀和吸氧腐蚀
3、金属电化学腐蚀的类型
(1)析氢腐蚀:
A
—水膜为较强酸性溶液
H前金属根据介质环境,既可以发生析氢也可以发生吸氧腐蚀;H后金属只能发生吸氧腐蚀
【思考】铜能发生析氢腐蚀吗?
负极(Fe):
正极(C):
Fe - 2e- = Fe2+
2H++2e-=H2↑
Fe + 2H+=Fe2++H2↑
电池总反应:
(2) 吸氧腐蚀
——水膜呈弱酸性或中性溶液
Fe - 2e- = Fe2+
负极(Fe):
正极(C):
2H2O + O2+ 4e-=4OH-
电池总反应:
进一步:
2Fe+ O2+2H2O =2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3 = Fe2O3·xH2O + (3-x)H2O
学以致用 提升关键能力 校本P141
1.某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。对该条件下铁
制品发生电化学腐蚀的叙述正确的是 ( )
A.该电化学腐蚀是析氢腐蚀
B.正极反应式:C.原电池反应减缓了铁制品的腐蚀
D.负极反应式:<
A
【实验4-3】(1)将经过酸洗除锈的铁钉用饱和食盐水浸泡一下如下图所示具支试管中,几分钟后,观察到导管中水柱的变化,解释引起这种变化的原因
实验现象
实验结论
装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀腐蚀
导管中有水柱上升(消耗气体),铁钉表面有铁锈生成
装置中进一步反应:
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3 2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O(脱水)
铁锈主要成分Fe2O3·xH2O
实验现象
实验结论
盐酸浸泡过的铁钉
装置中铁、碳和盐酸构成原电池,
铁钉发生析氢腐蚀腐蚀
导管中有水柱下降(生成气体),铁钉表面有铁锈生成
【实验4-3】变式:将经过酸洗除锈的铁钉用盐酸浸泡一下如下图所示具支试管中,几分钟后,观察到导管中水柱的变化,解释引起这种变化的原因
校本P141
2.如图,小试管内为红墨水,具支试管内盛有的雨水和生铁片。实
验观察到开始时导管内液面下降,一段时间后导管内液面回升,略高于小
试管内液面。下列说法正确的是( )
A.生铁片中的碳是原电池的负极,发生氧化反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.液面回升时,碳电极反应式为>
D.具支试管中溶液酸性增强
C
校本P144
5.(2023·三明高二月考)钢铁很容易因生锈而被腐蚀。
Ⅰ.如图装置中形管内为红墨水、试管内分别盛
有氯化铵溶液和食盐水中的一种,各加入生铁块,放置一
段时间均被腐蚀,这两种腐蚀都属于________腐蚀。
电化学
(1)红墨水柱两边的液面变为左低右高,则___(填“”或“ ”)试管内
盛有食盐水。
(2)试管中铁发生的是______腐蚀。
吸氧
实验现象
实验解释
①试管中产生气泡速率比②试管中大
【实验4-3】(2)取两支试管,分别放入两颗锌粒和的体积等浓度的稀盐酸,观察现象。然后,向一只试管中滴加1~2滴硫酸铜溶液,在观察现象。解释产生不同现象的原因。
与反应生成、和稀盐酸
构成原电池,发生电化学腐蚀,产生气泡的
速率更大
判断金属腐蚀快慢的规律
1、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀> 防腐措施的腐蚀
2、对同一种金属来说,腐蚀的快慢:
3、活泼性不同的两金属,活泼性差别越大,腐蚀越快。
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
4、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
1.下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是____________。
④>②>①>③
电解原理引起的腐蚀
>原电池原理引起的腐蚀
>有防护措施的腐蚀
>化学腐蚀
校本P143
【自我诊断】校本P141
(1)无论化学腐蚀还是电化学腐蚀,都是金属失电子被氧化的过程( )
√
(2)因为普遍存在,所以钢铁的腐蚀以析氢腐蚀为主( )
×
(3)铜在酸性条件下也可以发生析氢腐蚀( )
×
(4)钢铁发生电化学腐蚀的负极反应式为( )
×
(5)钢铁的析氢腐蚀和吸氧腐蚀的区别在于前者有生成,后者有
加( )
√
(6)纯铁不易腐蚀,生铁易腐蚀,是因为生铁中含碳,能形成原电池,
发生电化学腐蚀( )
√
校本P141
3.是海洋大气环境中金属表面的主要
固体沉积物之一,颗粒落在金属表面
上,具有很强的吸湿性,促进了金属的腐
蚀。下图为碳钢基体在大气环境中
A.腐蚀过程中为负极,发生氧化反应
B.正极反应式为
C.对腐蚀反应起催化作用
D.随着锈层不断增厚,腐蚀速率增大
发生电化学腐蚀的原理示意图。下列说法不正确的是( )
D
二、金属的防护
(一)目的:防止金属被氧化
(二)依据:依据金属腐蚀的化学反应原理和腐蚀类型来确定金属防护的方法
(三)金属防护的方法
1、改变金属材料的组成
2、在金属表面覆盖保护层
3、电化学保护法
1、改变金属材料的组成
在金属中添加其他金属或非金属可以制成性能优异的合金。
例如,不锈钢、钛合金等。
2、在金属表面覆盖保护层(覆盖致密的保护层)
(1)非金属保护层:①喷涂漆;②涂油脂;③覆盖搪瓷、塑料
(2)金属保护层:电镀(在钢铁表面形成铬等耐腐蚀性较强的金属镀层)
搪瓷(táng cí),是将无机玻璃质材料通过熔融凝于基体金属上并与金属牢固结合在一起的一种复合材料。
2、在金属表面覆盖保护层(覆盖致密的保护层)
发蓝是钢铁零件表面处理的一种防腐蚀的工艺。其原理就是在钢铁表面生成一定厚度和强度的致密的氧化层,成分主要是Fe3O4
(4)钝化处理
(3)发蓝处理(致密的Fe3O4膜);
利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。另外,采用离子注入、表面渗镀等方式在金属表面也可以形成稳定的钝化膜。
3、电化学防护法
原理:原电池原理
(1)牺牲阳极法
要求:活泼性强的金属作负极,被保护金属作正极。
★牺牲阳极法的实验探究
教材P114 【实验4-4】(1)以Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液做电解质溶液,按图链接装置。观察电流表指针变化,以及两烧杯中电极附近发生的现象。过一段时间,用胶头滴管从电极区域取少量溶液于试管中,再向试管中滴入2滴(铁氰化钾)溶液,观察试管中溶液颜色的变化。
实验现象 电流表 阳极(负极区) 阴极(正极区)
______________ __________ ____气泡产生,____
蓝色沉淀生成
有关反应 - _________________ __________________
指针发生偏转
逐渐溶解
有
无
实验结论:锌片、铁片酸化的氯化钠溶液构成原电池,锌失电子,被腐蚀,铁被保护。
教材P114【实验4-4】(2)将1g的琼脂加入250ml烧杯中,再加入50ml饱和
食盐水 和150ml水。搅拌、加热煮沸,是琼脂溶解。稍冷后,趁热吧琼脂
溶液分别倒入两个培养皿中各滴入滴酚酞溶液和溶液,混
合均匀。取两个长的铁钉,用砂纸擦光。将裹有锌皮的铁钉放入a
培养皿,缠有铜丝的铁钉放入 培养皿。
(a) (b)
实验现象 铁钉周围______ 铁钉周围生成__________,铜丝周
围______
有关反应
实验结论 变红
蓝色沉淀
变红
;
,;
<
(a) (b)
铁作为负极时易被腐蚀,作为正极时未被腐蚀
白铁皮:锌比铁活泼,破损时与水膜构成原电池时,锌作负极失电子被氧化而腐蚀,铁作正极被保护。
马口铁:铁比锡活泼,破损时与水膜构成原电池时,铁作负极失电子被氧化而易腐蚀。
教材P112
要求:被保护的金属与外接电源负极相连作阴极。
(2)外加电流法
原理:电解池原理
教材P112
牺牲阳极法:
外加电流法:
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,惰性电极和金属均可作辅助阳极,但最好选用惰性电极,本身不被腐蚀而消耗)
一般而言,外加电流法比牺牲阳极法保护效果更好。
学以致用 提升关键能力校本P143
1.下列有关金属铁的腐蚀与防护,说法正确的是( )
A.在钢铁表面进行发蓝处理,生成四氧化三铁薄膜保护金属
B.在铁表面覆盖保护层,若保护层破损后,就完全失去了对铁的保护作用
C.铁与电源正极连接可实现电化学保护
D.阳极氧化处理铝制品生成致密的保护膜属于电化学保护法
A
校本P143
1.(2023·绵阳南山中学高二阶段练习)下列关于金属的腐蚀和防护说法不正
确的是( )
A.一般情况下,金属主要发生吸氧腐蚀
B.在轮船的船体上镶嵌锌块属于外加电流法
C.白铁(镀锌铁)镀层破损后不会导致铁迅速锈蚀
D.家用菜刀切完咸菜后应冲洗干净并擦干水渍
B
校本P143
2.相同材质的铁在下图中的各情形下最不易被腐蚀的是( )
A.&1& B. C.&3& D.&4&
C
校本P143
2.下列对如图所示的实验装置的判断错误的是( )
A.若为碳棒,开关置于处可减缓铁的腐蚀
B.若 为锌棒,开关置于 或处均可减缓铁的腐蚀
C.若为锌棒,开关置于处时,为牺牲阳极法
D.若为碳棒,开关置于处时,铁电极上发生的反应
为
D
校本P143
3.国产航母山东舰已经列装服役,它是
采用模块制造然后焊接组装而成的,对
焊接有着极高的要求。实验室模拟在海
水环境和河水环境下对焊接金属材料使
A.图示的金属腐蚀情况说明了的金属活动性强于
B.由图示可以看出甲是在海水环境下的腐蚀情况,乙是在河水环境下的腐
蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
用的影响(如图甲、乙)。下列相关描述正确的是( )
D
