北京市西城区部分中学2023-2024学年高二上学期12月月考化学试题(无答案)
文档属性
| 名称 | 北京市西城区部分中学2023-2024学年高二上学期12月月考化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 779.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 21:02:43 | ||
图片预览


文档简介
北京市西城区部分中学2023-2024学年高二上学期12月月考
化学
本试卷共10页,共100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 I 127
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.近年来,我国风电光伏基地建设稳步推进,各类储能项目加快落地,科技创新引领产业升级,助力我国经济高质量发展。下列说法不正确的是( )
A.太阳能电池是利用原电池原理实现电能生产的装置
B.二次电池可以利用电解原理实现电能存储
C.燃料电池放电过程中燃料在负极上发生氧化反应
D.燃料电池对能源的利用率高于火力发电
2.下列化学用语或图示表达正确的是( )
A.CO2的电子式为
B.:电子云图为
C.的VSEPR模型为
D.基态24Cr原子的价层电子轨道表示式为
3.下列事实不能用平衛移动原理解释的是( )
A.密闭烧瓶内的和的混合气体,受热后颜色加深
B.铁钉放入浓中,待不再变化后,加热能产生大量红棕色气体
C.打开可乐汽水瓶盖后有大量气泡冒出
D用制备时加入大量的水,同时加热
4.下列事实不能通过比较元素和氯元素的电负性进行解释的是( )
A.F-F键的键能小于Cl-Cl键的键能 B.H-F键的极性强于H-Cl键的极性
C.ClF3中F呈-1价,C呈+3价 D.AlF3属于离子化合物,AlCl3属于共价化合物
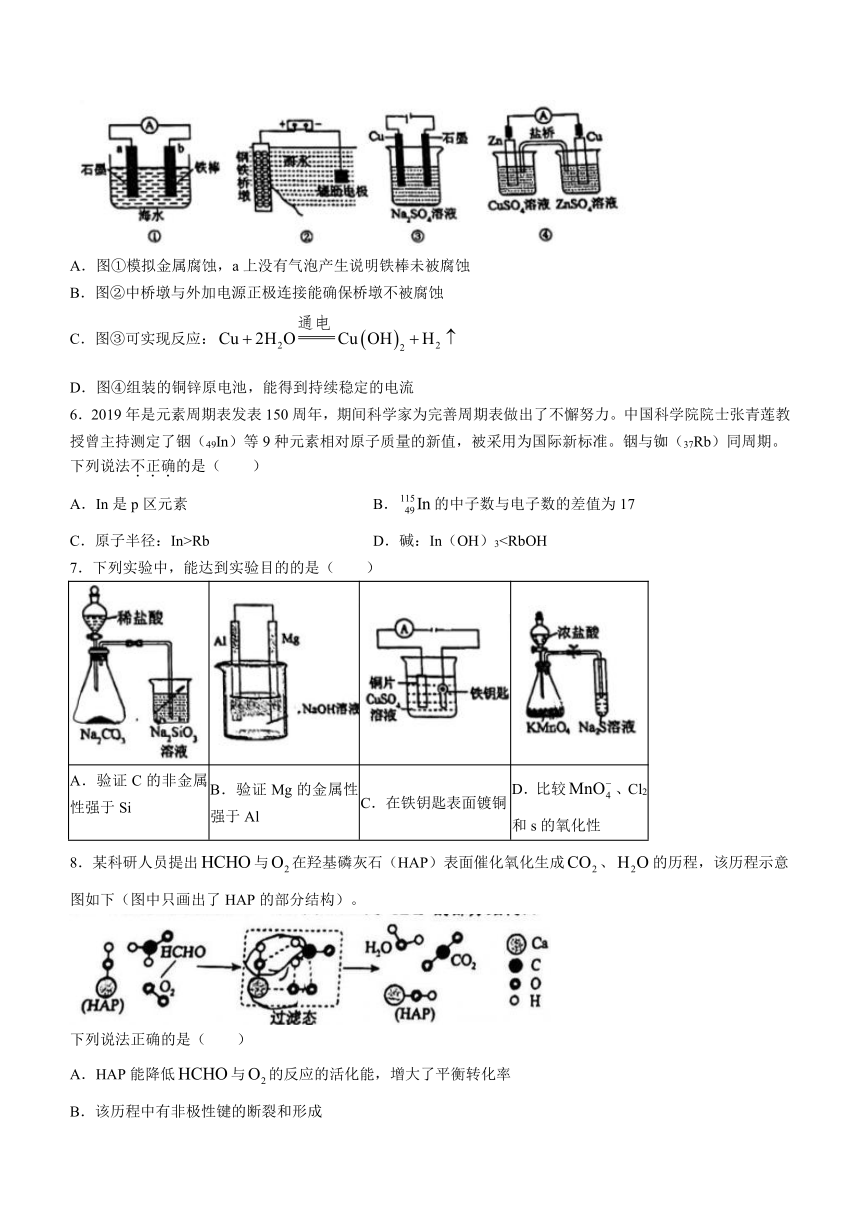
5.下列有关电化学实验装置或图示的说法正确的是( )
A.图①模拟金属腐蚀,a上没有气泡产生说明铁棒未被腐蚀
B.图②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.图③可实现反应:
D.图④组装的铜锌原电池,能得到持续稳定的电流
6.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是p区元素 B.的中子数与电子数的差值为17
C.原子半径:In>Rb D.碱:In(OH)37.下列实验中,能达到实验目的的是( )
A.验证C的非金属性强于Si B.验证Mg的金属性强于Al C.在铁钥匙表面镀铜 D.比较、Cl2和s的氧化性
8.某科研人员提出与在羟基磷灰石(HAP)表面催化氧化生成、的历程,该历程示意图如下(图中只画出了HAP的部分结构)。
下列说法正确的是( )
A.HAP能降低与的反应的活化能,增大了平衡转化率
B.该历程中有非极性键的断裂和形成
C.分子中键与键之比为
D.根据图示信息,分子中的氧原子全部来自
9.HNO自由基与反应过程的能量变化如图所示,下列说法不正确的是( )
A.反应物的键能总和大于生成物的键能总和
B.该历程中最大正反应的活化能
C.相同条件下转化为产物的速率:
D.产物的稳定性:
10.工业上利用和(g)在催化剂的作用下合成,发生如下反应:。现于一定条件下向的密闭容器中充入一定量的和发生反应,测得在不同压强下平衡体系中的转化率随温度的变化情况如图所示。下列说法正确的是( )
A.
B.在条件下,的过程中,平衡向正反应方向移动
C.a、b、c三点对应的平衡常数
D.b→c的过程中,v正减小,v逆增大
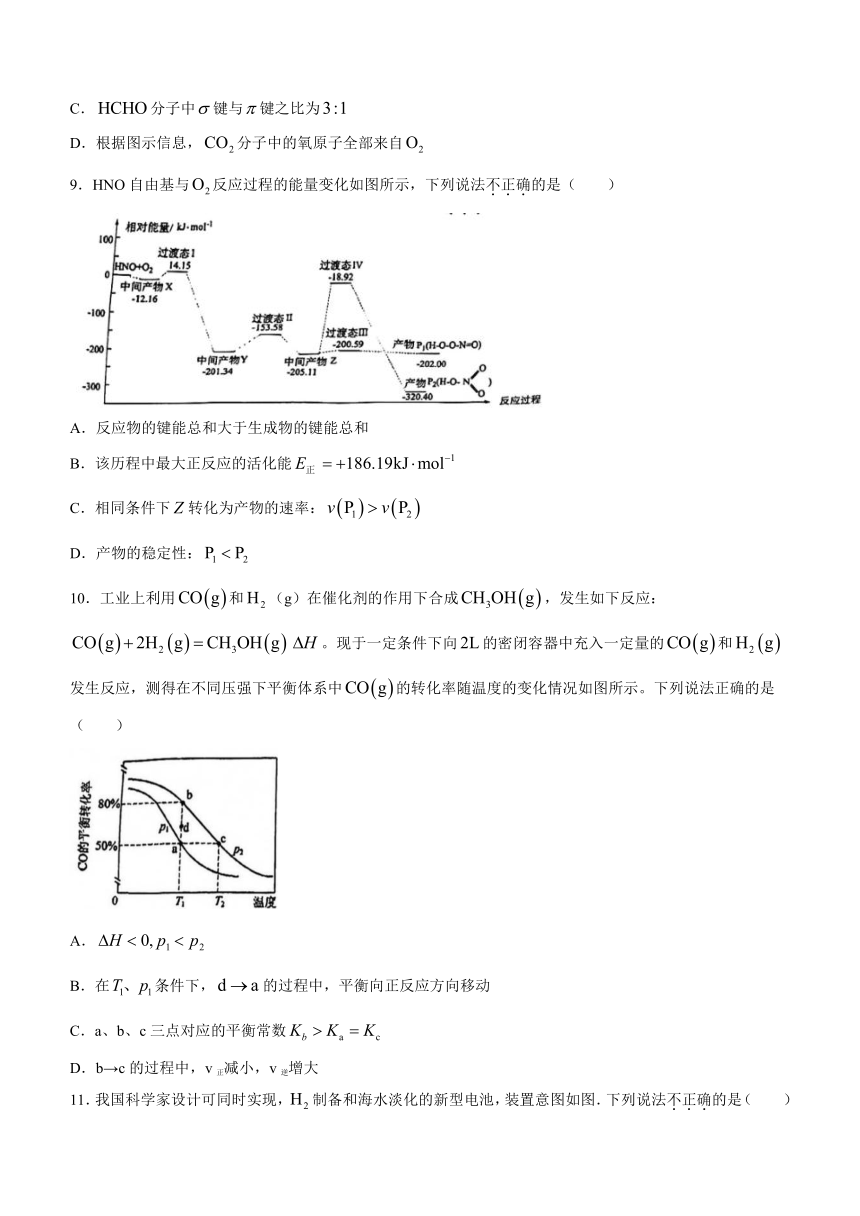
11.我国科学家设计可同时实现,制备和海水淡化的新型电池,装置意图如图.下列说法不正确的是( )
A.电极是正极
B.电极的反应式:
C.每生成,有发生迁移
D.离子交换膜c、d分别是阴离子交换膜和阳离子交换膜
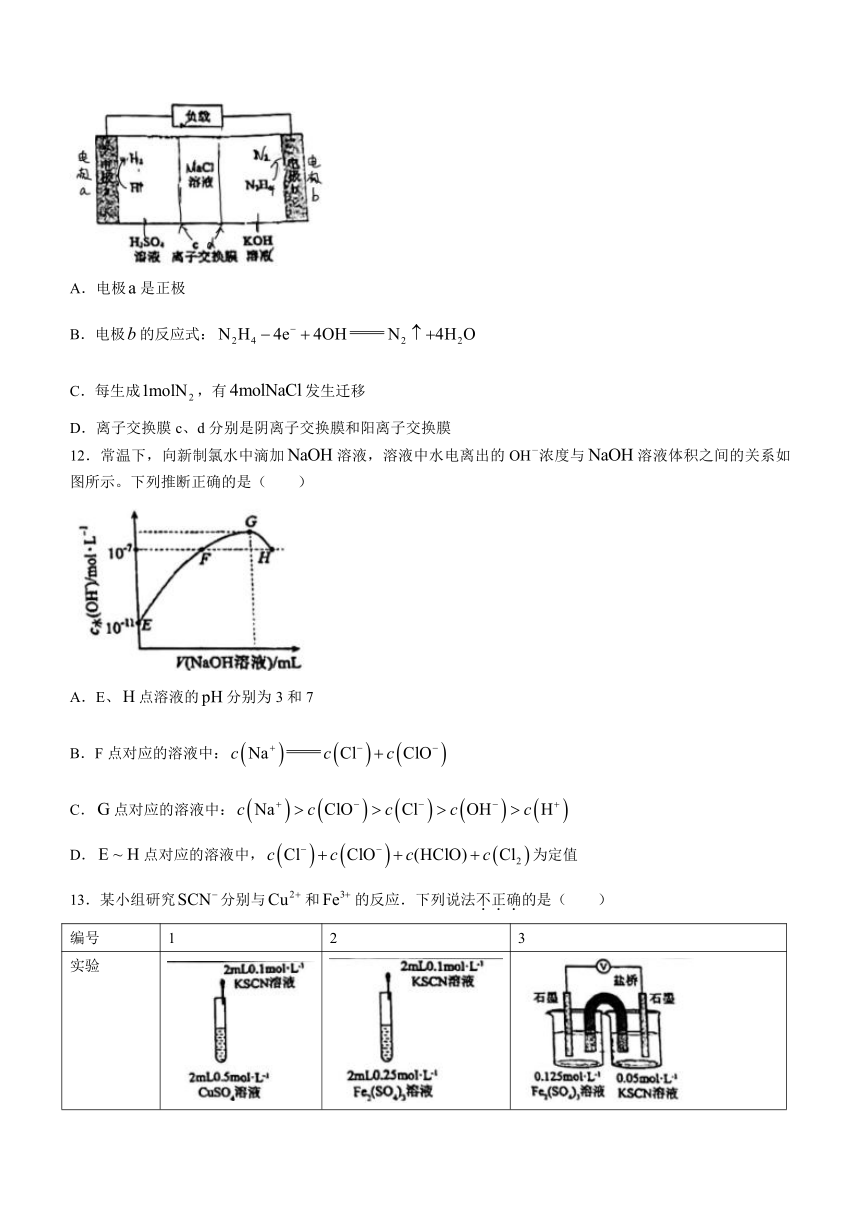
12.常温下,向新制氯水中滴加溶液,溶液中水电离出的OH-浓度与溶液体积之间的关系如图所示。下列推断正确的是( )
A.E、点溶液的分别为3和7
B.F点对应的溶液中:
C.点对应的溶液中:
D.点对应的溶液中,为定值
13.某小组研究分别与和的反应.下列说法不正确的是( )
编号 1 2 3
实验
现象 溶液变为黄绿色,产生白色沉淀(白色沉淀为 CuSCN) 溶液变红,向反应后溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,且沉淀量逐渐增多 接通电路后电压表指针不偏转。一段时间后,取出左侧烧杯中溶液,滴加K3[Fe(CN)6]溶液,未观察到蓝色沉淀
A,实验1中产生白色沉淀说明Cu2+被还原
B.实验2中的现象说明KSCN在溶液中发生了不止一个反应
C.若将实验3中Fe2(SO4)3溶液替换为0.25mol/LCuSO4溶液,接通电路后,可推测出电压表指针会发生偏转
D.综合实验1~3,说明微粒的氧化性与还原产物的价态和状态有关
14.一定温度下,两种碳酸盐的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
A.该温度下,的
B.该温度下,溶解度,
C.欲使点移动到点,可向浊液中加入适量固体
D.反应,正向转化比逆向转化更难实现
第二部分
本部分共5题,共58分。
15.(10分)磷酸铁锂电池是以磷酸铁锂为正极材料的锂离子电池,具有循环寿命长、安全性能好、无环境污染等特点。
(1)磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态的价层电子排布式为______。
②Li、P、O三种元素的电负性由大到小的顺序是______。
(2)硫酸亚铁可用于制备磷酸铁锂。
①根据价层电子对互斥理论可知,的价层电子对数为______,其空间结构为______。
②比较原子和O原子的第一电离能大小,从原子结构的角度说明理由:______。
(3)草酸亚铁也可用于制备磷酸铁锂。草酸根离子的结构简式为,其中碳原子的杂化轨道类型为______。
(4)磷酸铁与磷酸铁锂结构相似,其中围绕和分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,中的会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
①i表示______(填“充电”或“放电”)过程。
②已知Li+的脱嵌率=。某时刻,若正极材料中Li+的脱嵌率为,则其中______。
16.(9分)的资源化利用是实现我国“双碳”目标的有效途径之一。
(1)杭州第19届亚洲运动会开幕式主火炬创新使用“零碳”甲醇燃料,综合利用焦炉气中的与工业尾气中合成绿色甲醇,实现了循环内零碳排放。
①制备甲醇的主反应:该过程中还存在一个生成的副反应,结合反应: 写出该副反应的热化学方程式:______。
②将和按物质的量比混合,以固定流速通过盛放催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
已知:CH3OH产率=
i.催化剂活性最好的温度为______。(填字母序号)
a. 483 K b. 503 K c. 523 K d. 543 K
ii.温度升高时的平衡转化率降低,解释原因:______。
iii.温度由升到的实验产率降低,解释原因:______。
(2)近年研究发现,电催化和含氮物质等)在常温常压下合成尿素,有助于实现碳中和及解决含食废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成,电解原理如右图所示。
①电极是电解池的______极。
②电解过程中生成尿素的电极反应式是______。
17.(12分)维生素是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为。某小组同学测定了某新鲜水果中维生素的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素的含量。
【实验原理】。
【实验用品】标准溶液、指示剂、溶液、溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素的性质,待测溶液应用______(填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液于锥形瓶中,调节至3,加入适量指示剂后,小心地滴入标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素的质量分数。
①上述氧化还原滴定法应用______作指示剂,滴定终点的现象为______。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有______。
(3)库仑滴定法:取(1)中配制好的待测溶液,用库仑仪测定其中维生素的含量。平行测定三次,计算新鲜水果中维生素的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。将待测溶液加入电解池后,维生米将还原,库仑仪便立即自动进行电解到又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素的含量。
①库仑仪工作时电解池的阳极反应式为______。
②若电解消耗的电量为库仑,维生素的摩尔质量为,则新鲜水果中维生素的质量分数为______。(用含的代数式表示)
已知:电解中转移电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液,当时,部分易被空气中的直接氧化为,该过程的离子方程式为______。这部分非电解生成的;将导致测得的维生素的含量______。(填“偏大”或“偏小”)。
18.(14分)利用含锶废渣制备晶体的流程如下。
已知:i.含锶废渣中主要以和的形式存在
ii.
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是______。
②已知溶液显弱碱性,结合化学用语解释其原因:______。
③转化过程中,向中加入氨水,提高溶液,目的是提高______。(填粒子符号)的浓度,将转化为。
(2)溶出
溶出过程发生反应的离子方程式是______。
(3)纯化
溶出液中除了含有外,还含有和少量等杂质,其中与近似相等。纯化过程涉及操作如下。
已知:iii.和沉淀时的(金属离子浓度均为):
氢氧化物 开始沉降 沉淀完全 沉淀开始溶解
2.3 4.1 -
4.0 5.2 7.8
iv.和在不同温度下的溶解度:
温度/℃ 溶解度/g 氢氧化物 20 40 60 80 90
1.77 3.95 8.42 20.2 44.5
0.173 0.141 0.121 0.094 0.086
①为了除去溶出液中的和,应调节范围为______。
②滤液1中加入适量调节至14和升温至有利于析出的原因是______。
③时,______。(填“>”或“<”)
④操作是加热浓缩、______、______、洗涤。
19.(13分)某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含元素的常见粒子:(橙色)、(黄色)、(溶于水、蓝紫色,不稳定)、(绿色)、(蓝灰色,难溶于水,可溶于强酸、强碱)、(亮绿色)。
ii.在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,不能氧化+3价铬元素。
实验操作及现象如下:
装置 步骤 操作 现象
2mL0.0125mol·L-1K2Cr2O7溶液 I 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色
II 继续缓慢滴入10滴2mol·L-1NaOH溶液,边滴,边振荡 又有气泡生成,溶液最终变为黄色
(1)已知。请用化学平衡移动原理解释中滴入稀硫酸后溶液橙色加深的原因:______。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是______。
(3)II中,继续滴入NaOH溶液后,又有气泡生成的原因是______。
(4)II中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立;
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
右侧烧杯的溶液中,氧化剂是______。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入溶液,出现蓝灰色沉淀,继续缓慢滴入溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为______。
ii.向右侧烧杯中滴入溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为______。
(5)由上述实验,与与的氧化性强弱(填“>”或“<”);酸性条件下,______;碱性条件下,______。
化学
本试卷共10页,共100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 I 127
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.近年来,我国风电光伏基地建设稳步推进,各类储能项目加快落地,科技创新引领产业升级,助力我国经济高质量发展。下列说法不正确的是( )
A.太阳能电池是利用原电池原理实现电能生产的装置
B.二次电池可以利用电解原理实现电能存储
C.燃料电池放电过程中燃料在负极上发生氧化反应
D.燃料电池对能源的利用率高于火力发电
2.下列化学用语或图示表达正确的是( )
A.CO2的电子式为
B.:电子云图为
C.的VSEPR模型为
D.基态24Cr原子的价层电子轨道表示式为
3.下列事实不能用平衛移动原理解释的是( )
A.密闭烧瓶内的和的混合气体,受热后颜色加深
B.铁钉放入浓中,待不再变化后,加热能产生大量红棕色气体
C.打开可乐汽水瓶盖后有大量气泡冒出
D用制备时加入大量的水,同时加热
4.下列事实不能通过比较元素和氯元素的电负性进行解释的是( )
A.F-F键的键能小于Cl-Cl键的键能 B.H-F键的极性强于H-Cl键的极性
C.ClF3中F呈-1价,C呈+3价 D.AlF3属于离子化合物,AlCl3属于共价化合物
5.下列有关电化学实验装置或图示的说法正确的是( )
A.图①模拟金属腐蚀,a上没有气泡产生说明铁棒未被腐蚀
B.图②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.图③可实现反应:
D.图④组装的铜锌原电池,能得到持续稳定的电流
6.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是p区元素 B.的中子数与电子数的差值为17
C.原子半径:In>Rb D.碱:In(OH)3
A.验证C的非金属性强于Si B.验证Mg的金属性强于Al C.在铁钥匙表面镀铜 D.比较、Cl2和s的氧化性
8.某科研人员提出与在羟基磷灰石(HAP)表面催化氧化生成、的历程,该历程示意图如下(图中只画出了HAP的部分结构)。
下列说法正确的是( )
A.HAP能降低与的反应的活化能,增大了平衡转化率
B.该历程中有非极性键的断裂和形成
C.分子中键与键之比为
D.根据图示信息,分子中的氧原子全部来自
9.HNO自由基与反应过程的能量变化如图所示,下列说法不正确的是( )
A.反应物的键能总和大于生成物的键能总和
B.该历程中最大正反应的活化能
C.相同条件下转化为产物的速率:
D.产物的稳定性:
10.工业上利用和(g)在催化剂的作用下合成,发生如下反应:。现于一定条件下向的密闭容器中充入一定量的和发生反应,测得在不同压强下平衡体系中的转化率随温度的变化情况如图所示。下列说法正确的是( )
A.
B.在条件下,的过程中,平衡向正反应方向移动
C.a、b、c三点对应的平衡常数
D.b→c的过程中,v正减小,v逆增大
11.我国科学家设计可同时实现,制备和海水淡化的新型电池,装置意图如图.下列说法不正确的是( )
A.电极是正极
B.电极的反应式:
C.每生成,有发生迁移
D.离子交换膜c、d分别是阴离子交换膜和阳离子交换膜
12.常温下,向新制氯水中滴加溶液,溶液中水电离出的OH-浓度与溶液体积之间的关系如图所示。下列推断正确的是( )
A.E、点溶液的分别为3和7
B.F点对应的溶液中:
C.点对应的溶液中:
D.点对应的溶液中,为定值
13.某小组研究分别与和的反应.下列说法不正确的是( )
编号 1 2 3
实验
现象 溶液变为黄绿色,产生白色沉淀(白色沉淀为 CuSCN) 溶液变红,向反应后溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,且沉淀量逐渐增多 接通电路后电压表指针不偏转。一段时间后,取出左侧烧杯中溶液,滴加K3[Fe(CN)6]溶液,未观察到蓝色沉淀
A,实验1中产生白色沉淀说明Cu2+被还原
B.实验2中的现象说明KSCN在溶液中发生了不止一个反应
C.若将实验3中Fe2(SO4)3溶液替换为0.25mol/LCuSO4溶液,接通电路后,可推测出电压表指针会发生偏转
D.综合实验1~3,说明微粒的氧化性与还原产物的价态和状态有关
14.一定温度下,两种碳酸盐的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
A.该温度下,的
B.该温度下,溶解度,
C.欲使点移动到点,可向浊液中加入适量固体
D.反应,正向转化比逆向转化更难实现
第二部分
本部分共5题,共58分。
15.(10分)磷酸铁锂电池是以磷酸铁锂为正极材料的锂离子电池,具有循环寿命长、安全性能好、无环境污染等特点。
(1)磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态的价层电子排布式为______。
②Li、P、O三种元素的电负性由大到小的顺序是______。
(2)硫酸亚铁可用于制备磷酸铁锂。
①根据价层电子对互斥理论可知,的价层电子对数为______,其空间结构为______。
②比较原子和O原子的第一电离能大小,从原子结构的角度说明理由:______。
(3)草酸亚铁也可用于制备磷酸铁锂。草酸根离子的结构简式为,其中碳原子的杂化轨道类型为______。
(4)磷酸铁与磷酸铁锂结构相似,其中围绕和分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,中的会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
①i表示______(填“充电”或“放电”)过程。
②已知Li+的脱嵌率=。某时刻,若正极材料中Li+的脱嵌率为,则其中______。
16.(9分)的资源化利用是实现我国“双碳”目标的有效途径之一。
(1)杭州第19届亚洲运动会开幕式主火炬创新使用“零碳”甲醇燃料,综合利用焦炉气中的与工业尾气中合成绿色甲醇,实现了循环内零碳排放。
①制备甲醇的主反应:该过程中还存在一个生成的副反应,结合反应: 写出该副反应的热化学方程式:______。
②将和按物质的量比混合,以固定流速通过盛放催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
已知:CH3OH产率=
i.催化剂活性最好的温度为______。(填字母序号)
a. 483 K b. 503 K c. 523 K d. 543 K
ii.温度升高时的平衡转化率降低,解释原因:______。
iii.温度由升到的实验产率降低,解释原因:______。
(2)近年研究发现,电催化和含氮物质等)在常温常压下合成尿素,有助于实现碳中和及解决含食废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成,电解原理如右图所示。
①电极是电解池的______极。
②电解过程中生成尿素的电极反应式是______。
17.(12分)维生素是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为。某小组同学测定了某新鲜水果中维生素的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素的含量。
【实验原理】。
【实验用品】标准溶液、指示剂、溶液、溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素的性质,待测溶液应用______(填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液于锥形瓶中,调节至3,加入适量指示剂后,小心地滴入标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素的质量分数。
①上述氧化还原滴定法应用______作指示剂,滴定终点的现象为______。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有______。
(3)库仑滴定法:取(1)中配制好的待测溶液,用库仑仪测定其中维生素的含量。平行测定三次,计算新鲜水果中维生素的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。将待测溶液加入电解池后,维生米将还原,库仑仪便立即自动进行电解到又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素的含量。
①库仑仪工作时电解池的阳极反应式为______。
②若电解消耗的电量为库仑,维生素的摩尔质量为,则新鲜水果中维生素的质量分数为______。(用含的代数式表示)
已知:电解中转移电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液,当时,部分易被空气中的直接氧化为,该过程的离子方程式为______。这部分非电解生成的;将导致测得的维生素的含量______。(填“偏大”或“偏小”)。
18.(14分)利用含锶废渣制备晶体的流程如下。
已知:i.含锶废渣中主要以和的形式存在
ii.
(1)转化
①转化前,含锶废渣需要粉碎研磨的目的是______。
②已知溶液显弱碱性,结合化学用语解释其原因:______。
③转化过程中,向中加入氨水,提高溶液,目的是提高______。(填粒子符号)的浓度,将转化为。
(2)溶出
溶出过程发生反应的离子方程式是______。
(3)纯化
溶出液中除了含有外,还含有和少量等杂质,其中与近似相等。纯化过程涉及操作如下。
已知:iii.和沉淀时的(金属离子浓度均为):
氢氧化物 开始沉降 沉淀完全 沉淀开始溶解
2.3 4.1 -
4.0 5.2 7.8
iv.和在不同温度下的溶解度:
温度/℃ 溶解度/g 氢氧化物 20 40 60 80 90
1.77 3.95 8.42 20.2 44.5
0.173 0.141 0.121 0.094 0.086
①为了除去溶出液中的和,应调节范围为______。
②滤液1中加入适量调节至14和升温至有利于析出的原因是______。
③时,______。(填“>”或“<”)
④操作是加热浓缩、______、______、洗涤。
19.(13分)某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含元素的常见粒子:(橙色)、(黄色)、(溶于水、蓝紫色,不稳定)、(绿色)、(蓝灰色,难溶于水,可溶于强酸、强碱)、(亮绿色)。
ii.在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,不能氧化+3价铬元素。
实验操作及现象如下:
装置 步骤 操作 现象
2mL0.0125mol·L-1K2Cr2O7溶液 I 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色
II 继续缓慢滴入10滴2mol·L-1NaOH溶液,边滴,边振荡 又有气泡生成,溶液最终变为黄色
(1)已知。请用化学平衡移动原理解释中滴入稀硫酸后溶液橙色加深的原因:______。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是______。
(3)II中,继续滴入NaOH溶液后,又有气泡生成的原因是______。
(4)II中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立;
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
右侧烧杯的溶液中,氧化剂是______。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入溶液,出现蓝灰色沉淀,继续缓慢滴入溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为______。
ii.向右侧烧杯中滴入溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为______。
(5)由上述实验,与与的氧化性强弱(填“>”或“<”);酸性条件下,______;碱性条件下,______。
同课章节目录
