辽宁省沈阳市名校2023-2024学年高二上学期12月第二次月考化学试题(PDF版含答案)
文档属性
| 名称 | 辽宁省沈阳市名校2023-2024学年高二上学期12月第二次月考化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 454.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 21:04:32 | ||
图片预览



文档简介
沈阳名校 2023-2024 学年度上学期第二次月
考 高二(25 届)化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Fe-56 Ag-108
第 I 卷 (选择题,共 45 分)
一、选择题(本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合要求)
1.化学与生活,工业生产息息相关。下列有关说法错误的是
A.明矾和漂白粉常用于自来水的处理,但二者作用的原理不同
B.用硫酸清洗锅炉中的水垢(主要成分是碳酸钙)
C.工业上常用 Na2S作沉淀剂除去废水中的 Cu2+和 Hg2+
D.实验室盛放 Na2CO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
2.下列说法正确的是
A.其他条件不变时,增大反应物浓度,可增大活化分子百分数,从而使单位时间有效碰撞次数增多
B.常温下,pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO +4三种溶液,c(NH4 )大小是 ①=②>③
C.已知 H3PO3与足量 NaOH反应生成 Na2HPO3,则 H3PO3为三元酸
D.改变某一条件,使电离平衡正向移动,电离度一定增大
3.下列化学用语或图示表达错误的是
A.砷原子的简化电子排布式为:[Ar]4s24p3 B.CaO2 的电子式为
C.铝原子最高能级的电子云轮廓图: D.HCl的 s-pσ键电子云图:
4.NA为阿伏加德罗常数的值。下列说法错误的是
A.23 g C 32H5OH中 sp 杂化的原子数为1.5NA
B.0.5 mol XeF4中氙的价层电子对数为 3NA
C.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7 733、10540、13630、17995、 21703,
当它与氯气反应时可能生成的阳离子是 X2+
D.1molN2H4分子中有σ键数目为 5NA,π键数目为 NA
5.下列说法正确的是
A.甲烷的燃烧热为 890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol
B.已知 2H2(g)+O2(g)===2H2O(l) ΔH1,2H2(g)+O2(g)===2H2O(g) ΔH2,则ΔH1>ΔH2
C.已知稀 HCl和稀 NaOH溶液反应生成 1mol液态水时 △H=-57.3 kJ/mol,则稀 H2SO4和稀 Ba(OH)2
反应生成 2mol液态水的反应热 △H=2×(-57.3) kJ/mol
D.高温下 C与 CO2 、C与 H2O(g)以及常温下碳酸氢钠溶液与盐酸的反应均属于吸热反应
1
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
6.下列各组澄清溶液中的离子能大量共存,且加入(或通入)X试剂后发生反应的离子方程式书写正
确的是
选项 离子组 X试剂 离子方程式
A K+、Na+、ClO- SO 2 、 4 足量 SO2 SO2+3ClO-+H2O=SO
2 +Cl-4 +2HClO
B Na+、Fe3+、Br-、SO 2 4 过量氨水 Fe3++3NH3·H2O=Fe(OH)
3↓+3NH 4
C NH 、Na+、Fe3+、AlO 过量铜粉 2Fe3++Cu=2Fe2++Cu2+4 2
D K+、Na+、HCO 、AlO 少量 HCl H++AlO 3 2 2 +H2O=Al(OH)3↓
7.下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为 1s2的 X原子与原子核外电子排布式为 1s22s2 的 Y原子
B.原子核外 M 层上仅有两个电子的 X原子与原子核外 N层上仅有两个电子的 Y原子
C.2p轨道上只有 2个电子的 X 原子与 3p 轨道上只有 2个电子的 Y原子
D.最外层都只有一个电子的 X 、Y原子
8.已知几种共价键的键能如下,下列说法错误的是
化学键 H—N N≡N Cl—Cl H—Cl
键能(kJ/mol) 391 946 243 431
A.键能:N≡N>N=N>N—N
B.H(g)+Cl(g)===HCl(g) ΔH=-431 kJ/mol
C.H—N 键能小于H—Cl 键能,所以NH3的沸点高于HCl
D.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=-457 kJ/mol
9.下列实验操作、现象及结论均正确的是
选项 操作 现象 结论
向两支盛有少量 H2O2溶液的试管中分别加入 加入 FeCl3溶液的试 FeCl3对 H2O2分
A 0.1 mol·L-1的 FeCl 溶液和 0.01 mol·L-3 1的 CuSO4 管生成气体的速率比 解的催化效果比
溶液 加入 CuSO4溶液的快 CuSO4强
在 0.5 mol·L-1 蓝色 CuCl2溶液中存在如下平衡: 对于该反应,升
溶液由蓝色转变为黄
B [Cu(H2O) ]2+4 (蓝色)+4Cl- [CuCl4]2-(黄色)+ 高温度,平衡正
绿色
4H2O ΔH>0,加热该溶液 向移动
取两支试管,各加入 4mL0.1mol/LKMnO4酸性溶 其他条件相同
液,然后向一支试管中加入 0.01mol/LH2C2O4溶液 H2C2O4浓度大的一支 时,反应物浓度
C
2mL,另一支试管中加入 0.02mol/LH2C2O4 溶液 试管中溶液先褪色 越大,反应速率
2mL 越快
酸 性 :
D 用 pH计分别测定 SO2和 CO2的饱和溶液的 pH SO2饱和溶液的 pH小
H2SO3>H2CO3
2
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
10.下列说法中错误的是
① s sσ键与 s pσ键的对称性不同 ②23V电子排布式 1s22s22p63s23p63d5违反了洪特规则
③原子最外层电子排布为 4s1的元素一定是 s区元素
④霓虹灯光、激光、荧光都与原子核外电子跃迁吸收能量有关
⑤CO2和 SO2分子中心原子的杂化轨道类型相同
⑥1个 N原子最多只能与 3个 H原子结合形成 NH3分子,是由共价键的饱和性决定的
A.3个 B.4个 C.5个 D.6个
11.前四周期主族元素 X、Y、Z、W的原子序数依次增大。X与 Z同主族,且基态 X原子中 p 能级和 s
能级上的电子数相同。Y、Z同周期,Y位于第ⅢA族,W最外层有 2个电子。下列说法正确的是
A.原子半径:r(X)B.最高价氧化物对应水化物的碱性:WC.Y的简单离子与 Z的简单离子在溶液中不能大量共存
D.基态W原子内层原子轨道均已充满电子
12.短周期元素 X、Y,Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 X Y Z W
最高价氧化物的水化物的分子式 H3ZO4
0.1 mol/L溶液对应的 pH(25℃) 1.00 13.00 1.57 0.70
A.元素第一电离能:WC.元素电负性:W13.现有常温下四种溶液,有关叙述正确的是
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 硫酸
A.③④中分别加入适量的醋酸钠晶体后,③pH增大,④pH不变
B.分别取③、④溶液等体积加入足量的锌粒,产生氢气的量③>④
C.将等体积的①②混合,则 NH3·H2O的电离平衡向逆向移动
D.取等体积①与④混合,则混合后溶液 pH<7
14.已知常温下 Ksp(AgCl)=1.0×10-10,Ksp(AgI)=8.5×10-17,现有等体积的 AgCl和 AgI的饱和溶液的清液。
下列说法错误的是
A.若向 AgI清液加入 AgNO3固体,则溶液中 c(Ag+)增大,KSp(AgI)不变
c(I )
B.若将等体积的两饱和清液混合,向其中加入AgNO3溶液,当AgCl开始沉淀时,溶液中c(Cl )=8.5×10
-7
C.若向 2mL 0.1mol/L NaCl 溶液中滴加 2 滴 0.1 mol/L AgNO3溶液,产生白色沉淀;再向其中滴加 4
滴 0.1mol/L的 KI溶液,有黄色沉淀产生,则可验证 Ksp(AgCl)> Ksp(AgI)
D.若将等体积的两饱和清液混合,再加入足量 AgNO3固体,则 AgCl和 AgI都可沉淀,以 AgI为主
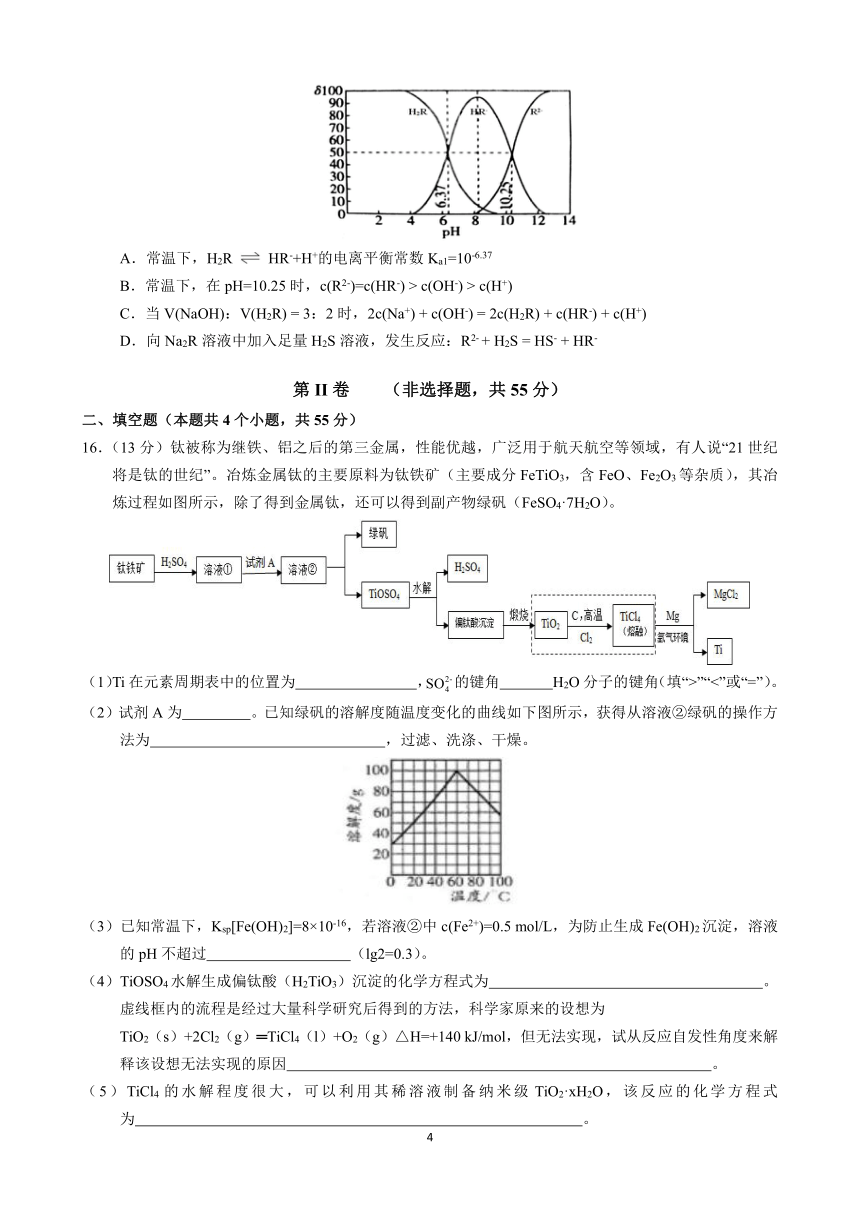
15.已知常温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。某二元酸 H2R易溶于水,将 NaOH溶液滴入等
物质的量浓度 H2R溶液中,H2R、HR-、R2-的物质的量分数随 pH的变化如图所示(10-6.37= 4.3×10-7,
10-10.25= 5.6×10-11)。下列说法错误的是
3
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
A.常温下,H2R HR-+H+的电离平衡常数 Ka1=10-6.37
B.常温下,在 pH=10.25时,c(R2-)=c(HR-) > c(OH-) > c(H+)
C.当 V(NaOH):V(H2R) = 3:2时,2c(Na+) + c(OH-) = 2c(H2R) + c(HR-) + c(H+)
D.向 Na2R溶液中加入足量 H2S溶液,发生反应:R2-+ H2S = HS- + HR-
第 II 卷 (非选择题,共 55 分)
二、填空题(本题共 4 个小题,共 55 分)
16.(13 分)钛被称为继铁、铝之后的第三金属,性能优越,广泛用于航天航空等领域,有人说“21世纪
将是钛的世纪”。冶炼金属钛的主要原料为钛铁矿(主要成分 FeTiO3,含 FeO、Fe2O3等杂质),其冶
炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾(FeSO4·7H2O)。
(1)Ti在元素周期表中的位置为 ,SO2-4 的键角 H2O分子的键角(填“>”“<”或“=”)。
(2)试剂 A为 。已知绿矾的溶解度随温度变化的曲线如下图所示,获得从溶液②绿矾的操作方
法为 ,过滤、洗涤、干燥。
(3)已知常温下,Ksp[Fe(OH)2]=8×10-16,若溶液②中 c(Fe2+)=0.5 mol/L,为防止生成 Fe(OH)2沉淀,溶液
的 pH不超过 (lg2=0.3)。
(4)TiOSO4水解生成偏钛酸(H2TiO3)沉淀的化学方程式为 。
虚线框内的流程是经过大量科学研究后得到的方法,科学家原来的设想为
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140 kJ/mol,但无法实现,试从反应自发性角度来解
释该设想无法实现的原因 。
( 5)TiCl4 的水解程度很大,可以利用其稀溶液制备纳米级 TiO2·xH2O,该反应的化学方程式
为 。
4
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
17.(14分)研究氮氧化物的处理对建设美丽中国具有重要意义。
(1)目前汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的 CO和 NO在催化剂的作
用下发生反应生成 CO2和 N2。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221.0 kJ/mol
则反应 2NO g 2CO g 2CO2 g N2 g 的△H为 kJ/mol。
(2)2NO g 2CO g 2CO2 g N2 g 的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应 (填对应序号)。
(3)向绝热恒容密闭容器中充入等物质的量的 NO和 CO进行反应,下列能判断反应已达到化学平衡状态
的是 。
a. 容器中的压强不变 b. 2v 正(CO)=v 逆(N2)
c. 气体的平均相对分子质量保持不变 d. NO和 CO的体积比保持不变
(4)T℃,将等物质的量的 NO和 CO 充入容积为 2L的恒容密闭容器中,若温度和体积不变,反应过程
中(0~15min)NO的物质的量随时间变化如下图所示。
该反应的化学平衡常数 K= ;平衡时若保持温度不变,再向容器中充入 CO、CO2各 0.2 mol,
则平衡将 (填“向左”、“向右”或“不”)移动。
(5)某研究小组探究催化剂Ⅰ、Ⅱ对 CO、NO转化的影响。将 CO和 NO以一定的流速通过两种不同的催
化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO的转化率),结果
如图所示。
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为 。
②温度低于 200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是 。
5
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
18.(15分)滴定实验操作简单、快速,而且具有足够的准确度,在生产生活和科学研究中具有广泛的应
用。
I.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于 0.035g/mL。某研究小
组用 0.1000 mol/LNaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。
(1)滴定前用 (填仪器名称)量取 20.00mL待测白醋溶液于锥形瓶中并滴入几滴指示剂。
(2)根据下表中数据该待测白醋 (填“符合”或“不符合”)国家标准。
滴定次数
实验数据
1 2 3 4
V(样品)/mL 20.00 20.00 20.00 20.00
滴定前 V(NaOH)/mL 0.00 0.10 0.20 1.00
滴定后 V(NaOH)/mL 15.95 15.10 15.25 15.95
(3)常温下,某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,
c CH3COOH 1
测得溶液中 c CH COO 1.8 103 ,则此时溶液中的 pH 。(已知室温下醋酸的3
Ka 1.8 10
5 ),所以滴定时选用的指示剂为 。
II.测血钙的含量时,进行如下实验:
①可将 2mL血液用蒸馏水稀释后,向其中加入足量草酸铵 NH4 2 C2O4 晶体,反应生成 CaC2O4沉淀,
将沉淀用稀硫酸处理得 H2C2O4溶液
②将①得到 H2C2O4溶液,再用酸性 KMnO4溶液滴定
(1)到达滴定终点的现象为 。
(2)若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果 (填“偏高”“偏
低”或“无影响”)。
III. 沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和指示剂生成沉淀的溶解度要比滴定剂和被滴
定物生成沉淀的溶解度大,否则不能用这种指示剂。根据下表数据,回答下列问题:
常温下,用 0.100 mol/L的 AgNO3溶液滴定 50.0 mL 0.0500 mol/L KCl溶液,以 (填选项)
为指示剂,滴定中指示剂的有效浓度应维持在 mol/L。
A.K2CrO4 B.K2SO4 C.KBr D.KCl
AgCl AgBr Ag2SO4 Ag2CrO4
颜色 白 浅黄 白 砖红
Ksp 1.0×10-10 5.4×10-13 1.2×10-5 2×10-12
6
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
19.(13分)依据物质结构知识回答下列问题。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第 34号元素,其基态原子的核外电子简化电子排布式为________________。
(2)根据价层电子对互斥理论,可以推知 SeO 2 4 的空间构型为 ,其中 Se 原子采用的
轨道杂化方式为 。
(3)已知 CSe2与 CO2结构相似,①CSe2分子内的键角 Se—C—Se、②H2Se 分子内的键角 H—Se—H、
③SeO3分子内的键角 O—Se—O,三种键角由大到小的顺序为 (填序号)。
II.碳是一种重要元素,可形成多种单质及化合物。
(4)C60分子中每个碳原子只跟相邻的 3个碳原子形成共价键,且每个碳原子最外层都满足 8电子稳定结
构,则一个 C60分子中π键的数目为________。
-
(5)已知 CN 与 N2结构相似,推算 HCN分子中σ键与π键数目之比为________。氨基氰(CH2N2)为原料可
制得类石墨相氮化碳(g-C3N4),氨基氰(CH2N2)分子中碳、氮原子均满足 8电子稳定结构,则该分
子的结构式为________。
(6)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量
状态的是 。
A. B.
C. D.
7
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
沈阳名校2023-2024学年度上学期第二次月考
高二(25届)化学答案
一、选择题(本题共 15题,每小题 3分,共 45分。每小题只有一个选项符合要求)
题号 1 2 3 4 5 6 7 8
答案 B B A D D B C C
题号 9 10 11 12 13 14 15
答案 B C C A B D C
二、填空题(本题共 4个小题,共 55分,除标注外每空 2分)
16.(13分)
(1)第四周期第 IVB族(1分) >(1分)
(2)Fe(1分) 蒸发浓缩、冷却结晶
(3)6.6
(4)TiOSO4+2H2O=H2TiO3↓+H2SO4
该反应为吸热、熵减的反应,△G>0,无法自发进行
(5)TiCl4+(x+2)H2O==TiO2·xH2O↓+4HCl
17.(14分)
(1)-746.5 (2)① (3)ac (4)5 不
(5)① 催化剂 II,450℃ ②温度较低时,催化剂的活性偏低
18.(15分)
I.(1)酸式滴定管(1分) (2)不符合 (3)8 酚酞
II.(1)最后半滴酸性 KMnO4溶液滴入后,溶液由无色变为浅紫色,且半分钟不褪色
(2)偏高
III. A 2.0×10-2
19.(13分)
(1)[Ar]3d104s24p4(1分) (2) 正四面体 (1分) sp3(1分)
(3) ①>③>② (4)30 (5) 1:1 (6)A
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
考 高二(25 届)化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Fe-56 Ag-108
第 I 卷 (选择题,共 45 分)
一、选择题(本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合要求)
1.化学与生活,工业生产息息相关。下列有关说法错误的是
A.明矾和漂白粉常用于自来水的处理,但二者作用的原理不同
B.用硫酸清洗锅炉中的水垢(主要成分是碳酸钙)
C.工业上常用 Na2S作沉淀剂除去废水中的 Cu2+和 Hg2+
D.实验室盛放 Na2CO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
2.下列说法正确的是
A.其他条件不变时,增大反应物浓度,可增大活化分子百分数,从而使单位时间有效碰撞次数增多
B.常温下,pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO +4三种溶液,c(NH4 )大小是 ①=②>③
C.已知 H3PO3与足量 NaOH反应生成 Na2HPO3,则 H3PO3为三元酸
D.改变某一条件,使电离平衡正向移动,电离度一定增大
3.下列化学用语或图示表达错误的是
A.砷原子的简化电子排布式为:[Ar]4s24p3 B.CaO2 的电子式为
C.铝原子最高能级的电子云轮廓图: D.HCl的 s-pσ键电子云图:
4.NA为阿伏加德罗常数的值。下列说法错误的是
A.23 g C 32H5OH中 sp 杂化的原子数为1.5NA
B.0.5 mol XeF4中氙的价层电子对数为 3NA
C.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7 733、10540、13630、17995、 21703,
当它与氯气反应时可能生成的阳离子是 X2+
D.1molN2H4分子中有σ键数目为 5NA,π键数目为 NA
5.下列说法正确的是
A.甲烷的燃烧热为 890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol
B.已知 2H2(g)+O2(g)===2H2O(l) ΔH1,2H2(g)+O2(g)===2H2O(g) ΔH2,则ΔH1>ΔH2
C.已知稀 HCl和稀 NaOH溶液反应生成 1mol液态水时 △H=-57.3 kJ/mol,则稀 H2SO4和稀 Ba(OH)2
反应生成 2mol液态水的反应热 △H=2×(-57.3) kJ/mol
D.高温下 C与 CO2 、C与 H2O(g)以及常温下碳酸氢钠溶液与盐酸的反应均属于吸热反应
1
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
6.下列各组澄清溶液中的离子能大量共存,且加入(或通入)X试剂后发生反应的离子方程式书写正
确的是
选项 离子组 X试剂 离子方程式
A K+、Na+、ClO- SO 2 、 4 足量 SO2 SO2+3ClO-+H2O=SO
2 +Cl-4 +2HClO
B Na+、Fe3+、Br-、SO 2 4 过量氨水 Fe3++3NH3·H2O=Fe(OH)
3↓+3NH 4
C NH 、Na+、Fe3+、AlO 过量铜粉 2Fe3++Cu=2Fe2++Cu2+4 2
D K+、Na+、HCO 、AlO 少量 HCl H++AlO 3 2 2 +H2O=Al(OH)3↓
7.下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为 1s2的 X原子与原子核外电子排布式为 1s22s2 的 Y原子
B.原子核外 M 层上仅有两个电子的 X原子与原子核外 N层上仅有两个电子的 Y原子
C.2p轨道上只有 2个电子的 X 原子与 3p 轨道上只有 2个电子的 Y原子
D.最外层都只有一个电子的 X 、Y原子
8.已知几种共价键的键能如下,下列说法错误的是
化学键 H—N N≡N Cl—Cl H—Cl
键能(kJ/mol) 391 946 243 431
A.键能:N≡N>N=N>N—N
B.H(g)+Cl(g)===HCl(g) ΔH=-431 kJ/mol
C.H—N 键能小于H—Cl 键能,所以NH3的沸点高于HCl
D.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=-457 kJ/mol
9.下列实验操作、现象及结论均正确的是
选项 操作 现象 结论
向两支盛有少量 H2O2溶液的试管中分别加入 加入 FeCl3溶液的试 FeCl3对 H2O2分
A 0.1 mol·L-1的 FeCl 溶液和 0.01 mol·L-3 1的 CuSO4 管生成气体的速率比 解的催化效果比
溶液 加入 CuSO4溶液的快 CuSO4强
在 0.5 mol·L-1 蓝色 CuCl2溶液中存在如下平衡: 对于该反应,升
溶液由蓝色转变为黄
B [Cu(H2O) ]2+4 (蓝色)+4Cl- [CuCl4]2-(黄色)+ 高温度,平衡正
绿色
4H2O ΔH>0,加热该溶液 向移动
取两支试管,各加入 4mL0.1mol/LKMnO4酸性溶 其他条件相同
液,然后向一支试管中加入 0.01mol/LH2C2O4溶液 H2C2O4浓度大的一支 时,反应物浓度
C
2mL,另一支试管中加入 0.02mol/LH2C2O4 溶液 试管中溶液先褪色 越大,反应速率
2mL 越快
酸 性 :
D 用 pH计分别测定 SO2和 CO2的饱和溶液的 pH SO2饱和溶液的 pH小
H2SO3>H2CO3
2
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
10.下列说法中错误的是
① s sσ键与 s pσ键的对称性不同 ②23V电子排布式 1s22s22p63s23p63d5违反了洪特规则
③原子最外层电子排布为 4s1的元素一定是 s区元素
④霓虹灯光、激光、荧光都与原子核外电子跃迁吸收能量有关
⑤CO2和 SO2分子中心原子的杂化轨道类型相同
⑥1个 N原子最多只能与 3个 H原子结合形成 NH3分子,是由共价键的饱和性决定的
A.3个 B.4个 C.5个 D.6个
11.前四周期主族元素 X、Y、Z、W的原子序数依次增大。X与 Z同主族,且基态 X原子中 p 能级和 s
能级上的电子数相同。Y、Z同周期,Y位于第ⅢA族,W最外层有 2个电子。下列说法正确的是
A.原子半径:r(X)
D.基态W原子内层原子轨道均已充满电子
12.短周期元素 X、Y,Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 X Y Z W
最高价氧化物的水化物的分子式 H3ZO4
0.1 mol/L溶液对应的 pH(25℃) 1.00 13.00 1.57 0.70
A.元素第一电离能:W
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 硫酸
A.③④中分别加入适量的醋酸钠晶体后,③pH增大,④pH不变
B.分别取③、④溶液等体积加入足量的锌粒,产生氢气的量③>④
C.将等体积的①②混合,则 NH3·H2O的电离平衡向逆向移动
D.取等体积①与④混合,则混合后溶液 pH<7
14.已知常温下 Ksp(AgCl)=1.0×10-10,Ksp(AgI)=8.5×10-17,现有等体积的 AgCl和 AgI的饱和溶液的清液。
下列说法错误的是
A.若向 AgI清液加入 AgNO3固体,则溶液中 c(Ag+)增大,KSp(AgI)不变
c(I )
B.若将等体积的两饱和清液混合,向其中加入AgNO3溶液,当AgCl开始沉淀时,溶液中c(Cl )=8.5×10
-7
C.若向 2mL 0.1mol/L NaCl 溶液中滴加 2 滴 0.1 mol/L AgNO3溶液,产生白色沉淀;再向其中滴加 4
滴 0.1mol/L的 KI溶液,有黄色沉淀产生,则可验证 Ksp(AgCl)> Ksp(AgI)
D.若将等体积的两饱和清液混合,再加入足量 AgNO3固体,则 AgCl和 AgI都可沉淀,以 AgI为主
15.已知常温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。某二元酸 H2R易溶于水,将 NaOH溶液滴入等
物质的量浓度 H2R溶液中,H2R、HR-、R2-的物质的量分数随 pH的变化如图所示(10-6.37= 4.3×10-7,
10-10.25= 5.6×10-11)。下列说法错误的是
3
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
A.常温下,H2R HR-+H+的电离平衡常数 Ka1=10-6.37
B.常温下,在 pH=10.25时,c(R2-)=c(HR-) > c(OH-) > c(H+)
C.当 V(NaOH):V(H2R) = 3:2时,2c(Na+) + c(OH-) = 2c(H2R) + c(HR-) + c(H+)
D.向 Na2R溶液中加入足量 H2S溶液,发生反应:R2-+ H2S = HS- + HR-
第 II 卷 (非选择题,共 55 分)
二、填空题(本题共 4 个小题,共 55 分)
16.(13 分)钛被称为继铁、铝之后的第三金属,性能优越,广泛用于航天航空等领域,有人说“21世纪
将是钛的世纪”。冶炼金属钛的主要原料为钛铁矿(主要成分 FeTiO3,含 FeO、Fe2O3等杂质),其冶
炼过程如图所示,除了得到金属钛,还可以得到副产物绿矾(FeSO4·7H2O)。
(1)Ti在元素周期表中的位置为 ,SO2-4 的键角 H2O分子的键角(填“>”“<”或“=”)。
(2)试剂 A为 。已知绿矾的溶解度随温度变化的曲线如下图所示,获得从溶液②绿矾的操作方
法为 ,过滤、洗涤、干燥。
(3)已知常温下,Ksp[Fe(OH)2]=8×10-16,若溶液②中 c(Fe2+)=0.5 mol/L,为防止生成 Fe(OH)2沉淀,溶液
的 pH不超过 (lg2=0.3)。
(4)TiOSO4水解生成偏钛酸(H2TiO3)沉淀的化学方程式为 。
虚线框内的流程是经过大量科学研究后得到的方法,科学家原来的设想为
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140 kJ/mol,但无法实现,试从反应自发性角度来解
释该设想无法实现的原因 。
( 5)TiCl4 的水解程度很大,可以利用其稀溶液制备纳米级 TiO2·xH2O,该反应的化学方程式
为 。
4
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
17.(14分)研究氮氧化物的处理对建设美丽中国具有重要意义。
(1)目前汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的 CO和 NO在催化剂的作
用下发生反应生成 CO2和 N2。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221.0 kJ/mol
则反应 2NO g 2CO g 2CO2 g N2 g 的△H为 kJ/mol。
(2)2NO g 2CO g 2CO2 g N2 g 的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应 (填对应序号)。
(3)向绝热恒容密闭容器中充入等物质的量的 NO和 CO进行反应,下列能判断反应已达到化学平衡状态
的是 。
a. 容器中的压强不变 b. 2v 正(CO)=v 逆(N2)
c. 气体的平均相对分子质量保持不变 d. NO和 CO的体积比保持不变
(4)T℃,将等物质的量的 NO和 CO 充入容积为 2L的恒容密闭容器中,若温度和体积不变,反应过程
中(0~15min)NO的物质的量随时间变化如下图所示。
该反应的化学平衡常数 K= ;平衡时若保持温度不变,再向容器中充入 CO、CO2各 0.2 mol,
则平衡将 (填“向左”、“向右”或“不”)移动。
(5)某研究小组探究催化剂Ⅰ、Ⅱ对 CO、NO转化的影响。将 CO和 NO以一定的流速通过两种不同的催
化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO的转化率),结果
如图所示。
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为 。
②温度低于 200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是 。
5
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
18.(15分)滴定实验操作简单、快速,而且具有足够的准确度,在生产生活和科学研究中具有广泛的应
用。
I.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于 0.035g/mL。某研究小
组用 0.1000 mol/LNaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。
(1)滴定前用 (填仪器名称)量取 20.00mL待测白醋溶液于锥形瓶中并滴入几滴指示剂。
(2)根据下表中数据该待测白醋 (填“符合”或“不符合”)国家标准。
滴定次数
实验数据
1 2 3 4
V(样品)/mL 20.00 20.00 20.00 20.00
滴定前 V(NaOH)/mL 0.00 0.10 0.20 1.00
滴定后 V(NaOH)/mL 15.95 15.10 15.25 15.95
(3)常温下,某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,
c CH3COOH 1
测得溶液中 c CH COO 1.8 103 ,则此时溶液中的 pH 。(已知室温下醋酸的3
Ka 1.8 10
5 ),所以滴定时选用的指示剂为 。
II.测血钙的含量时,进行如下实验:
①可将 2mL血液用蒸馏水稀释后,向其中加入足量草酸铵 NH4 2 C2O4 晶体,反应生成 CaC2O4沉淀,
将沉淀用稀硫酸处理得 H2C2O4溶液
②将①得到 H2C2O4溶液,再用酸性 KMnO4溶液滴定
(1)到达滴定终点的现象为 。
(2)若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果 (填“偏高”“偏
低”或“无影响”)。
III. 沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和指示剂生成沉淀的溶解度要比滴定剂和被滴
定物生成沉淀的溶解度大,否则不能用这种指示剂。根据下表数据,回答下列问题:
常温下,用 0.100 mol/L的 AgNO3溶液滴定 50.0 mL 0.0500 mol/L KCl溶液,以 (填选项)
为指示剂,滴定中指示剂的有效浓度应维持在 mol/L。
A.K2CrO4 B.K2SO4 C.KBr D.KCl
AgCl AgBr Ag2SO4 Ag2CrO4
颜色 白 浅黄 白 砖红
Ksp 1.0×10-10 5.4×10-13 1.2×10-5 2×10-12
6
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
19.(13分)依据物质结构知识回答下列问题。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第 34号元素,其基态原子的核外电子简化电子排布式为________________。
(2)根据价层电子对互斥理论,可以推知 SeO 2 4 的空间构型为 ,其中 Se 原子采用的
轨道杂化方式为 。
(3)已知 CSe2与 CO2结构相似,①CSe2分子内的键角 Se—C—Se、②H2Se 分子内的键角 H—Se—H、
③SeO3分子内的键角 O—Se—O,三种键角由大到小的顺序为 (填序号)。
II.碳是一种重要元素,可形成多种单质及化合物。
(4)C60分子中每个碳原子只跟相邻的 3个碳原子形成共价键,且每个碳原子最外层都满足 8电子稳定结
构,则一个 C60分子中π键的数目为________。
-
(5)已知 CN 与 N2结构相似,推算 HCN分子中σ键与π键数目之比为________。氨基氰(CH2N2)为原料可
制得类石墨相氮化碳(g-C3N4),氨基氰(CH2N2)分子中碳、氮原子均满足 8电子稳定结构,则该分
子的结构式为________。
(6)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量
状态的是 。
A. B.
C. D.
7
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
沈阳名校2023-2024学年度上学期第二次月考
高二(25届)化学答案
一、选择题(本题共 15题,每小题 3分,共 45分。每小题只有一个选项符合要求)
题号 1 2 3 4 5 6 7 8
答案 B B A D D B C C
题号 9 10 11 12 13 14 15
答案 B C C A B D C
二、填空题(本题共 4个小题,共 55分,除标注外每空 2分)
16.(13分)
(1)第四周期第 IVB族(1分) >(1分)
(2)Fe(1分) 蒸发浓缩、冷却结晶
(3)6.6
(4)TiOSO4+2H2O=H2TiO3↓+H2SO4
该反应为吸热、熵减的反应,△G>0,无法自发进行
(5)TiCl4+(x+2)H2O==TiO2·xH2O↓+4HCl
17.(14分)
(1)-746.5 (2)① (3)ac (4)5 不
(5)① 催化剂 II,450℃ ②温度较低时,催化剂的活性偏低
18.(15分)
I.(1)酸式滴定管(1分) (2)不符合 (3)8 酚酞
II.(1)最后半滴酸性 KMnO4溶液滴入后,溶液由无色变为浅紫色,且半分钟不褪色
(2)偏高
III. A 2.0×10-2
19.(13分)
(1)[Ar]3d104s24p4(1分) (2) 正四面体 (1分) sp3(1分)
(3) ①>③>② (4)30 (5) 1:1 (6)A
{#{QQABAQSUoggAAhBAABhCAQlKCAMQkBACAKoGQEAMMAAAQQNABAA=}#}
同课章节目录
