2024届高三一轮复习 原电池 化学电源(共47张PPT)
文档属性
| 名称 | 2024届高三一轮复习 原电池 化学电源(共47张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 21:06:16 | ||
图片预览





文档简介
(共47张PPT)
1
第2讲 原电池 化学电源
课标要求 核心素养
1.理解原电池的构成、工作原理及应用 2.正确判断原电池的两极,能书写电极反应式和总反应式 3.了解常见化学电源的种类及其工作原理,了解燃料电池的应用 1.宏观辨识与微观探析:认识原电池的本质是氧化还原反应,能多角度、动态分析原电池中物质的变化及能量的变化
2.变化观念与平衡思想:能多角度、动态分析原池中发生的反应,并运用原电池原理解决实际问题
3.科学精神与社会责任:通过原电池装置的应用,能对与化学有关的热点问题做出正确的价值判断,能参与有关化学问题的社会实践
一、原电池原理
1. 原电池的概念:原电池是把①____________转化为②__________的装置。其反应本质是③______________反应。
化学能
电能
氧化还原
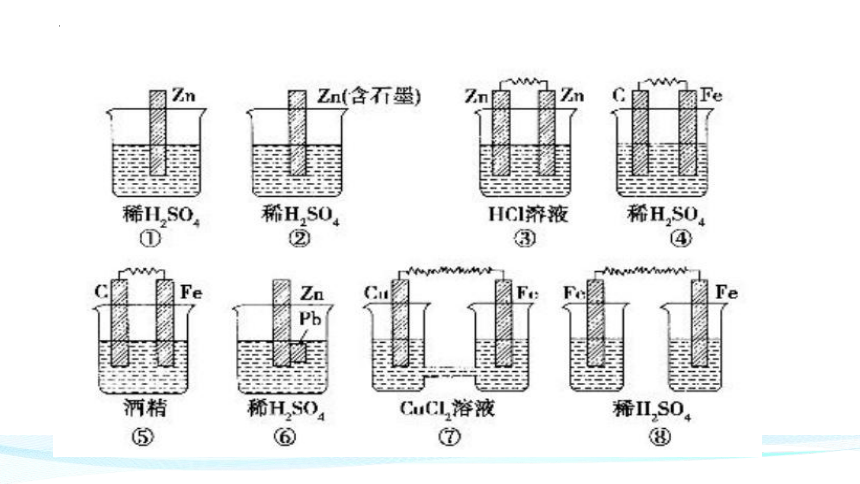
2. 原电池形成的条件:①有两个活泼型有差异的电极
②有电解质溶液/熔融电解质
③构成闭合回路
④能__________的氧化还原反应。
自发
考点一 原电池原理
两极一液一回路;
氧化还原是本质。
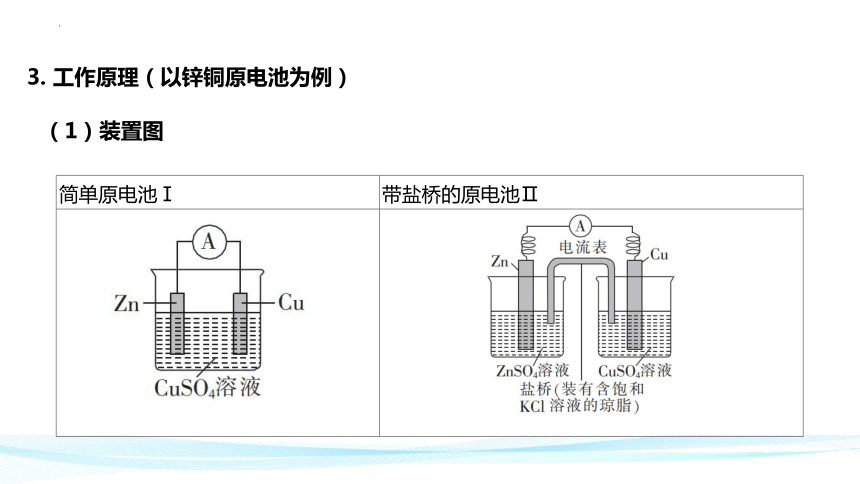
(1)装置图
简单原电池Ⅰ 带盐桥的原电池Ⅱ
3. 工作原理(以锌铜原电池为例)
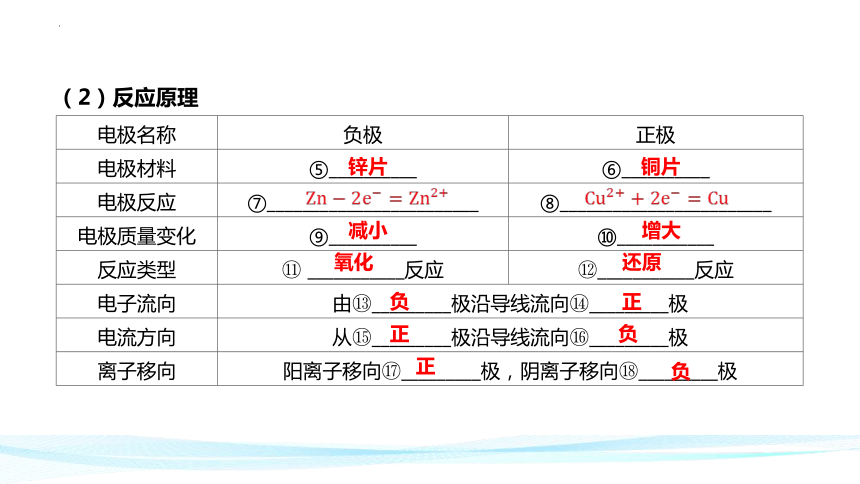
(2)反应原理
电极名称 负极 正极
电极材料 ⑤__________ ⑥__________
电极反应 ⑦________________________ ⑧________________________
电极质量变化 ⑨__________ ⑩___________
反应类型 ___________反应 ___________反应
电子流向 由 _________极沿导线流向 _________极 电流方向 从 _________极沿导线流向 _________极 离子移向 阳离子移向 _________极,阴离子移向 _________极 锌片
铜片
减小
增大
氧化
还原
负
正
正
负
正
负
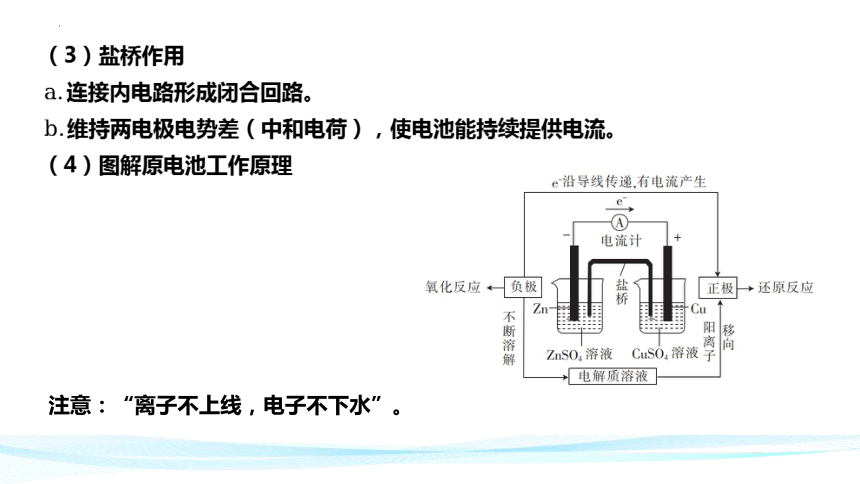
(3)盐桥作用
连接内电路形成闭合回路。
维持两电极电势差(中和电荷),使电池能持续提供电流。
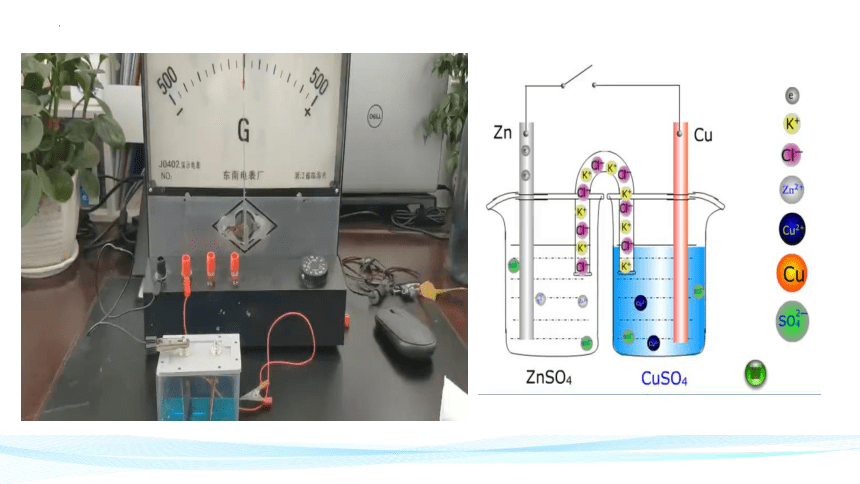
(4)图解原电池工作原理
注意:“离子不上线,电子不下水”。
二、原电池原理的应用
1. 比较金属的活动性强弱:原电池中,_________极一般是活动性较强的金属,_________极一般是活动性较弱的金属(或非金属)。
负
正
2. 加快化学反应速率:氧化还原反应形成原电池时,反应速率___________。
加快
3. 用于金属的防护:将需要保护的金属制品作原电池的_________极而受到保护。
正
实验装置 部分实验现象
a极质量减少;量增加
实验装置 部分实验现象
b极有气体产生;
c极无变化
d极溶解;
c极有气体产生
实验装置 部分实验现象
电流从a极
流向d极
典例2 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
C
原电池正、
负极的判断
4. 设计原电池
电解质溶液一般要能够与负极发生反应
例:将2Ag++Cu=Cu2++2Ag
设计成原电池。
√
×
×
【易错辨析】
判断正误,正确的画“√”,错误的画“×”。
(1)理论上,任何自发的氧化还原反应都可设计成原电池。( )
(2)放热反应都可设计成原电池。( )
(3)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。( )
×
√
√
(6)因为铁比铜活动性更强,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极。( )
×
原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,活泼电极不一定作负极
(4)两种活动性不同的金属组成原电池的两极,活泼金属一定作负极。( )
(5)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高。( )
(6)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳。( )
考向1 电极判断和电极反应式书写
典例1 (2020 ·全国Ⅰ卷)科学家近
年发明了一种新型Zn-CO2水介
质电池。电池示意图如图,电极
为金属锌和选择性催化材料,放
电时,温室气体CO2被转化为储
氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
D
下列说法错误的是( )
D.充电时,正极溶液中的OH-浓度升高
电极反应式的书写方法
[方法一]直接书写
B
对点训练1 (2022·泰安模拟)镁-空气电
池是一种新型燃料电池,其工作原理
如图所示。下列说法错误的是( )
A.金属Mg电极为负极,其电势低于空
气电极的电势
B.电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极
C.电池总反应为2Mg+O2+2H2O===2Mg(OH)2
D.回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用
对点训练2 化学电源在日常生活和高科技领域中都有广泛应用。
A
下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增大
B.乙:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
知能点二 化学电源
总反应: 。
负极材料:①___________。
电极反应:②___________________________________。
正极材料:碳棒。
电极反应:③___________________________________。
1.一次电池(碱性锌锰干电池)
碱性锌锰干电池的工作原理如图:
总反应: 。
(1)放电时——原电池
负极反应:⑨_________________________________;
正极反应:⑩_________________________________。
(2)充电时——电解池
阴极反应: ____________________________________;
阳极反应: ____________________________________。
2.二次电池(以铅蓄电池为例)
(3).图解二次电池的充放电
(4).二次电池充放电规律
①充电时电极的连接:充电的目的是使电池恢复其供电能力,因此负极应与电源的负极相连以获得电子,可简记为负接负后作阴极,正接正后作阳极。
②工作时的电极反应式:同一电极上的电极反应式、电池的总反应式,在充电与放电时,形式上恰好相反(同一电极周围,充电与放电时电解质溶液中 的变化趋势也恰好相反)。
三、“高效、环境友好”的燃料电池
1. 氢氧燃料电池
氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。
种类 酸性 碱性
负极反应式 _________________________ _____________________________
正极反应式 ___________________________ ______________________________
电池总反应式 备注 燃料电池的电极不参与反应,有很强的催化活性,起导电作用
燃料电池的正负极判断:通燃料一极是负极,通空气/氧气以极是正极。
② KOH溶液:
负极:CH4+10OH--8e-====CO32-+7H2O
正极:2O2+4H2O+8e-====8OH-
总反应式:CH4+2O2+2OH-====CO32-+3H2O
① H2SO4溶液:
负极:CH4+2H2O-8e-====CO2+8H+
正极:2O2+8H++8e-====4H2O
总反应式:CH4+2O2====CO2+2H2O
2.甲烷燃料电池
用导线连接的两个铂电极插入电解质溶液中,然后向两极分别通入CH4和O2,该电池的反应式:
3.甲醇(CH3OH)燃料电池
一个电极通入甲醇,一个电极通入氧气,固体电解质,高温时能传导O2-。
负极:CH3OH-6e-+3O2-====CO2+2H2O
正极:O2+4e-====2O2-
总反应式:2CH3OH+3O2====2CO2+4H2O
4.熔融盐燃料电池
一极通入CO,一极通入空气和CO2混合气体,以Li2CO3和Na2CO3的熔融盐作电解质。
负 极:2CO+2CO32--4e-====4CO2
正 极:O2+2CO2+4e-====2CO32-
总反应式:2CO+O2====2CO2
【特别提醒】(1)书写燃料电池电极反应时要特别注意电解质溶液的离子参与电极反应,要写入电极反应式中。
(2)溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
书写燃料电池电极反应式的步骤如下:
(1)第一步:写出电池总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。
如甲烷燃料电池(电解质为NaOH)的反应式为
CH4+2O2===CO2+2H2O①
CO2+2NaOH===Na2CO3+H2O②
①式+②式得燃料电池总反应式:CH4+2O2+2NaOH=== Na2CO3+3H2O。
(2)第二步:写出电池的正极反应式
根据燃料电池的特点,一般在正极上发生还原反应的物质是O2,随着电解质溶液的不同,其电极反应式有所不同,大致有以下四种情况:
①酸性电解质溶液环境下的电极反应式:
O2+4H++4e-===2H2O
②碱性电解质溶液环境下的电极反应式:
O2+2H2O+4e-===4OH-
③固体电解质(高温下能传导O2-)环境下的电极反应式:
O2+4e-===2O2-
④熔融碳酸盐(如熔融K2CO3)环境下的电极反应式:
(3)第三步:根据电池总反应式和正极反应式,写出负极反应式
电池总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
√
×
√
√
【易错辨析】
判断正误,正确的画“√”,错误的画“×”。
(1)太阳能电池不属于原电池。( )
(2)可充电电池中的放电反应和充电反应互为可逆反应。( )
(3)铅酸蓄电池工作时,当电路中转移0.1 mol电子时,负极增重4.8 g( )
(4)燃料电池的电极不参与反应,起导电作用。( )
考向1 化学电源电极反应式书写
典例1 二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( )
D
A.该电池放电时H+从Pt2电极经过内电路移向Pt1电极
B.Pt1电极附近发生的电极反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的电极反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
D
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)2+OH--e-===NiOOH+H2O
C.放电时负极反应为Zn+2OH--2e-===ZnO+H2O
D.放电过程中OH-通过隔膜从负极区移向正极区
考向2 新型化学电源
典例2 (2022·海口模拟)微生物燃料电池(MFC)是
以微生物为催化剂将碳水化合物[用(CH2O)n表
示]中的化学能转化为电能的装置,其工作原理
如图所示。下列说法错误的是( )
A.b电极为正极
B.a极的电极反应式为(CH2O)n+nH2O-4ne-
===nCO2↑+4nH+
C.a电极的电势高于b电极
D.MFC本质上是利用微生物代谢过程中转移
的电子并传递而产生电流的系统
C
1.新型燃料电池
(1)新型燃料电池的分析模板
2.可充电电池的思维流程
对点训练2 以KOH溶液为电解质溶液,分别组成CH3OH-O2、N2H4-O2、CH4-O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH的物质的量均减小
C.消耗等质量的燃料,CH4-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
答案:C
03
真 题 考 场
C
(2022·广东卷)科学家基于Cl2易溶于CCl4
的性质,发展了一种无须离子交换膜的
新型氯流电池,可作储能设备(如图所
示)。充电时电极a的反应为NaTi2(PO4)3
+2Na++2e-===Na3Ti2(PO4)3。下列说
法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a的质量理论上增加23 g
1.(2022·湖南卷)海水电池在海洋能源领域备受
关注,一种锂-海水电池构造示意图如图所示。
下列说法错误的是( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-===
2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
答案:B
答案:A
(原创题)一种Zn-PbO2电池工作原理如装置图所示。
答案:D
下列说法正确的是( )
A.电极a为负极,发生还原反应
B.放电过程中电极a区溶液的pH增大
C.电池工作一段时间后K2SO4浓度减小
1
第2讲 原电池 化学电源
课标要求 核心素养
1.理解原电池的构成、工作原理及应用 2.正确判断原电池的两极,能书写电极反应式和总反应式 3.了解常见化学电源的种类及其工作原理,了解燃料电池的应用 1.宏观辨识与微观探析:认识原电池的本质是氧化还原反应,能多角度、动态分析原电池中物质的变化及能量的变化
2.变化观念与平衡思想:能多角度、动态分析原池中发生的反应,并运用原电池原理解决实际问题
3.科学精神与社会责任:通过原电池装置的应用,能对与化学有关的热点问题做出正确的价值判断,能参与有关化学问题的社会实践
一、原电池原理
1. 原电池的概念:原电池是把①____________转化为②__________的装置。其反应本质是③______________反应。
化学能
电能
氧化还原
2. 原电池形成的条件:①有两个活泼型有差异的电极
②有电解质溶液/熔融电解质
③构成闭合回路
④能__________的氧化还原反应。
自发
考点一 原电池原理
两极一液一回路;
氧化还原是本质。
(1)装置图
简单原电池Ⅰ 带盐桥的原电池Ⅱ
3. 工作原理(以锌铜原电池为例)
(2)反应原理
电极名称 负极 正极
电极材料 ⑤__________ ⑥__________
电极反应 ⑦________________________ ⑧________________________
电极质量变化 ⑨__________ ⑩___________
反应类型 ___________反应 ___________反应
电子流向 由 _________极沿导线流向 _________极 电流方向 从 _________极沿导线流向 _________极 离子移向 阳离子移向 _________极,阴离子移向 _________极 锌片
铜片
减小
增大
氧化
还原
负
正
正
负
正
负
(3)盐桥作用
连接内电路形成闭合回路。
维持两电极电势差(中和电荷),使电池能持续提供电流。
(4)图解原电池工作原理
注意:“离子不上线,电子不下水”。
二、原电池原理的应用
1. 比较金属的活动性强弱:原电池中,_________极一般是活动性较强的金属,_________极一般是活动性较弱的金属(或非金属)。
负
正
2. 加快化学反应速率:氧化还原反应形成原电池时,反应速率___________。
加快
3. 用于金属的防护:将需要保护的金属制品作原电池的_________极而受到保护。
正
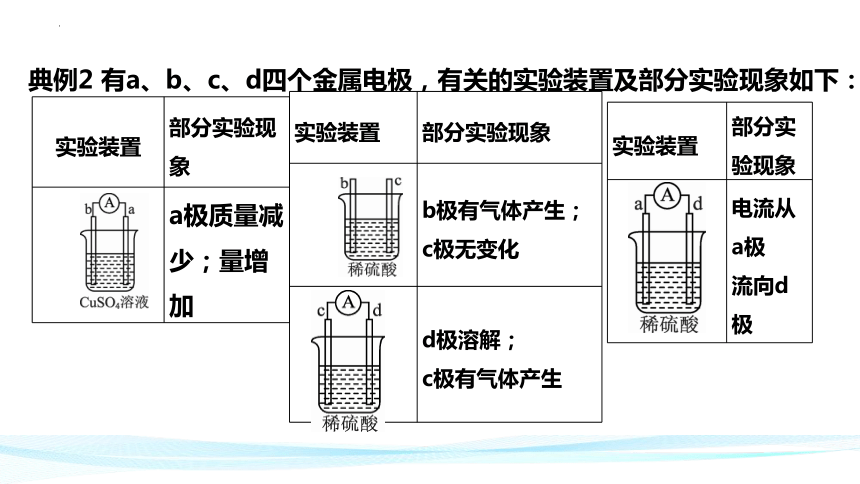
实验装置 部分实验现象
a极质量减少;量增加
实验装置 部分实验现象
b极有气体产生;
c极无变化
d极溶解;
c极有气体产生
实验装置 部分实验现象
电流从a极
流向d极
典例2 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
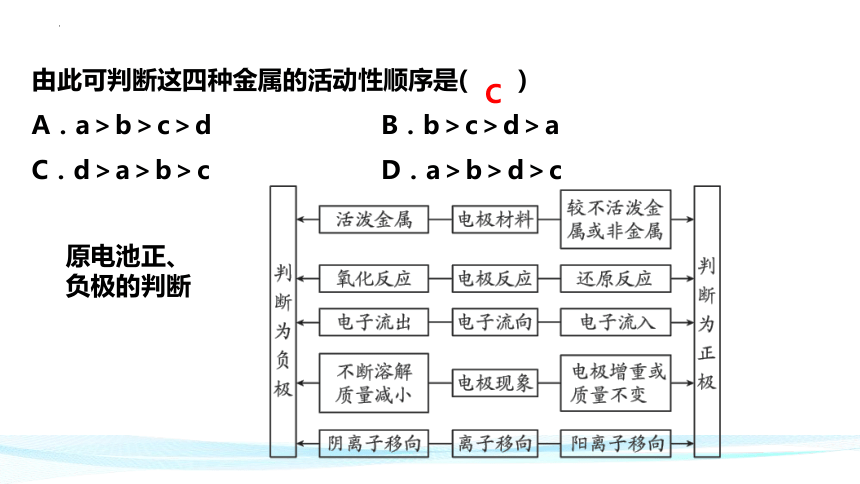
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
C
原电池正、
负极的判断
4. 设计原电池
电解质溶液一般要能够与负极发生反应
例:将2Ag++Cu=Cu2++2Ag
设计成原电池。
√
×
×
【易错辨析】
判断正误,正确的画“√”,错误的画“×”。
(1)理论上,任何自发的氧化还原反应都可设计成原电池。( )
(2)放热反应都可设计成原电池。( )
(3)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。( )
×
√
√
(6)因为铁比铜活动性更强,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极。( )
×
原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,活泼电极不一定作负极
(4)两种活动性不同的金属组成原电池的两极,活泼金属一定作负极。( )
(5)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高。( )
(6)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳。( )
考向1 电极判断和电极反应式书写
典例1 (2020 ·全国Ⅰ卷)科学家近
年发明了一种新型Zn-CO2水介
质电池。电池示意图如图,电极
为金属锌和选择性催化材料,放
电时,温室气体CO2被转化为储
氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
D
下列说法错误的是( )
D.充电时,正极溶液中的OH-浓度升高
电极反应式的书写方法
[方法一]直接书写
B
对点训练1 (2022·泰安模拟)镁-空气电
池是一种新型燃料电池,其工作原理
如图所示。下列说法错误的是( )
A.金属Mg电极为负极,其电势低于空
气电极的电势
B.电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极
C.电池总反应为2Mg+O2+2H2O===2Mg(OH)2
D.回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用
对点训练2 化学电源在日常生活和高科技领域中都有广泛应用。
A
下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增大
B.乙:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
知能点二 化学电源
总反应: 。
负极材料:①___________。
电极反应:②___________________________________。
正极材料:碳棒。
电极反应:③___________________________________。
1.一次电池(碱性锌锰干电池)
碱性锌锰干电池的工作原理如图:
总反应: 。
(1)放电时——原电池
负极反应:⑨_________________________________;
正极反应:⑩_________________________________。
(2)充电时——电解池
阴极反应: ____________________________________;
阳极反应: ____________________________________。
2.二次电池(以铅蓄电池为例)
(3).图解二次电池的充放电
(4).二次电池充放电规律
①充电时电极的连接:充电的目的是使电池恢复其供电能力,因此负极应与电源的负极相连以获得电子,可简记为负接负后作阴极,正接正后作阳极。
②工作时的电极反应式:同一电极上的电极反应式、电池的总反应式,在充电与放电时,形式上恰好相反(同一电极周围,充电与放电时电解质溶液中 的变化趋势也恰好相反)。
三、“高效、环境友好”的燃料电池
1. 氢氧燃料电池
氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。
种类 酸性 碱性
负极反应式 _________________________ _____________________________
正极反应式 ___________________________ ______________________________
电池总反应式 备注 燃料电池的电极不参与反应,有很强的催化活性,起导电作用
燃料电池的正负极判断:通燃料一极是负极,通空气/氧气以极是正极。
② KOH溶液:
负极:CH4+10OH--8e-====CO32-+7H2O
正极:2O2+4H2O+8e-====8OH-
总反应式:CH4+2O2+2OH-====CO32-+3H2O
① H2SO4溶液:
负极:CH4+2H2O-8e-====CO2+8H+
正极:2O2+8H++8e-====4H2O
总反应式:CH4+2O2====CO2+2H2O
2.甲烷燃料电池
用导线连接的两个铂电极插入电解质溶液中,然后向两极分别通入CH4和O2,该电池的反应式:
3.甲醇(CH3OH)燃料电池
一个电极通入甲醇,一个电极通入氧气,固体电解质,高温时能传导O2-。
负极:CH3OH-6e-+3O2-====CO2+2H2O
正极:O2+4e-====2O2-
总反应式:2CH3OH+3O2====2CO2+4H2O
4.熔融盐燃料电池
一极通入CO,一极通入空气和CO2混合气体,以Li2CO3和Na2CO3的熔融盐作电解质。
负 极:2CO+2CO32--4e-====4CO2
正 极:O2+2CO2+4e-====2CO32-
总反应式:2CO+O2====2CO2
【特别提醒】(1)书写燃料电池电极反应时要特别注意电解质溶液的离子参与电极反应,要写入电极反应式中。
(2)溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
书写燃料电池电极反应式的步骤如下:
(1)第一步:写出电池总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。
如甲烷燃料电池(电解质为NaOH)的反应式为
CH4+2O2===CO2+2H2O①
CO2+2NaOH===Na2CO3+H2O②
①式+②式得燃料电池总反应式:CH4+2O2+2NaOH=== Na2CO3+3H2O。
(2)第二步:写出电池的正极反应式
根据燃料电池的特点,一般在正极上发生还原反应的物质是O2,随着电解质溶液的不同,其电极反应式有所不同,大致有以下四种情况:
①酸性电解质溶液环境下的电极反应式:
O2+4H++4e-===2H2O
②碱性电解质溶液环境下的电极反应式:
O2+2H2O+4e-===4OH-
③固体电解质(高温下能传导O2-)环境下的电极反应式:
O2+4e-===2O2-
④熔融碳酸盐(如熔融K2CO3)环境下的电极反应式:
(3)第三步:根据电池总反应式和正极反应式,写出负极反应式
电池总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
√
×
√
√
【易错辨析】
判断正误,正确的画“√”,错误的画“×”。
(1)太阳能电池不属于原电池。( )
(2)可充电电池中的放电反应和充电反应互为可逆反应。( )
(3)铅酸蓄电池工作时,当电路中转移0.1 mol电子时,负极增重4.8 g( )
(4)燃料电池的电极不参与反应,起导电作用。( )
考向1 化学电源电极反应式书写
典例1 二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( )
D
A.该电池放电时H+从Pt2电极经过内电路移向Pt1电极
B.Pt1电极附近发生的电极反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的电极反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
D
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)2+OH--e-===NiOOH+H2O
C.放电时负极反应为Zn+2OH--2e-===ZnO+H2O
D.放电过程中OH-通过隔膜从负极区移向正极区
考向2 新型化学电源
典例2 (2022·海口模拟)微生物燃料电池(MFC)是
以微生物为催化剂将碳水化合物[用(CH2O)n表
示]中的化学能转化为电能的装置,其工作原理
如图所示。下列说法错误的是( )
A.b电极为正极
B.a极的电极反应式为(CH2O)n+nH2O-4ne-
===nCO2↑+4nH+
C.a电极的电势高于b电极
D.MFC本质上是利用微生物代谢过程中转移
的电子并传递而产生电流的系统
C
1.新型燃料电池
(1)新型燃料电池的分析模板
2.可充电电池的思维流程
对点训练2 以KOH溶液为电解质溶液,分别组成CH3OH-O2、N2H4-O2、CH4-O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH的物质的量均减小
C.消耗等质量的燃料,CH4-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
答案:C
03
真 题 考 场
C
(2022·广东卷)科学家基于Cl2易溶于CCl4
的性质,发展了一种无须离子交换膜的
新型氯流电池,可作储能设备(如图所
示)。充电时电极a的反应为NaTi2(PO4)3
+2Na++2e-===Na3Ti2(PO4)3。下列说
法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a的质量理论上增加23 g
1.(2022·湖南卷)海水电池在海洋能源领域备受
关注,一种锂-海水电池构造示意图如图所示。
下列说法错误的是( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-===
2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
答案:B
答案:A
(原创题)一种Zn-PbO2电池工作原理如装置图所示。
答案:D
下列说法正确的是( )
A.电极a为负极,发生还原反应
B.放电过程中电极a区溶液的pH增大
C.电池工作一段时间后K2SO4浓度减小
同课章节目录
