第四章 物质结构元素周期律 单元同步训练题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律 单元同步训练题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 362.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 22:41:57 | ||
图片预览




文档简介
第四章 物质结构 元素周期律 单元同步训练题
一、单选题
1.明矾是一种常用的净水剂。下列说法正确的是
A.K位于元素周期表的第三周期 B.非金属性:
C.离子半径大小: D.碱性强弱:
2.现有下列短周期元素性质的数据,下列说法不正确的是
元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径 (10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 1.43
最高正化合价 +2 +1 +5 +7 +1 +5 +3
最低负化合价 -2 -3 -1 -3
A.上述元素中处于处于第三周期的有②④⑤⑥⑧
B.元素④与元素⑦相比较,气态氢化物较稳定的是⑦
C.元素①、⑥形成的化合物一定含离子键、共价键
D.元素⑥的离子半径在同周期元素中最小
3.下列能够证明氯的非金属性比硫强的事实是
①HClO3酸性比H2SO4强
②HCl酸性比H2S强
③HCl稳定性比H2S强
④HCl还原性比H2S弱
⑤Cl2与H2S反应生成S
⑥Cl2与Fe反应生成FeCl3,Br2与Fe反应生成FeBr3
⑦Na2S可与HCl反应生成H2
A.①③⑤⑥ B.②③④⑤ C.③⑤⑥⑦ D.③④⑤
4.正高碘酸具有强氧化性和弱酸性,脱水可得偏高碘酸,下列说法正确的是
A.碘元素在自然界中无游离态
B.的酸性强于
C.正高碘酸与反应后溶液呈橙色,反应如下:
D.正高碘酸隔绝空气加热分解仅生成
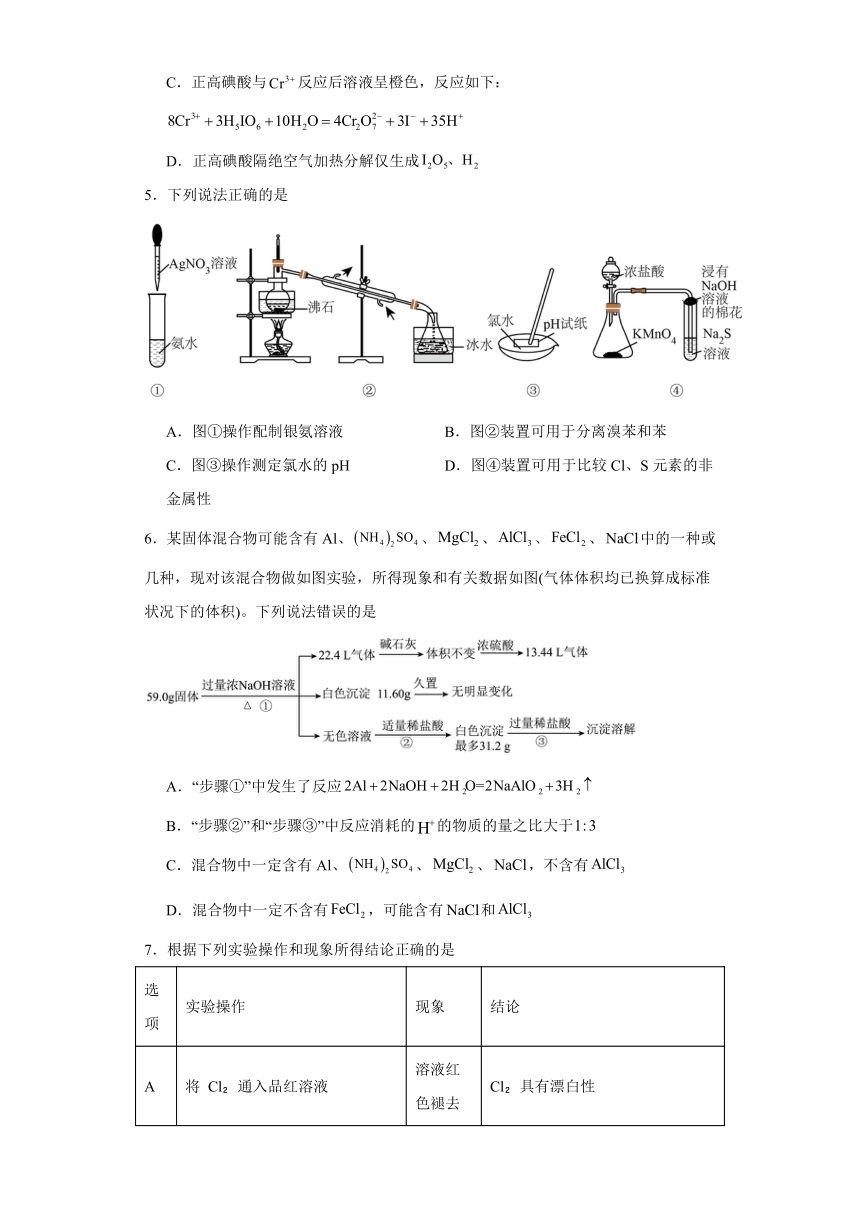
5.下列说法正确的是
A.图①操作配制银氨溶液 B.图②装置可用于分离溴苯和苯
C.图③操作测定氯水的pH D.图④装置可用于比较Cl、S元素的非金属性
6.某固体混合物可能含有Al、、、、、中的一种或几种,现对该混合物做如图实验,所得现象和有关数据如图(气体体积均已换算成标准状况下的体积)。下列说法错误的是
A.“步骤①”中发生了反应
B.“步骤②”和“步骤③”中反应消耗的的物质的量之比大于
C.混合物中一定含有Al、、、,不含有
D.混合物中一定不含有,可能含有和
7.根据下列实验操作和现象所得结论正确的是
选项 实验操作 现象 结论
A 将 Cl 通入品红溶液 溶液红色褪去 Cl 具有漂白性
B 向某溶液中滴加几滴氯水,再滴加KSCN溶液 溶液变红 原溶液中有Fe2+
C 向Ca(ClO)2溶液中通入SO2气体 有沉淀生成 酸性:H2SO3>HClO
D 向Al(OH)3沉淀中分别滴加足量盐酸或NaOH溶液 沉淀均溶解 Al(OH)3是两性氢氧化物,Al 表现一定的非金属性
A.A B.B C.C D.D
8.A、B、C、D、E是原子序数依次增大的五种常见短周期主族元素,其中A、B、C、D四种元素的原子序数之和为E元素原子序数的2倍。E是短周期中原子半径最大的元素。A、B、C、D四种元素形成的化合物[CA4]+[BD4]-有多种用途,可用来合成纳米管,还可作杀虫剂、催化剂、阻燃剂等,其结构如图所示。下列说法正确的是
A.元素A、C能形成含有非极性键的18电子化合物
B.最简单氢化物的稳定性:C>D
C.元素D、E形成的化合物为共价化合物
D.化合物[CA4]+[BD4]-中各原子均满足8电子稳定结构
9.化学在生产、生活中起着重要的作用:
①碳酸钠能与酸反应,因而可用它作膨松剂
②SO2作为辅料添加在红酒中可以起到杀菌和防止葡萄酒中一些成分被氧化的作用
③氕1H与核污水中的放射性元素氚3H互为同素异形体
④维生素C可用作水果罐头的抗氧化剂是由于其具有还原性
⑤晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维
其中叙述正确的个数有
A.1项 B.2项 C.3项 D.4项
10.短周期元素W、X、Y、Z的原子序数依次增大,Y最外层电子数等于最内层电子数的3倍,X、Y、Z的次外层电子数之和为Z的最外层电子数的6倍,W的一种核素可用于考古。下列说法正确的是
A.W的简单氢化物比X的简单氢化物稳定
B.简单离子半径的大小:
C.简单氢化物的沸点:X>Y
D.Y元素的最高正价与它的最低负价代数和为4
11.2016年11月国际纯粹与应用化学联合会(IUPAC)公布了人工合成的第113、115、117和118号元素。其中118号元素是由美国与俄罗斯科学家合作合成的,其质量数为294。下列关于该元素的说法中,正确的是
A.其原子核内中子数和质子数都是118 B.其原子核内中子数为176
C.其原子核外电子数为176 D.其原子最外层电子数为18
12.W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,X、Y、Z同周期且相邻,Z、Q位于同一主族且Z的核电荷数是Q的一半。下列说法正确的是
A.Z、Q元素的最高正价相同
B.W、X、Y、Z四种元素不能形成离子化合物
C.X、Q的最高价氧化物对应水化物的酸性:
D.X、Y、Z分别与W形成的简单化合物的沸点:
13.化学家为推动社会发展做出了重大贡献,下列说法不正确的是
A.中国化学家屠呦呦发现并提取青蒿素,有效降低了疟疾患者死亡率
B.中国化学家合成结晶牛胰岛素,为人类揭开生命奥秘作出了贡献
C.俄国化学家门捷列夫发现元素周期律,使化学研究变得有规律可循
D.瑞典化学家舍勒发现并命名了氯气,开启了氯气研究的序幕
14.我国科学家研制的“人造太阳”成功运行。所谓“人造太阳”是指受控核聚变。从1L海水中提取出来的氘 ()发生受控核聚变变成氦()时产生的能量相当于汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法不正确的是
A.氘()变成氦()发生化学变化
B.中的“2”与中的“2”意义不相同
C.的中子数和质子数均为2
D.和为不同核素
二、非选择题
15.人体必需的一些元素在周期表中的分布情况如下:
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是 。H2O2是一种绿色氧化剂,电子式为 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是 ,原子序数为 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。
A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性
B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性
C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性
D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性
16.现有下列4组物质:
A.CaO、MgO、CuO、NO B.CO、NaOH、KOH、
C.、Fe、Cu、Na D.HCl、、、
按要求填空。
组别 A组 B组 C组 D组
分类标准 金属氧化物 碱 金属单质 酸
不属于该类别的物质 ① ② ③ ④
(1)上述表格中④是: (填化学式)。
(2)上表中的①②是汽车尾气中的主要成分,二者在汽车尾气排气系统中催化剂的作用下发生反应,生成和。请写出该反应的化学方程式: 。该反应中氧化剂是: (填化学式)。
(3)同素异形体是指同一元素形成的性质不同的单质,与上表中③互为同素异形体的是: (填化学式)。
(4)把上表中④的饱和溶液滴入沸水中继续加热可得到一种胶体,该胶体的颜色为: 。
17.高铁酸钠()是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法是用次氯酸钠、烧碱和硫酸铁反应制备。回答下列问题:
(1)高铁酸钠()中铁元素的化合价是 ,据此判断高铁酸钠有 (填“氧化性”或“还原性”),中的中子数为 。
(2)用次氯酸钠、烧碱和氯化铁反应制备的化学原理可表示为。该反应中,氧化剂是 (填化学式),被氧化的元素是 (填元素符号),氧化产物和还原产物的物质的量之比为 ,生成1时,转移电子的物质的量为 。
(3)下列物质中可用于自来水消毒的是___________(填标号)。
A.臭氧 B.氯化钠 C.活性炭 D.二氧化氯
18.门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。回答下列问题:
Ⅰ. “类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
(1)铝是一种活泼金属,工业上采用电解熔融Al2O3制备金属Al。电解反应方程式为2Al2O34Al+3O2↑,加入冰晶石的目的是 。Al可以与NaOH溶液反应生成Na[Al(OH)4]与H2,该反应的离子方程式为 。
(2)镓与铝同主族,且位于铝的下一周期,则镓的原子结构示意图为 。
(3)废弃的含GaAs的材料可以用浓硝酸溶解,放出红棕色气体,同时生成H3AsO4和Ga(NO3)3,该反应的化学方程式为 。
Ⅱ.门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途: 、 。
(5)写出SiCl4的电子式:
(6)硅和锗单质分别与H2反应时,反应较难进行的是 (填“硅”或“锗”)。
试卷第1页,共3页
参考答案:
1.C
【详解】A.K是19号元素,核外有四层电子,位于第四周期,故A错误;
B.同主族元素非金属性随核电荷数增大而减小,非金属性:S<O,故B错误;
C.钾离子和硫离子的核外电子排布相同,硫离子的核电荷数小半径大,故C正确;
D.K的金属性强于Al因此,碱性,故D正确;
故答案为:C。
2.C
【分析】由表中数据知,①的最低负价为-2价,故为O元素,高正化合价为+1价的元素③和⑥分别为Li元素和Na元素,高正化合价为+5价和最低负化合价为-3价的元素④和⑦分别为N元素和P元素,最高正化合价+2的②为Mg元素,最高正化合价+3的⑧为Al元素,高正化合价为+7价和最低负化合价为-1价的⑤为Cl元素。
【详解】A.由分析可知,最高正化合价为+1价的元素③和⑥分别为Li元素和Na元素,Li元素和Na元素位于元素周期表ⅠA族;Na元素、Mg元素、Al元素、P元素和Cl元素都位于元素周期表第三周期,A正确;
B.元素的非金属性越强,气态氢化物越稳定,非金属性P>N,气态氢化物较稳定的是⑦,B正确;
C. 元素①、⑥形成化合物为氧化钠和过氧化钠。氧化钠中只存在离子键,过氧化钠中钠离子和过氧根离子间形成离子键,过氧根离子中两氧原子间为共价键,C错误;
D.⑥的离子为Al3+,与同周期的非金属离子相比较电子层数最少,与同周期金属离子相比核电荷数最大,故半径为最小,D正确;
故选C。
3.D
【详解】①元素的非金属性越强,其最高价含氧酸的酸性就越强,HClO3不是Cl元素的最高价的含氧酸,因此不能通过比较HClO3酸性与H2SO4的强弱判断元素的非金属性的强弱;错误;②元素的非金属性Cl>S,则元素的氢化物的稳定性HCl>H2S,而不能通过比较氢化物的酸性判断元素的非金属性强弱,错误;③HCl稳定性比H2S强,则可以证明元素的非金属性Cl>S,正确;④氢化物的还原性越强,对应元素氧化性越弱,非金属性越弱,正确;⑤Cl2与H2S反应生成S,元素的非金属性越强,活动性越强,活动性强的可以把活动性弱的从化合物则置换出来,因此可以通过Cl2与H2S反应生成S,证明元素的非金属性Cl>S,正确;⑥Fe是变价金属,活动性强的可以把Fe氧化为高价态,活动性弱的非金属只能把变价金属氧化为低价态,但Cl2与Fe反应生成FeCl3,Br2与Fe反应生成FeBr3,都是生成Fe的最高价态无法比较,不正确;⑦Na2S可与HCl反应生成H2S,只能证明酸性HCl>H2S,而不能证明元素的非金属性Cl>S,错误。故能够证明氯的非金属性比硫强的事实是③④⑤,故选D。
4.A
【详解】A.碘元素在自然界中无游离态,A正确;
B.元素非金属性越强,最高价含氧酸的酸性越强,非金属性Cl>I,所以HIO4的酸性弱于HClO4,故B错误;
C.正高碘酸与反应后溶液呈橙色,二者反应生成碘酸根离子和重铬酸根离子,故C错误;
D.根据氧化还原反应规律,正高碘酸隔绝空气加热分解生成H2O、I2O5、O2,故D错误;
故选A。
5.D
【详解】A.配制银氨溶液,应该把氨水滴入硝酸银溶液中,故A错误;
B.分馏装置中,接收器锥形瓶上不能塞橡胶塞,故B错误;
C.氯水中的次氯酸具有漂白性,不能用pH试纸测氯水的pH,故C错误;
D.锥形瓶中生成氯气,氯气和试管内的硫化钠反应生成氯化钠和S沉淀,氯气是氧化剂、S是氧化产物,氧化性Cl2>S,可知非金属性Cl>S,故D正确;
选D。
6.D
【分析】加过量浓溶液后加热,产生白色沉淀,久置无明显变化,判断沉淀为,混合物中含有(质量为),不含;“步骤①”产生标准状况下气体经过碱石灰后体积不变,经过浓硫酸后剩余气体,故“步骤①”产生的气体为氢气和氨气,依据,可推出混合物中含铝单质(质量为),含(质量为);“步骤②”最多得到白色沉淀[,物质的量为],说明混合物中不含;由质量守恒得知混合物中还含有,质量为;
【详解】A.“步骤①”中涉及铝与氢氧化铝反应,发生了反应,选项A正确;
B.“步骤②”为H++OH-=H2O和,“步骤③”为,二者反应消耗的的物质的量之比因过量氢氧根离子过量而大于,选项B正确;
C.根据分析可知,混合物中一定含有Al、、、,不含有,选项C正确;
D.混合物中一定不含有和,含有 ,选项D错误;
答案选D。
7.D
【详解】A.Cl2没有漂白性,而是Cl2与水反应生成HClO的漂白性,A错误;
B.若原溶液中含有Fe3+,滴加几滴氯水,再滴加KSCN溶液,溶液也会变红;应该先滴加KSCN溶液,溶液不变色,再滴加氯水,溶液变红,说明原溶液中有Fe2+;B错误;
C.Ca(ClO)2溶液中的ClO-具有氧化性,能将SO2氧化成,生成微溶物CaSO4,而不是CaSO3,不能说明酸性H2SO3>HClO,C错误;
D.Al(OH)3可与盐酸或NaOH溶液反应生成盐和水,说明Al(OH)3是两性氢氧化物,具有一定的酸性,能说明Al具有一定的非金属性,D正确;
答案选D。
8.A
【分析】A、B、C、D、E是原子序数依次增大的五种常见的短周期主族元素,E是短周期中原子半径最大的元素,E为Na;A、B、C、D四种元素的原子序数之和11×2=22,由化合物[CA4]+[BD4]-的结构可知,A、D只形成1个共价键,A为H、D为F;结合原子序数及形成的离子可知B为B,C为N,符合1+5+7+9=22,以此来解答。
【详解】由上述分析可知,A为H、B为B、C为N、D为F、E为Na;
A.元素A、C能形成含有非极性键的18电子化合物为N2H4,故A正确;
B.非金属性F大于N,则最简单氢化物的稳定性:C<D,故B错误;
C.元素D、E形成的化合物为NaF,NaF为离子化合物,故C错误;
D.化合物[CA4]+[BD4]-中H、B原子不满足8电子稳定结构,故D错误。
答案选A。
9.B
【详解】①碳酸氢钠能受热分解产生二氧化碳气体,因而可用它作膨松剂,①错误;
②SO2有还原性,作为辅料添加在红酒中可以起到杀菌和防止葡萄酒中一些成分被氧化的作用,②正确;
③氕1H与核污水中的放射性元素氚3H互为同位素,③错误;
④维生素C可用作水果罐头的抗氧化剂是由于其具有还原性,④正确;
⑤晶体硅的导电性介于导体和绝缘体之间,常用于制造半导体,二氧化硅用于制备光导纤维,⑤错误;
故②④正确,选B。
10.B
【分析】短周期元素W、X、Y、Z的原子序数依次增大,Y最外层电子数等于最内层电子数的3倍,则Y为O, W的一种核素可用于考古,则W为C,则X为N,X、Y、Z的次外层电子数之和为Z的最外层电子数的6倍,则Z为Mg。
【详解】A.同周期从左到右非金属性逐渐增强,其氢化物稳定性逐渐增强,因此W的简单氢化物(甲烷)比X的简单氢化物(氨气)不稳定,故A错误;
B.根据层多径大,同电子层结构核多径小,则简单离子半径的大小:,故B正确;
C.水中分子间氢键比氨气分子间氢键多,因此简单氢化物的沸点:Y > X,故C错误;
D.Y元素没有最高正价,氧与氟化合物中氧显+2价,氧元素的负价为-2,它的化合价价代数和为0,故D错误。
综上所述,答案为B。
11.B
【详解】A.其原子核内质子数是118,中子数为294-118=176,故A错误;
B.其原子核内中子数为294-118=176,故B正确;
C.其原子核外电子数=质子数=118,故C错误;
D.其原子最外层电子数为8,故D错误;
选B。
12.C
【分析】W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,则W为H,Z、Q位于同一主族且Z的核电荷数是Q的一半,则Z为O,Q为S,X、Y、Z同周期且相邻,故X为C,Y为N;
【详解】A.Z为O,Q为S,Z一般没有正价,Q元素的最高正价为+6价,选项A错误;
B.W、X、Y、Z四种元素能形成离子化合物NH4HCO3或(NH4)2CO3,选项B错误;
C.元素非金属性S>C,故X、Q的最高价氧化物对应水化物的酸性:,选项C正确;
D.X、Y、Z分别与W形成的简单化合物中H2O、NH3存在氢键,沸点:,选项D错误;
答案选C。
13.D
【详解】A.中国化学家屠呦呦发现并提取青蒿素,有效降低了疟疾患者死亡率,故A正确;
B.中国化学家合成结晶牛胰岛素,为人类揭开生命奥秘作出了贡献,故B正确;
C.俄国化学家门捷列夫发现元素周期律,使化学研究变得有规律可循,故C正确;
D.瑞典化学家舍勒发现了氯气,英国化学家戴维命名了氯气,故D错误;
故答案为:D。
14.A
【详解】A.氘受控核聚变成氦是一种核反应,A错误;
B.符号中的“2”符号表示质量数是2,中“2”符号表示质子数是2,意义不同,B正确;
C.中子数为2,质子数为2,C错误;
D.属于质子数相同,中子数不同的不同核素,D正确;
故答案为:A。
15.(1) 14C
(2)
(3) 第四周期VIA族 34
(4)
(5)BD
【详解】(1)碳有多种同位素,14C具有放射性,其中考古时用于测定文物年代的是14C。H2O2是一种绿色氧化剂,电子式为。故答案为:14C;;
(2)常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,含有NaClO和NaCl,反应的化学方程式为。故答案为:;
(3)Se在元素周期表中的位置是第四周期VIA族,原子序数为34。故答案为:第四周期VIA族;34;
(4)向少量酸性H2O2溶液中加入FeSO4溶液,生成硫酸铁,发生反应的离子方程式为。故答案为:;
(5)A. 若a、b、c表示氧族元素,对应氢化物的稳定性逐渐减弱,故A不符;B. 若a、b、c表示卤族元素,则X表示对应简单离子的还原性由弱变强,故B符合;C. 若a、b、c表示第IA族元素,对应离子的氧化性逐渐减弱,故C不符;D. 若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性由弱变强,故D符合;故答案为:BD。
16.(1)FeCl3
(2) 2NO+2CON2+2CO2 NO
(3)O3
(4)红褐色
【分析】A.NO为非金属氧化物,CaO、MgO、CuO为金属氧化物;
B.CO为非金属氧化物,NaOH、KOH、Ba(OH)2为碱;
C.O2为非金属单质,Fe、Cu、Na为金属单质;
D.FeCl3为盐,HCl、H2SO4、HNO3为酸;
【详解】(1)根据分析,表格④中FeCl3为盐,HCl、H2SO4、HNO3为酸;
故答案为:FeCl3;
(2)①为NO,②为CO,催化剂的作用下NO与CO发生反应,生成CO2和N2,,NO中N为+2价,化合价降低,得电子发生还原反应生成N2,NO作氧化剂;CO中C为+2价,化合价升高,失电子发生氧化反应生成CO2,CO作还原剂;
故答案为:;NO;
(3)③为O2,同素异形体为O3;
故答案为:O3;
(4)FeCl3的饱和溶液滴入沸水中继续加热可得到红褐色Fe(OH)3胶体,;
故答案为:红褐色。
17.(1) +6 氧化性 12
(2) NaClO Fe 2:3 3mol
(3)AD
【详解】(1)中钠、氧化合价分别为+1、-2,根据正负化合价为零的原则可知,其中Fe的化合价为+6价;高铁酸钠中铁为+6价,处于高价态,有强氧化性;质量数等于质子数加中子数,则中的中子数为23-11=12;
(2)该反应中次氯酸根中的氯由+1价降低到-1价,则氧化剂为NaClO,发生还原反应得到还原产物为9个NaCl中的3个NaCl;铁元素由+3价升高到+6价,发生氧化反应,被氧化元素为Fe,发生氧化反应得到氧化产物;氧化产物和还原产物的物质的量之比为2:3;该反应中铁元素由+3价升高到+6价,生成1时,转移电子的物质的量为3mol;
(3)臭氧、二氧化氯具有强氧化性,能杀菌消毒,故选AD。
18.(1) 降低Al2O3熔融温度或作助熔剂 2Al+2OH- + 6H2O=2[Al(OH)4]-+3H2↑
(2)
(3)GaAs+11HNO3=Ga(NO3)3+ H3AsO4+ 8NO2↑+ 4H2O
(4) 芯片 硅太阳能电池
(5)
(6)锗
【详解】(1)电解熔融Al2O3制备金属Al的过程中,加入冰晶石的目的是降低Al2O3熔融温度或作助熔剂。Al可以与NaOH溶液反应生成Na[Al(OH)4]与H2,根据得失电子守恒和电荷守恒配平离子方程式为:2Al+2OH- + 6H2O=2[Al(OH)4]-+3H2↑。
(2)镓与铝同主族,最外层有3个电子,且位于铝的下一周期,含有4个电子层,则镓的原子结构示意图为。
(3)GaAs和浓硝酸反应,生成红棕色气体NO2,同时生成H3AsO4和Ga(NO3)3,根据得失电子守恒和原子守恒配平化学方程式为:GaAs+11HNO3=Ga(NO3)3+ H3AsO4+ 8NO2↑+ 4H2O。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途:芯片、硅太阳能电池。
(5)SiCl4是共价化合物,电子式为:。
(6)锗位于硅的下一周期,且位于同一主族,同主族自上而下元素的非金属性逐渐减弱,元素的非金属性Si>Ge,非金属性越强,越容易和H2反应,硅和锗单质分别与H2反应时,反应较难进行的是锗
一、单选题
1.明矾是一种常用的净水剂。下列说法正确的是
A.K位于元素周期表的第三周期 B.非金属性:
C.离子半径大小: D.碱性强弱:
2.现有下列短周期元素性质的数据,下列说法不正确的是
元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径 (10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 1.43
最高正化合价 +2 +1 +5 +7 +1 +5 +3
最低负化合价 -2 -3 -1 -3
A.上述元素中处于处于第三周期的有②④⑤⑥⑧
B.元素④与元素⑦相比较,气态氢化物较稳定的是⑦
C.元素①、⑥形成的化合物一定含离子键、共价键
D.元素⑥的离子半径在同周期元素中最小
3.下列能够证明氯的非金属性比硫强的事实是
①HClO3酸性比H2SO4强
②HCl酸性比H2S强
③HCl稳定性比H2S强
④HCl还原性比H2S弱
⑤Cl2与H2S反应生成S
⑥Cl2与Fe反应生成FeCl3,Br2与Fe反应生成FeBr3
⑦Na2S可与HCl反应生成H2
A.①③⑤⑥ B.②③④⑤ C.③⑤⑥⑦ D.③④⑤
4.正高碘酸具有强氧化性和弱酸性,脱水可得偏高碘酸,下列说法正确的是
A.碘元素在自然界中无游离态
B.的酸性强于
C.正高碘酸与反应后溶液呈橙色,反应如下:
D.正高碘酸隔绝空气加热分解仅生成
5.下列说法正确的是
A.图①操作配制银氨溶液 B.图②装置可用于分离溴苯和苯
C.图③操作测定氯水的pH D.图④装置可用于比较Cl、S元素的非金属性
6.某固体混合物可能含有Al、、、、、中的一种或几种,现对该混合物做如图实验,所得现象和有关数据如图(气体体积均已换算成标准状况下的体积)。下列说法错误的是
A.“步骤①”中发生了反应
B.“步骤②”和“步骤③”中反应消耗的的物质的量之比大于
C.混合物中一定含有Al、、、,不含有
D.混合物中一定不含有,可能含有和
7.根据下列实验操作和现象所得结论正确的是
选项 实验操作 现象 结论
A 将 Cl 通入品红溶液 溶液红色褪去 Cl 具有漂白性
B 向某溶液中滴加几滴氯水,再滴加KSCN溶液 溶液变红 原溶液中有Fe2+
C 向Ca(ClO)2溶液中通入SO2气体 有沉淀生成 酸性:H2SO3>HClO
D 向Al(OH)3沉淀中分别滴加足量盐酸或NaOH溶液 沉淀均溶解 Al(OH)3是两性氢氧化物,Al 表现一定的非金属性
A.A B.B C.C D.D
8.A、B、C、D、E是原子序数依次增大的五种常见短周期主族元素,其中A、B、C、D四种元素的原子序数之和为E元素原子序数的2倍。E是短周期中原子半径最大的元素。A、B、C、D四种元素形成的化合物[CA4]+[BD4]-有多种用途,可用来合成纳米管,还可作杀虫剂、催化剂、阻燃剂等,其结构如图所示。下列说法正确的是
A.元素A、C能形成含有非极性键的18电子化合物
B.最简单氢化物的稳定性:C>D
C.元素D、E形成的化合物为共价化合物
D.化合物[CA4]+[BD4]-中各原子均满足8电子稳定结构
9.化学在生产、生活中起着重要的作用:
①碳酸钠能与酸反应,因而可用它作膨松剂
②SO2作为辅料添加在红酒中可以起到杀菌和防止葡萄酒中一些成分被氧化的作用
③氕1H与核污水中的放射性元素氚3H互为同素异形体
④维生素C可用作水果罐头的抗氧化剂是由于其具有还原性
⑤晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维
其中叙述正确的个数有
A.1项 B.2项 C.3项 D.4项
10.短周期元素W、X、Y、Z的原子序数依次增大,Y最外层电子数等于最内层电子数的3倍,X、Y、Z的次外层电子数之和为Z的最外层电子数的6倍,W的一种核素可用于考古。下列说法正确的是
A.W的简单氢化物比X的简单氢化物稳定
B.简单离子半径的大小:
C.简单氢化物的沸点:X>Y
D.Y元素的最高正价与它的最低负价代数和为4
11.2016年11月国际纯粹与应用化学联合会(IUPAC)公布了人工合成的第113、115、117和118号元素。其中118号元素是由美国与俄罗斯科学家合作合成的,其质量数为294。下列关于该元素的说法中,正确的是
A.其原子核内中子数和质子数都是118 B.其原子核内中子数为176
C.其原子核外电子数为176 D.其原子最外层电子数为18
12.W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,X、Y、Z同周期且相邻,Z、Q位于同一主族且Z的核电荷数是Q的一半。下列说法正确的是
A.Z、Q元素的最高正价相同
B.W、X、Y、Z四种元素不能形成离子化合物
C.X、Q的最高价氧化物对应水化物的酸性:
D.X、Y、Z分别与W形成的简单化合物的沸点:
13.化学家为推动社会发展做出了重大贡献,下列说法不正确的是
A.中国化学家屠呦呦发现并提取青蒿素,有效降低了疟疾患者死亡率
B.中国化学家合成结晶牛胰岛素,为人类揭开生命奥秘作出了贡献
C.俄国化学家门捷列夫发现元素周期律,使化学研究变得有规律可循
D.瑞典化学家舍勒发现并命名了氯气,开启了氯气研究的序幕
14.我国科学家研制的“人造太阳”成功运行。所谓“人造太阳”是指受控核聚变。从1L海水中提取出来的氘 ()发生受控核聚变变成氦()时产生的能量相当于汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法不正确的是
A.氘()变成氦()发生化学变化
B.中的“2”与中的“2”意义不相同
C.的中子数和质子数均为2
D.和为不同核素
二、非选择题
15.人体必需的一些元素在周期表中的分布情况如下:
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是 。H2O2是一种绿色氧化剂,电子式为 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是 ,原子序数为 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。
A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性
B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性
C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性
D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性
16.现有下列4组物质:
A.CaO、MgO、CuO、NO B.CO、NaOH、KOH、
C.、Fe、Cu、Na D.HCl、、、
按要求填空。
组别 A组 B组 C组 D组
分类标准 金属氧化物 碱 金属单质 酸
不属于该类别的物质 ① ② ③ ④
(1)上述表格中④是: (填化学式)。
(2)上表中的①②是汽车尾气中的主要成分,二者在汽车尾气排气系统中催化剂的作用下发生反应,生成和。请写出该反应的化学方程式: 。该反应中氧化剂是: (填化学式)。
(3)同素异形体是指同一元素形成的性质不同的单质,与上表中③互为同素异形体的是: (填化学式)。
(4)把上表中④的饱和溶液滴入沸水中继续加热可得到一种胶体,该胶体的颜色为: 。
17.高铁酸钠()是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法是用次氯酸钠、烧碱和硫酸铁反应制备。回答下列问题:
(1)高铁酸钠()中铁元素的化合价是 ,据此判断高铁酸钠有 (填“氧化性”或“还原性”),中的中子数为 。
(2)用次氯酸钠、烧碱和氯化铁反应制备的化学原理可表示为。该反应中,氧化剂是 (填化学式),被氧化的元素是 (填元素符号),氧化产物和还原产物的物质的量之比为 ,生成1时,转移电子的物质的量为 。
(3)下列物质中可用于自来水消毒的是___________(填标号)。
A.臭氧 B.氯化钠 C.活性炭 D.二氧化氯
18.门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。回答下列问题:
Ⅰ. “类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
(1)铝是一种活泼金属,工业上采用电解熔融Al2O3制备金属Al。电解反应方程式为2Al2O34Al+3O2↑,加入冰晶石的目的是 。Al可以与NaOH溶液反应生成Na[Al(OH)4]与H2,该反应的离子方程式为 。
(2)镓与铝同主族,且位于铝的下一周期,则镓的原子结构示意图为 。
(3)废弃的含GaAs的材料可以用浓硝酸溶解,放出红棕色气体,同时生成H3AsO4和Ga(NO3)3,该反应的化学方程式为 。
Ⅱ.门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途: 、 。
(5)写出SiCl4的电子式:
(6)硅和锗单质分别与H2反应时,反应较难进行的是 (填“硅”或“锗”)。
试卷第1页,共3页
参考答案:
1.C
【详解】A.K是19号元素,核外有四层电子,位于第四周期,故A错误;
B.同主族元素非金属性随核电荷数增大而减小,非金属性:S<O,故B错误;
C.钾离子和硫离子的核外电子排布相同,硫离子的核电荷数小半径大,故C正确;
D.K的金属性强于Al因此,碱性,故D正确;
故答案为:C。
2.C
【分析】由表中数据知,①的最低负价为-2价,故为O元素,高正化合价为+1价的元素③和⑥分别为Li元素和Na元素,高正化合价为+5价和最低负化合价为-3价的元素④和⑦分别为N元素和P元素,最高正化合价+2的②为Mg元素,最高正化合价+3的⑧为Al元素,高正化合价为+7价和最低负化合价为-1价的⑤为Cl元素。
【详解】A.由分析可知,最高正化合价为+1价的元素③和⑥分别为Li元素和Na元素,Li元素和Na元素位于元素周期表ⅠA族;Na元素、Mg元素、Al元素、P元素和Cl元素都位于元素周期表第三周期,A正确;
B.元素的非金属性越强,气态氢化物越稳定,非金属性P>N,气态氢化物较稳定的是⑦,B正确;
C. 元素①、⑥形成化合物为氧化钠和过氧化钠。氧化钠中只存在离子键,过氧化钠中钠离子和过氧根离子间形成离子键,过氧根离子中两氧原子间为共价键,C错误;
D.⑥的离子为Al3+,与同周期的非金属离子相比较电子层数最少,与同周期金属离子相比核电荷数最大,故半径为最小,D正确;
故选C。
3.D
【详解】①元素的非金属性越强,其最高价含氧酸的酸性就越强,HClO3不是Cl元素的最高价的含氧酸,因此不能通过比较HClO3酸性与H2SO4的强弱判断元素的非金属性的强弱;错误;②元素的非金属性Cl>S,则元素的氢化物的稳定性HCl>H2S,而不能通过比较氢化物的酸性判断元素的非金属性强弱,错误;③HCl稳定性比H2S强,则可以证明元素的非金属性Cl>S,正确;④氢化物的还原性越强,对应元素氧化性越弱,非金属性越弱,正确;⑤Cl2与H2S反应生成S,元素的非金属性越强,活动性越强,活动性强的可以把活动性弱的从化合物则置换出来,因此可以通过Cl2与H2S反应生成S,证明元素的非金属性Cl>S,正确;⑥Fe是变价金属,活动性强的可以把Fe氧化为高价态,活动性弱的非金属只能把变价金属氧化为低价态,但Cl2与Fe反应生成FeCl3,Br2与Fe反应生成FeBr3,都是生成Fe的最高价态无法比较,不正确;⑦Na2S可与HCl反应生成H2S,只能证明酸性HCl>H2S,而不能证明元素的非金属性Cl>S,错误。故能够证明氯的非金属性比硫强的事实是③④⑤,故选D。
4.A
【详解】A.碘元素在自然界中无游离态,A正确;
B.元素非金属性越强,最高价含氧酸的酸性越强,非金属性Cl>I,所以HIO4的酸性弱于HClO4,故B错误;
C.正高碘酸与反应后溶液呈橙色,二者反应生成碘酸根离子和重铬酸根离子,故C错误;
D.根据氧化还原反应规律,正高碘酸隔绝空气加热分解生成H2O、I2O5、O2,故D错误;
故选A。
5.D
【详解】A.配制银氨溶液,应该把氨水滴入硝酸银溶液中,故A错误;
B.分馏装置中,接收器锥形瓶上不能塞橡胶塞,故B错误;
C.氯水中的次氯酸具有漂白性,不能用pH试纸测氯水的pH,故C错误;
D.锥形瓶中生成氯气,氯气和试管内的硫化钠反应生成氯化钠和S沉淀,氯气是氧化剂、S是氧化产物,氧化性Cl2>S,可知非金属性Cl>S,故D正确;
选D。
6.D
【分析】加过量浓溶液后加热,产生白色沉淀,久置无明显变化,判断沉淀为,混合物中含有(质量为),不含;“步骤①”产生标准状况下气体经过碱石灰后体积不变,经过浓硫酸后剩余气体,故“步骤①”产生的气体为氢气和氨气,依据,可推出混合物中含铝单质(质量为),含(质量为);“步骤②”最多得到白色沉淀[,物质的量为],说明混合物中不含;由质量守恒得知混合物中还含有,质量为;
【详解】A.“步骤①”中涉及铝与氢氧化铝反应,发生了反应,选项A正确;
B.“步骤②”为H++OH-=H2O和,“步骤③”为,二者反应消耗的的物质的量之比因过量氢氧根离子过量而大于,选项B正确;
C.根据分析可知,混合物中一定含有Al、、、,不含有,选项C正确;
D.混合物中一定不含有和,含有 ,选项D错误;
答案选D。
7.D
【详解】A.Cl2没有漂白性,而是Cl2与水反应生成HClO的漂白性,A错误;
B.若原溶液中含有Fe3+,滴加几滴氯水,再滴加KSCN溶液,溶液也会变红;应该先滴加KSCN溶液,溶液不变色,再滴加氯水,溶液变红,说明原溶液中有Fe2+;B错误;
C.Ca(ClO)2溶液中的ClO-具有氧化性,能将SO2氧化成,生成微溶物CaSO4,而不是CaSO3,不能说明酸性H2SO3>HClO,C错误;
D.Al(OH)3可与盐酸或NaOH溶液反应生成盐和水,说明Al(OH)3是两性氢氧化物,具有一定的酸性,能说明Al具有一定的非金属性,D正确;
答案选D。
8.A
【分析】A、B、C、D、E是原子序数依次增大的五种常见的短周期主族元素,E是短周期中原子半径最大的元素,E为Na;A、B、C、D四种元素的原子序数之和11×2=22,由化合物[CA4]+[BD4]-的结构可知,A、D只形成1个共价键,A为H、D为F;结合原子序数及形成的离子可知B为B,C为N,符合1+5+7+9=22,以此来解答。
【详解】由上述分析可知,A为H、B为B、C为N、D为F、E为Na;
A.元素A、C能形成含有非极性键的18电子化合物为N2H4,故A正确;
B.非金属性F大于N,则最简单氢化物的稳定性:C<D,故B错误;
C.元素D、E形成的化合物为NaF,NaF为离子化合物,故C错误;
D.化合物[CA4]+[BD4]-中H、B原子不满足8电子稳定结构,故D错误。
答案选A。
9.B
【详解】①碳酸氢钠能受热分解产生二氧化碳气体,因而可用它作膨松剂,①错误;
②SO2有还原性,作为辅料添加在红酒中可以起到杀菌和防止葡萄酒中一些成分被氧化的作用,②正确;
③氕1H与核污水中的放射性元素氚3H互为同位素,③错误;
④维生素C可用作水果罐头的抗氧化剂是由于其具有还原性,④正确;
⑤晶体硅的导电性介于导体和绝缘体之间,常用于制造半导体,二氧化硅用于制备光导纤维,⑤错误;
故②④正确,选B。
10.B
【分析】短周期元素W、X、Y、Z的原子序数依次增大,Y最外层电子数等于最内层电子数的3倍,则Y为O, W的一种核素可用于考古,则W为C,则X为N,X、Y、Z的次外层电子数之和为Z的最外层电子数的6倍,则Z为Mg。
【详解】A.同周期从左到右非金属性逐渐增强,其氢化物稳定性逐渐增强,因此W的简单氢化物(甲烷)比X的简单氢化物(氨气)不稳定,故A错误;
B.根据层多径大,同电子层结构核多径小,则简单离子半径的大小:,故B正确;
C.水中分子间氢键比氨气分子间氢键多,因此简单氢化物的沸点:Y > X,故C错误;
D.Y元素没有最高正价,氧与氟化合物中氧显+2价,氧元素的负价为-2,它的化合价价代数和为0,故D错误。
综上所述,答案为B。
11.B
【详解】A.其原子核内质子数是118,中子数为294-118=176,故A错误;
B.其原子核内中子数为294-118=176,故B正确;
C.其原子核外电子数=质子数=118,故C错误;
D.其原子最外层电子数为8,故D错误;
选B。
12.C
【分析】W、X、Y、Z、Q是核电荷数依次增大的五种短周期元素。的半径在所有离子中最小,则W为H,Z、Q位于同一主族且Z的核电荷数是Q的一半,则Z为O,Q为S,X、Y、Z同周期且相邻,故X为C,Y为N;
【详解】A.Z为O,Q为S,Z一般没有正价,Q元素的最高正价为+6价,选项A错误;
B.W、X、Y、Z四种元素能形成离子化合物NH4HCO3或(NH4)2CO3,选项B错误;
C.元素非金属性S>C,故X、Q的最高价氧化物对应水化物的酸性:,选项C正确;
D.X、Y、Z分别与W形成的简单化合物中H2O、NH3存在氢键,沸点:,选项D错误;
答案选C。
13.D
【详解】A.中国化学家屠呦呦发现并提取青蒿素,有效降低了疟疾患者死亡率,故A正确;
B.中国化学家合成结晶牛胰岛素,为人类揭开生命奥秘作出了贡献,故B正确;
C.俄国化学家门捷列夫发现元素周期律,使化学研究变得有规律可循,故C正确;
D.瑞典化学家舍勒发现了氯气,英国化学家戴维命名了氯气,故D错误;
故答案为:D。
14.A
【详解】A.氘受控核聚变成氦是一种核反应,A错误;
B.符号中的“2”符号表示质量数是2,中“2”符号表示质子数是2,意义不同,B正确;
C.中子数为2,质子数为2,C错误;
D.属于质子数相同,中子数不同的不同核素,D正确;
故答案为:A。
15.(1) 14C
(2)
(3) 第四周期VIA族 34
(4)
(5)BD
【详解】(1)碳有多种同位素,14C具有放射性,其中考古时用于测定文物年代的是14C。H2O2是一种绿色氧化剂,电子式为。故答案为:14C;;
(2)常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,含有NaClO和NaCl,反应的化学方程式为。故答案为:;
(3)Se在元素周期表中的位置是第四周期VIA族,原子序数为34。故答案为:第四周期VIA族;34;
(4)向少量酸性H2O2溶液中加入FeSO4溶液,生成硫酸铁,发生反应的离子方程式为。故答案为:;
(5)A. 若a、b、c表示氧族元素,对应氢化物的稳定性逐渐减弱,故A不符;B. 若a、b、c表示卤族元素,则X表示对应简单离子的还原性由弱变强,故B符合;C. 若a、b、c表示第IA族元素,对应离子的氧化性逐渐减弱,故C不符;D. 若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性由弱变强,故D符合;故答案为:BD。
16.(1)FeCl3
(2) 2NO+2CON2+2CO2 NO
(3)O3
(4)红褐色
【分析】A.NO为非金属氧化物,CaO、MgO、CuO为金属氧化物;
B.CO为非金属氧化物,NaOH、KOH、Ba(OH)2为碱;
C.O2为非金属单质,Fe、Cu、Na为金属单质;
D.FeCl3为盐,HCl、H2SO4、HNO3为酸;
【详解】(1)根据分析,表格④中FeCl3为盐,HCl、H2SO4、HNO3为酸;
故答案为:FeCl3;
(2)①为NO,②为CO,催化剂的作用下NO与CO发生反应,生成CO2和N2,,NO中N为+2价,化合价降低,得电子发生还原反应生成N2,NO作氧化剂;CO中C为+2价,化合价升高,失电子发生氧化反应生成CO2,CO作还原剂;
故答案为:;NO;
(3)③为O2,同素异形体为O3;
故答案为:O3;
(4)FeCl3的饱和溶液滴入沸水中继续加热可得到红褐色Fe(OH)3胶体,;
故答案为:红褐色。
17.(1) +6 氧化性 12
(2) NaClO Fe 2:3 3mol
(3)AD
【详解】(1)中钠、氧化合价分别为+1、-2,根据正负化合价为零的原则可知,其中Fe的化合价为+6价;高铁酸钠中铁为+6价,处于高价态,有强氧化性;质量数等于质子数加中子数,则中的中子数为23-11=12;
(2)该反应中次氯酸根中的氯由+1价降低到-1价,则氧化剂为NaClO,发生还原反应得到还原产物为9个NaCl中的3个NaCl;铁元素由+3价升高到+6价,发生氧化反应,被氧化元素为Fe,发生氧化反应得到氧化产物;氧化产物和还原产物的物质的量之比为2:3;该反应中铁元素由+3价升高到+6价,生成1时,转移电子的物质的量为3mol;
(3)臭氧、二氧化氯具有强氧化性,能杀菌消毒,故选AD。
18.(1) 降低Al2O3熔融温度或作助熔剂 2Al+2OH- + 6H2O=2[Al(OH)4]-+3H2↑
(2)
(3)GaAs+11HNO3=Ga(NO3)3+ H3AsO4+ 8NO2↑+ 4H2O
(4) 芯片 硅太阳能电池
(5)
(6)锗
【详解】(1)电解熔融Al2O3制备金属Al的过程中,加入冰晶石的目的是降低Al2O3熔融温度或作助熔剂。Al可以与NaOH溶液反应生成Na[Al(OH)4]与H2,根据得失电子守恒和电荷守恒配平离子方程式为:2Al+2OH- + 6H2O=2[Al(OH)4]-+3H2↑。
(2)镓与铝同主族,最外层有3个电子,且位于铝的下一周期,含有4个电子层,则镓的原子结构示意图为。
(3)GaAs和浓硝酸反应,生成红棕色气体NO2,同时生成H3AsO4和Ga(NO3)3,根据得失电子守恒和原子守恒配平化学方程式为:GaAs+11HNO3=Ga(NO3)3+ H3AsO4+ 8NO2↑+ 4H2O。
(4)硅是应用最为广泛的半导体材料,写出高纯硅的两种用途:芯片、硅太阳能电池。
(5)SiCl4是共价化合物,电子式为:。
(6)锗位于硅的下一周期,且位于同一主族,同主族自上而下元素的非金属性逐渐减弱,元素的非金属性Si>Ge,非金属性越强,越容易和H2反应,硅和锗单质分别与H2反应时,反应较难进行的是锗
