第五单元 化学方程式【考点串讲PPT】-2023-2024学年九年级化学上学期期末考点大串讲(人教版)
文档属性
| 名称 | 第五单元 化学方程式【考点串讲PPT】-2023-2024学年九年级化学上学期期末考点大串讲(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 26.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 10:24:22 | ||
图片预览







文档简介
(共36张PPT)
举一反三
典例精讲
考点梳理
思维导图
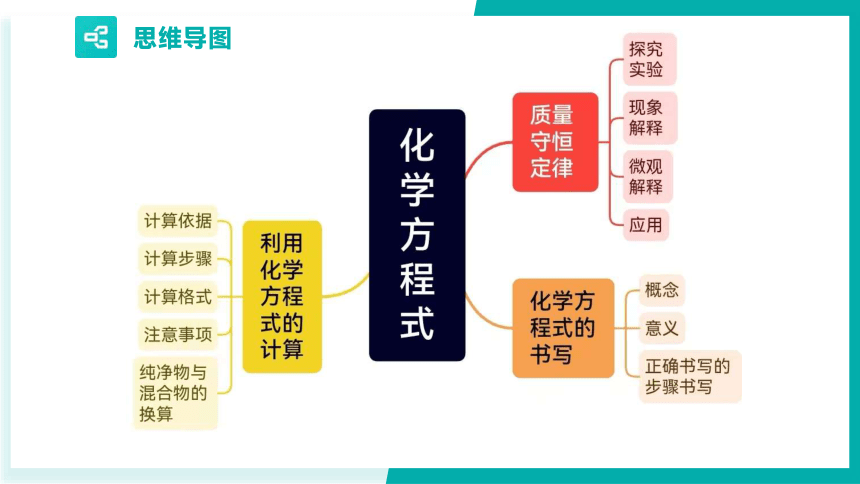
化学方程式
第五单元
考点串讲PPT
目
录
CONTENTS
1
质量守恒定律
2
如何正确书写化学方程式
3
利用化学方程式的计算
思维导图
质量守恒定律
的探究及解释
考点01
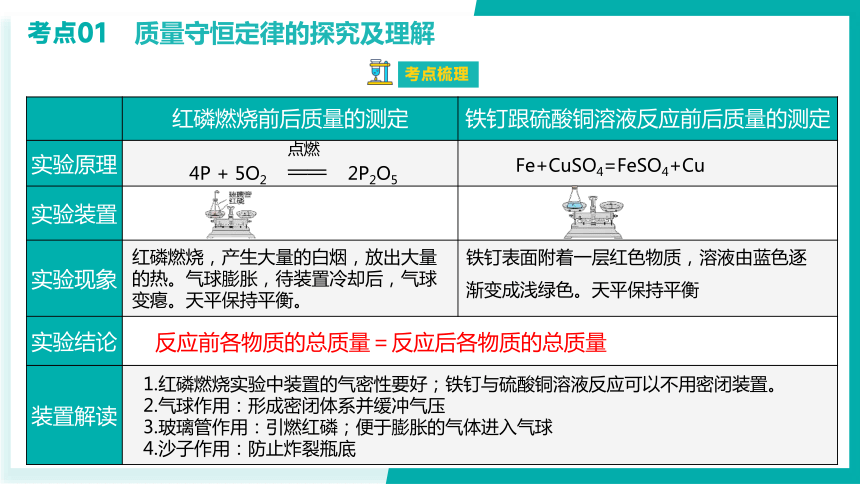
红磷燃烧前后质量的测定 铁钉跟硫酸铜溶液反应前后质量的测定
实验原理
实验装置
实验现象
实验结论 装置解读 考点01 质量守恒定律的探究及理解
考点梳理
红磷燃烧,产生大量的白烟,放出大量的热。气球膨胀,待装置冷却后,气球变瘪。天平保持平衡。
铁钉表面附着一层红色物质,溶液由蓝色逐渐变成浅绿色。天平保持平衡
反应前各物质的总质量=反应后各物质的总质量
1.红磷燃烧实验中装置的气密性要好;铁钉与硫酸铜溶液反应可以不用密闭装置。
2.气球作用:形成密闭体系并缓冲气压
3.玻璃管作用:引燃红磷;便于膨胀的气体进入气球
4.沙子作用:防止炸裂瓶底
Fe+CuSO4=FeSO4+Cu
4P + 5O2 —— 2P2O5
点燃
——
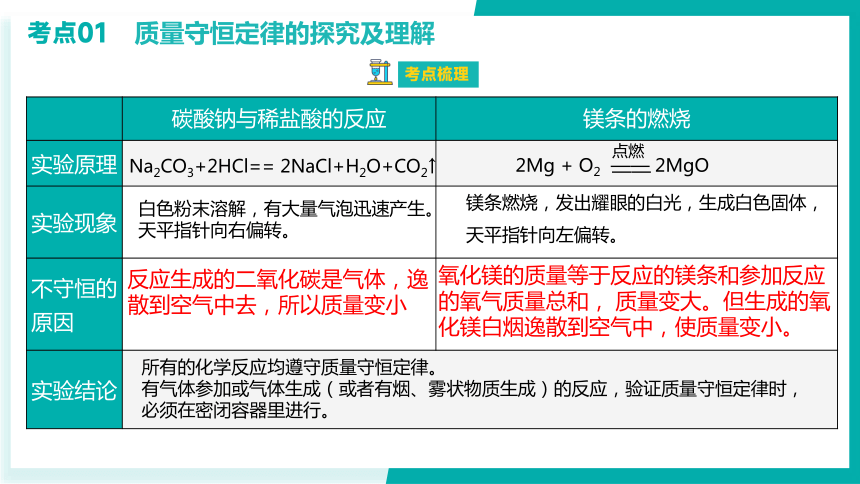
碳酸钠与稀盐酸的反应 镁条的燃烧
实验原理
实验现象
不守恒的原因
实验结论 考点01 质量守恒定律的探究及理解
考点梳理
白色粉末溶解,有大量气泡迅速产生。天平指针向右偏转。
镁条燃烧,发出耀眼的白光,生成白色固体,天平指针向左偏转。
反应生成的二氧化碳是气体,逸散到空气中去,所以质量变小
所有的化学反应均遵守质量守恒定律。
有气体参加或气体生成(或者有烟、雾状物质生成)的反应,验证质量守恒定律时,必须在密闭容器里进行。
Na2CO3+2HCl== 2NaCl+H2O+CO2↑
2Mg + O2 —— 2MgO
点燃
——
氧化镁的质量等于反应的镁条和参加反应的氧气质量总和, 质量变大。但生成的氧化镁白烟逸散到空气中,使质量变小。
内容
关键词 参加
各物质
质量总和
适用范围
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
参加反应或反应生成所有物质,特别注意气体、沉淀不能遗漏。
没有参加反应的物质(反应剩余的物质)、不是反应生成的物质,质量不能计入“总和”中。
是质量之和,不是体积、分子个数。
考点02 质量守恒定律的探究及理解
考点梳理
适用于一切化学变化,不适用于物理变化。
考点01 质量守恒定律的探究及理解
典例精讲
【典例01】(2023年湖北宜昌中考)下列现象能用质量守恒定律解释的是( )
A. 蔗糖溶于水后总质量不变 B. 浓硫酸敞口放置质量增加
C. 饱和硝酸钾溶液升温,溶液质量不变 D. 硫酸铜溶液和氢氧化钠溶液混合,溶液质量减小
D
【典例02】(2023年黑龙江龙东中考)在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一
定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确
的是( )
A.x的数值为8
B.反应前后元素的化合价可能改变
C.该反应一定属于置换反应
D.反应前后甲、戊变化的质量之比为3:1
C
考点01 质量守恒定律的探究及理解
典例精讲
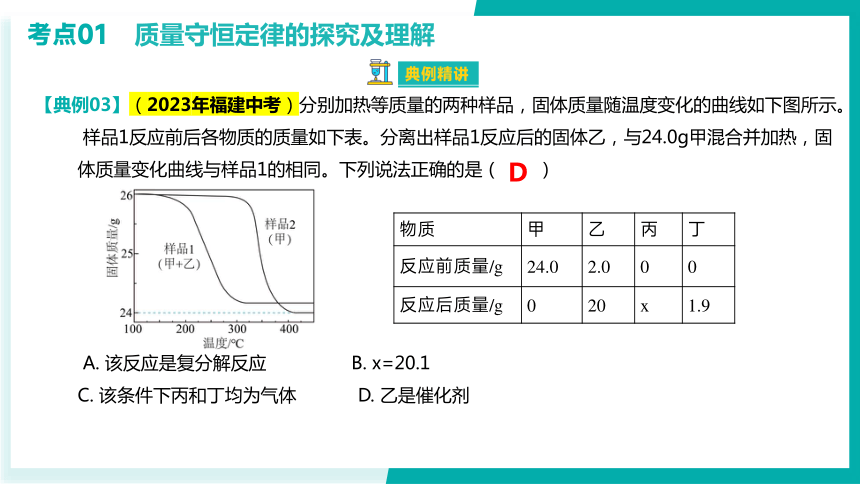
【典例03】(2023年福建中考)分别加热等质量的两种样品,固体质量随温度变化的曲线如下图所示。
样品1反应前后各物质的质量如下表。分离出样品1反应后的固体乙,与24.0g甲混合并加热,固
体质量变化曲线与样品1的相同。下列说法正确的是( )
A. 该反应是复分解反应 B. x=20.1
C. 该条件下丙和丁均为气体 D. 乙是催化剂
D
物质 甲 乙 丙 丁
反应前质量/g 24.0 2.0 0 0
反应后质量/g 0 20 x 1.9
举一反三
考点01 质量守恒定律的探究及理解
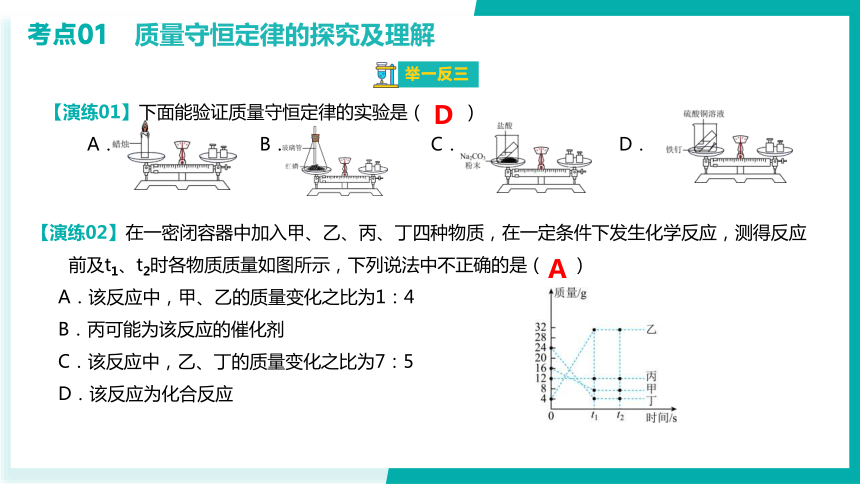
【演练01】下面能验证质量守恒定律的实验是( )
A. B. C. D.
D
【演练02】在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应
前及t1、t2时各物质质量如图所示,下列说法中不正确的是( )
A.该反应中,甲、乙的质量变化之比为1:4
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7:5
D.该反应为化合反应
A
【演练03】(2022年湖北宜昌中考)(3)如图所示,利用红磷与空气中的氧气反应验证质量守恒定律。
①用红热的玻璃管引燃红磷,其燃烧过程中能观察到的现象是 ,
反应的化学方程式为 。
②待红磷熄灭后再次称量,天平不再平衡,其原因可能是___________。
A.装置漏气 B.用橡胶塞塞紧锥形瓶速度太慢
C.红磷太少 D.没有等锥形瓶冷却就再次称量
冒白烟、放热、气球膨胀
举一反三
考点01 质量守恒定律的探究及理解
ABD
质量守恒定律的
微观解释及应用
考点02
化学 变化微观解释
微观 实质
化学反应的实质是反应物的分子破裂成原子,原子又重新组合成新的分子。在反应前后原子的种类没变,原子的数目没有增减,原子的质量没有变化,所以化学反应前后各物质的质量总和必然相等。
考点02 质量守恒定律的微观解释及应用
考点梳理
重组
分解
宏观 微观
一定不变
一定改变
可能改变
应用 考点02 质量守恒定律的微观解释及应用
考点梳理
物质的总质量不变;
元素的种类不变;
元素的质量不变
原子的种类不变
原子的数目不变
原子的质量不变
物质的种类一定改变
分子的种类一定改变
分子总数可能改变
化合价可能改变
1.求某种反应物或生成物的质量。
2.推断反应物或生成物的组成(化学式)
3.推断反应物是否全部参加了反应。
4.利用原子、分子知识解释质量守恒原因
【典例01】(2023年安徽中考)口罩中的熔喷布具有过滤病毒的作用, Z 是合成熔喷布的主要
原料,由X制 备Z的微现示意图如下。下列说法正确的是 ( )
A. X 的化学式为C8H3 B. 反应前后分子种类不变
C. Y、Z在O2中充分燃烧产物相同 D. 反应前后原子个数不变
考点02 质量守恒定律的微观解释及应用
典例精讲
D
【典例02】(2022年安徽省中考)我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,
合成过程中主要物质向转化的微观示意图如下、下列说法错误的是 ( )
A. 催化剂提高了合成效率 B. X的化学式为CH2O
C. CO2合成的过程中伴随能量变化 D. 一定有含氢元素的物质参与合成
B
考点02 质量守恒定律的微观解释及应用
典例精讲
【典例03】(2023年广东中考)梦天舱燃烧科学柜采用a作燃料成功实施首次在轨点火实验。a完全
燃烧的反应微观示意图如图所示。下列说法错误的是( )
A. 反应前后元素种类不变 B. 反应前后分子个数不变
C. a分子中C、H原子个数比为1:4
D. 反应生成c、d的质量比为 22:9
D
【典例04】(2023年山东聊城中考)我国科学家在国际上首次以CO2和H2为原料,在构筑的纳米
“蓄水”膜反应器中实现了二氧化碳在温和条件下一步转化为乙醇的反应,该反应微观示意图如
下。 有关说法不正确的是 ( )
A.无机物在一定条件下可以转化成有机物
B.反应前后分子种类改变,原子种类不变
C.参加反应的二氧化碳和氢气的分子个数比为2:7
D.该反应生成物是CH3CH2OH和H2O
C
【演练01】(2023年四川眉山中考)科学家利用某纳米纤维催化剂将二氧化碳转化为液体燃料
甲醇(CH3OH),其微观示意图如下(图中的分子恰好完全反应)。下列说法错误的是( )
A. 生成物丙中碳元素的质量分数为37.5% B. 该反应的化学方程式为
C. 生成物丙和丁的质量比为1:1 D. 该反应有助于实现“碳中和”
考点02 质量守恒定律的微观解释及应用
举一反三
C
【演练02】(2023年湖北随州中考)纯净物甲是一种绿色能源,相对分子质量为46。在一定条件下,
一定质量的甲与8.0g乙恰好完全反应,生成4.4g丙、5.4g丁和2.8g戊。反应的微观示意图如下,
下列有关说法错误的是( )
A.参加反应甲的质量为4.6g
B.甲物质中碳元素和氢元素的质量比为4∶1
C.甲物质中含有碳、氢、氧三种元素
D.若使生成的戊充分氧化,至少还需乙3.2g
D
【演练04】某化合物与9.6g氧气在点燃的条件下恰好完全反应,生成8.8g二氧化碳和5.4g水,则该
化合物的化学式为( )
A.CH3OH B.C2H5OH C.CH4 D.C2H6
考点02 质量守恒定律的微观解释及应用
举一反三
B
【演练03】(2023年黑龙江齐齐哈尔中考)石灰岩的主要成分是碳酸钙,在一定条件下发生反应,生成
溶解性较大的碳酸氢钙,反应的化学方程式为:CaCO3+X+H2O==Ca(HCO3-)2 ,其中X的化学
式为( )
A. CaO B. Ca(OH)2 C. H2CO3 D. CO2
D
化学方程式的
意义及书写
考点03
考点03 化学方程式的意义
考点梳理
意义 以 为例 读法
质的方面
量的方面 宏观
微观
参加反应的碳、氧气与生成的二氧化碳的质量之比为3:8:11
反应中碳、氧气与二氧化碳的分子个数之比为1:1:1
碳和氧气在点燃条件下反应生成水
每12份质量的碳和32份质量的氧气在点燃的条件下恰好完全反应,生成44份质量的二氧化碳。
每1个碳原子和1个氧分子在点燃的条件下恰好完全反应,生成1个二氧化碳分子。
C+O2==CO2
点燃
碳和氧气在点燃条件下反应生成水
化学方程式:用化学式表示化学反应的式子。
表明反应物、生成物和反应条件
各物质间反应时的质量比
各物质间反应时的微粒个数比
考点03 化学方程式的书写
考点梳理
书写 原则
步骤 写
配
等
注
查
把“——”改成“ ”
根据客观事实,正确写出反应物和生成物的化学式,中间用“——”连接
配平化学方程式,使式子两边各元素的原子数目相等
① 必须以客观事实为基础;
② 必须遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
——
——
注明反应条件、生成物状态,如点燃、加热、催化剂、“↑”、“↓”等
检查化学式的书写、配平、条件、生成物状态符号等
注:生成物中是“无中生有“时需要标注生成物状态
考点03 化学方程式的意义及书写
典例精讲
【典例01】(2023年四川眉山中考)下列描述涉及反应的化学方程式正确的是( )
A. 服用含氢氧化铝的药物治疗胃酸过多:
B. 用过氧化氢溶液制氧气:
C. 将铁丝浸入稀盐酸中:
D. 用食醋清洗水壶中的水垢:
D
【典例02】(2023年河南中考)下列化学方程式符合题意且书写正确的是( )
A. 酸雨形成的原因:
B. 盐酸除去铁锈:
C. 除去二氧化碳中的一氧化碳:
D. 小苏打治疗胃酸过多症:
D
考点03 化学方程式的意义及书写
典例精讲
【典例03】(2023年湖北潜江中考)现有O2、Fe、CO、稀硫酸、KOH溶液、CaCO3、MgCl2溶液
七种物质,请选择适当的物质按照要求书写化学方程式(每种物质只能选用一次):
(1)化合反应: 。
(2)分解反应: 。
(3)置换反应: 。
(4)复分解反应: 。
【演练01】北京冬奥会火炬“飞扬”采用液氢作为燃料,真正做到了零排放、零污染。氢气燃烧的
化学方程式为 2H2 + O2 —— 2H2O,从中获得的信息错误的是( )
A.氢气和氧气在点燃的条件下生成水
B.在点燃条件下,2份质量的氢气和1份质量的氧气反应生成2份质量的水
C.反应前后原子的种类、数目均不变
D.在点燃条件下,每2个氢气分子和1个氧气分子反应生成2个水分子
点燃
——
举一反三
B
考点03 化学方程式的意义及书写
【演练02】(2022天津中考)写出下列反应的化学方程式。
(1)硫在氧气中燃烧 _____ ;
(2)铜与硝酸银溶液反应 _____ ;
(3)大理石与稀盐酸反应 _____ 。
【演练03】近几年,我国在科学技术领域取得了举世瞩目的成就。2022年6月5日,我国神舟十四
号载人飞船发射成功。
(1)在发射现场看到的大量红棕色的烟,是引燃后产生的一氧化氮气体遇到氧气反应生成的二氧
化氮,该反应的化学方程式为 。
(2)飞船上的“轨道舱”是航天员生活和工作的地方。航天员呼出的气体中含有大量二氧化碳,
利用过氧化钠(Na2O2)可将二氧化碳转化为氧气的同时生成碳酸钠,该反应的化学方程
式为 。
举一反三
考点03 化学方程式的意义及书写
利用化学方程式
的计算
考点04
考点04 利用化学方程式的计算
考点梳理
依据 利用化学方程式能反映物质间的质量比,且质量比呈正比例关系。
步骤
格式
①设未知数;
②根据题意写出方程式;
③根据化学方程式找出已知量与未知量的质量比;
④列出比例式,并求出未知数;
⑤答:简明地写出答案。
考点04 利用化学方程式的计算
考点梳理
注 意 事 项
纯净物和混合物的换算
1、物质的纯度=纯物质的质量/不纯物质的质量×100%
变形: 纯物质的质量=不纯物质的质量×物质的纯度
不纯物质的质量=纯物质的质量÷物质的纯度
2、物质的纯度(纯物质的质量分数)=1-杂质的质量分数
①一定要检查化学方程式有没有配平。
②解设的未知数不能带单位,未知数包含数字和单位。
③由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是质量。
④关系式中的数据与物质的化学式要对齐。
⑤由于方程式中各物质是纯净物,因此代入方程式中的量必须是纯净物的质量。
⑥关系式和比例式中的质量均要带单位,且单位要统一。
【典例02】(2022安徽中考)某同学在学习质量守恒定律时,称取0.6g镁条进行燃烧实验(如下图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于0.6g,原因可能
考点04 利用化学方程式的计算
典例精讲
【典例01】(2023年河南东中考)乙醇常用作燃料,乙醇完全燃烧的化学方程式
为 ;乙炔(化学式为C2H2)也可用作燃料,当氧气不足时,乙
炔燃烧会生成二氧化碳、一氧化碳和水,若一定质量的乙炔燃烧生成了3.3g二氧化碳、0.9g水和
mg一氧化碳,则m的数值为 。
0.7
考点04 利用化学方程式的计算
典例精讲
【典例03】(2023年安徽中考)过氧化尿素[化学式为 CO (NH2)2.H2O2,简称 UP ,相对分子质量
是94]因其可消毒杀菌而广泛应用于洗涤剂中。 UP 在空气中或遇水缓慢分解,MnO2能催化该
反应,化学方程式如下:2CO(NH2)2·H2O2 2CO(NH2)2+O2↑+2H2O,为测定某品牌洗涤
剂中 UP 的含量,取100g该洗涤剂样品溶于一定量的水中,再加入2gMnO2,共产生0.32gO2。
(1)计算该洗涤剂中 UP 的质量分数(请写出计算过程)。
(2)上述实验测定结果比该洗涤剂标示的 UP 质量分数低,可能的原因是 (填字母序号)。
A.实际称量的洗涤剂样品多于100g B.实际称量的MnO2多于2g
C.实验前该样品曝露在空气中时间过长 D.实验产生的O2未完全逸出
CD
(1)解:设该洗涤剂中UP的质量为x
该洗涤剂中UP的质量分数为
答:该洗涤剂中UP的质量分数为1.88%。
考点04 利用化学方程式的计算
典例精讲
【演练01】(2023年新疆中考)《天工开物》中有“煤饼烧石成灰”的记载,“烧石成灰”发生的
反应为: 。请根据此化学方程式计算,实验室中10g碳酸钙充分反应后。
可制得氧化钙的质量是多少?
举一反三
考点04 利用化学方程式的计算
解:设产生CaO的质量为x
答:可制得氧化钙的质量为5.6g。
【演练02】(2023年湖南省怀化市中考)铜锌合金外观形似黄金,某化学兴趣小组为检测合金的成
分,进行了如下图所示的实验。(注,铜与稀硫酸不反应,锌与稀硫酸反应的化学方程式为:。
根据图示数据进行如下计算:
(1)生成氢气的质量为 ______ 。
(2)稀硫酸中溶质的质量分数为多少?(写出计算过程)
举一反三
考点04 利用化学方程式的计算
解:设硫酸的质量为x
x=9.8g
答:这一定量石油产品中含 H2SO4 的质量是9.8g。
【演练03】(2023年甘肃省白银市中考)取CaCl2和CaCO3的混合物25g于烧杯中,向其中加入200g一定溶质质量分数的稀盐酸,恰好完全反应,反应后称得烧杯中溶液的质量为216.2g。请计算:
(1)混合物中CaCO3的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数(计算结果精确到0.1%)。
举一反三
考点04 利用化学方程式的计算
解:(1)解:设混合物中CaCO3的质量为x,反应后生成的CaCl2质量为y,
由题目可知生成二氧化碳的质量为200g+25g-216.2g=8.8g
则混合物中CaCO3的质量分数:
x=20g, y=22.2g
举一反三
考点04 利用化学方程式的计算
(2)恰好完全反应时,所得溶液为CaCl2溶液,溶液中溶质的质量
分数为:
答:混合物中碳酸钙的质量分数为80%,
恰好完全反应后所得氯化钙的溶质质量分数为12.6%。
实验方案
实验课题
实验报告
实验总结
谢谢您的观看
THANKS
汇报人 / 稻小壳 >
举一反三
典例精讲
考点梳理
思维导图
化学方程式
第五单元
考点串讲PPT
目
录
CONTENTS
1
质量守恒定律
2
如何正确书写化学方程式
3
利用化学方程式的计算
思维导图
质量守恒定律
的探究及解释
考点01
红磷燃烧前后质量的测定 铁钉跟硫酸铜溶液反应前后质量的测定
实验原理
实验装置
实验现象
实验结论 装置解读 考点01 质量守恒定律的探究及理解
考点梳理
红磷燃烧,产生大量的白烟,放出大量的热。气球膨胀,待装置冷却后,气球变瘪。天平保持平衡。
铁钉表面附着一层红色物质,溶液由蓝色逐渐变成浅绿色。天平保持平衡
反应前各物质的总质量=反应后各物质的总质量
1.红磷燃烧实验中装置的气密性要好;铁钉与硫酸铜溶液反应可以不用密闭装置。
2.气球作用:形成密闭体系并缓冲气压
3.玻璃管作用:引燃红磷;便于膨胀的气体进入气球
4.沙子作用:防止炸裂瓶底
Fe+CuSO4=FeSO4+Cu
4P + 5O2 —— 2P2O5
点燃
——
碳酸钠与稀盐酸的反应 镁条的燃烧
实验原理
实验现象
不守恒的原因
实验结论 考点01 质量守恒定律的探究及理解
考点梳理
白色粉末溶解,有大量气泡迅速产生。天平指针向右偏转。
镁条燃烧,发出耀眼的白光,生成白色固体,天平指针向左偏转。
反应生成的二氧化碳是气体,逸散到空气中去,所以质量变小
所有的化学反应均遵守质量守恒定律。
有气体参加或气体生成(或者有烟、雾状物质生成)的反应,验证质量守恒定律时,必须在密闭容器里进行。
Na2CO3+2HCl== 2NaCl+H2O+CO2↑
2Mg + O2 —— 2MgO
点燃
——
氧化镁的质量等于反应的镁条和参加反应的氧气质量总和, 质量变大。但生成的氧化镁白烟逸散到空气中,使质量变小。
内容
关键词 参加
各物质
质量总和
适用范围
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
参加反应或反应生成所有物质,特别注意气体、沉淀不能遗漏。
没有参加反应的物质(反应剩余的物质)、不是反应生成的物质,质量不能计入“总和”中。
是质量之和,不是体积、分子个数。
考点02 质量守恒定律的探究及理解
考点梳理
适用于一切化学变化,不适用于物理变化。
考点01 质量守恒定律的探究及理解
典例精讲
【典例01】(2023年湖北宜昌中考)下列现象能用质量守恒定律解释的是( )
A. 蔗糖溶于水后总质量不变 B. 浓硫酸敞口放置质量增加
C. 饱和硝酸钾溶液升温,溶液质量不变 D. 硫酸铜溶液和氢氧化钠溶液混合,溶液质量减小
D
【典例02】(2023年黑龙江龙东中考)在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一
定条件下发生反应,测得反应前后各物质质量的变化量(单位:g)如图所示。下列说法不正确
的是( )
A.x的数值为8
B.反应前后元素的化合价可能改变
C.该反应一定属于置换反应
D.反应前后甲、戊变化的质量之比为3:1
C
考点01 质量守恒定律的探究及理解
典例精讲
【典例03】(2023年福建中考)分别加热等质量的两种样品,固体质量随温度变化的曲线如下图所示。
样品1反应前后各物质的质量如下表。分离出样品1反应后的固体乙,与24.0g甲混合并加热,固
体质量变化曲线与样品1的相同。下列说法正确的是( )
A. 该反应是复分解反应 B. x=20.1
C. 该条件下丙和丁均为气体 D. 乙是催化剂
D
物质 甲 乙 丙 丁
反应前质量/g 24.0 2.0 0 0
反应后质量/g 0 20 x 1.9
举一反三
考点01 质量守恒定律的探究及理解
【演练01】下面能验证质量守恒定律的实验是( )
A. B. C. D.
D
【演练02】在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应
前及t1、t2时各物质质量如图所示,下列说法中不正确的是( )
A.该反应中,甲、乙的质量变化之比为1:4
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7:5
D.该反应为化合反应
A
【演练03】(2022年湖北宜昌中考)(3)如图所示,利用红磷与空气中的氧气反应验证质量守恒定律。
①用红热的玻璃管引燃红磷,其燃烧过程中能观察到的现象是 ,
反应的化学方程式为 。
②待红磷熄灭后再次称量,天平不再平衡,其原因可能是___________。
A.装置漏气 B.用橡胶塞塞紧锥形瓶速度太慢
C.红磷太少 D.没有等锥形瓶冷却就再次称量
冒白烟、放热、气球膨胀
举一反三
考点01 质量守恒定律的探究及理解
ABD
质量守恒定律的
微观解释及应用
考点02
化学 变化微观解释
微观 实质
化学反应的实质是反应物的分子破裂成原子,原子又重新组合成新的分子。在反应前后原子的种类没变,原子的数目没有增减,原子的质量没有变化,所以化学反应前后各物质的质量总和必然相等。
考点02 质量守恒定律的微观解释及应用
考点梳理
重组
分解
宏观 微观
一定不变
一定改变
可能改变
应用 考点02 质量守恒定律的微观解释及应用
考点梳理
物质的总质量不变;
元素的种类不变;
元素的质量不变
原子的种类不变
原子的数目不变
原子的质量不变
物质的种类一定改变
分子的种类一定改变
分子总数可能改变
化合价可能改变
1.求某种反应物或生成物的质量。
2.推断反应物或生成物的组成(化学式)
3.推断反应物是否全部参加了反应。
4.利用原子、分子知识解释质量守恒原因
【典例01】(2023年安徽中考)口罩中的熔喷布具有过滤病毒的作用, Z 是合成熔喷布的主要
原料,由X制 备Z的微现示意图如下。下列说法正确的是 ( )
A. X 的化学式为C8H3 B. 反应前后分子种类不变
C. Y、Z在O2中充分燃烧产物相同 D. 反应前后原子个数不变
考点02 质量守恒定律的微观解释及应用
典例精讲
D
【典例02】(2022年安徽省中考)我国科研人员将二氧化碳高效合成为可供微生物直接利用的物质X,
合成过程中主要物质向转化的微观示意图如下、下列说法错误的是 ( )
A. 催化剂提高了合成效率 B. X的化学式为CH2O
C. CO2合成的过程中伴随能量变化 D. 一定有含氢元素的物质参与合成
B
考点02 质量守恒定律的微观解释及应用
典例精讲
【典例03】(2023年广东中考)梦天舱燃烧科学柜采用a作燃料成功实施首次在轨点火实验。a完全
燃烧的反应微观示意图如图所示。下列说法错误的是( )
A. 反应前后元素种类不变 B. 反应前后分子个数不变
C. a分子中C、H原子个数比为1:4
D. 反应生成c、d的质量比为 22:9
D
【典例04】(2023年山东聊城中考)我国科学家在国际上首次以CO2和H2为原料,在构筑的纳米
“蓄水”膜反应器中实现了二氧化碳在温和条件下一步转化为乙醇的反应,该反应微观示意图如
下。 有关说法不正确的是 ( )
A.无机物在一定条件下可以转化成有机物
B.反应前后分子种类改变,原子种类不变
C.参加反应的二氧化碳和氢气的分子个数比为2:7
D.该反应生成物是CH3CH2OH和H2O
C
【演练01】(2023年四川眉山中考)科学家利用某纳米纤维催化剂将二氧化碳转化为液体燃料
甲醇(CH3OH),其微观示意图如下(图中的分子恰好完全反应)。下列说法错误的是( )
A. 生成物丙中碳元素的质量分数为37.5% B. 该反应的化学方程式为
C. 生成物丙和丁的质量比为1:1 D. 该反应有助于实现“碳中和”
考点02 质量守恒定律的微观解释及应用
举一反三
C
【演练02】(2023年湖北随州中考)纯净物甲是一种绿色能源,相对分子质量为46。在一定条件下,
一定质量的甲与8.0g乙恰好完全反应,生成4.4g丙、5.4g丁和2.8g戊。反应的微观示意图如下,
下列有关说法错误的是( )
A.参加反应甲的质量为4.6g
B.甲物质中碳元素和氢元素的质量比为4∶1
C.甲物质中含有碳、氢、氧三种元素
D.若使生成的戊充分氧化,至少还需乙3.2g
D
【演练04】某化合物与9.6g氧气在点燃的条件下恰好完全反应,生成8.8g二氧化碳和5.4g水,则该
化合物的化学式为( )
A.CH3OH B.C2H5OH C.CH4 D.C2H6
考点02 质量守恒定律的微观解释及应用
举一反三
B
【演练03】(2023年黑龙江齐齐哈尔中考)石灰岩的主要成分是碳酸钙,在一定条件下发生反应,生成
溶解性较大的碳酸氢钙,反应的化学方程式为:CaCO3+X+H2O==Ca(HCO3-)2 ,其中X的化学
式为( )
A. CaO B. Ca(OH)2 C. H2CO3 D. CO2
D
化学方程式的
意义及书写
考点03
考点03 化学方程式的意义
考点梳理
意义 以 为例 读法
质的方面
量的方面 宏观
微观
参加反应的碳、氧气与生成的二氧化碳的质量之比为3:8:11
反应中碳、氧气与二氧化碳的分子个数之比为1:1:1
碳和氧气在点燃条件下反应生成水
每12份质量的碳和32份质量的氧气在点燃的条件下恰好完全反应,生成44份质量的二氧化碳。
每1个碳原子和1个氧分子在点燃的条件下恰好完全反应,生成1个二氧化碳分子。
C+O2==CO2
点燃
碳和氧气在点燃条件下反应生成水
化学方程式:用化学式表示化学反应的式子。
表明反应物、生成物和反应条件
各物质间反应时的质量比
各物质间反应时的微粒个数比
考点03 化学方程式的书写
考点梳理
书写 原则
步骤 写
配
等
注
查
把“——”改成“ ”
根据客观事实,正确写出反应物和生成物的化学式,中间用“——”连接
配平化学方程式,使式子两边各元素的原子数目相等
① 必须以客观事实为基础;
② 必须遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
——
——
注明反应条件、生成物状态,如点燃、加热、催化剂、“↑”、“↓”等
检查化学式的书写、配平、条件、生成物状态符号等
注:生成物中是“无中生有“时需要标注生成物状态
考点03 化学方程式的意义及书写
典例精讲
【典例01】(2023年四川眉山中考)下列描述涉及反应的化学方程式正确的是( )
A. 服用含氢氧化铝的药物治疗胃酸过多:
B. 用过氧化氢溶液制氧气:
C. 将铁丝浸入稀盐酸中:
D. 用食醋清洗水壶中的水垢:
D
【典例02】(2023年河南中考)下列化学方程式符合题意且书写正确的是( )
A. 酸雨形成的原因:
B. 盐酸除去铁锈:
C. 除去二氧化碳中的一氧化碳:
D. 小苏打治疗胃酸过多症:
D
考点03 化学方程式的意义及书写
典例精讲
【典例03】(2023年湖北潜江中考)现有O2、Fe、CO、稀硫酸、KOH溶液、CaCO3、MgCl2溶液
七种物质,请选择适当的物质按照要求书写化学方程式(每种物质只能选用一次):
(1)化合反应: 。
(2)分解反应: 。
(3)置换反应: 。
(4)复分解反应: 。
【演练01】北京冬奥会火炬“飞扬”采用液氢作为燃料,真正做到了零排放、零污染。氢气燃烧的
化学方程式为 2H2 + O2 —— 2H2O,从中获得的信息错误的是( )
A.氢气和氧气在点燃的条件下生成水
B.在点燃条件下,2份质量的氢气和1份质量的氧气反应生成2份质量的水
C.反应前后原子的种类、数目均不变
D.在点燃条件下,每2个氢气分子和1个氧气分子反应生成2个水分子
点燃
——
举一反三
B
考点03 化学方程式的意义及书写
【演练02】(2022天津中考)写出下列反应的化学方程式。
(1)硫在氧气中燃烧 _____ ;
(2)铜与硝酸银溶液反应 _____ ;
(3)大理石与稀盐酸反应 _____ 。
【演练03】近几年,我国在科学技术领域取得了举世瞩目的成就。2022年6月5日,我国神舟十四
号载人飞船发射成功。
(1)在发射现场看到的大量红棕色的烟,是引燃后产生的一氧化氮气体遇到氧气反应生成的二氧
化氮,该反应的化学方程式为 。
(2)飞船上的“轨道舱”是航天员生活和工作的地方。航天员呼出的气体中含有大量二氧化碳,
利用过氧化钠(Na2O2)可将二氧化碳转化为氧气的同时生成碳酸钠,该反应的化学方程
式为 。
举一反三
考点03 化学方程式的意义及书写
利用化学方程式
的计算
考点04
考点04 利用化学方程式的计算
考点梳理
依据 利用化学方程式能反映物质间的质量比,且质量比呈正比例关系。
步骤
格式
①设未知数;
②根据题意写出方程式;
③根据化学方程式找出已知量与未知量的质量比;
④列出比例式,并求出未知数;
⑤答:简明地写出答案。
考点04 利用化学方程式的计算
考点梳理
注 意 事 项
纯净物和混合物的换算
1、物质的纯度=纯物质的质量/不纯物质的质量×100%
变形: 纯物质的质量=不纯物质的质量×物质的纯度
不纯物质的质量=纯物质的质量÷物质的纯度
2、物质的纯度(纯物质的质量分数)=1-杂质的质量分数
①一定要检查化学方程式有没有配平。
②解设的未知数不能带单位,未知数包含数字和单位。
③由于方程式只能反映物质间的质量比,因此代入方程式中的各个量必须是质量。
④关系式中的数据与物质的化学式要对齐。
⑤由于方程式中各物质是纯净物,因此代入方程式中的量必须是纯净物的质量。
⑥关系式和比例式中的质量均要带单位,且单位要统一。
【典例02】(2022安徽中考)某同学在学习质量守恒定律时,称取0.6g镁条进行燃烧实验(如下图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于0.6g,原因可能
考点04 利用化学方程式的计算
典例精讲
【典例01】(2023年河南东中考)乙醇常用作燃料,乙醇完全燃烧的化学方程式
为 ;乙炔(化学式为C2H2)也可用作燃料,当氧气不足时,乙
炔燃烧会生成二氧化碳、一氧化碳和水,若一定质量的乙炔燃烧生成了3.3g二氧化碳、0.9g水和
mg一氧化碳,则m的数值为 。
0.7
考点04 利用化学方程式的计算
典例精讲
【典例03】(2023年安徽中考)过氧化尿素[化学式为 CO (NH2)2.H2O2,简称 UP ,相对分子质量
是94]因其可消毒杀菌而广泛应用于洗涤剂中。 UP 在空气中或遇水缓慢分解,MnO2能催化该
反应,化学方程式如下:2CO(NH2)2·H2O2 2CO(NH2)2+O2↑+2H2O,为测定某品牌洗涤
剂中 UP 的含量,取100g该洗涤剂样品溶于一定量的水中,再加入2gMnO2,共产生0.32gO2。
(1)计算该洗涤剂中 UP 的质量分数(请写出计算过程)。
(2)上述实验测定结果比该洗涤剂标示的 UP 质量分数低,可能的原因是 (填字母序号)。
A.实际称量的洗涤剂样品多于100g B.实际称量的MnO2多于2g
C.实验前该样品曝露在空气中时间过长 D.实验产生的O2未完全逸出
CD
(1)解:设该洗涤剂中UP的质量为x
该洗涤剂中UP的质量分数为
答:该洗涤剂中UP的质量分数为1.88%。
考点04 利用化学方程式的计算
典例精讲
【演练01】(2023年新疆中考)《天工开物》中有“煤饼烧石成灰”的记载,“烧石成灰”发生的
反应为: 。请根据此化学方程式计算,实验室中10g碳酸钙充分反应后。
可制得氧化钙的质量是多少?
举一反三
考点04 利用化学方程式的计算
解:设产生CaO的质量为x
答:可制得氧化钙的质量为5.6g。
【演练02】(2023年湖南省怀化市中考)铜锌合金外观形似黄金,某化学兴趣小组为检测合金的成
分,进行了如下图所示的实验。(注,铜与稀硫酸不反应,锌与稀硫酸反应的化学方程式为:。
根据图示数据进行如下计算:
(1)生成氢气的质量为 ______ 。
(2)稀硫酸中溶质的质量分数为多少?(写出计算过程)
举一反三
考点04 利用化学方程式的计算
解:设硫酸的质量为x
x=9.8g
答:这一定量石油产品中含 H2SO4 的质量是9.8g。
【演练03】(2023年甘肃省白银市中考)取CaCl2和CaCO3的混合物25g于烧杯中,向其中加入200g一定溶质质量分数的稀盐酸,恰好完全反应,反应后称得烧杯中溶液的质量为216.2g。请计算:
(1)混合物中CaCO3的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数(计算结果精确到0.1%)。
举一反三
考点04 利用化学方程式的计算
解:(1)解:设混合物中CaCO3的质量为x,反应后生成的CaCl2质量为y,
由题目可知生成二氧化碳的质量为200g+25g-216.2g=8.8g
则混合物中CaCO3的质量分数:
x=20g, y=22.2g
举一反三
考点04 利用化学方程式的计算
(2)恰好完全反应时,所得溶液为CaCl2溶液,溶液中溶质的质量
分数为:
答:混合物中碳酸钙的质量分数为80%,
恰好完全反应后所得氯化钙的溶质质量分数为12.6%。
实验方案
实验课题
实验报告
实验总结
谢谢您的观看
THANKS
汇报人 / 稻小壳 >
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
