2024届高三一轮复习课件:第26讲水的电离和溶液的pH(共52张PPT)
文档属性
| 名称 | 2024届高三一轮复习课件:第26讲水的电离和溶液的pH(共52张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 08:08:58 | ||
图片预览









文档简介
(共52张PPT)
第26讲 水的电离和溶液的pH
考点一
考点二
高考真题演练
随堂过关训练
考点一
考点一 水的电离与水的离子积
必备知识梳理·夯实学科基础
1.水的电离
(1)水是极弱的电解质,其电离方程式为2H2O H3O++OH-,可简写为H2O H++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7 mol·L-1。
2.水的离子积常数
c(H+)·c(OH-)
1×10-14
增大
特别提醒
Kw=c(H+)·c(OH-)中的H+和OH-不一定都是由水电离出来的,而是指溶液中的c(H+)和c(OH-),即不仅仅适用于纯水,还适用于酸、碱、盐的稀溶液。
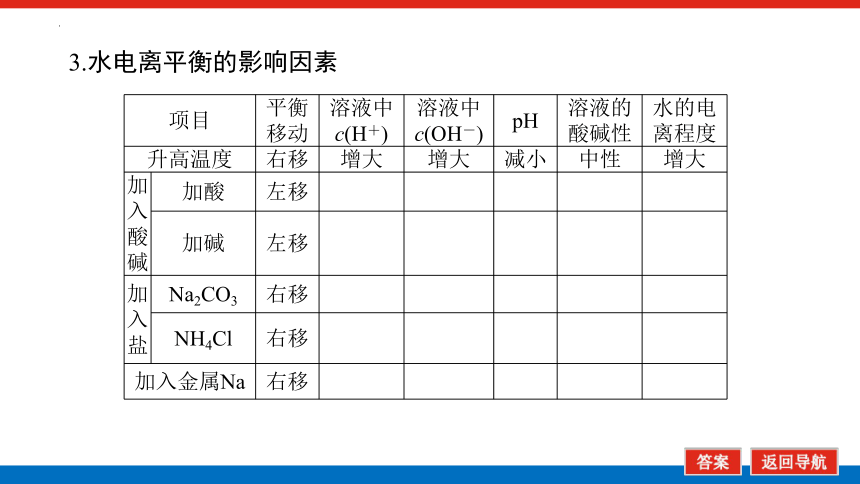
3.水电离平衡的影响因素
项目 平衡 移动 溶液中 c(H+) 溶液中 c(OH-) pH 溶液的 酸碱性 水的电
离程度
升高温度 右移 增大 增大 减小 中性 增大
加入 酸碱 加酸 左移
加碱 左移
加 入 盐 Na2CO3 右移
NH4Cl 右移
加入金属Na 右移
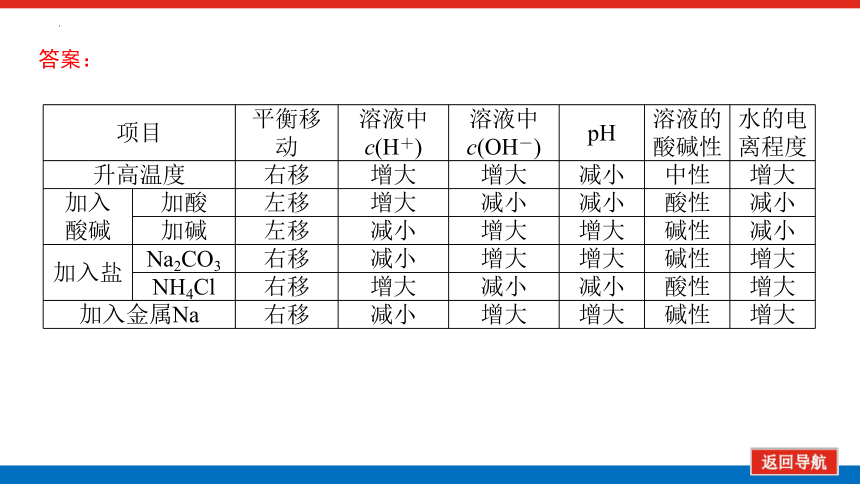
项目 平衡移动 溶液中c(H+) 溶液中c(OH-) pH 溶液的 酸碱性 水的电
离程度
升高温度 右移 增大 增大 减小 中性 增大
加入 酸碱 加酸 左移 增大 减小 减小 酸性 减小
加碱 左移 减小 增大 增大 碱性 减小
加入盐 Na2CO3 右移 减小 增大 增大 碱性 增大
NH4Cl 右移 增大 减小 减小 酸性 增大
加入金属Na 右移 减小 增大 增大 碱性 增大
答案:
微点拨
(1)给水加热,水的电离程度增大,c(H+)>10-7 mol·L-1,pH<7,但水仍显中性。
(2)酸、碱能抑制水的电离,故室温下,酸、碱溶液中水电离产生的c(H+)<1×10-7 mol·L-1,而能水解的盐溶液中水电离产生的c(H+)[或c(OH-)]>1×10-7 mol·L-1。
[易错易混辨析] (错误的说明错因)
(1)在蒸馏水中滴加浓H2SO4,Kw不变( )
错因:_________________________________________
(2)温度一定时,在纯水中通入少量SO2,水的电离平衡不移动,Kw不变( )
错因:_________________________________________
(3)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1的NaOH溶液中水的电离程度相等( )
错因:_________________________________________
(4)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
错因:_________________________________________
×
浓硫酸滴入水中放热,溶液温度升高,Kw变大
×
二氧化硫与水反应生成的亚硫酸抑制水的电离
√
×
CH3COONH4溶液中的醋酸根离子和铵根离子均能水解,促进水的电离
[深度思考]
如何计算水电离的c(H+)或c(OH-)
(1)任何情况下水电离产生的c(H+)和c(OH-)总是________的。
(2)当抑制水的电离时(如酸或碱溶液)
在溶液中c(H+)、c(OH-)较小的数值是水电离出来的。具体见下表:
溶液(25 ℃) c(H+) /(mol·L-1) c(OH-) /(mol·L-1) c(H+)水或c(OH-)水/(mol·L-1)
0.01 mol·L-1 盐酸 ________ ________ ________
0.1 mol·L-1 NaOH溶液 ________ ________ ________
相等
1.0×10-2
1.0×10-12
1.0×10-12
1.0×10-13
1.0×10-1
1.0×10-13
(3)当促进水的电离时(如盐的水解)
在溶液中c(H+)、c(OH-)较大的数值是水电离出来的。具体见下表:
溶液(25 ℃) c(H+) /(mol·L-1) c(OH-) /(mol·L-1) c(H+)水或c(OH-)水/(mol·L-1)
pH=5的 NH4Cl溶液 ____________ ____________ ____________
pH=10的 Na2CO3溶液 ____________ ____________ ____________
1.0×10-5
1.0×10-9
1.0×10-5
1.0×10-10
1.0×10-4
题组强化训练·形成关键能力
题组一 影响水电离平衡的因素及结果判断
1.25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
答案:B
解析:A项,向水中加入稀氨水,NH3·H2O电离出和OH-,c(OH-)增大,平衡逆向移动,错误;B项,向水中加入少量固体NaHSO4,NaHSO4电离出Na+、H+和,c(H+)增大,平衡逆向移动,温度不变,Kw不变,正确;C项,向水中加入少量固体CH3COONa,CH3COONa电离出CH3COO-和Na+,CH3COO-与H+结合成弱酸CH3COOH,c(H+)降低,平衡正向移动,错误;D项,水的电离是吸热过程,将水加热促进水的电离,Kw增大,pH减小,错误。
2.(双选)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-14
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案:BC
解析: A项,c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小,错误。B项,由b点对应c(H+)与c(OH-)可知,Kw=c(H+)·c(OH-)=1.0×10-7×1.0×10-7=1.0×10-14,正确。C项,FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化,正确。D项,c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化,错误。
题组二 溶液中由水电离出的c(OH-)或c(H+)的求算
3.25 ℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是( )
①pH=0的H2SO4溶液 ②0.05 mol·L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
答案:A
解析:设溶液的体积为1 L,①中pH=0的H2SO4溶液中c(H+)=1 mol·L-1,c(OH-)=10-14 mol·L-1,电离的水的物质的量为10-14 mol;②中c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1,电离的水的物质的量为10-13 mol;③中c(OH-)=10-4 mol·L-1,电离的水的物质的量为10-4 mol;④中c(H+)=10-5 mol·L-1,电离的水的物质的量为10-5 mol;故①②③④中电离的水的物质的量之比为10-14∶10-13∶10-4∶10-5=1∶10∶1010∶109。
4.T ℃时0.1 mol·L-1 NaOH溶液的pH=12,则T ℃时pH=10的Na2CO3溶液中c(H+)H2O=________ mol·L-1。
1×10-3
解析:T ℃时0.1 mol·L-1 NaOH溶液中c(H+)=1×10-12 mol·L-1,c(OH-)=1×10-1 mol·L-1,Kw=1×10-13。T ℃,pH=10的Na2CO3溶液中c(H+)H2O=c(OH-)==1×10-3mol·L-1。
考点二
考点二 溶液的酸碱性与pH
必备知识梳理·夯实学科基础
1.溶液的酸碱性
溶液的酸碱性取决于c(H+)与c(OH-)的相对大小,具体内容见下表:
适用的温度 25 ℃ 各种温度
项目 pH c(H+)/(mol·L-1) c(H+)与
c(OH-)的相对大小
酸性 <____ >________ c(H+)____c(OH-)
中性 =____ =________ c(H+)____c(OH-)
碱性 >____ <________ c(H+)____c(OH-)
7
10-7
>
7
10-7
=
7
10-7
<
2.溶液的pH
(1)表达式:pH=__________。
(2)使用范围:pH的取值范围为0~14,即只适用于c(H+)≤1 mol·L-1或c(OH-)≤1 mol·L-1的电解质溶液,当c(H+)≥1 mol·L-1或c(OH-)≥1 mol·L-1时,直接用c(H+)或c(OH-)表示溶液的酸碱性。
(3)pH的意义:pH表示溶液酸碱性的强弱。在相同温度下,pH越小,溶液酸性________;pH越大,溶液碱性________。
(4)溶液的酸碱性与pH的关系
-lg c(H+)
越强
越强
3.pH的测定
(1)pH试纸测定
①使用方法:取一小片试纸放在洁净的________或________上,用________蘸取待测液点在试纸的中央,变色稳定后与标准比色卡对照,即可确定溶液的pH。
②注意事项:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能会产生误差;用广范pH试纸读出的pH只能是________。
(2)pH计测定:可精确测定溶液的pH,可读取一位或两位小数。
玻璃片
表面皿
玻璃棒
整数
4.溶液pH的计算
(1)单一溶液pH的计算
强酸溶液:如HnA,设浓度为c mol·L-1,c(H+)=______mol·L-1,pH=-lg c(H+)=________。
强碱溶液(25 ℃):如B(OH)n,设浓度为c mol·L-1,c(H+)=
___________ mol·L-1,pH=-lg c(H+)=____________。
nc
-lg (nc)
14+lg (nc)
(2)混合溶液pH的计算类型(混合前后溶液体积变化忽略不计)
①两种强酸混合:直接求出c(H+)混,再据此求pH。c(H+)混=。
②两种强碱混合:先求出c(OH-)混,再根据Kw求出c(H+)混,最后求pH。
c(OH-)混=。
③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。c(H+)混或c(OH-)混=。
[易错易混辨析] (错误的说明错因)
(1)酸性溶液中只有H+没有OH-( )
错因:____________________________________
(2)pH=7的溶液一定呈中性( )
错因:____________________________________
(3)用pH试纸测溶液的pH时,应先用蒸馏水润湿试纸( )
错因:____________________________________
(4)用湿润的pH试纸测溶液的pH一定有误差( )
错因:____________________________________
(5)用广范pH试纸测得某溶液的pH为3.4( )
错因:____________________________________
(6)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性( )
错因:____________________________________
×
水溶液中同时存在H+和OH-
×
水的电离受温度的影响,因而溶液的pH也与温度有关
×
用蒸馏水润湿试纸,相当于稀释待测液
×
pH试纸使用时不能湿润,但用湿润的pH测定中性溶液的pH不产生误差
×
广范pH试纸只能读取1~14的整数
√
[深度思考]
常温下,两种溶液混合后酸碱性的判断(在括号中填“酸性”“碱性”或“中性”)。
(1)相同浓度的HCl和NaOH溶液等体积混合( )
(2)相同浓度的CH3COOH和NaOH溶液等体积混合( )
(3)相同浓度的NH3·H2O和HCl溶液等体积混合( )
(4)pH=2的H2SO4和pH=12的NaOH溶液等体积混合( )
(5)pH=3的HCl和pH=10的NaOH溶液等体积混合( )
(6)pH=3的HCl和pH=12的NaOH溶液等体积混合( )
(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( )
(8)pH=2的H2SO4和pH=12的NH3·H2O等体积混合( )
中性
碱性
酸性
中性
酸性
碱性
酸性
碱性
微点拨 酸碱溶液混合后酸碱性的判断规律
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。
(3)已知强酸和强碱的pH,等体积混合(25 ℃时):
①pH之和等于14,呈中性;②pH之和小于14,呈酸性;③pH之和大于14,呈碱性。
题组强化训练·形成关键能力
题组一 酸、碱混合溶液酸碱性的判断
1.在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A.pH=3的HNO3和pH=11的KOH溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的醋酸和pH=11的Ba(OH)2溶液
D.pH=3的硫酸和pH=11的NaOH溶液
答案:C
解析:A项,pH=3的HNO3和pH=11的KOH溶液,c(H+)=c(OH-)=10-3 mol·L-1,等体积混合恰好反应生成硝酸钾,溶液为中性,错误;B项,pH=3的盐酸和pH=11的氨水,c(H+)=10-3 mol·L-1,氨水浓度大于10-3 mol·L-1,等体积混合时碱过量,溶液pH大于7,错误;C项,pH=3的醋酸,醋酸的浓度大于10-3mol·L-1,pH=11的Ba(OH)2溶液中c(OH-)=10-3 mol·L-1,等体积混合时酸过量,pH一定小于7,正确;D项,pH=3的硫酸和pH=11的NaOH溶液,c(H+)=c(OH-)=10-3 mol·L-1,等体积混合恰好反应生成硫酸钠,溶液为中性,错误。
2.现有室温下四种溶液,有关叙述不正确的是( )
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
答案:D
解析:从平衡移动角度分析,CH3COONa电离出的CH3COO-与盐酸中的H+结合生成CH3COOH,会使醋酸中平衡CH3COOH CH3COO-+H+左移,两溶液中H+浓度均减小,所以pH均增大,A项正确;假设均是强酸强碱,则物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,c(H+)>c(OH-),B项正确;分别加水稀释10倍,假设平衡不移动,那么①②溶液的pH均为10,但稀释氨水使平衡+OH-右移,使①pH>10,同理醋酸稀释后pH<4,C项正确;假设均是强酸强碱,混合后溶液呈中性,则V1=V2,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要的①氨水少,即V1>V2,D项错误。
题组二 pH的简单计算
3.将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比值为( )
A.9 B.10
C.11 D.12
答案:C
解析:将pH=1的盐酸加适量水,pH升高了1,说明所加的水是原溶液的9倍;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH升高了1,则10-1×1-10-1·x=10-2·(1+x),解得x=,则加入的水与NaOH溶液的体积比为9∶=11∶1。
4.根据要求解答下列问题(常温条件下):
(1)pH=5的H2SO4溶液,加水稀释到500倍,则稀释后)与c(H+)的比值为__________。
(2)取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为__________。
(3)在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则溶液与NaHSO4溶液的体积比是________。
(4)将pH=a的NaOH溶液Va L与pH=b的稀盐酸Vb L混合,若所得溶液呈中性,且a+b=13,则=______。
0.05 mol·L-1
1∶4
10
解析:(1)稀释前)= mol·L-1,稀释后)= mol·L-1=10-8 mol·L-1,c(H+)稀释后接近10-7 mol·L-1,所以≈=。(2)=0.01 mol·L-1,c=0.05 mol·L-1。(3)设氢氧化钡溶液的体积为V1 L,硫酸氢钠溶液的体积为V2 L,依题意知,n(Ba2+)=),由Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=5×10-3V1 mol,=1×10-3 mol·L-1,则V1∶V2=1∶4。(4)pH=a的NaOH溶液中c(OH-)=10a-14 mol·L-1,pH=b的稀盐酸中c(H+)=10-b mol·L-1,根据中和反应H++OH-===H2O,知c(OH-)·Va=c(H+)·Vb,===1014-(a+b),a+b=13,则=10。
[思维建模] 溶液pH计算的一般思维模型
高考真题演练
1.判断正误。
[2020·浙江6月]25 ℃时,若测得HR溶液pH=a,取该溶液10.00 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR为弱酸( )
×
解析:无论HR是强酸还是弱酸,当6<a<7时,稀释10倍后溶液的pH始终小于7,即b—a<1。
2.[2020·浙江7月]下列说法不正确的是( )
A.2.0×10-7 mol·L-1的盐酸中c(H+)=2.0×10-7 mol·L-1
B.将KCl溶液从常温加热至80 ℃,溶液的pH变小但仍保持中性
C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
答案:A
解析:本题考查电离平衡知识,考查的化学核心素养是变化观念与平衡思想。极稀的溶液中,H2O电离出的H+不能忽略,故c(H+)大于2×10-7mol·L-1,A项错误;水的电离是吸热的,升高温度促进水的电离,氢离子浓度和氢氧根离子浓度均增大,pH减小,但氢离子浓度和氢氧根离子浓度仍相等,溶液呈中性,B项正确;常温下,NaCN溶液呈碱性,说明NaCN是强碱弱酸盐,HCN是弱酸,C项正确;醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,pH增大,D项正确。
3.[2019·天津卷]某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
答案:C
解析:酸的电离平衡常数越大,酸的酸性越强,由电离常数可知,HNO2的酸性大于CH3COOH,pH相同的一元酸分别稀释相同的位数,pH变化较大的酸酸性较强,所以曲线Ⅱ表示HNO2溶液,曲线Ⅰ表示CH3COOH溶液,故A错误;氢离子抑制水的电离,氢离子浓度越大,水的电离程度越小,c(H+):b>c,则水电离程度:b4.[2019·浙江4月,节选]水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2 ℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因____________________________________________________。
②如果水的离子积Kw从1.0×10-14增大到1.0×10-10,则相应的电离度是原来的________倍。
水的电离为吸热过程,升高温度有利于电离(压强对电离平衡影响不大)
100
随堂过关训练
1.25 ℃时,水中存在电离平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)减小
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
答案:B
解析:加热促进水的电离,Kw增大,pH减小,但水仍呈中性,A项错误;加入NaOH固体,c(OH-)增大,C项错误;加入NH4Cl固体水解促进水的电离,但c(OH-)减小,D项错误。
2.已知:pOH=-lg c(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH( )
A.大于6.7 B.小于6.7
C.等于6.7 D.无法判断
答案:B
解析:升高温度,促进水电离,则水的离子积常数大于10-14,pH+pOH<14。
3.已知在100 ℃下,水的离子积Kw=1×10-12,下列说法正确的是( )
A.0.05 mol·L-1的H2SO4溶液pH=1
B.0.001 mol·L-1的NaOH溶液pH=11
C.0.005 mol·L-1的H2SO4溶液与的NaOH溶液等体积混合,混合后溶液pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
答案:A
解析:A项,c(H+)=0.05 mol·L-1×2=0.1 mol·L-1,pH=-lg c(H+)=-lg 0.1=1,正确;B项,c(OH-)=10-3 mol·L-1,则100 ℃时,c(H+)==mol·L-1=10-9 mol·L-1,pH=9,错误;C项,c(H+)=2×0.005 mol·L-1=0.01 mol·L-1,c(OH-)=0.01 mol·L-1,等体积混合后溶液呈中性,c(H+)=c(OH-)=10-6 mol·L-1,pH=6,错误;D项,所需NaOH溶液的体积V= mL=0.5 mL,错误。
4.如图表示1 mol·L-1醋酸溶液的pH随温度变化的曲线(假设加热过程中醋酸不挥发)。下列说法错误的是( )
A.10 ℃升温到25 ℃时,断键吸热和分子间氢键断裂吸热导致醋酸电离程度增加
B.30 ℃后升温,形成水合离子的过程放热导致醋酸的电离程度减小
C.23 ℃时,保持温度不变向1 mol·L-1醋酸溶液中加入少量pH=2.65的盐酸,pH不变
D.33 ℃时,醋酸电离平衡常数的数量级为10-5
答案:D
解析:电解质溶于水包含自身电离吸热过程和形成水合离子放热过程,由图可知10 ℃升温到25 ℃时,电解质电离吸热和分子间氢键断裂吸热占主导,升温促进电离,pH减小,A正确;30 ℃后升温,形成水合离子的过程放热占主导,导致醋酸的电离程度减小,pH增大,B正确;23 ℃时,溶液pH=2.65,保持温度不变加入少量pH=2.65的盐酸,可看成等效平衡,pH不变,C正确;33 ℃时,pH=2.7,K=≈10-5.4,电离平衡常数数量级为10-6,D错误。
5.现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答问题:
(1)常温下0.1 mol·L-1 CH3COOH溶液加水稀释过程,下列表达式的数值一定变小的是________(填字母)。
A.c(H+) B. C.c(H+)·c(OH-) D.
(2)取10 mL的乙溶液,加入等体积的水,醋酸的电离平衡________(填“向左”“向右”或“不”)移动;另取10 mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中的值将________(填“增大”“减小”或“无法确定”)。
A
向右
减小
解析:(1)CH3COOH溶液中存在电离平衡:CH3COOH H++CH3COO-,加水稀释过程中,平衡正向移动,但溶液中c(H+) 、c(CH3COO-)均减小,A符合题意。CH3COOH的电离平衡常数Ka=,则有=,加水稀释时,c(CH3COO-)减小,但Ka不变,则增大,B不符合题意。由于温度不变,则 c(H+)·c(OH-)=Kw不变,C不符合题意。加水稀释时,溶液中c(H+)减小,由于c(H+)·c(OH-)=Kw不变,则c(OH-)增大,故增大,D不符合题意。(2)醋酸溶液中加入等体积的水,醋酸的电离平衡向右移动,电离程度增大;醋酸溶液中加入少量无水醋酸钠固体,c(CH3COO-)增大,电离平衡逆向移动,根据CH3COOH的电离平衡常数Ka=推知,=,由于温度不变,Ka不变,c(CH3COO-)增大,则溶液中的值减小。
(3)相同条件下,取等体积的甲、乙两溶液,分别加水稀释100倍,所得溶液的pH大小关系为pH(甲)________pH(乙)(填“>”“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲)________V(乙)(填“>”“<”或“=”)。
>
<
解析:(3)常温下,pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),取等体积的甲、乙两溶液,分别加水稀释100倍,醋酸的电离平衡正向移动,pH变化小,则所得溶液的pH:pH(甲)>pH(乙)。(4)pH均为2的盐酸和醋酸溶液相比,其浓度:c(HCl)n(HCl),分别用等浓度的NaOH稀溶液中和,醋酸溶液消耗NaOH溶液的体积大于盐酸。
第26讲 水的电离和溶液的pH
考点一
考点二
高考真题演练
随堂过关训练
考点一
考点一 水的电离与水的离子积
必备知识梳理·夯实学科基础
1.水的电离
(1)水是极弱的电解质,其电离方程式为2H2O H3O++OH-,可简写为H2O H++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7 mol·L-1。
2.水的离子积常数
c(H+)·c(OH-)
1×10-14
增大
特别提醒
Kw=c(H+)·c(OH-)中的H+和OH-不一定都是由水电离出来的,而是指溶液中的c(H+)和c(OH-),即不仅仅适用于纯水,还适用于酸、碱、盐的稀溶液。
3.水电离平衡的影响因素
项目 平衡 移动 溶液中 c(H+) 溶液中 c(OH-) pH 溶液的 酸碱性 水的电
离程度
升高温度 右移 增大 增大 减小 中性 增大
加入 酸碱 加酸 左移
加碱 左移
加 入 盐 Na2CO3 右移
NH4Cl 右移
加入金属Na 右移
项目 平衡移动 溶液中c(H+) 溶液中c(OH-) pH 溶液的 酸碱性 水的电
离程度
升高温度 右移 增大 增大 减小 中性 增大
加入 酸碱 加酸 左移 增大 减小 减小 酸性 减小
加碱 左移 减小 增大 增大 碱性 减小
加入盐 Na2CO3 右移 减小 增大 增大 碱性 增大
NH4Cl 右移 增大 减小 减小 酸性 增大
加入金属Na 右移 减小 增大 增大 碱性 增大
答案:
微点拨
(1)给水加热,水的电离程度增大,c(H+)>10-7 mol·L-1,pH<7,但水仍显中性。
(2)酸、碱能抑制水的电离,故室温下,酸、碱溶液中水电离产生的c(H+)<1×10-7 mol·L-1,而能水解的盐溶液中水电离产生的c(H+)[或c(OH-)]>1×10-7 mol·L-1。
[易错易混辨析] (错误的说明错因)
(1)在蒸馏水中滴加浓H2SO4,Kw不变( )
错因:_________________________________________
(2)温度一定时,在纯水中通入少量SO2,水的电离平衡不移动,Kw不变( )
错因:_________________________________________
(3)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1的NaOH溶液中水的电离程度相等( )
错因:_________________________________________
(4)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
错因:_________________________________________
×
浓硫酸滴入水中放热,溶液温度升高,Kw变大
×
二氧化硫与水反应生成的亚硫酸抑制水的电离
√
×
CH3COONH4溶液中的醋酸根离子和铵根离子均能水解,促进水的电离
[深度思考]
如何计算水电离的c(H+)或c(OH-)
(1)任何情况下水电离产生的c(H+)和c(OH-)总是________的。
(2)当抑制水的电离时(如酸或碱溶液)
在溶液中c(H+)、c(OH-)较小的数值是水电离出来的。具体见下表:
溶液(25 ℃) c(H+) /(mol·L-1) c(OH-) /(mol·L-1) c(H+)水或c(OH-)水/(mol·L-1)
0.01 mol·L-1 盐酸 ________ ________ ________
0.1 mol·L-1 NaOH溶液 ________ ________ ________
相等
1.0×10-2
1.0×10-12
1.0×10-12
1.0×10-13
1.0×10-1
1.0×10-13
(3)当促进水的电离时(如盐的水解)
在溶液中c(H+)、c(OH-)较大的数值是水电离出来的。具体见下表:
溶液(25 ℃) c(H+) /(mol·L-1) c(OH-) /(mol·L-1) c(H+)水或c(OH-)水/(mol·L-1)
pH=5的 NH4Cl溶液 ____________ ____________ ____________
pH=10的 Na2CO3溶液 ____________ ____________ ____________
1.0×10-5
1.0×10-9
1.0×10-5
1.0×10-10
1.0×10-4
题组强化训练·形成关键能力
题组一 影响水电离平衡的因素及结果判断
1.25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
答案:B
解析:A项,向水中加入稀氨水,NH3·H2O电离出和OH-,c(OH-)增大,平衡逆向移动,错误;B项,向水中加入少量固体NaHSO4,NaHSO4电离出Na+、H+和,c(H+)增大,平衡逆向移动,温度不变,Kw不变,正确;C项,向水中加入少量固体CH3COONa,CH3COONa电离出CH3COO-和Na+,CH3COO-与H+结合成弱酸CH3COOH,c(H+)降低,平衡正向移动,错误;D项,水的电离是吸热过程,将水加热促进水的电离,Kw增大,pH减小,错误。
2.(双选)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-14
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案:BC
解析: A项,c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小,错误。B项,由b点对应c(H+)与c(OH-)可知,Kw=c(H+)·c(OH-)=1.0×10-7×1.0×10-7=1.0×10-14,正确。C项,FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化,正确。D项,c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化,错误。
题组二 溶液中由水电离出的c(OH-)或c(H+)的求算
3.25 ℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是( )
①pH=0的H2SO4溶液 ②0.05 mol·L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
答案:A
解析:设溶液的体积为1 L,①中pH=0的H2SO4溶液中c(H+)=1 mol·L-1,c(OH-)=10-14 mol·L-1,电离的水的物质的量为10-14 mol;②中c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1,电离的水的物质的量为10-13 mol;③中c(OH-)=10-4 mol·L-1,电离的水的物质的量为10-4 mol;④中c(H+)=10-5 mol·L-1,电离的水的物质的量为10-5 mol;故①②③④中电离的水的物质的量之比为10-14∶10-13∶10-4∶10-5=1∶10∶1010∶109。
4.T ℃时0.1 mol·L-1 NaOH溶液的pH=12,则T ℃时pH=10的Na2CO3溶液中c(H+)H2O=________ mol·L-1。
1×10-3
解析:T ℃时0.1 mol·L-1 NaOH溶液中c(H+)=1×10-12 mol·L-1,c(OH-)=1×10-1 mol·L-1,Kw=1×10-13。T ℃,pH=10的Na2CO3溶液中c(H+)H2O=c(OH-)==1×10-3mol·L-1。
考点二
考点二 溶液的酸碱性与pH
必备知识梳理·夯实学科基础
1.溶液的酸碱性
溶液的酸碱性取决于c(H+)与c(OH-)的相对大小,具体内容见下表:
适用的温度 25 ℃ 各种温度
项目 pH c(H+)/(mol·L-1) c(H+)与
c(OH-)的相对大小
酸性 <____ >________ c(H+)____c(OH-)
中性 =____ =________ c(H+)____c(OH-)
碱性 >____ <________ c(H+)____c(OH-)
7
10-7
>
7
10-7
=
7
10-7
<
2.溶液的pH
(1)表达式:pH=__________。
(2)使用范围:pH的取值范围为0~14,即只适用于c(H+)≤1 mol·L-1或c(OH-)≤1 mol·L-1的电解质溶液,当c(H+)≥1 mol·L-1或c(OH-)≥1 mol·L-1时,直接用c(H+)或c(OH-)表示溶液的酸碱性。
(3)pH的意义:pH表示溶液酸碱性的强弱。在相同温度下,pH越小,溶液酸性________;pH越大,溶液碱性________。
(4)溶液的酸碱性与pH的关系
-lg c(H+)
越强
越强
3.pH的测定
(1)pH试纸测定
①使用方法:取一小片试纸放在洁净的________或________上,用________蘸取待测液点在试纸的中央,变色稳定后与标准比色卡对照,即可确定溶液的pH。
②注意事项:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能会产生误差;用广范pH试纸读出的pH只能是________。
(2)pH计测定:可精确测定溶液的pH,可读取一位或两位小数。
玻璃片
表面皿
玻璃棒
整数
4.溶液pH的计算
(1)单一溶液pH的计算
强酸溶液:如HnA,设浓度为c mol·L-1,c(H+)=______mol·L-1,pH=-lg c(H+)=________。
强碱溶液(25 ℃):如B(OH)n,设浓度为c mol·L-1,c(H+)=
___________ mol·L-1,pH=-lg c(H+)=____________。
nc
-lg (nc)
14+lg (nc)
(2)混合溶液pH的计算类型(混合前后溶液体积变化忽略不计)
①两种强酸混合:直接求出c(H+)混,再据此求pH。c(H+)混=。
②两种强碱混合:先求出c(OH-)混,再根据Kw求出c(H+)混,最后求pH。
c(OH-)混=。
③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。c(H+)混或c(OH-)混=。
[易错易混辨析] (错误的说明错因)
(1)酸性溶液中只有H+没有OH-( )
错因:____________________________________
(2)pH=7的溶液一定呈中性( )
错因:____________________________________
(3)用pH试纸测溶液的pH时,应先用蒸馏水润湿试纸( )
错因:____________________________________
(4)用湿润的pH试纸测溶液的pH一定有误差( )
错因:____________________________________
(5)用广范pH试纸测得某溶液的pH为3.4( )
错因:____________________________________
(6)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性( )
错因:____________________________________
×
水溶液中同时存在H+和OH-
×
水的电离受温度的影响,因而溶液的pH也与温度有关
×
用蒸馏水润湿试纸,相当于稀释待测液
×
pH试纸使用时不能湿润,但用湿润的pH测定中性溶液的pH不产生误差
×
广范pH试纸只能读取1~14的整数
√
[深度思考]
常温下,两种溶液混合后酸碱性的判断(在括号中填“酸性”“碱性”或“中性”)。
(1)相同浓度的HCl和NaOH溶液等体积混合( )
(2)相同浓度的CH3COOH和NaOH溶液等体积混合( )
(3)相同浓度的NH3·H2O和HCl溶液等体积混合( )
(4)pH=2的H2SO4和pH=12的NaOH溶液等体积混合( )
(5)pH=3的HCl和pH=10的NaOH溶液等体积混合( )
(6)pH=3的HCl和pH=12的NaOH溶液等体积混合( )
(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( )
(8)pH=2的H2SO4和pH=12的NH3·H2O等体积混合( )
中性
碱性
酸性
中性
酸性
碱性
酸性
碱性
微点拨 酸碱溶液混合后酸碱性的判断规律
(1)等浓度等体积的一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
(2)室温下c酸(H+)=c碱(OH-),即pH之和等于14时,一强一弱等体积混合——“谁弱谁过量,谁弱显谁性”。
(3)已知强酸和强碱的pH,等体积混合(25 ℃时):
①pH之和等于14,呈中性;②pH之和小于14,呈酸性;③pH之和大于14,呈碱性。
题组强化训练·形成关键能力
题组一 酸、碱混合溶液酸碱性的判断
1.在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A.pH=3的HNO3和pH=11的KOH溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的醋酸和pH=11的Ba(OH)2溶液
D.pH=3的硫酸和pH=11的NaOH溶液
答案:C
解析:A项,pH=3的HNO3和pH=11的KOH溶液,c(H+)=c(OH-)=10-3 mol·L-1,等体积混合恰好反应生成硝酸钾,溶液为中性,错误;B项,pH=3的盐酸和pH=11的氨水,c(H+)=10-3 mol·L-1,氨水浓度大于10-3 mol·L-1,等体积混合时碱过量,溶液pH大于7,错误;C项,pH=3的醋酸,醋酸的浓度大于10-3mol·L-1,pH=11的Ba(OH)2溶液中c(OH-)=10-3 mol·L-1,等体积混合时酸过量,pH一定小于7,正确;D项,pH=3的硫酸和pH=11的NaOH溶液,c(H+)=c(OH-)=10-3 mol·L-1,等体积混合恰好反应生成硫酸钠,溶液为中性,错误。
2.现有室温下四种溶液,有关叙述不正确的是( )
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
答案:D
解析:从平衡移动角度分析,CH3COONa电离出的CH3COO-与盐酸中的H+结合生成CH3COOH,会使醋酸中平衡CH3COOH CH3COO-+H+左移,两溶液中H+浓度均减小,所以pH均增大,A项正确;假设均是强酸强碱,则物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,c(H+)>c(OH-),B项正确;分别加水稀释10倍,假设平衡不移动,那么①②溶液的pH均为10,但稀释氨水使平衡+OH-右移,使①pH>10,同理醋酸稀释后pH<4,C项正确;假设均是强酸强碱,混合后溶液呈中性,则V1=V2,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要的①氨水少,即V1>V2,D项错误。
题组二 pH的简单计算
3.将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比值为( )
A.9 B.10
C.11 D.12
答案:C
解析:将pH=1的盐酸加适量水,pH升高了1,说明所加的水是原溶液的9倍;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH升高了1,则10-1×1-10-1·x=10-2·(1+x),解得x=,则加入的水与NaOH溶液的体积比为9∶=11∶1。
4.根据要求解答下列问题(常温条件下):
(1)pH=5的H2SO4溶液,加水稀释到500倍,则稀释后)与c(H+)的比值为__________。
(2)取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为__________。
(3)在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则溶液与NaHSO4溶液的体积比是________。
(4)将pH=a的NaOH溶液Va L与pH=b的稀盐酸Vb L混合,若所得溶液呈中性,且a+b=13,则=______。
0.05 mol·L-1
1∶4
10
解析:(1)稀释前)= mol·L-1,稀释后)= mol·L-1=10-8 mol·L-1,c(H+)稀释后接近10-7 mol·L-1,所以≈=。(2)=0.01 mol·L-1,c=0.05 mol·L-1。(3)设氢氧化钡溶液的体积为V1 L,硫酸氢钠溶液的体积为V2 L,依题意知,n(Ba2+)=),由Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=5×10-3V1 mol,=1×10-3 mol·L-1,则V1∶V2=1∶4。(4)pH=a的NaOH溶液中c(OH-)=10a-14 mol·L-1,pH=b的稀盐酸中c(H+)=10-b mol·L-1,根据中和反应H++OH-===H2O,知c(OH-)·Va=c(H+)·Vb,===1014-(a+b),a+b=13,则=10。
[思维建模] 溶液pH计算的一般思维模型
高考真题演练
1.判断正误。
[2020·浙江6月]25 ℃时,若测得HR溶液pH=a,取该溶液10.00 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR为弱酸( )
×
解析:无论HR是强酸还是弱酸,当6<a<7时,稀释10倍后溶液的pH始终小于7,即b—a<1。
2.[2020·浙江7月]下列说法不正确的是( )
A.2.0×10-7 mol·L-1的盐酸中c(H+)=2.0×10-7 mol·L-1
B.将KCl溶液从常温加热至80 ℃,溶液的pH变小但仍保持中性
C.常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D.常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
答案:A
解析:本题考查电离平衡知识,考查的化学核心素养是变化观念与平衡思想。极稀的溶液中,H2O电离出的H+不能忽略,故c(H+)大于2×10-7mol·L-1,A项错误;水的电离是吸热的,升高温度促进水的电离,氢离子浓度和氢氧根离子浓度均增大,pH减小,但氢离子浓度和氢氧根离子浓度仍相等,溶液呈中性,B项正确;常温下,NaCN溶液呈碱性,说明NaCN是强碱弱酸盐,HCN是弱酸,C项正确;醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,pH增大,D项正确。
3.[2019·天津卷]某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
答案:C
解析:酸的电离平衡常数越大,酸的酸性越强,由电离常数可知,HNO2的酸性大于CH3COOH,pH相同的一元酸分别稀释相同的位数,pH变化较大的酸酸性较强,所以曲线Ⅱ表示HNO2溶液,曲线Ⅰ表示CH3COOH溶液,故A错误;氢离子抑制水的电离,氢离子浓度越大,水的电离程度越小,c(H+):b>c,则水电离程度:b
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因____________________________________________________。
②如果水的离子积Kw从1.0×10-14增大到1.0×10-10,则相应的电离度是原来的________倍。
水的电离为吸热过程,升高温度有利于电离(压强对电离平衡影响不大)
100
随堂过关训练
1.25 ℃时,水中存在电离平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)减小
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
答案:B
解析:加热促进水的电离,Kw增大,pH减小,但水仍呈中性,A项错误;加入NaOH固体,c(OH-)增大,C项错误;加入NH4Cl固体水解促进水的电离,但c(OH-)减小,D项错误。
2.已知:pOH=-lg c(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH( )
A.大于6.7 B.小于6.7
C.等于6.7 D.无法判断
答案:B
解析:升高温度,促进水电离,则水的离子积常数大于10-14,pH+pOH<14。
3.已知在100 ℃下,水的离子积Kw=1×10-12,下列说法正确的是( )
A.0.05 mol·L-1的H2SO4溶液pH=1
B.0.001 mol·L-1的NaOH溶液pH=11
C.0.005 mol·L-1的H2SO4溶液与的NaOH溶液等体积混合,混合后溶液pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
答案:A
解析:A项,c(H+)=0.05 mol·L-1×2=0.1 mol·L-1,pH=-lg c(H+)=-lg 0.1=1,正确;B项,c(OH-)=10-3 mol·L-1,则100 ℃时,c(H+)==mol·L-1=10-9 mol·L-1,pH=9,错误;C项,c(H+)=2×0.005 mol·L-1=0.01 mol·L-1,c(OH-)=0.01 mol·L-1,等体积混合后溶液呈中性,c(H+)=c(OH-)=10-6 mol·L-1,pH=6,错误;D项,所需NaOH溶液的体积V= mL=0.5 mL,错误。
4.如图表示1 mol·L-1醋酸溶液的pH随温度变化的曲线(假设加热过程中醋酸不挥发)。下列说法错误的是( )
A.10 ℃升温到25 ℃时,断键吸热和分子间氢键断裂吸热导致醋酸电离程度增加
B.30 ℃后升温,形成水合离子的过程放热导致醋酸的电离程度减小
C.23 ℃时,保持温度不变向1 mol·L-1醋酸溶液中加入少量pH=2.65的盐酸,pH不变
D.33 ℃时,醋酸电离平衡常数的数量级为10-5
答案:D
解析:电解质溶于水包含自身电离吸热过程和形成水合离子放热过程,由图可知10 ℃升温到25 ℃时,电解质电离吸热和分子间氢键断裂吸热占主导,升温促进电离,pH减小,A正确;30 ℃后升温,形成水合离子的过程放热占主导,导致醋酸的电离程度减小,pH增大,B正确;23 ℃时,溶液pH=2.65,保持温度不变加入少量pH=2.65的盐酸,可看成等效平衡,pH不变,C正确;33 ℃时,pH=2.7,K=≈10-5.4,电离平衡常数数量级为10-6,D错误。
5.现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答问题:
(1)常温下0.1 mol·L-1 CH3COOH溶液加水稀释过程,下列表达式的数值一定变小的是________(填字母)。
A.c(H+) B. C.c(H+)·c(OH-) D.
(2)取10 mL的乙溶液,加入等体积的水,醋酸的电离平衡________(填“向左”“向右”或“不”)移动;另取10 mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中的值将________(填“增大”“减小”或“无法确定”)。
A
向右
减小
解析:(1)CH3COOH溶液中存在电离平衡:CH3COOH H++CH3COO-,加水稀释过程中,平衡正向移动,但溶液中c(H+) 、c(CH3COO-)均减小,A符合题意。CH3COOH的电离平衡常数Ka=,则有=,加水稀释时,c(CH3COO-)减小,但Ka不变,则增大,B不符合题意。由于温度不变,则 c(H+)·c(OH-)=Kw不变,C不符合题意。加水稀释时,溶液中c(H+)减小,由于c(H+)·c(OH-)=Kw不变,则c(OH-)增大,故增大,D不符合题意。(2)醋酸溶液中加入等体积的水,醋酸的电离平衡向右移动,电离程度增大;醋酸溶液中加入少量无水醋酸钠固体,c(CH3COO-)增大,电离平衡逆向移动,根据CH3COOH的电离平衡常数Ka=推知,=,由于温度不变,Ka不变,c(CH3COO-)增大,则溶液中的值减小。
(3)相同条件下,取等体积的甲、乙两溶液,分别加水稀释100倍,所得溶液的pH大小关系为pH(甲)________pH(乙)(填“>”“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为V(甲)________V(乙)(填“>”“<”或“=”)。
>
<
解析:(3)常温下,pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),取等体积的甲、乙两溶液,分别加水稀释100倍,醋酸的电离平衡正向移动,pH变化小,则所得溶液的pH:pH(甲)>pH(乙)。(4)pH均为2的盐酸和醋酸溶液相比,其浓度:c(HCl)
同课章节目录
