重庆市铁路中学2023-2024学年高二上学期12月月考化学试题(无答案)
文档属性
| 名称 | 重庆市铁路中学2023-2024学年高二上学期12月月考化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 720.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 10:51:19 | ||
图片预览

文档简介
重庆市铁路中学2023-2024学年高二上学期12月月考化学试题
可能用到的相对原子质量:H 1 C 12 O 16 Ag 108
一、选择题(本大题包含14个小题,每小题3分,共42分)每小题只有一个选项符合题意.
1.下列说法正确的是( )
A.化学反应中的能量变化均表现为热量变化
B.灼热的炭与水蒸气反应既属于氧化还原反应又属于吸热反应
C.农业上将草木灰和铵态氮肥一起施用肥效更佳
D.工业上用电解熔融的方式冶炼金属铝
2.下列推论正确的是( )
A.燃烧热为,则有
B. , ;则:
C.通常状况下,中和热为57.4kJ/mol,则有:
D. ,则:该反应在高温下能自发进行
3.下列溶液一定显中性的是( )
A.或的溶液 B.酸和碱恰好反应完全的溶液
C.的溶液 D.不发生水解的盐溶液
4.下列方程式书写正确的是( )
A.碳酸的电离:
B.NaHS的水解:
C.去除废水中的:
D.的溶解:
5.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.溶液中:、、、
B.澄清透明溶液中:、、、
C.溶液中:、、、
D.由水电离产生的的溶液中:、、、
6.下列有关阿伏伽德罗常数的说法正确的是( )
A.100mL 1mol/L溶液中的数目为
B.一定温度下,的纯水中的数目为
C.一定条件下,1mol和3mol充分反应,转移的电子数小于
D.用电解法精炼铜时,若阳极质量减轻64g,电路中转移电子数目为
7.下列说法符合勒夏特列原理的是( )
A.pH值相同的盐酸和醋酸溶液稀释相同倍数后,醋酸的pH值较小
B.锌片和稀硫酸反应过程中,加入少些固体,促进的产生
C.工业合成氨时采用500℃左右高温而不采用常温
D.压缩盛有和的透明容器,容器中颜色变深
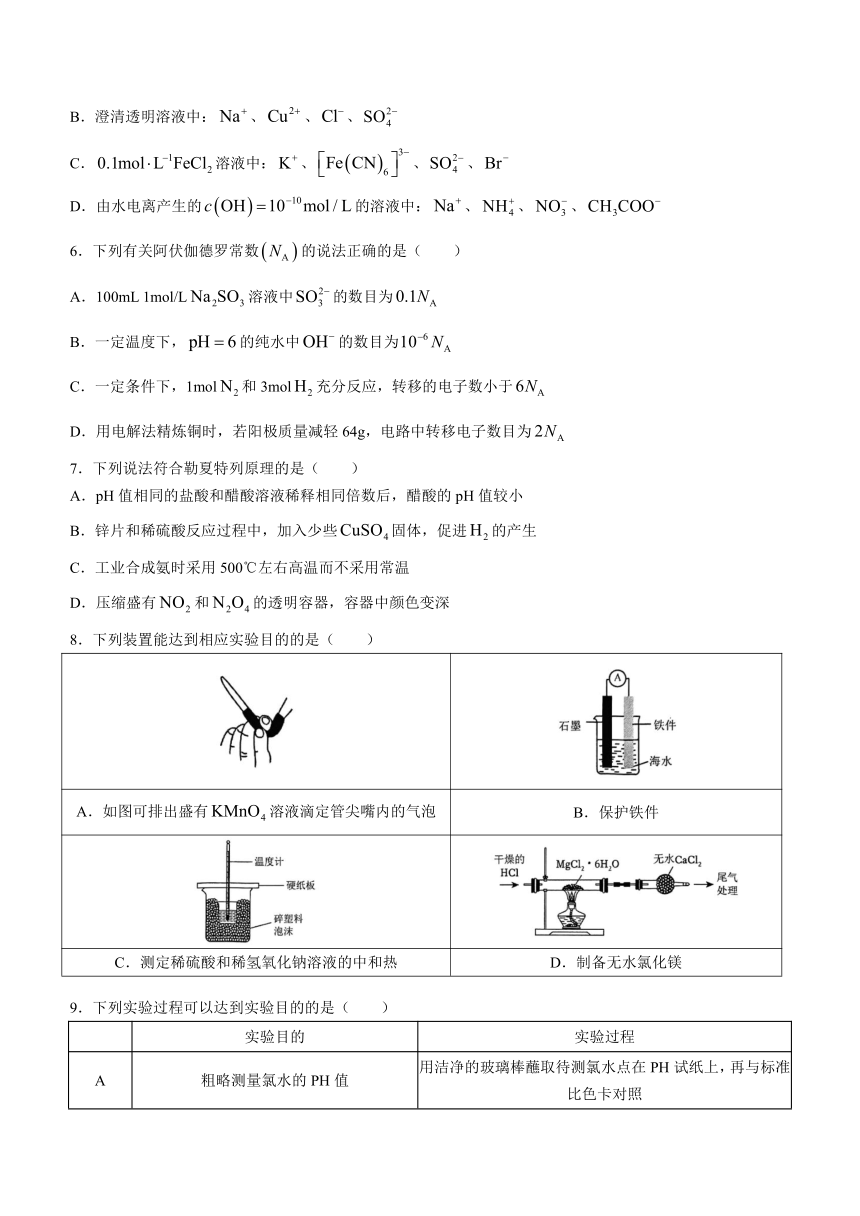
8.下列装置能达到相应实验目的的是( )
A.如图可排出盛有溶液滴定管尖嘴内的气泡 B.保护铁件
C.测定稀硫酸和稀氢氧化钠溶液的中和热 D.制备无水氯化镁
9.下列实验过程可以达到实验目的的是( )
实验目的 实验过程
A 粗略测量氯水的PH值 用洁净的玻璃棒蘸取待测氯水点在PH试纸上,再与标准比色卡对照
B 证明(橙色)(黄色)具有可逆性 向溶液中滴入少量稀溶液橙色加深
C 根据褪色时间来探究浓度对反应速率的影响 向2支试管中加入少量同体积、同浓度的草酸溶液,再分别加入过量同体积、不同浓度的溶液
D 证明AgI溶解度小于AgCl溶解度 向2mL0.1mol/L溶液中先滴加4滴0.1mol/L KCl溶液,再滴加4滴0.1mol/L KI溶液
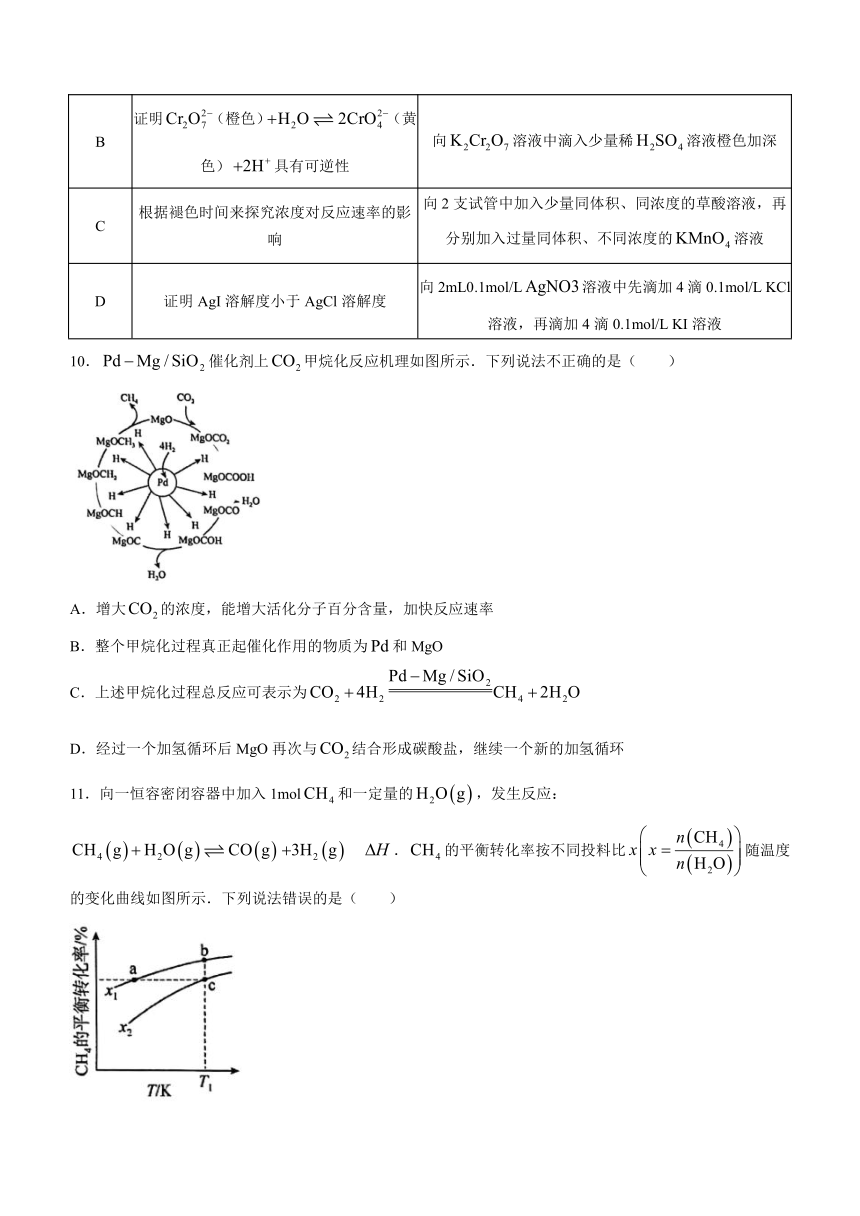
10.催化剂上甲烷化反应机理如图所示.下列说法不正确的是( )
A.增大的浓度,能增大活化分子百分含量,加快反应速率
B.整个甲烷化过程真正起催化作用的物质为和MgO
C.上述甲烷化过程总反应可表示为
D.经过一个加氢循环后MgO再次与结合形成碳酸盐,继续一个新的加氢循环
11.向一恒容密闭容器中加入1mol和一定量的,发生反应: .的平衡转化率按不同投料比随温度的变化曲线如图所示.下列说法错误的是( )
A.
B.加入催化剂,反应物的平衡转化率和反应的均不变
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
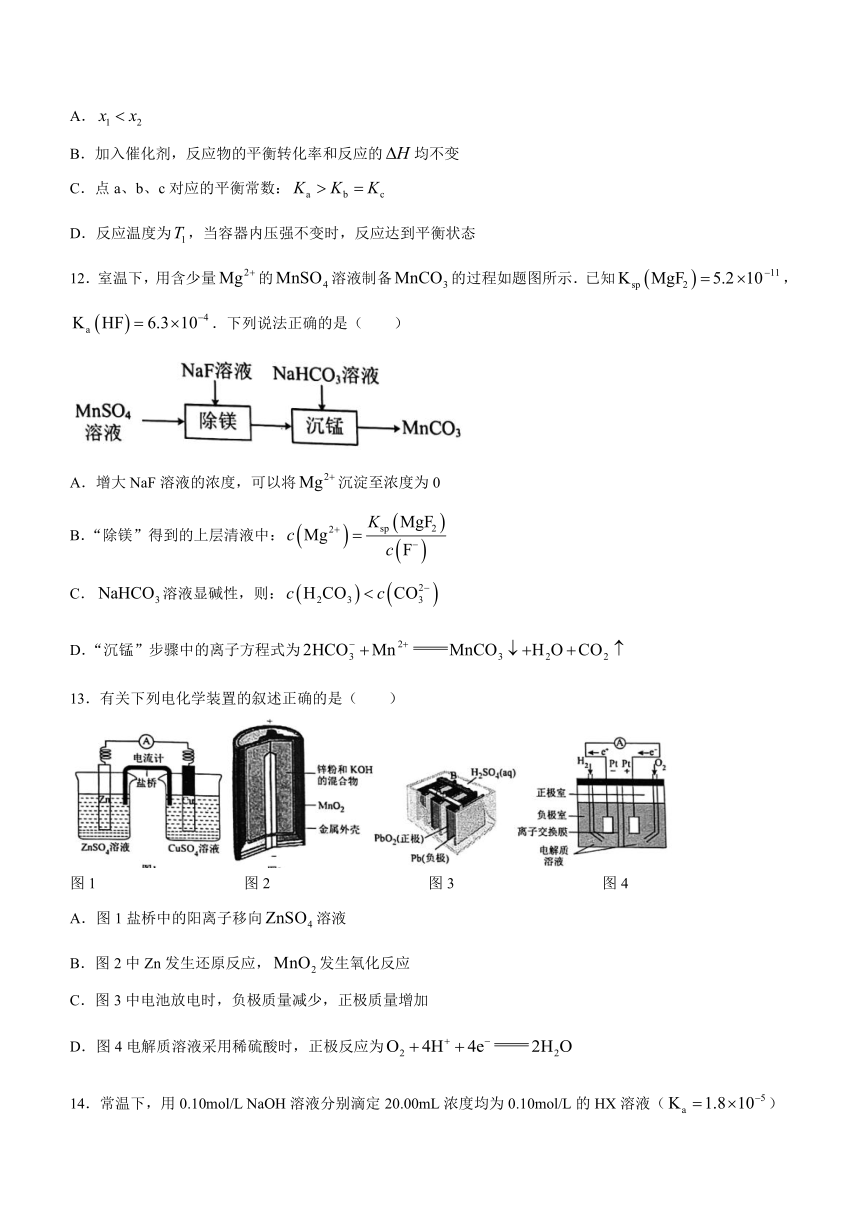
12.室温下,用含少量的溶液制备的过程如题图所示.已知,.下列说法正确的是( )
A.增大NaF溶液的浓度,可以将沉淀至浓度为0
B.“除镁”得到的上层清液中:
C.溶液显碱性,则:
D.“沉锰”步骤中的离子方程式为
13.有关下列电化学装置的叙述正确的是( )
图1 图2 图3 图4
A.图1盐桥中的阳离子移向溶液
B.图2中Zn发生还原反应,发生氧化反应
C.图3中电池放电时,负极质量减少,正极质量增加
D.图4电解质溶液采用稀硫酸时,正极反应为
14.常温下,用0.10mol/L NaOH溶液分别滴定20.00mL浓度均为0.10mol/L的HX溶液()和HY溶液()所得滴定曲线如图,下列说法正确的是( )
A.曲线b是滴定HY溶液的pH变化曲线
B.滴定过程可使用甲基橙做指示剂
C.溶液中水的电离程度②<③<④
D.点①和点②所示溶液中:
二、非选择题,本题包括4个小题,共58分.
15.(17分,除特殊标记外,每空2分)
Ⅰ.25℃时,某些弱电解质的电离常数如表所示,回答下列问题.
弱电解质 HClO
电离常数
(1)25℃时,盐酸的pH约为______,该溶液中水电离出的______.
(2)少量的通入溶液中,发生反应的离子方程式为______.
(3)发生水解反应的水解平衡常数表达式为______;25℃时,的水解平衡常数______其电离平衡常数(填“>”或“<”),故溶液显______性.
Ⅱ.请分析如下电化学装置,回答下列问题:
(4)甲池为______(填“原电池”“电解池”或“电镀池”),通入电极的电极反应式正确的为______.
A. B.
C. D.
(5)当甲池中消耗为1.12L(标准状况下)时,理论上乙池中B极质量增加______g.
(6)丙池中发生的总反应化学方程式为______;为了防止丙池中两极产物相互反应,实际生产中在两极之间设有______离子交换膜(填“阴”或“阳”或“质子”).
16.(14分,每空2分)环戊二烯()是一种重要的有机化工原料.
Ⅰ.环戊二烯容易反应生成双环戊二烯():.不同温度下,溶液中环戊二烯()浓度(初始浓度为)与反应时间的关系如图所示.
(1)反应开始至b点时,用双环戊二烯()表示的平均速率为______(小数表示).
(2)______(填“大于”、“小于”或“等于”)
(3)a点的正反应速率______b点的逆反应速率(填“大于”、“小于”或“等于”)
Ⅱ.可用环戊二烯()制备环戊烯().有如下反应:
反应ⅰ:
反应ⅱ:
反应ⅲ:
(4)反应ⅲ的焓变______
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应iii,起始总压为,平衡时总压为.
①平衡时环戊烯()的体积分数为______%.
②用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算压强平衡常数______.
A. B. C. D.
③达到平衡后,欲增加环戊烯()的平衡转化率,可采取的措施有______.
A.加压 B.适当升高温度 C.增大环戊烯的浓度 D.适当降低压强
17.(14分)邻苯二甲酸(分子式为,)常用表示)是一种二元弱酸,,.邻苯二甲酸样品中含有少量杂质(不参与反应),某同学现用中和滴定的方法测定邻苯二甲酸样品中邻苯二甲酸的纯度(质量分数).
(1)用NaOH固体配制250mLNaOH标准溶液,必须使用的仪器除天平、烧杯、玻璃棒、量筒外,还需要______、______.
(2)将NaOH标准溶液装入______(填“酸式”或“碱式”)滴定管中;该滴定管在注入NaOH标准溶液之前,需要进行的上一步操作是______.
(3)盛放NaOH标准溶液的滴定管,滴定前尖嘴部分有气泡,滴定后尖嘴部分无气泡,则测得该样品中邻苯二甲酸的质量分数将______(填“偏高”、“偏低”或“无影响”).
(4)称取2.50g邻苯二甲酸样品,配制成100mL溶液,用酸式滴定管量取10.00mL待测液于锥形瓶中,并滴入2~3滴______试液作为指示剂.
(5)有关数据记录如表:
序号 待测样品溶液体积/mL NaOH标准溶液/mL
滴定前的刻度 滴定后的刻度 消耗的体积
1 10.00
2 10.00 0.10 24.68 24.58
3 10.00 1.23 25.85 24.62
第一次滴定前、后滴定管中液面的位置如图所示,则该次滴定所消耗NaOH标准溶液的体积为______mL.
滴定前 滴定后
(6)到达滴定终点的现象是______.
(7)根据所给数据,该邻苯二甲酸样品中邻苯二甲酸的质量分数为______(保留四位有效数字).
18.(13分,除特殊标注外,每空2分)某科研小组设计出利用工业废酸(主要成分为稀硫酸)浸取某废弃的氧化铜锌矿(主要含CuO、ZnO和)的方案,实现废物综合利用,如图所示.
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子
开始沉淀时的PH 6.34 1.48 6.2
完全沉淀时的PH 9.7 3.2 8.0
请回答下列问题:
(1)堆浸时,为了提高浸出效率可采取的措施有(任写1种):______.
(2)堆浸时产生的矿渣主要成分是______.
(3)物质A的作用是______,可使用下列物质中的______.
A. B. C. D.
(4)除铁过程中加入氨水的目的是调节溶液的PH,PH应控制在______范围;
(5)物质B可直接用作氮肥,则B的化学式是______.
(5)除铁后得到的可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂―,写出该反应的离子方程式______.
可能用到的相对原子质量:H 1 C 12 O 16 Ag 108
一、选择题(本大题包含14个小题,每小题3分,共42分)每小题只有一个选项符合题意.
1.下列说法正确的是( )
A.化学反应中的能量变化均表现为热量变化
B.灼热的炭与水蒸气反应既属于氧化还原反应又属于吸热反应
C.农业上将草木灰和铵态氮肥一起施用肥效更佳
D.工业上用电解熔融的方式冶炼金属铝
2.下列推论正确的是( )
A.燃烧热为,则有
B. , ;则:
C.通常状况下,中和热为57.4kJ/mol,则有:
D. ,则:该反应在高温下能自发进行
3.下列溶液一定显中性的是( )
A.或的溶液 B.酸和碱恰好反应完全的溶液
C.的溶液 D.不发生水解的盐溶液
4.下列方程式书写正确的是( )
A.碳酸的电离:
B.NaHS的水解:
C.去除废水中的:
D.的溶解:
5.室温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.溶液中:、、、
B.澄清透明溶液中:、、、
C.溶液中:、、、
D.由水电离产生的的溶液中:、、、
6.下列有关阿伏伽德罗常数的说法正确的是( )
A.100mL 1mol/L溶液中的数目为
B.一定温度下,的纯水中的数目为
C.一定条件下,1mol和3mol充分反应,转移的电子数小于
D.用电解法精炼铜时,若阳极质量减轻64g,电路中转移电子数目为
7.下列说法符合勒夏特列原理的是( )
A.pH值相同的盐酸和醋酸溶液稀释相同倍数后,醋酸的pH值较小
B.锌片和稀硫酸反应过程中,加入少些固体,促进的产生
C.工业合成氨时采用500℃左右高温而不采用常温
D.压缩盛有和的透明容器,容器中颜色变深
8.下列装置能达到相应实验目的的是( )
A.如图可排出盛有溶液滴定管尖嘴内的气泡 B.保护铁件
C.测定稀硫酸和稀氢氧化钠溶液的中和热 D.制备无水氯化镁
9.下列实验过程可以达到实验目的的是( )
实验目的 实验过程
A 粗略测量氯水的PH值 用洁净的玻璃棒蘸取待测氯水点在PH试纸上,再与标准比色卡对照
B 证明(橙色)(黄色)具有可逆性 向溶液中滴入少量稀溶液橙色加深
C 根据褪色时间来探究浓度对反应速率的影响 向2支试管中加入少量同体积、同浓度的草酸溶液,再分别加入过量同体积、不同浓度的溶液
D 证明AgI溶解度小于AgCl溶解度 向2mL0.1mol/L溶液中先滴加4滴0.1mol/L KCl溶液,再滴加4滴0.1mol/L KI溶液
10.催化剂上甲烷化反应机理如图所示.下列说法不正确的是( )
A.增大的浓度,能增大活化分子百分含量,加快反应速率
B.整个甲烷化过程真正起催化作用的物质为和MgO
C.上述甲烷化过程总反应可表示为
D.经过一个加氢循环后MgO再次与结合形成碳酸盐,继续一个新的加氢循环
11.向一恒容密闭容器中加入1mol和一定量的,发生反应: .的平衡转化率按不同投料比随温度的变化曲线如图所示.下列说法错误的是( )
A.
B.加入催化剂,反应物的平衡转化率和反应的均不变
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
12.室温下,用含少量的溶液制备的过程如题图所示.已知,.下列说法正确的是( )
A.增大NaF溶液的浓度,可以将沉淀至浓度为0
B.“除镁”得到的上层清液中:
C.溶液显碱性,则:
D.“沉锰”步骤中的离子方程式为
13.有关下列电化学装置的叙述正确的是( )
图1 图2 图3 图4
A.图1盐桥中的阳离子移向溶液
B.图2中Zn发生还原反应,发生氧化反应
C.图3中电池放电时,负极质量减少,正极质量增加
D.图4电解质溶液采用稀硫酸时,正极反应为
14.常温下,用0.10mol/L NaOH溶液分别滴定20.00mL浓度均为0.10mol/L的HX溶液()和HY溶液()所得滴定曲线如图,下列说法正确的是( )
A.曲线b是滴定HY溶液的pH变化曲线
B.滴定过程可使用甲基橙做指示剂
C.溶液中水的电离程度②<③<④
D.点①和点②所示溶液中:
二、非选择题,本题包括4个小题,共58分.
15.(17分,除特殊标记外,每空2分)
Ⅰ.25℃时,某些弱电解质的电离常数如表所示,回答下列问题.
弱电解质 HClO
电离常数
(1)25℃时,盐酸的pH约为______,该溶液中水电离出的______.
(2)少量的通入溶液中,发生反应的离子方程式为______.
(3)发生水解反应的水解平衡常数表达式为______;25℃时,的水解平衡常数______其电离平衡常数(填“>”或“<”),故溶液显______性.
Ⅱ.请分析如下电化学装置,回答下列问题:
(4)甲池为______(填“原电池”“电解池”或“电镀池”),通入电极的电极反应式正确的为______.
A. B.
C. D.
(5)当甲池中消耗为1.12L(标准状况下)时,理论上乙池中B极质量增加______g.
(6)丙池中发生的总反应化学方程式为______;为了防止丙池中两极产物相互反应,实际生产中在两极之间设有______离子交换膜(填“阴”或“阳”或“质子”).
16.(14分,每空2分)环戊二烯()是一种重要的有机化工原料.
Ⅰ.环戊二烯容易反应生成双环戊二烯():.不同温度下,溶液中环戊二烯()浓度(初始浓度为)与反应时间的关系如图所示.
(1)反应开始至b点时,用双环戊二烯()表示的平均速率为______(小数表示).
(2)______(填“大于”、“小于”或“等于”)
(3)a点的正反应速率______b点的逆反应速率(填“大于”、“小于”或“等于”)
Ⅱ.可用环戊二烯()制备环戊烯().有如下反应:
反应ⅰ:
反应ⅱ:
反应ⅲ:
(4)反应ⅲ的焓变______
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应iii,起始总压为,平衡时总压为.
①平衡时环戊烯()的体积分数为______%.
②用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算压强平衡常数______.
A. B. C. D.
③达到平衡后,欲增加环戊烯()的平衡转化率,可采取的措施有______.
A.加压 B.适当升高温度 C.增大环戊烯的浓度 D.适当降低压强
17.(14分)邻苯二甲酸(分子式为,)常用表示)是一种二元弱酸,,.邻苯二甲酸样品中含有少量杂质(不参与反应),某同学现用中和滴定的方法测定邻苯二甲酸样品中邻苯二甲酸的纯度(质量分数).
(1)用NaOH固体配制250mLNaOH标准溶液,必须使用的仪器除天平、烧杯、玻璃棒、量筒外,还需要______、______.
(2)将NaOH标准溶液装入______(填“酸式”或“碱式”)滴定管中;该滴定管在注入NaOH标准溶液之前,需要进行的上一步操作是______.
(3)盛放NaOH标准溶液的滴定管,滴定前尖嘴部分有气泡,滴定后尖嘴部分无气泡,则测得该样品中邻苯二甲酸的质量分数将______(填“偏高”、“偏低”或“无影响”).
(4)称取2.50g邻苯二甲酸样品,配制成100mL溶液,用酸式滴定管量取10.00mL待测液于锥形瓶中,并滴入2~3滴______试液作为指示剂.
(5)有关数据记录如表:
序号 待测样品溶液体积/mL NaOH标准溶液/mL
滴定前的刻度 滴定后的刻度 消耗的体积
1 10.00
2 10.00 0.10 24.68 24.58
3 10.00 1.23 25.85 24.62
第一次滴定前、后滴定管中液面的位置如图所示,则该次滴定所消耗NaOH标准溶液的体积为______mL.
滴定前 滴定后
(6)到达滴定终点的现象是______.
(7)根据所给数据,该邻苯二甲酸样品中邻苯二甲酸的质量分数为______(保留四位有效数字).
18.(13分,除特殊标注外,每空2分)某科研小组设计出利用工业废酸(主要成分为稀硫酸)浸取某废弃的氧化铜锌矿(主要含CuO、ZnO和)的方案,实现废物综合利用,如图所示.
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子
开始沉淀时的PH 6.34 1.48 6.2
完全沉淀时的PH 9.7 3.2 8.0
请回答下列问题:
(1)堆浸时,为了提高浸出效率可采取的措施有(任写1种):______.
(2)堆浸时产生的矿渣主要成分是______.
(3)物质A的作用是______,可使用下列物质中的______.
A. B. C. D.
(4)除铁过程中加入氨水的目的是调节溶液的PH,PH应控制在______范围;
(5)物质B可直接用作氮肥,则B的化学式是______.
(5)除铁后得到的可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂―,写出该反应的离子方程式______.
同课章节目录
