2023-2024学年八年级化学人教版(五四制)全一册5.3利用化学方程式的简单计算同步练习(含解析)
文档属性
| 名称 | 2023-2024学年八年级化学人教版(五四制)全一册5.3利用化学方程式的简单计算同步练习(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 193.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:43:03 | ||
图片预览



文档简介
5.3利用化学方程式的简单计算
一、单选题
1.有关反应2Mg+O22MgO的说法正确的是
A.镁加氧气在点燃条件下生成氧化镁
B.每3克镁和2克氧气在点燃条件下生成5克氧化镁
C.每2克镁和3克氧气在点燃条件下生成5克氧化镁
D.每2份镁和1份氧气在点燃条件下生成2份氧化镁
2.在点燃条件下,甲和乙反应生成丙和丁。它们的微观结构示意图如下所示(其中“”代表氢原子,“”代表碳原子,“”代表氧原子)。下列叙述错误的是
物质 甲 乙 丙 丁
微观示意图
A.生成物均为氧化物
B.甲中碳、氢、氧三种元素的质量比为12:3:8
C.在该反应中,生成丙和丁的质量比为3:11
D.在该反应中,甲和乙的分子个数比为1:3
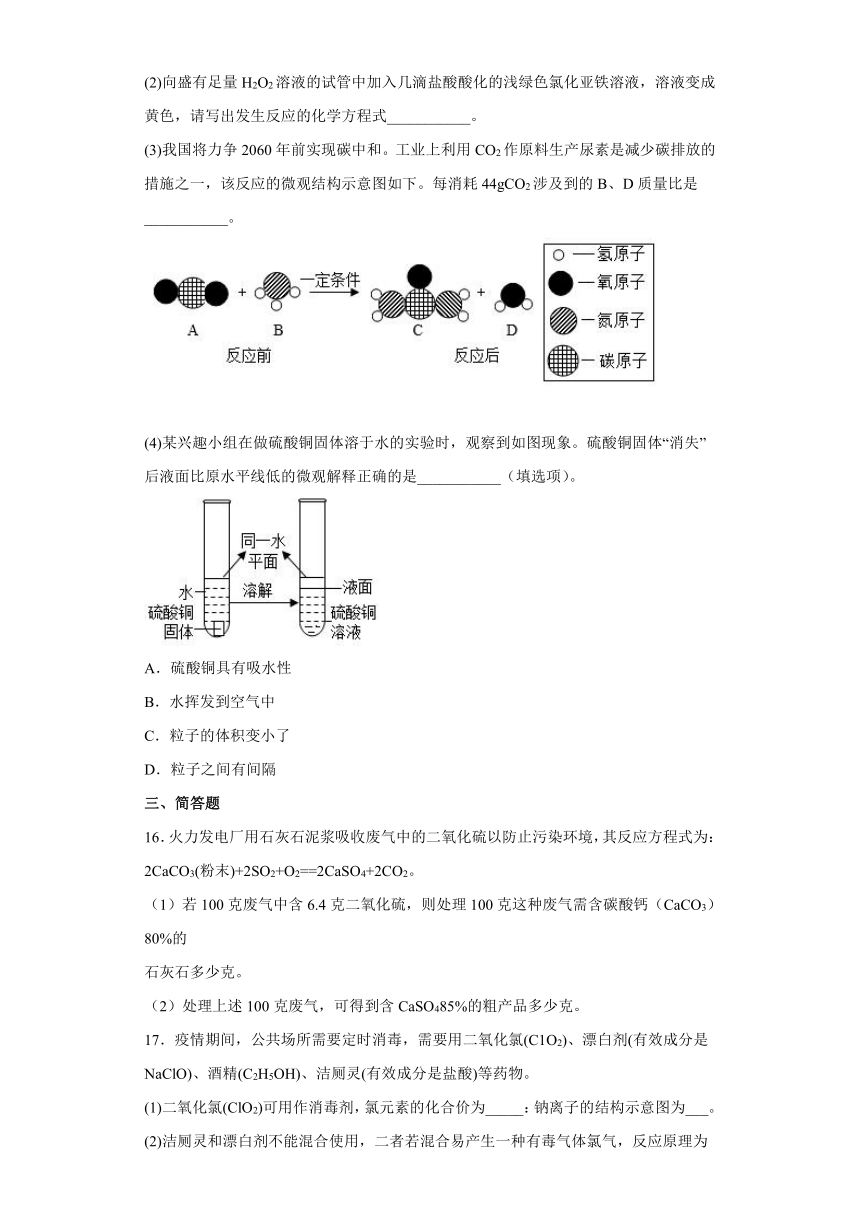
3.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量 变化如图。下列说法中不正确的是( )
A.该反应为分解反应 B.丙可能为该反应的催化剂
C.参加反应的乙、丁质量比为 3:2 D.丁相对分子质量是甲的 2 倍
4.在反应2CO+O22CO2中,各物质间的质量比为
A.2:1:2 B.56:32:88 C.28:32:44 D.1:1:2
5.甲和乙可以合成清洁燃料丙,微观过程如图所示。下列说法正确的是
A.丙物质中氢元素的质量分数最大 B.丙物质属于有机物,可用作溶剂和消毒剂
C.丙中C、H、O的质量比为 2∶6∶1 D.生成的丙和丁的分子个数比为1∶3
6.实验室可用“高锰酸钾、氯酸钾、双氧水”分解制取氧气。关于这三个反应原理,下列说法正确的是( )
A.都需要加催化剂
B.都有两种元素的化合价发生了变化
C.都生成氧化物
D.生成等量的O2消耗KMnO4的质量最大
7.在反应 中,28gA与一定质量的B恰好完全反应,生成88gC。若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为
A.7:8
B.8:7
C.7:24
D.24:7
8.某反应前后分子种类变化的微观示意图如下。下列说法正确的是
A.丙中碳氢元素的质量比为 4:1 B.反应前后分子总数不变
C.参加反应的甲、乙的质量比为 22:3 D.该反应属于置换反应
9.2020年5月5日,配置有氢氧发动机的长征五号B火箭,搭载我国新一代载人试验飞船顺利升空,飞船成功返回。从变化观念和平衡思想认识反应: 。下列说法正确的是
A.氢气和氧气混合生成水
B.反应前后元素种类不变、化合价改变
C.2g氢气和1g氧气反应生成3g水
D.氢气和氧气反应吸收热量
10.化学是在分子、原子层次上研究物质性质、组成、结构与变化规律的科学。下面是某反应的微观示意图,根据图示得到的信息正确的是
A.氧化汞由汞原子和氧分子构成
B.反应前后原子的数目没有增减
C.反应前后分子的种类没有改变
D.生成汞和氧气的质量比是2:1
二、填空题
11.发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧二化氮(N2O4)助燃,生成物不会对大气造成污染。
⑴反应的化学方程式为:2N2H4+N2O4="3_____" +4H2O,请在横线上填写化学式以完成该化学方程式。
⑵请计算9.6kgN2H4完全燃烧需要助燃物N2O4的质量____________。
12.高铁酸钾能溶于水,是高效、多功能水处理剂。
(1)中铁元素的化合价为_______。
(2)如图所示,将溶于水,几天后振荡、静置,再滴入酚酞,出现如图所示现象。写出与反应的化学方程式(其中与的化学计量数之比为)________。
(3)处理水时,不仅能杀菌,生成的红褐色固体还能使悬浮杂质沉降。某自来水厂每天需要使用19.8kg 处理水,至少产生红褐色沉淀_______kg。
13.已知A、B两种物质反应生成C:A+B→C.用7gA和2gB或4gA和5gB充分反应都可以得到6gC.现取A、B固体混合物共9g,充分反应后得到7.5gC.此混合物中A和B的质量分别是 ________ .
14.(1)镁是一种很活泼的金属,点燃后,它既能在氮气中燃烧,又能在二氧化碳中燃烧。已知镁在氮气中燃烧,化合生成一种物质,其中氮元素的化合价为-3价,镁在二氧化碳中燃烧,生成黑色炭粒和一种金属氧化物。试写出上述两个反应的化学方程式:______;______。
(2)3g碳在10g氧气中充分燃烧发生反应,则生成的二氧化碳的质量为______。
15.建立“宏观一微观—符号”之间的联系是学习化学的重要方法。据此回答下列问题:
(1)镁的化学性质比较活泼,因此常用电解熔融氯化镁来制取镁。如图是氯化镁在熔融状态下分解的微观示意图,请补充完整。已知:MgCl2(熔融)Mg+Cl2↑
(2)向盛有足量H2O2溶液的试管中加入几滴盐酸酸化的浅绿色氯化亚铁溶液,溶液变成黄色,请写出发生反应的化学方程式___________。
(3)我国将力争2060年前实现碳中和。工业上利用CO2作原料生产尿素是减少碳排放的措施之一,该反应的微观结构示意图如下。每消耗44gCO2涉及到的B、D质量比是___________。
(4)某兴趣小组在做硫酸铜固体溶于水的实验时,观察到如图现象。硫酸铜固体“消失”后液面比原水平线低的微观解释正确的是___________(填选项)。
A.硫酸铜具有吸水性
B.水挥发到空气中
C.粒子的体积变小了
D.粒子之间有间隔
三、简答题
16.火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2+O2==2CaSO4+2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的
石灰石多少克。
(2)处理上述100克废气,可得到含CaSO485%的粗产品多少克。
17.疫情期间,公共场所需要定时消毒,需要用二氧化氯(C1O2)、漂白剂(有效成分是NaClO)、酒精(C2H5OH)、洁厕灵(有效成分是盐酸)等药物。
(1)二氧化氯(ClO2)可用作消毒剂,氯元素的化合价为_____:钠离子的结构示意图为___。
(2)洁厕灵和漂白剂不能混合使用,二者若混合易产生一种有毒气体氯气,反应原理为,根据质量守恒定律,可推出X的化学式为__________。
(3)根据化学反应方程式计算,洁厕灵与漂白剂混用若产生了142克C12,则消耗NaClO的质量为____?
18.工业上用电解氧化铝的方法制取单质铝的化学方程式为↑。对“电解10kg氧化铝最多可生产多少千克铝?”一题,小明和小亮两位同学分别采用了两种不同的计算方法。
小明同学的解法 小亮同学的解法
解:设铝的质量为。 ↑ 204 108 10kg 答:最多可生产5.3kg铝。 解:氧化铝中铝元素的质量分数为 。 铝的质量为o 答:最多可生产5.3kg铝。
请你完成下列问题。
(1)你认为他们的解题思路和方法都正确吗___?
(2)对“34kg过氧化氢完全分解可产生多少克氧气?”一题,你认为也能用上述两种方法解答吗__?试试看,请把你用的解法过程写出来。
19.小苏打常用作焙制高点的发酵剂。为测定某小苏打样品的纯度,现取样品10g 加热到质量不再减少(杂质不参加反应),共收集到二氧化碳2.2g,求样品中小苏打的纯度。
提示:碳酸氢钠受热分解的化学方程式:2NaHCO3Na2CO3+H2O+CO2↑
20.通过计算回答,将10g氯化钠,10g胆矾(),10g氧化钠,分别溶解在90g水中,所得溶液中溶质的质量分数是否相等____。
参考答案:
1.B
【解析】
【详解】
A、“+”应该读作“和”,“=”应该读作“生成”,应该读作,镁和氧气在点燃的条件下反应生成氧化镁,故选项说法错误。
B、由化学方程式可知,在点燃条件下,每48克镁跟32克氧气反应生成80克氧化镁,即每3克镁和2克氧气在点燃条件下生成5克氧化镁,故选项说法正确。
C、由B可知该选项说法错误。
D、由化学方程式可知,在点燃条件下,每48克镁跟32克氧气反应生成80克氧化镁,即每3份质量的镁跟2份质量的氧气在点燃的条件下反应生成5份质量的氧化镁,故选项说法错误。
故选:B。
2.C
【解析】
【详解】
根据题意,该反应的方程式为C2H6O+3O22CO2+3H2O。
A、生成物是水与二氧化碳,两者均是由两种元素组成的化合物,且其中一种是氧元素,因此都是氧化物,故A正确;
B、甲即为乙醇,则甲中碳、氢、氧三种元素的质量比=(12×2):(1×6):16=12:3:8,故B正确;
C、反应中生成丙和丁的质量比等于其相对分子质量和化学计量数乘积的比,即:(3×16)(2×44)=54:88=27:44,故C错误;
D、由反应方程式可知在该反应中,甲和乙两种物质的分子个数比为1:3,故D正确;
故选C。
3.D
【解析】
【分析】
根据质量守恒定律可知:反应后丙的质量X=4g+10g+3g+4g-6g-4g-8g=3g,乙反应前后质量减少,为反应物,甲、丁反应前后质量增加,为生成物,丙质量不变,可能为催化剂,也可能是不参与反应的杂质,该反应是乙生成甲和丁,属于分解反应。
【详解】
A、该反应为分解反应,说法正确;
B、丙可能为催化剂,说法正确;
C、参加反应的乙、丁的质量比=,说法正确;
D、生成甲、丁的质量比=,由于未知该反应的化学方程式的化学计量数,无法确定甲、丁的相对分子质量比,说法不正确;
答案:D。
4.B
【解析】
【详解】
反应2CO+O22CO2中,各物质间的质量比为,故选B。
5.B
【解析】
【分析】
甲物质的化学式为,乙物质的化学式,丙物质的化学式为
【详解】
A、根据丙的化学式,碳、氢、氧元素的质量比为,元素的质量分数最小,故错误;
B、丙物质是酒精,属于有机物,可用作溶剂和消毒剂,故正确;
C、碳、氢、氧元素的质量比为,故错误;
D、根据质量守恒定律,生成的丙和丁的分子个数比为1:1,故错误。
故选B
6.D
【解析】
【详解】
A.加热高锰酸钾制取氧气不需要催化剂,此选项错误;
B.用过氧化氢制取氧气时,过氧化氢在二氧化锰的催化作用下生成水和氧气,只有氧元素的化合价由﹣1价变成﹣2价和0价,此选项错误;
C.氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,没有氧化物生成,此选项错误;
D.由化学方程式
可知,生成等量的O2消耗KMnO4的质量最大,此选项正确。
故选D。
7.A
【解析】
【详解】
解:设C相对分子质量22,D相对分子质量9,设D质量为x, 根据质量守恒B质量为88g+36g-28g=96g,设A相对分子质量y与B的相对分子质量为z则;
故选:A。
8.C
【解析】
【分析】
由微观示意图可知甲为二氧化碳,乙为氢气,丙为甲醇,丁为水,甲乙反应物,丙丁生成物,化学方程式为CO2+3H2CH3OH+H2O 。
【详解】
A、由分析可知丙为甲醇,碳氢元素质量比为12:4=3:1,A错。
B、由分析知反应化学方程式为CO2+3H2CH3OH+H2O,反应前后分子数目减少,B错。
C、由分析知反应化学方程式为CO2+3H2CH3OH+H2O,参加反应的甲、乙的质量比为 44:6=22:3,C正确。
D、由微观示意图可知,生成物都不是一种元素组成的,是两种化合物,不符合置换反应的反应物是单质化合物,生成物是单质化合物特点,不属于置换反应,D错。
故选:C。
9.B
【解析】
【详解】
A、氢气和氧气在点燃的条件下才能生成水,不符合题意;
B、根据质量守恒定律,化学反应前后,元素的种类不变,氢、氧元素由游离态变为化合态,化合价一定发生了改变,符合题意;
C、设2g氢气消耗氧气的质量为x,参加反应的氢气与氧气的质量比为:4:32=2g:x,x=16g,故氢气剩余,不可能生成3g水,不符合题意;
D、氢气燃烧,放出大量的热,不符合题意。
故选B。
10.B
【解析】
【详解】
A、氧化汞由氧化汞分子构成,错误,不符合题意。
B、原子是化学变化中的最小微粒,在化学反应过程中原子不发生变化,因此反应前后原子的数目没有增减,正确,符合题意。
C、由图片可知反应前是由氧化汞分子变成了氧分子和汞原子,分子的种类发生了变化,错误,不符合题意。
D、生成汞和氧气的质量比是(4×201):(4×16)=201:16,错误,不符合题意。
因此本题选择B。
11. N2 13.8g
【解析】
【详解】
(1)根据质量守恒定律和给出2N2H4+N2O4=3 +4H2O,可知反应后缺少6个氮原子,是分布在三个分子中的,所以对应的是N2;
(2)设需要助燃物N2O4的质量为x
2N2H4+N2O4=3N2+4H2O
64 92
9.6kg x
64/92=9.6kg/x
x=13.8kg
答:需要助燃物N2O4的质量为13.8kg。
12. +6 10.7
【解析】
【详解】
(1)根据类似熟悉的,可快速判断铁元素的化合价为+6。
(2)根据题给文字信息和实验现象,生成的红褐色沉淀是,酚酞变红是因为生成了,气球变鼓是因为生成了一种气体,该气体根据质量守恒定律的原子种类和个数守恒判断为;最后配平,得化学方程式为:。
(3)设至少产生红褐色沉淀质量为x,根据
所以至少产生红褐色沉淀10.7kg。
13.A=6.5g,B=2.5g或A=5g,B=4g
【解析】
【详解】
由7gA和2gB或4gA和5gB充分反应都可以得到6gC,可知4gA和2gB恰好完全反应,即A和B的质量比为4g:2g=2:1,
A+B→C
2 1
当A、B恰好反应得到7.5gC时,需要A的质量为:7.5g×=5g,B的质量为:7.5g×=2.5g;9g混合物要得到7.5gC,需要B恰好为2.5gB或A恰好5g,所以有两种可能:A=6.5g,B=2.5g或A=5g,B=4g。
14. 11g
【解析】
【分析】
【详解】
(1)由题意得知镁在氮气中燃烧生成一种物质,根据质量守恒定律可以得知反应后的物质中含有氮元素和镁元素,且其中氮元素的化合价为-3价,化合物的化合价为0,故生成物的化学式为,故反应的化学方程式为。
由题意得知镁在二氧化碳中燃烧生成黑色碳粒和金属氧化物,根据质量守恒定律可以得知,金属氧化物为氧化镁,故该反应的化学方程式为。
(2)由反应方程式可知,每12份质量的碳消耗32份质量的氧气,故3g碳需只能消耗8g的氧气,氧气过量。
设生成的二氧化碳的质量为。
则生成的二氧化碳的质量为11g。
15.(1)
(2)
(3)17:9
(4)D
【解析】
(1)
氯化镁在通电的条件下反应生成镁和氯气,即,镁由镁原子构成,氯气由氯分子构成,故图中应补充1个镁原子和1个氯分子,故填: ;
(2)
向盛有足量H2O2溶液的试管中加入几滴盐酸酸化的浅绿色氯化亚铁溶液,溶液变成黄色,说明生成了氯化铁,反应物中含氢元素,则还应生成了水,则该反应为过氧化氢和氯化亚铁、盐酸反应生成氯化铁和水,该反应的化学方程式为:;
(3)
由图可知,该反应为二氧化碳和氨气在一定条件下反应生成尿素和水,该反应的化学方程式为:,故参加反应的B与生成D的质量比为:(17×2):18=17:9;
(4)
硫酸铜固体溶于水后,液面比原水平线低,是因为微粒之间存在间隔,部分铜离子和硫酸根离子扩散到了水分子的间隔中去。
故选D。
16.(1)12.5; (2)16g
【解析】
【详解】
试题分析:解:设处理上述100克废气,可得到含CaSO4 85%的粗产品x克。需要含碳酸钙80%的石灰石为Y
则:2CaCO3(粉末)+2SO2 + O2 ="==" 2CaSO4+2CO2
200 128 272
Y ×80% 6.4 x×85%
解得:Y= 12.5g x="16" (克)
答:设处理上述100克废气,需要含碳酸钙80%的石灰石为12.5g;可得到含CaSO4 85%的粗产品16克。
考点:化学计算
17.(1) +4
(2)H2O
(3)
149g
【解析】
(1)
根据化合物中各元素正负化合价代数和为0的规则,由于二氧化氯中氧元素的化合价是。设:二氧化氯中氯元素的化合价为x。
x+(2)2=0,所以x=+4。
在钠离子中,由于钠原子失去1个电子,所以质子数=11,电子数=10。钠离子的结构示意图为
(2)
根据质量守恒定律,反应前后各原子个数相等。所以
反应前钠原子1个,反应后钠原子1个;
反应前氯原子3个,反应后氯原子3个;
反应前氢原子2个,反应前氧原子1个;所以x的化学式为H2O。
(3)
解:设消耗NaClO的质量为x。
答:消耗NaClO的质量为149g。
18. 都正确 本题不能用小亮同学的方法解答
【解析】
【详解】
(1)他们的解题思路和方法都正确.因为小丽用的是“根据化学方程式的计算”,小明用的是根据元素的质量分数的计算;
(2)本题不能用小明的方法解答,因为过氧化氢完全分解后,氧元素没有都在氧气中,还有一部分在H2O中存在。
设产生氧气的质量为x,
解得:x=16kg.
答:产生氧气的质量为16kg。
19.84%
【解析】
【分析】
根据化学方程式:2NaHCO3Na2CO3+H2O+CO2↑中NaHCO3与CO2的质量关系,可先计算出NaHCO3的质量,再计算样品中小苏打的纯度;
【详解】
设样品中的小苏打碳酸氢钠的质量为x
2NaHCO3Na2CO3+H2O+CO2↑
168 44
x 2.2g
168:44=x:2.2g
x=8.4g
样品中小苏打的纯度为:×100%=84%
20.所得溶液中溶质的质量分数不相等
【解析】
【分析】
氯化钠溶于水时,溶质不变,即所得溶液中溶质的质量是,溶液的质量是,代公式求解。胆矾溶于水时,溶质不是胆矾而是硫酸铜,结晶水在溶液中成为溶剂,即所得溶液中溶质的质量等于胆矾的质量乘胆矾中硫酸铜的质量分数,溶液的质量是,代入公式求解。氧化钠溶于水时,氧化钠与水化合生成氢氧化钠,所得溶液为氢氧化钠溶液,而氢氧化钠的质量应根据化学方程式计算求得,最后求出溶质的质量分数。
【详解】
氯化钠溶液中溶质的质量分数是。;
硫酸铜的质量是;硫酸铜溶液中溶质的质量分数是;
设10g氧化钠与水反应生成氢氧化钠的质量为。
,解得。
氢氧化钠溶液中溶质的质量分数是。
则通过计算可知,所得溶液中溶质的质量分数不相等。
【点睛】
解题关键点是考虑10g物质放入水中时是否发生了变化,溶质的量是否发生了改变。
答案第1页,共2页
一、单选题
1.有关反应2Mg+O22MgO的说法正确的是
A.镁加氧气在点燃条件下生成氧化镁
B.每3克镁和2克氧气在点燃条件下生成5克氧化镁
C.每2克镁和3克氧气在点燃条件下生成5克氧化镁
D.每2份镁和1份氧气在点燃条件下生成2份氧化镁
2.在点燃条件下,甲和乙反应生成丙和丁。它们的微观结构示意图如下所示(其中“”代表氢原子,“”代表碳原子,“”代表氧原子)。下列叙述错误的是
物质 甲 乙 丙 丁
微观示意图
A.生成物均为氧化物
B.甲中碳、氢、氧三种元素的质量比为12:3:8
C.在该反应中,生成丙和丁的质量比为3:11
D.在该反应中,甲和乙的分子个数比为1:3
3.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量 变化如图。下列说法中不正确的是( )
A.该反应为分解反应 B.丙可能为该反应的催化剂
C.参加反应的乙、丁质量比为 3:2 D.丁相对分子质量是甲的 2 倍
4.在反应2CO+O22CO2中,各物质间的质量比为
A.2:1:2 B.56:32:88 C.28:32:44 D.1:1:2
5.甲和乙可以合成清洁燃料丙,微观过程如图所示。下列说法正确的是
A.丙物质中氢元素的质量分数最大 B.丙物质属于有机物,可用作溶剂和消毒剂
C.丙中C、H、O的质量比为 2∶6∶1 D.生成的丙和丁的分子个数比为1∶3
6.实验室可用“高锰酸钾、氯酸钾、双氧水”分解制取氧气。关于这三个反应原理,下列说法正确的是( )
A.都需要加催化剂
B.都有两种元素的化合价发生了变化
C.都生成氧化物
D.生成等量的O2消耗KMnO4的质量最大
7.在反应 中,28gA与一定质量的B恰好完全反应,生成88gC。若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为
A.7:8
B.8:7
C.7:24
D.24:7
8.某反应前后分子种类变化的微观示意图如下。下列说法正确的是
A.丙中碳氢元素的质量比为 4:1 B.反应前后分子总数不变
C.参加反应的甲、乙的质量比为 22:3 D.该反应属于置换反应
9.2020年5月5日,配置有氢氧发动机的长征五号B火箭,搭载我国新一代载人试验飞船顺利升空,飞船成功返回。从变化观念和平衡思想认识反应: 。下列说法正确的是
A.氢气和氧气混合生成水
B.反应前后元素种类不变、化合价改变
C.2g氢气和1g氧气反应生成3g水
D.氢气和氧气反应吸收热量
10.化学是在分子、原子层次上研究物质性质、组成、结构与变化规律的科学。下面是某反应的微观示意图,根据图示得到的信息正确的是
A.氧化汞由汞原子和氧分子构成
B.反应前后原子的数目没有增减
C.反应前后分子的种类没有改变
D.生成汞和氧气的质量比是2:1
二、填空题
11.发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧二化氮(N2O4)助燃,生成物不会对大气造成污染。
⑴反应的化学方程式为:2N2H4+N2O4="3_____" +4H2O,请在横线上填写化学式以完成该化学方程式。
⑵请计算9.6kgN2H4完全燃烧需要助燃物N2O4的质量____________。
12.高铁酸钾能溶于水,是高效、多功能水处理剂。
(1)中铁元素的化合价为_______。
(2)如图所示,将溶于水,几天后振荡、静置,再滴入酚酞,出现如图所示现象。写出与反应的化学方程式(其中与的化学计量数之比为)________。
(3)处理水时,不仅能杀菌,生成的红褐色固体还能使悬浮杂质沉降。某自来水厂每天需要使用19.8kg 处理水,至少产生红褐色沉淀_______kg。
13.已知A、B两种物质反应生成C:A+B→C.用7gA和2gB或4gA和5gB充分反应都可以得到6gC.现取A、B固体混合物共9g,充分反应后得到7.5gC.此混合物中A和B的质量分别是 ________ .
14.(1)镁是一种很活泼的金属,点燃后,它既能在氮气中燃烧,又能在二氧化碳中燃烧。已知镁在氮气中燃烧,化合生成一种物质,其中氮元素的化合价为-3价,镁在二氧化碳中燃烧,生成黑色炭粒和一种金属氧化物。试写出上述两个反应的化学方程式:______;______。
(2)3g碳在10g氧气中充分燃烧发生反应,则生成的二氧化碳的质量为______。
15.建立“宏观一微观—符号”之间的联系是学习化学的重要方法。据此回答下列问题:
(1)镁的化学性质比较活泼,因此常用电解熔融氯化镁来制取镁。如图是氯化镁在熔融状态下分解的微观示意图,请补充完整。已知:MgCl2(熔融)Mg+Cl2↑
(2)向盛有足量H2O2溶液的试管中加入几滴盐酸酸化的浅绿色氯化亚铁溶液,溶液变成黄色,请写出发生反应的化学方程式___________。
(3)我国将力争2060年前实现碳中和。工业上利用CO2作原料生产尿素是减少碳排放的措施之一,该反应的微观结构示意图如下。每消耗44gCO2涉及到的B、D质量比是___________。
(4)某兴趣小组在做硫酸铜固体溶于水的实验时,观察到如图现象。硫酸铜固体“消失”后液面比原水平线低的微观解释正确的是___________(填选项)。
A.硫酸铜具有吸水性
B.水挥发到空气中
C.粒子的体积变小了
D.粒子之间有间隔
三、简答题
16.火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2+O2==2CaSO4+2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的
石灰石多少克。
(2)处理上述100克废气,可得到含CaSO485%的粗产品多少克。
17.疫情期间,公共场所需要定时消毒,需要用二氧化氯(C1O2)、漂白剂(有效成分是NaClO)、酒精(C2H5OH)、洁厕灵(有效成分是盐酸)等药物。
(1)二氧化氯(ClO2)可用作消毒剂,氯元素的化合价为_____:钠离子的结构示意图为___。
(2)洁厕灵和漂白剂不能混合使用,二者若混合易产生一种有毒气体氯气,反应原理为,根据质量守恒定律,可推出X的化学式为__________。
(3)根据化学反应方程式计算,洁厕灵与漂白剂混用若产生了142克C12,则消耗NaClO的质量为____?
18.工业上用电解氧化铝的方法制取单质铝的化学方程式为↑。对“电解10kg氧化铝最多可生产多少千克铝?”一题,小明和小亮两位同学分别采用了两种不同的计算方法。
小明同学的解法 小亮同学的解法
解:设铝的质量为。 ↑ 204 108 10kg 答:最多可生产5.3kg铝。 解:氧化铝中铝元素的质量分数为 。 铝的质量为o 答:最多可生产5.3kg铝。
请你完成下列问题。
(1)你认为他们的解题思路和方法都正确吗___?
(2)对“34kg过氧化氢完全分解可产生多少克氧气?”一题,你认为也能用上述两种方法解答吗__?试试看,请把你用的解法过程写出来。
19.小苏打常用作焙制高点的发酵剂。为测定某小苏打样品的纯度,现取样品10g 加热到质量不再减少(杂质不参加反应),共收集到二氧化碳2.2g,求样品中小苏打的纯度。
提示:碳酸氢钠受热分解的化学方程式:2NaHCO3Na2CO3+H2O+CO2↑
20.通过计算回答,将10g氯化钠,10g胆矾(),10g氧化钠,分别溶解在90g水中,所得溶液中溶质的质量分数是否相等____。
参考答案:
1.B
【解析】
【详解】
A、“+”应该读作“和”,“=”应该读作“生成”,应该读作,镁和氧气在点燃的条件下反应生成氧化镁,故选项说法错误。
B、由化学方程式可知,在点燃条件下,每48克镁跟32克氧气反应生成80克氧化镁,即每3克镁和2克氧气在点燃条件下生成5克氧化镁,故选项说法正确。
C、由B可知该选项说法错误。
D、由化学方程式可知,在点燃条件下,每48克镁跟32克氧气反应生成80克氧化镁,即每3份质量的镁跟2份质量的氧气在点燃的条件下反应生成5份质量的氧化镁,故选项说法错误。
故选:B。
2.C
【解析】
【详解】
根据题意,该反应的方程式为C2H6O+3O22CO2+3H2O。
A、生成物是水与二氧化碳,两者均是由两种元素组成的化合物,且其中一种是氧元素,因此都是氧化物,故A正确;
B、甲即为乙醇,则甲中碳、氢、氧三种元素的质量比=(12×2):(1×6):16=12:3:8,故B正确;
C、反应中生成丙和丁的质量比等于其相对分子质量和化学计量数乘积的比,即:(3×16)(2×44)=54:88=27:44,故C错误;
D、由反应方程式可知在该反应中,甲和乙两种物质的分子个数比为1:3,故D正确;
故选C。
3.D
【解析】
【分析】
根据质量守恒定律可知:反应后丙的质量X=4g+10g+3g+4g-6g-4g-8g=3g,乙反应前后质量减少,为反应物,甲、丁反应前后质量增加,为生成物,丙质量不变,可能为催化剂,也可能是不参与反应的杂质,该反应是乙生成甲和丁,属于分解反应。
【详解】
A、该反应为分解反应,说法正确;
B、丙可能为催化剂,说法正确;
C、参加反应的乙、丁的质量比=,说法正确;
D、生成甲、丁的质量比=,由于未知该反应的化学方程式的化学计量数,无法确定甲、丁的相对分子质量比,说法不正确;
答案:D。
4.B
【解析】
【详解】
反应2CO+O22CO2中,各物质间的质量比为,故选B。
5.B
【解析】
【分析】
甲物质的化学式为,乙物质的化学式,丙物质的化学式为
【详解】
A、根据丙的化学式,碳、氢、氧元素的质量比为,元素的质量分数最小,故错误;
B、丙物质是酒精,属于有机物,可用作溶剂和消毒剂,故正确;
C、碳、氢、氧元素的质量比为,故错误;
D、根据质量守恒定律,生成的丙和丁的分子个数比为1:1,故错误。
故选B
6.D
【解析】
【详解】
A.加热高锰酸钾制取氧气不需要催化剂,此选项错误;
B.用过氧化氢制取氧气时,过氧化氢在二氧化锰的催化作用下生成水和氧气,只有氧元素的化合价由﹣1价变成﹣2价和0价,此选项错误;
C.氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,没有氧化物生成,此选项错误;
D.由化学方程式
可知,生成等量的O2消耗KMnO4的质量最大,此选项正确。
故选D。
7.A
【解析】
【详解】
解:设C相对分子质量22,D相对分子质量9,设D质量为x, 根据质量守恒B质量为88g+36g-28g=96g,设A相对分子质量y与B的相对分子质量为z则;
故选:A。
8.C
【解析】
【分析】
由微观示意图可知甲为二氧化碳,乙为氢气,丙为甲醇,丁为水,甲乙反应物,丙丁生成物,化学方程式为CO2+3H2CH3OH+H2O 。
【详解】
A、由分析可知丙为甲醇,碳氢元素质量比为12:4=3:1,A错。
B、由分析知反应化学方程式为CO2+3H2CH3OH+H2O,反应前后分子数目减少,B错。
C、由分析知反应化学方程式为CO2+3H2CH3OH+H2O,参加反应的甲、乙的质量比为 44:6=22:3,C正确。
D、由微观示意图可知,生成物都不是一种元素组成的,是两种化合物,不符合置换反应的反应物是单质化合物,生成物是单质化合物特点,不属于置换反应,D错。
故选:C。
9.B
【解析】
【详解】
A、氢气和氧气在点燃的条件下才能生成水,不符合题意;
B、根据质量守恒定律,化学反应前后,元素的种类不变,氢、氧元素由游离态变为化合态,化合价一定发生了改变,符合题意;
C、设2g氢气消耗氧气的质量为x,参加反应的氢气与氧气的质量比为:4:32=2g:x,x=16g,故氢气剩余,不可能生成3g水,不符合题意;
D、氢气燃烧,放出大量的热,不符合题意。
故选B。
10.B
【解析】
【详解】
A、氧化汞由氧化汞分子构成,错误,不符合题意。
B、原子是化学变化中的最小微粒,在化学反应过程中原子不发生变化,因此反应前后原子的数目没有增减,正确,符合题意。
C、由图片可知反应前是由氧化汞分子变成了氧分子和汞原子,分子的种类发生了变化,错误,不符合题意。
D、生成汞和氧气的质量比是(4×201):(4×16)=201:16,错误,不符合题意。
因此本题选择B。
11. N2 13.8g
【解析】
【详解】
(1)根据质量守恒定律和给出2N2H4+N2O4=3 +4H2O,可知反应后缺少6个氮原子,是分布在三个分子中的,所以对应的是N2;
(2)设需要助燃物N2O4的质量为x
2N2H4+N2O4=3N2+4H2O
64 92
9.6kg x
64/92=9.6kg/x
x=13.8kg
答:需要助燃物N2O4的质量为13.8kg。
12. +6 10.7
【解析】
【详解】
(1)根据类似熟悉的,可快速判断铁元素的化合价为+6。
(2)根据题给文字信息和实验现象,生成的红褐色沉淀是,酚酞变红是因为生成了,气球变鼓是因为生成了一种气体,该气体根据质量守恒定律的原子种类和个数守恒判断为;最后配平,得化学方程式为:。
(3)设至少产生红褐色沉淀质量为x,根据
所以至少产生红褐色沉淀10.7kg。
13.A=6.5g,B=2.5g或A=5g,B=4g
【解析】
【详解】
由7gA和2gB或4gA和5gB充分反应都可以得到6gC,可知4gA和2gB恰好完全反应,即A和B的质量比为4g:2g=2:1,
A+B→C
2 1
当A、B恰好反应得到7.5gC时,需要A的质量为:7.5g×=5g,B的质量为:7.5g×=2.5g;9g混合物要得到7.5gC,需要B恰好为2.5gB或A恰好5g,所以有两种可能:A=6.5g,B=2.5g或A=5g,B=4g。
14. 11g
【解析】
【分析】
【详解】
(1)由题意得知镁在氮气中燃烧生成一种物质,根据质量守恒定律可以得知反应后的物质中含有氮元素和镁元素,且其中氮元素的化合价为-3价,化合物的化合价为0,故生成物的化学式为,故反应的化学方程式为。
由题意得知镁在二氧化碳中燃烧生成黑色碳粒和金属氧化物,根据质量守恒定律可以得知,金属氧化物为氧化镁,故该反应的化学方程式为。
(2)由反应方程式可知,每12份质量的碳消耗32份质量的氧气,故3g碳需只能消耗8g的氧气,氧气过量。
设生成的二氧化碳的质量为。
则生成的二氧化碳的质量为11g。
15.(1)
(2)
(3)17:9
(4)D
【解析】
(1)
氯化镁在通电的条件下反应生成镁和氯气,即,镁由镁原子构成,氯气由氯分子构成,故图中应补充1个镁原子和1个氯分子,故填: ;
(2)
向盛有足量H2O2溶液的试管中加入几滴盐酸酸化的浅绿色氯化亚铁溶液,溶液变成黄色,说明生成了氯化铁,反应物中含氢元素,则还应生成了水,则该反应为过氧化氢和氯化亚铁、盐酸反应生成氯化铁和水,该反应的化学方程式为:;
(3)
由图可知,该反应为二氧化碳和氨气在一定条件下反应生成尿素和水,该反应的化学方程式为:,故参加反应的B与生成D的质量比为:(17×2):18=17:9;
(4)
硫酸铜固体溶于水后,液面比原水平线低,是因为微粒之间存在间隔,部分铜离子和硫酸根离子扩散到了水分子的间隔中去。
故选D。
16.(1)12.5; (2)16g
【解析】
【详解】
试题分析:解:设处理上述100克废气,可得到含CaSO4 85%的粗产品x克。需要含碳酸钙80%的石灰石为Y
则:2CaCO3(粉末)+2SO2 + O2 ="==" 2CaSO4+2CO2
200 128 272
Y ×80% 6.4 x×85%
解得:Y= 12.5g x="16" (克)
答:设处理上述100克废气,需要含碳酸钙80%的石灰石为12.5g;可得到含CaSO4 85%的粗产品16克。
考点:化学计算
17.(1) +4
(2)H2O
(3)
149g
【解析】
(1)
根据化合物中各元素正负化合价代数和为0的规则,由于二氧化氯中氧元素的化合价是。设:二氧化氯中氯元素的化合价为x。
x+(2)2=0,所以x=+4。
在钠离子中,由于钠原子失去1个电子,所以质子数=11,电子数=10。钠离子的结构示意图为
(2)
根据质量守恒定律,反应前后各原子个数相等。所以
反应前钠原子1个,反应后钠原子1个;
反应前氯原子3个,反应后氯原子3个;
反应前氢原子2个,反应前氧原子1个;所以x的化学式为H2O。
(3)
解:设消耗NaClO的质量为x。
答:消耗NaClO的质量为149g。
18. 都正确 本题不能用小亮同学的方法解答
【解析】
【详解】
(1)他们的解题思路和方法都正确.因为小丽用的是“根据化学方程式的计算”,小明用的是根据元素的质量分数的计算;
(2)本题不能用小明的方法解答,因为过氧化氢完全分解后,氧元素没有都在氧气中,还有一部分在H2O中存在。
设产生氧气的质量为x,
解得:x=16kg.
答:产生氧气的质量为16kg。
19.84%
【解析】
【分析】
根据化学方程式:2NaHCO3Na2CO3+H2O+CO2↑中NaHCO3与CO2的质量关系,可先计算出NaHCO3的质量,再计算样品中小苏打的纯度;
【详解】
设样品中的小苏打碳酸氢钠的质量为x
2NaHCO3Na2CO3+H2O+CO2↑
168 44
x 2.2g
168:44=x:2.2g
x=8.4g
样品中小苏打的纯度为:×100%=84%
20.所得溶液中溶质的质量分数不相等
【解析】
【分析】
氯化钠溶于水时,溶质不变,即所得溶液中溶质的质量是,溶液的质量是,代公式求解。胆矾溶于水时,溶质不是胆矾而是硫酸铜,结晶水在溶液中成为溶剂,即所得溶液中溶质的质量等于胆矾的质量乘胆矾中硫酸铜的质量分数,溶液的质量是,代入公式求解。氧化钠溶于水时,氧化钠与水化合生成氢氧化钠,所得溶液为氢氧化钠溶液,而氢氧化钠的质量应根据化学方程式计算求得,最后求出溶质的质量分数。
【详解】
氯化钠溶液中溶质的质量分数是。;
硫酸铜的质量是;硫酸铜溶液中溶质的质量分数是;
设10g氧化钠与水反应生成氢氧化钠的质量为。
,解得。
氢氧化钠溶液中溶质的质量分数是。
则通过计算可知,所得溶液中溶质的质量分数不相等。
【点睛】
解题关键点是考虑10g物质放入水中时是否发生了变化,溶质的量是否发生了改变。
答案第1页,共2页
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
