4.1 原电池 课时作业(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1 原电池 课时作业(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 432.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:44:02 | ||
图片预览


文档简介
4.1 原电池 课时作业
一、单选题
1.银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为Ag2O+Zn+H2O=2Ag+Zn(OH)2,电池放电时,负极发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
2.下图为番茄电池装置示意图,下列说法正确的是( )
A.铜片上发生氧化反应 B.锌片质量减小,发生还原反应
C.电子由锌片通过导线流向铜片 D.该装置可将电能转化为化学能
3.有关电化学知识的描述正确的是( )
A.原电池的两极一定是由活动性不同的两种金属组成
B.一般地说,能自发进行的氧化还原反应可设计成原电池
C.CaO+H2O=Ca(OH)2可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
D.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
4.根据下图,下列判断中正确的是( )
A.烧杯a中的溶液pH升高
B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH-
C.烧杯b中发生还原反应
D.烧杯b中发生的反应为2Cl--2e-=Cl2↑
5.铅蓄电池的充放电总反应为:PbO2 + 2H2SO4 + Pb 2 PbSO4 + 2H2O 下列说法正确的是( )
A.在放电时,该电池正极上的金属铅被还原
B.在放电时,负极发生的反应是 Pb + SO42--2e-=PbSO4
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4 + 2e-=Pb + SO42-
6.电池是人类生产和生活中的重要能量来源,各式各样的电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.太阳能电池的主要材料是高纯度的二氧化硅
B.氢氧燃料电池可将热能直接转变为电能
C.铅蓄电池充电时也发生了氧化还原反应
D.氢氧燃料电池工作时,H2在负极上得到电子
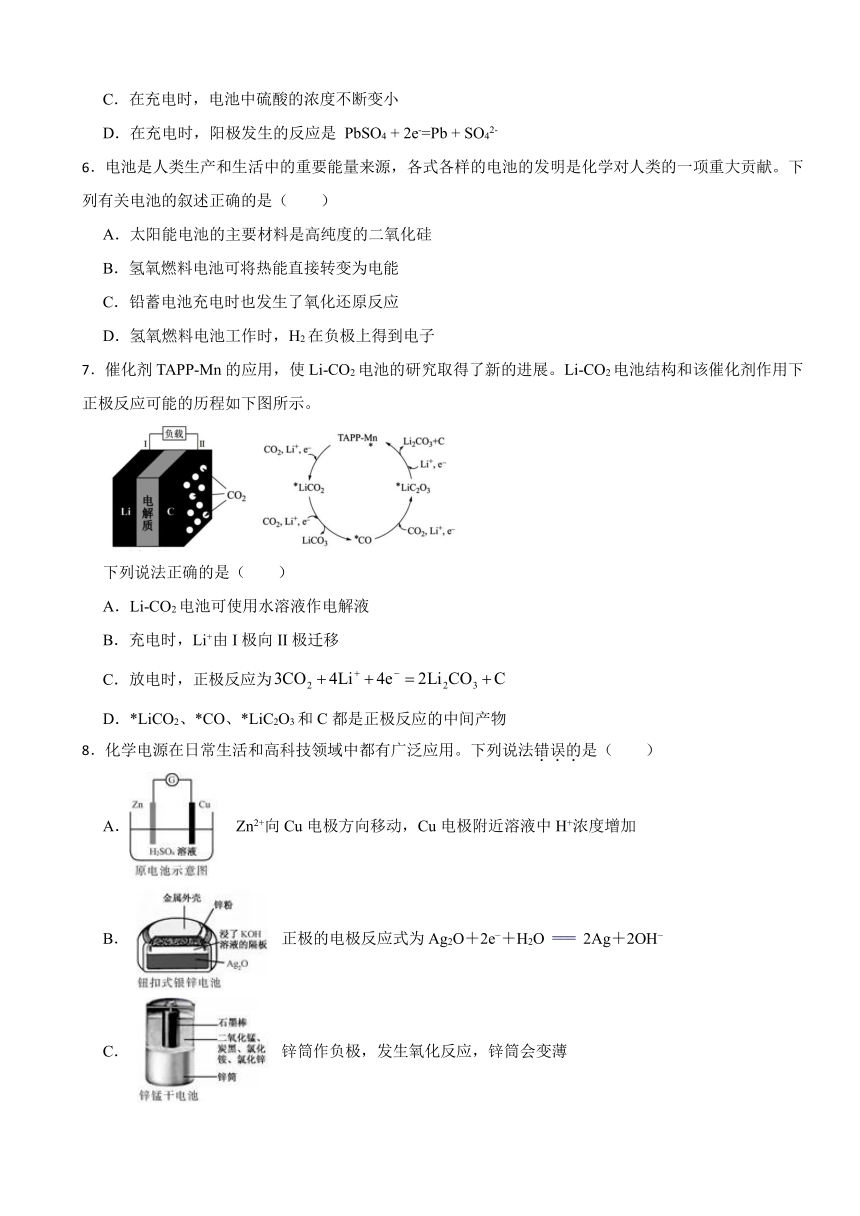
7.催化剂TAPP-Mn的应用,使Li-CO2电池的研究取得了新的进展。Li-CO2电池结构和该催化剂作用下正极反应可能的历程如下图所示。
下列说法正确的是( )
A.Li-CO2电池可使用水溶液作电解液
B.充电时,Li+由I极向II极迁移
C.放电时,正极反应为
D.*LiCO2、*CO、*LiC2O3和C都是正极反应的中间产物
8.化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A. Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e +H2O 2Ag+2OH
C. 锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
9.Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示。已知电池放电时的反应为4Li+FeS2=Fe+2Li2S。下列说法正确的是 ( )
A.Li为电池的正极
B.电池工作时,Li+向负极移动
C.正极的电极反应式为FeS2+4e-=Fe+2S2-
D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
10.某原电池结构如图所示,下列有关该原电池的说法正确的是( )
A.铜作负极被还原
B.银为正极被还原
C.电子从铜片经外电路流向银片
D.NO3-向正极移动
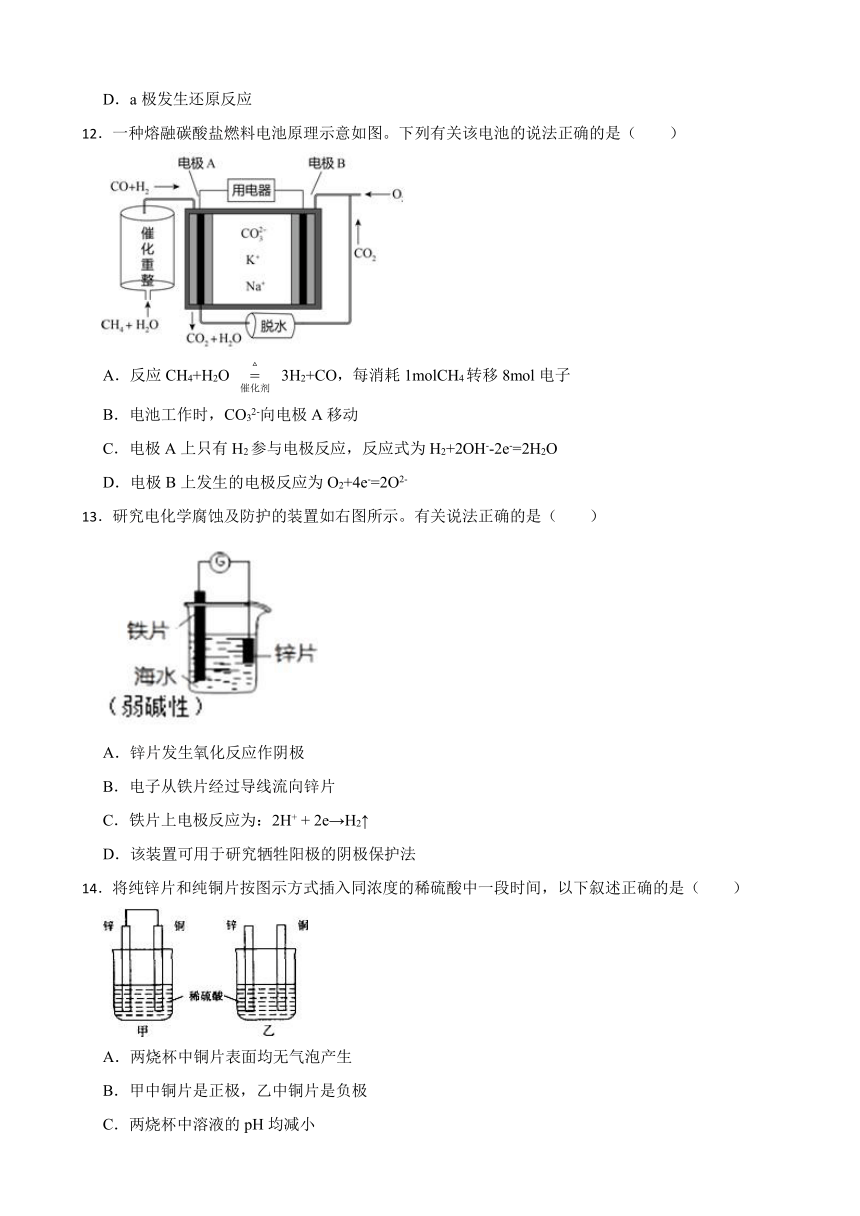
11.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质的有机溶液迁移入MnO2晶格中,生成 LiMnO2。下列说法正确的是()
A.外电路的电流方向是由 a 极流向 b 极。
B.电池b 极反应式为 MnO2+e-+Li+=LiMnO2
C.可用水代替电池中的混合有机溶剂
D.a极发生还原反应
12.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移8mol电子
B.电池工作时,CO32-向电极A移动
C.电极A上只有H2参与电极反应,反应式为H2+2OH--2e-=2H2O
D.电极B上发生的电极反应为O2+4e-=2O2-
13.研究电化学腐蚀及防护的装置如右图所示。有关说法正确的是( )
A.锌片发生氧化反应作阴极
B.电子从铁片经过导线流向锌片
C.铁片上电极反应为:2H+ + 2e→H2↑
D.该装置可用于研究牺牲阳极的阴极保护法
14.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
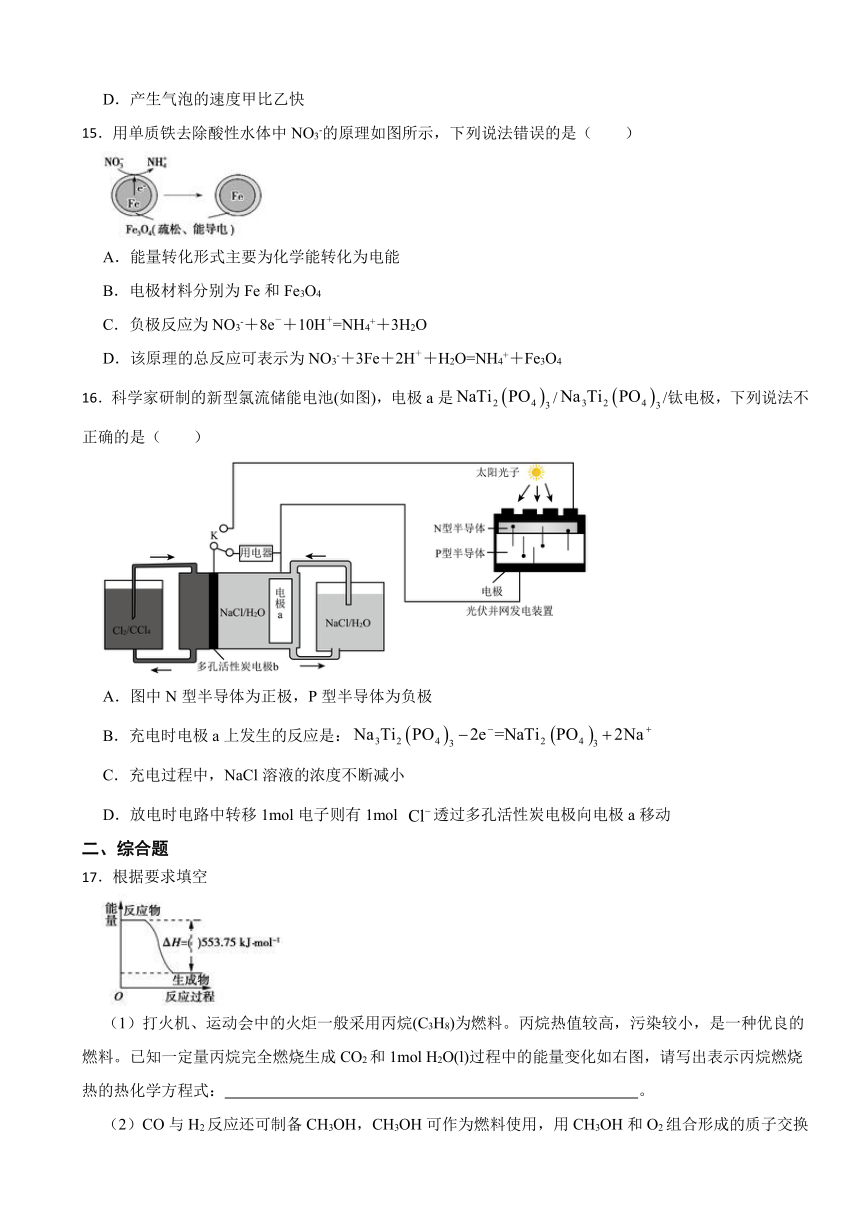
15.用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )
A.能量转化形式主要为化学能转化为电能
B.电极材料分别为Fe和Fe3O4
C.负极反应为NO3-+8e-+10H+=NH4++3H2O
D.该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4
16.科学家研制的新型氯流储能电池(如图),电极a是//钛电极,下列说法不正确的是( )
A.图中N型半导体为正极,P型半导体为负极
B.充电时电极a上发生的反应是:
C.充电过程中,NaCl溶液的浓度不断减小
D.放电时电路中转移1mol电子则有1mol 透过多孔活性炭电极向电极a移动
二、综合题
17.根据要求填空
(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化如右图,请写出表示丙烷燃烧热的热化学方程式: 。
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH= (不考虑溶液体积变化)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是 ,该反应能设计成原电池的原因是 。A是 (填物质名称)。
18.汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol 1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol 1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol 1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ·mol 1。
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a
mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K= 。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a
mol的N2、0.2mol的NO,平衡将 (填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是 (填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n
mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是
(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式: 。
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是____。
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
19.能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,旧键断裂,新键形成必然有能量变化.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要 (填“放出”或“吸收”) kJ的热量.
(2)在生产和生活中经常遇到化学能与电能的相互转化.
在如图甲、乙两装置中,甲中负极电极反应式为 ,溶液中的阴离子向 极移动(填“Zn”或“Pt”);乙中铜电极作 极,发生 反应(填“氧化”或“还原”)
20.图为CH4燃料电池的装置(A、B为多孔碳棒):
(1) (填A或B)处电极入口通甲烷,其电极反应式为 。
(2)该燃料电池工作时溶液中的K+向 (填A或B)极移动。
(3)现有500 mL KNO3和Cu(NO3)2的混合溶液,其中c(NO3-)=6.0mol·L-1,若以CH4燃料电池作为外接电源,且两极均用石墨作电极电解此混合溶液,工作一段时间后,电解池中两极均收集到22.4 L气体(标准状况,下同),则燃料电池消耗CH4体积为 L;假定电解后溶液体积仍为500 mL,原混合溶液中c(K+)为 mol·L-1。
21.我国提出2030年实现“碳达峰”,2060年实现“碳中和”,的再利用成为热门话题。回答下列问题:
(1)Ⅰ.光热化学循环分解为CO和的反应为温室气体减排提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示。
已知:,根据数据计算,分解需吸收 kJ的能量。
(2)Ⅱ.工业上可用来生产燃料甲醇,实验室模拟该过程,在体积为2L的密闭容器中,充入和,一定条件下发生反应:,测得和的浓度随时间变化如图所示:
时刻,正、逆反应速率大小:v(正) v(逆)(填“>”“=”或“<”),在0min到4min时间段, 。
(3)下列措施能增大反应速率的是 (填字母)。
a.升高温度 b.扩大容器体积
c.充入一定量氦气 d.加入催化剂
(4)能说明上述反应达到平衡状态的是 (填字母)。
a.
b.的物质的量不再变化
c.容器内气体的总质量保持不变
d.单位时间内,每生成,同时生成
e.
(5)可以作燃料电池,工作原理如图。电池放电时,应从 (填“B”或“D”)通入,该电极发生 反应(填“氧化”或“还原”),理论上每消耗转移 mol电子。
答案解析部分
1.【答案】D
【解析】【解答】原电池中正极发生还原反应,负极发生氧化反应,Zn从0价升高到+2价,失去电子,发生氧化反应,因此负极为Zn;
故答案为:D。
【分析】银锌电池放电的反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,反应中Ag化合价从+1价降低到0价,得到电子,发生还原反应,Zn从0价升高到+2价,失去电子,发生氧化反应。
2.【答案】C
【解析】【解答】铜为正极发生还原反应,锌为负极发生氧化反应,电子从负极锌片通过导线流向正极铜片,故A、B处不符合题意,C符合题意;该装置是将化学能转化为电能的装置,故D不符合题意。
【分析】关于原电池的题目,核心在于判断正负极,掌握正向正、负向负的电荷移动原理,结合核心产物与溶液环境,书写电极反应式,根据电极反应式进行计算。
3.【答案】B
【解析】【解答】A. 原电池的两极可能是由活动性不同的两种金属或金属和石墨等组成,A不符合题意;
B. 一般地说,能自发进行的氧化还原反应有电子转移,可设计成原电池,B符合题意;
C. CaO+H2O=Ca(OH)2可以放出大量的热,但该反应不是氧化还原反应,没有电子转移,不能把该反应设计成原电池,C不符合题意;
D. 某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,若装置中的盐桥中装有含琼胶的KCl饱和溶液,则会与硝酸银反应生成氯化银沉淀,会造成银离子减少,故不能装氯化钾。D不符合题意。
故答案为:B
【分析】原电池形成条件:能进行自发的氧化还原反应;两个活泼型不同的金属或者金属和非金属;电极插入电解质溶液中;构成闭合回路。
4.【答案】A
【解析】【解答】根据图中电子移动的方向判断,烧杯a为正极区,电极反应为:O2+4e-+2H2O=4OH-,烧杯a中c(OH-)增大,pH升高,故A正确,B错误;烧杯b为负极区,电极反应为:Zn-2e-=Zn2+,为氧化反应,故C、D错误。
故答案为:A
【分析】在原电池中,根据电子的流向来判断正负极,再根据正极得电子发生还原反应,负极失电子发生氧化反应,正确书写方程式即可。
5.【答案】B
【解析】【解答】A.在放电时,该电池正极上的氧化铅得电子,被还原,A不符合题意;
B.放电时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,B符合题意;
C.由充电的总反应方程式:2PbSO4+2H2O=PbO2+2H2SO4+Pb,可知充电时,硫酸的浓度增大,C不符合题意;
D.充电时,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,D不符合题意。
故答案为:B。
【分析】由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42-+2e-=2H2O+PbSO4。在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,放电时,阴离子向负极移动,阳离子向正极移动。
6.【答案】C
【解析】【解答】A.太阳能电池的主要材料是高纯度的硅,A不符合题意;
B.氢氧燃料电池可将化学能直接转变为电能,B不符合题意;
C.铅蓄电池在充电、放电时发生的反应中都有元素化合价的变化,因此发生的反应为氧化还原反应,C符合题意;
D.氢氧燃料电池工作时,H2在负极上失去电子发生氧化反应,D不符合题意;
故答案为:C。
【分析】A.二氧化硅是制备光导纤维的材料,而硅单质是制备太阳能电池板和芯片的成分
B.氢氧燃料电池是通过氢气和氧气的的电子转移将化学能转为电能
C.铅蓄电池在充电和放电时电极材料有电子的得失,发生了氧化还原反应
D.氢氧燃料电池在工作时,氢气在负极失去电子发生的是氧化反应,正极是氧气得到电子发生的还原反应
7.【答案】C
【解析】【解答】A.Li是活泼金属能与水发生反应,因此不能采用水溶液作为电解质,A不符合题意;
B.由分析知,电极I为负极,充电时连接电源负极作阴极,电极Ⅱ为正极,充电时作阳极,Li+由阳极(电极Ⅱ)移向阴极(电极I),B不符合题意;
C.由分析知C符合题意;
D.由正极的反应历程图示可知,C为最终的产物,不是中间产物,D不符合题意;
故答案为:C。
【分析】由图可知,放电时,Li作负极,电极反应式为Li e =Li+,C作正极,电极反应式为3CO2+4Li++4e ═2Li2CO3+C,电池总反应为4Li+3CO2═2Li2CO3+C,充电时,Li作阴极,C作阳极,据此作答。
8.【答案】A
【解析】【解答】A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而c(H+)减小,A项符合题意;
B. Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e +H2O 2Ag+2OH ,B项不符合题意;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项不符合题意;
D.铅蓄电池总反应式为PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项不符合题意。
故答案为:A。
【分析】A.根据原电池中离子移动是正移正,负移负,及电极反应进行判断。
9.【答案】C
【解析】【解答】A.根据总反应得到,Li为还原剂,在反应中失电子,所以Li是负极,选项A不符合题意。
B.原电池的电解质溶液内阳离子应该向正极移动,选项B不符合题意。
C.正极为FeS2得电子,生成物为单质铁,考虑到电解质为熔融的盐,可以认为生成的Li2S熔融电离为S2-,所以方程式中写成S2-,选项C符合题意。
D.单质Li与水反应,所以不可以用任何水溶液作为电解质,选项D不符合题意。
【分析】根据电池反应式知,放电时Li失电子发生氧化反应,则Li是负极,电极反应式为Li-e-=Li+,FeS2为正极,电极反应为FeS2+4e-=Fe+2S2-,放电时电解质中阳离子向正极移动、阴离子向负极移动,据此解答。
10.【答案】C
【解析】【解答】A. 铜的金属性弱于银,铜作负极被氧化,A不符合题意;
B. 银为正极,溶液中的银离子得到电子,被还原,B不符合题意;
C. 铜是负极,电子从铜片经外电路流向银片,C符合题意;
D. NO3-向负极移动,D不符合题意,
故答案为:C。
【分析】对于原电池来说:相对活泼金属做负极,化合价升高,失电子,发生氧化反应,做还原剂;化合价降低,得电子,发生还原反应,做氧化剂;电子由负极流向正极。
11.【答案】B
【解析】【解答】A.外电路中电流应由正极流向负极,即b极流向a极,故A不符合题意;
B.MnO2为正极,被还原,电极反应式为MnO2+e-+Li+=LiMnO2,故B符合题意;
C.因负极材料为Li,可与水反应,则不能用水代替电池中的混合有机溶剂,故C不符合题意;
D.a极为负极,发生氧化反应,故D不符合题意。
故答案为:B。
【分析】本题考查的是锂锰电池的结构和性质,掌握反应原理以及原电池的结构特点是解题的关键。
12.【答案】B
【解析】【解答】A.CH4→CO,化合价由-4价→+2价,上升6价,则1molCH4参加反应共转移6mol电子,A不符合题意;
B.通氧气的一极为正极,则B为正极,A为负极,原电池中阴离子向负极移动,A为负极,所以CO32-向电极A移动,B符合题意;
C.通氧气的一极为正极,则B为正极,A为负极,负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,C不符合题意;
D.B电极上氧气得电子发生还原反应O2+2CO2+4e-=2CO32-,D不符合题意。
故答案为:B。
【分析】通过氧化还原反应而产生电流的装置称为原电池,也可以说是把化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。
13.【答案】D
【解析】【解答】A、锌片比铁片活泼,根据原电池工作原理,锌片作负极,发生氧化反应,故A不符合题意;
B、根据原电池工作原理,电子从负极经外电路流向正极,即从锌片经外电路流向铁片,故B不符合题意;
C、因为环境时弱碱性,因此发生吸氧腐蚀,正极反应式:O2+2H2O+4e-=4OH-,故C不符合题意;
D、此装置保护铁不被腐蚀,根据原理,该装置课用于研究牺牲阳极的阴极保护法,故D符合题意。
故答案为:D
【分析】A、负极为较活泼的金属;
B、电子从负极流向正极;
C、吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀;
D、根据阴极铁不被腐蚀;
14.【答案】D
【解析】【解答】解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C错误;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D正确;
故选D.
【分析】甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
15.【答案】C
【解析】【解答】A.此为原电池,其能量转化形式主要为化学能转化为电能,故A符合题意;
B.由图示可知负极为Fe,正极材料Fe3O4,故B符合题意;
C.负极发生的反应为失电子的氧化反应,故C不符合题意;
D.该原电池的总反应可表示为NO3-+3Fe+2H++H2O= NH4+ +Fe3O4,故D符合题意;
故答案为:C。
【分析】构成的原电池中,铁失电子作负极生成亚铁离子;硝酸根离子在正极上得电子生成铵根离子,结合原电池原理来解答。
16.【答案】B
【解析】【解答】放电时,Cl2/CCl4为正极,反应为Cl2+2e-=2Cl-, NaTi2(PO4)3/Na3Ti2(PO4)3/钛电极为负极,反应为Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+ , 则充电时,Cl2/CCl4为阳极,连接N型半导体为正极,NaTi2(PO4)3/Na3Ti2(PO4)3/钛电极为阴极,连接P型半导体为负极;
A.结合分析,可以知道N型半导体为正极,P型半导体为负极,A错误;
B.充电时,a电极的反应为其放电时的逆反应,即NaTi2(PO4)3+2Na+ +2e-=Na3Ti2(PO4)3,B正确;
C.充电过程中,反应为2Cl--2e-=Cl2,NaTi2(PO4)3+2Na+ +2e-=Na3Ti2(PO4)3,Cl-和Na+消耗,NaCl溶液浓度减小,C错误;
D.Cl2+2e-=2Cl-,则每转移1mol电子有1mol Cl-移向a电极,D错误。
故答案为:B
【分析】A、电池的负极在充电时作为阴极,正极作为阳极,分别连接外接电源的负极和正极;
B、充电和放电的反应互为逆反应,可以利用放电时的反应判断;
C、溶液浓度的变化可以根据其溶质或者溶剂的物质的量变化判断;
D、结合化学计量数之比等于物质的量之比判断电荷和离子的物质的量。
17.【答案】(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) OH=-2215.0kJ/mol
(2)负极;CH3OH-6e-+H2O=CO2+6H+;13
(3)N2+8H++6e-=2NH4+;合成氨是放热的氧化还原反应;氯化铵
【解析】【解答】(1)丙烷燃烧的化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),由图像可知,当反应生成1molH2O(l)时放出的热量为553.75kJ/mol,因此反应生成4molH2O(l)时放出的热量为553.75kJ/mol×4=2215.0kJ/mol,因此该反应的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0kJ/mol;
(2)①由图可知,电子由电极c移动电极b,而在原电池中,电子由负极流向正极,因此c电极为负极;CH3OH在负极发生失电子的氧化反应,生成CO2,反应过程中,碳元素由-2价变为+4价,失去6个电子,电解质溶液中使用质子交换膜,只允许H+通过,因此c电极的电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
②0.56L氧气的物质的量,反应过程中转移电子数为0.025mol×4=0.1mol;电解饱和NaCl溶液时,阴极的电极反应式为2H2O+2e-=2OH-+H2↑,因此反应生成n(OH-)=0.1mol,则溶液中,因此溶液的pH=13;
(3)利用N2和H2进行的固氮反应为N2+3H2=2NH3,正极发生的是得电子的还原反应,因此正极的电极反应式为N2+8H++6e-=2NH4+,负极的电极反应式为3H2-6e-=6H+;因此可得A为NH4Cl;该反应能设计成原电池是由于合成氨的过程为放热的氧化还原反应;
【分析】(1)根据丙烷燃烧生成H2O和CO2,书写反应的化学方程式,结合生成H2O的量计算反应热;
(2)①根据电子移动方向确定正负极;根据化合价变化确定电极反应式;
②根据得失电子守恒进行计算;
(3)酸性条件下,利用N2和H2进行的固氮反应为N2+3H2+2H+=2NH4+,据此结合氧化还原反应和电化学知识进行分析;
18.【答案】(1)-746.5
(2)270;向右;CD;增大反应物浓度;增大压强
(3)CO-2e +4OH =CO32-+2H2O
(4)B
【解析】【解答】(1) 所求反应2NO(g)+2CO(g)=N2(g)+2CO2(g),用盖斯定律知其等于②×2-①-③,ΔH=ΔH2-ΔH1-ΔH3,可得ΔH=-746.5 kJ·mol 1,答案ΔH=-746.5 kJ·mol 1。(2)列出“三段式”:
2NO(g)+ 2CO(g) N2(g)+ 2CO2(g)
起始(mol) 2a+0.2 2a+0.1 0 0
转化(mol) 2a 2a a 2a
平衡(mol) 0.2 0.1 a 2a
依题意得:0.2+0.1+a+2a=0.8(2a+0.2+2a+0.1),解得:a=0.3
平衡时 0.2 0.2 0.3 0.6
①该反应的平衡常数 。平衡后在此基础上再向容器中充入2a mol的N2、0.2 mol的NO时,各物质的浓度变成了0.4、0.2、0.9、0.6。 ,Q②A项,v(CO2)消耗是向正反应方向,v(CO)生成也是向正反应方向,不能说明达到平衡状态;B项,由ρ(混合气体)=m(混合气体)/V知,密闭容器中m(混合气体)和V都不变,比值不变,即ρ(混合气体)不变,故密度不再改变不能说明达到平衡状态;C项,由M(混合气体)=m(混合气体)/n(混合气体)知,密闭容器中m(混合气体)不变,n(混合气体)向正反应方向移动时减小,向逆反应方向移动时增大,故平均相对分子质量不再改变,平衡不移动,能说明达到平衡状态;D项,NO、CO、N2、CO2的浓度不再变化是各物质的浓度保持不变,能说明达到平衡状态;E项,单位时间内生成2n mol碳氧双键即生成n mol的CO2,反应向正反应方向,同时消耗n mol N≡N即消耗n mol N2,反应向逆反应方向,但不与物质计量数成正比,故不能说明达到平衡状态。答案为CD;③根据图像知,改变某一外界条件,平衡向正反应方向移动,可增大反应物的浓度,也可增大压强。答案为增大反应物浓度 增大压强;(3)阳极是失电子的一极为CO,CO失电子后成为CO2,在KOH电解质溶液中最终生成CO ,电极反应式:CO-2e +4OH =CO +2H2O。答案为CO-2e +4OH =CO32-+2H2O;(4)A.降低温度,不能提高反应的速率,A项错误;
B.增大压强加入催化剂,可以加快化学反应速率,增大压强使平衡向着气体体积减小的方向移动,正向移动,NO的转化率增大,B项正确;
C.升高温度可以加快反应速率,但是该反应为放热反应,会减小NO的转化率,加入N2,反应逆向移动,NO转化率降低,C项错误;
D.及时将产物移走,可以增加NO的转化率,但是不能增加反应速率。答案为B。
【分析】(1)盖斯定律的主要内容是:反应热只与反应的始终态有关,而与反应经过的途径无关;
(2)①向容器中充入2a mol的N2、0.2mol的NO相当于增大了反应物的浓度,反应会向正方向进行;
②判断正逆反应达到平衡的标志是正反应和逆反应的速率达到相等;
(3)阳极失去电子,发生的是氧化反应,即一氧化碳失去电子结合氢氧根生成碳酸根和水;
(4)改变反应速率的方法有:温度、催化剂和反应物的浓度等。
19.【答案】(1)放出;5.5
(2)Zn﹣2e﹣=Zn2+;Zn;负;氧化
【解析】【解答】解:(1)氢气和碘反应生成2molHI时,旧键断裂吸收能量的值为:436kJ+151kJ=587kJ,新键生成释放能量为:299kJ×2=598kJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,放出的热量为:598KJ﹣587kJ=11kJ,生成1molHI放出5.5kJ,故答案为:放出;5.5;(2)甲中锌失电子作负极,则负极的电极反应为:Zn﹣2e﹣=Zn2+;溶液中阴离子向负极移动;乙中Al发生钝化,铜易与浓硝酸反应,铜在负极失电子被氧化,
故答案为:Zn﹣2e﹣=Zn2+;Zn;负;氧化.
【分析】(1)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应;(2)甲中锌失电子作负极;溶液中阴离子向负极移动;乙中Al发生钝化,铜易与浓硝酸反应,铜在负极失电子被氧化.
20.【答案】(1)B;CH4+10OH--8e-= CO32-+7H2O
(2)A
(3)11.2;2.0
【解析】【解答】(1) 根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以B处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,
故答案为:B;CH4-8e-+10OH-═CO32-+7H2O;(2)原电池中,阳离子通常向正极移动,所以K+向A极移动,
故答案为:A;(3) KNO3和Cu(NO3)2的混合溶液中,阳极上的电极反应式:4OH--4e-=2H2O+O2↑,当产生22.4L即1mol(标准状况)氧气时,转移电子是4mol,根据转移电子数守恒,可知原电池中甲烷转移4mol电子,根据电极反应式可知,甲烷中的碳元素的化合价由-4升高到+4,则n(CH4)=0.5mol,即标况下为11.2L;阴极上先发生电极反应:Cu2++2e-=Cu,然后是:2H++2e-=H2↑,在阴极上生成1mol的氢气时,转移电子是2mol,所以铜离子共得到电子是2mol,根据电子得失守恒:n(Cu2+)=1mol;再根据溶液中电荷守恒,在500 mL KNO3和Cu(NO3)2的混合溶液中存在关系:2c(Cu2+)+c(K+)=c(NO3-),可以求出c(K+)=2 mol·L-1 。
【分析】(1)根据原电池的工作原理及电极反应方程式书写分析解答;
(2)原电池中阳离子向正极方向移动;
(3)根据电解原理、电子守恒进行计算。
21.【答案】(1)556
(2)>;0.375
(3)ad
(4)bd
(5)B;氧化;1.2
【解析】【解答】(1)该反应△H=1598kJ/mol×2-1072kJ/mol-496kJ/mol=+556kJ/mol,则分解需吸收556kJ的能量,故答案为:556;
(2)t1时刻之后CO2的浓度继续降低,CH3OH的浓度继续增大,说明t1时刻反应未达到平衡状态,则此时v(正)> v(逆);在0min到4min时间段,CO2的浓度变化为1.00mol/L-0.50mol/L=0.50mol/L,则,故答案为:>;0.375;
(3)a.升高温度,反应速率加快,a项正确;
b.扩大容器体积,各物质的浓度减小,反应速率减小,b项不正确;
c.充入一定量氦气,体积不变,各物质的浓度也不变,反应速率不变,c项不正确;
d.加入催化剂能够增大反应速率,d项正确;
故答案为:ad;
(4)a.反应速率之比等于化学计量数之比,当v正(H2)=3v逆(CH3OH)时,反应才达到平衡状态,a项不正确;
b.H2的物质的量不再变化,说明正逆反应速率相等,反应达到平衡状态,b项正确;
c.该反应中容器内气体的总质量一直保持不变,不能说明反应达到平衡状态,c项不正确;
d.单位时间内,每生成1mol CH3OH,同时生成3mol H2,正逆反应速率相等,反应达到平衡状态,d项正确;
e.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1任何时候均成立,因此c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1不能判断反应是否达到平衡状态,e项不正确;
故答案为:bd;
(5)根据甲醇燃料电池的工作原理图可知,电子是从左边沿外接导线流向右边,CH3OH在反应中是还原剂,故可判断该电池工作时,CH3OH从B通入,为原电池负极,发生氧化反应,电极反应式为CH3OH-6e-+8OH-=+5H2O;根据负极反应式,当有32gCH3OH反应时,转移电子为6mol,所以当有6.4 g CH3OH完全反应时,转移电子物质的量应是1.2 mol,故答案为:B;氧化;1.2。
【分析】(1)△H=反应物总键能-生成物总键能;
(2)反应未达到平衡,此时正反应速率大于逆反应速率;
(3)增大化学反应速率的方法:升高温度,增大反应物的浓度,加入催化剂,增大接触面积,气体的反应压缩体积;
(4)化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
(5)燃料电池中,燃料由负极进入,发生氧化反应。
一、单选题
1.银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为Ag2O+Zn+H2O=2Ag+Zn(OH)2,电池放电时,负极发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
2.下图为番茄电池装置示意图,下列说法正确的是( )
A.铜片上发生氧化反应 B.锌片质量减小,发生还原反应
C.电子由锌片通过导线流向铜片 D.该装置可将电能转化为化学能
3.有关电化学知识的描述正确的是( )
A.原电池的两极一定是由活动性不同的两种金属组成
B.一般地说,能自发进行的氧化还原反应可设计成原电池
C.CaO+H2O=Ca(OH)2可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
D.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
4.根据下图,下列判断中正确的是( )
A.烧杯a中的溶液pH升高
B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH-
C.烧杯b中发生还原反应
D.烧杯b中发生的反应为2Cl--2e-=Cl2↑
5.铅蓄电池的充放电总反应为:PbO2 + 2H2SO4 + Pb 2 PbSO4 + 2H2O 下列说法正确的是( )
A.在放电时,该电池正极上的金属铅被还原
B.在放电时,负极发生的反应是 Pb + SO42--2e-=PbSO4
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4 + 2e-=Pb + SO42-
6.电池是人类生产和生活中的重要能量来源,各式各样的电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.太阳能电池的主要材料是高纯度的二氧化硅
B.氢氧燃料电池可将热能直接转变为电能
C.铅蓄电池充电时也发生了氧化还原反应
D.氢氧燃料电池工作时,H2在负极上得到电子
7.催化剂TAPP-Mn的应用,使Li-CO2电池的研究取得了新的进展。Li-CO2电池结构和该催化剂作用下正极反应可能的历程如下图所示。
下列说法正确的是( )
A.Li-CO2电池可使用水溶液作电解液
B.充电时,Li+由I极向II极迁移
C.放电时,正极反应为
D.*LiCO2、*CO、*LiC2O3和C都是正极反应的中间产物
8.化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A. Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e +H2O 2Ag+2OH
C. 锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
9.Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示。已知电池放电时的反应为4Li+FeS2=Fe+2Li2S。下列说法正确的是 ( )
A.Li为电池的正极
B.电池工作时,Li+向负极移动
C.正极的电极反应式为FeS2+4e-=Fe+2S2-
D.将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
10.某原电池结构如图所示,下列有关该原电池的说法正确的是( )
A.铜作负极被还原
B.银为正极被还原
C.电子从铜片经外电路流向银片
D.NO3-向正极移动
11.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质的有机溶液迁移入MnO2晶格中,生成 LiMnO2。下列说法正确的是()
A.外电路的电流方向是由 a 极流向 b 极。
B.电池b 极反应式为 MnO2+e-+Li+=LiMnO2
C.可用水代替电池中的混合有机溶剂
D.a极发生还原反应
12.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移8mol电子
B.电池工作时,CO32-向电极A移动
C.电极A上只有H2参与电极反应,反应式为H2+2OH--2e-=2H2O
D.电极B上发生的电极反应为O2+4e-=2O2-
13.研究电化学腐蚀及防护的装置如右图所示。有关说法正确的是( )
A.锌片发生氧化反应作阴极
B.电子从铁片经过导线流向锌片
C.铁片上电极反应为:2H+ + 2e→H2↑
D.该装置可用于研究牺牲阳极的阴极保护法
14.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
15.用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )
A.能量转化形式主要为化学能转化为电能
B.电极材料分别为Fe和Fe3O4
C.负极反应为NO3-+8e-+10H+=NH4++3H2O
D.该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4
16.科学家研制的新型氯流储能电池(如图),电极a是//钛电极,下列说法不正确的是( )
A.图中N型半导体为正极,P型半导体为负极
B.充电时电极a上发生的反应是:
C.充电过程中,NaCl溶液的浓度不断减小
D.放电时电路中转移1mol电子则有1mol 透过多孔活性炭电极向电极a移动
二、综合题
17.根据要求填空
(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化如右图,请写出表示丙烷燃烧热的热化学方程式: 。
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH= (不考虑溶液体积变化)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是 ,该反应能设计成原电池的原因是 。A是 (填物质名称)。
18.汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol 1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol 1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol 1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ·mol 1。
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a
mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K= 。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a
mol的N2、0.2mol的NO,平衡将 (填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是 (填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n
mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是
(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式: 。
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是____。
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
19.能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,旧键断裂,新键形成必然有能量变化.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要 (填“放出”或“吸收”) kJ的热量.
(2)在生产和生活中经常遇到化学能与电能的相互转化.
在如图甲、乙两装置中,甲中负极电极反应式为 ,溶液中的阴离子向 极移动(填“Zn”或“Pt”);乙中铜电极作 极,发生 反应(填“氧化”或“还原”)
20.图为CH4燃料电池的装置(A、B为多孔碳棒):
(1) (填A或B)处电极入口通甲烷,其电极反应式为 。
(2)该燃料电池工作时溶液中的K+向 (填A或B)极移动。
(3)现有500 mL KNO3和Cu(NO3)2的混合溶液,其中c(NO3-)=6.0mol·L-1,若以CH4燃料电池作为外接电源,且两极均用石墨作电极电解此混合溶液,工作一段时间后,电解池中两极均收集到22.4 L气体(标准状况,下同),则燃料电池消耗CH4体积为 L;假定电解后溶液体积仍为500 mL,原混合溶液中c(K+)为 mol·L-1。
21.我国提出2030年实现“碳达峰”,2060年实现“碳中和”,的再利用成为热门话题。回答下列问题:
(1)Ⅰ.光热化学循环分解为CO和的反应为温室气体减排提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示。
已知:,根据数据计算,分解需吸收 kJ的能量。
(2)Ⅱ.工业上可用来生产燃料甲醇,实验室模拟该过程,在体积为2L的密闭容器中,充入和,一定条件下发生反应:,测得和的浓度随时间变化如图所示:
时刻,正、逆反应速率大小:v(正) v(逆)(填“>”“=”或“<”),在0min到4min时间段, 。
(3)下列措施能增大反应速率的是 (填字母)。
a.升高温度 b.扩大容器体积
c.充入一定量氦气 d.加入催化剂
(4)能说明上述反应达到平衡状态的是 (填字母)。
a.
b.的物质的量不再变化
c.容器内气体的总质量保持不变
d.单位时间内,每生成,同时生成
e.
(5)可以作燃料电池,工作原理如图。电池放电时,应从 (填“B”或“D”)通入,该电极发生 反应(填“氧化”或“还原”),理论上每消耗转移 mol电子。
答案解析部分
1.【答案】D
【解析】【解答】原电池中正极发生还原反应,负极发生氧化反应,Zn从0价升高到+2价,失去电子,发生氧化反应,因此负极为Zn;
故答案为:D。
【分析】银锌电池放电的反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,反应中Ag化合价从+1价降低到0价,得到电子,发生还原反应,Zn从0价升高到+2价,失去电子,发生氧化反应。
2.【答案】C
【解析】【解答】铜为正极发生还原反应,锌为负极发生氧化反应,电子从负极锌片通过导线流向正极铜片,故A、B处不符合题意,C符合题意;该装置是将化学能转化为电能的装置,故D不符合题意。
【分析】关于原电池的题目,核心在于判断正负极,掌握正向正、负向负的电荷移动原理,结合核心产物与溶液环境,书写电极反应式,根据电极反应式进行计算。
3.【答案】B
【解析】【解答】A. 原电池的两极可能是由活动性不同的两种金属或金属和石墨等组成,A不符合题意;
B. 一般地说,能自发进行的氧化还原反应有电子转移,可设计成原电池,B符合题意;
C. CaO+H2O=Ca(OH)2可以放出大量的热,但该反应不是氧化还原反应,没有电子转移,不能把该反应设计成原电池,C不符合题意;
D. 某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,若装置中的盐桥中装有含琼胶的KCl饱和溶液,则会与硝酸银反应生成氯化银沉淀,会造成银离子减少,故不能装氯化钾。D不符合题意。
故答案为:B
【分析】原电池形成条件:能进行自发的氧化还原反应;两个活泼型不同的金属或者金属和非金属;电极插入电解质溶液中;构成闭合回路。
4.【答案】A
【解析】【解答】根据图中电子移动的方向判断,烧杯a为正极区,电极反应为:O2+4e-+2H2O=4OH-,烧杯a中c(OH-)增大,pH升高,故A正确,B错误;烧杯b为负极区,电极反应为:Zn-2e-=Zn2+,为氧化反应,故C、D错误。
故答案为:A
【分析】在原电池中,根据电子的流向来判断正负极,再根据正极得电子发生还原反应,负极失电子发生氧化反应,正确书写方程式即可。
5.【答案】B
【解析】【解答】A.在放电时,该电池正极上的氧化铅得电子,被还原,A不符合题意;
B.放电时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,B符合题意;
C.由充电的总反应方程式:2PbSO4+2H2O=PbO2+2H2SO4+Pb,可知充电时,硫酸的浓度增大,C不符合题意;
D.充电时,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,D不符合题意。
故答案为:B。
【分析】由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42-+2e-=2H2O+PbSO4。在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,放电时,阴离子向负极移动,阳离子向正极移动。
6.【答案】C
【解析】【解答】A.太阳能电池的主要材料是高纯度的硅,A不符合题意;
B.氢氧燃料电池可将化学能直接转变为电能,B不符合题意;
C.铅蓄电池在充电、放电时发生的反应中都有元素化合价的变化,因此发生的反应为氧化还原反应,C符合题意;
D.氢氧燃料电池工作时,H2在负极上失去电子发生氧化反应,D不符合题意;
故答案为:C。
【分析】A.二氧化硅是制备光导纤维的材料,而硅单质是制备太阳能电池板和芯片的成分
B.氢氧燃料电池是通过氢气和氧气的的电子转移将化学能转为电能
C.铅蓄电池在充电和放电时电极材料有电子的得失,发生了氧化还原反应
D.氢氧燃料电池在工作时,氢气在负极失去电子发生的是氧化反应,正极是氧气得到电子发生的还原反应
7.【答案】C
【解析】【解答】A.Li是活泼金属能与水发生反应,因此不能采用水溶液作为电解质,A不符合题意;
B.由分析知,电极I为负极,充电时连接电源负极作阴极,电极Ⅱ为正极,充电时作阳极,Li+由阳极(电极Ⅱ)移向阴极(电极I),B不符合题意;
C.由分析知C符合题意;
D.由正极的反应历程图示可知,C为最终的产物,不是中间产物,D不符合题意;
故答案为:C。
【分析】由图可知,放电时,Li作负极,电极反应式为Li e =Li+,C作正极,电极反应式为3CO2+4Li++4e ═2Li2CO3+C,电池总反应为4Li+3CO2═2Li2CO3+C,充电时,Li作阴极,C作阳极,据此作答。
8.【答案】A
【解析】【解答】A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而c(H+)减小,A项符合题意;
B. Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e +H2O 2Ag+2OH ,B项不符合题意;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项不符合题意;
D.铅蓄电池总反应式为PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项不符合题意。
故答案为:A。
【分析】A.根据原电池中离子移动是正移正,负移负,及电极反应进行判断。
9.【答案】C
【解析】【解答】A.根据总反应得到,Li为还原剂,在反应中失电子,所以Li是负极,选项A不符合题意。
B.原电池的电解质溶液内阳离子应该向正极移动,选项B不符合题意。
C.正极为FeS2得电子,生成物为单质铁,考虑到电解质为熔融的盐,可以认为生成的Li2S熔融电离为S2-,所以方程式中写成S2-,选项C符合题意。
D.单质Li与水反应,所以不可以用任何水溶液作为电解质,选项D不符合题意。
【分析】根据电池反应式知,放电时Li失电子发生氧化反应,则Li是负极,电极反应式为Li-e-=Li+,FeS2为正极,电极反应为FeS2+4e-=Fe+2S2-,放电时电解质中阳离子向正极移动、阴离子向负极移动,据此解答。
10.【答案】C
【解析】【解答】A. 铜的金属性弱于银,铜作负极被氧化,A不符合题意;
B. 银为正极,溶液中的银离子得到电子,被还原,B不符合题意;
C. 铜是负极,电子从铜片经外电路流向银片,C符合题意;
D. NO3-向负极移动,D不符合题意,
故答案为:C。
【分析】对于原电池来说:相对活泼金属做负极,化合价升高,失电子,发生氧化反应,做还原剂;化合价降低,得电子,发生还原反应,做氧化剂;电子由负极流向正极。
11.【答案】B
【解析】【解答】A.外电路中电流应由正极流向负极,即b极流向a极,故A不符合题意;
B.MnO2为正极,被还原,电极反应式为MnO2+e-+Li+=LiMnO2,故B符合题意;
C.因负极材料为Li,可与水反应,则不能用水代替电池中的混合有机溶剂,故C不符合题意;
D.a极为负极,发生氧化反应,故D不符合题意。
故答案为:B。
【分析】本题考查的是锂锰电池的结构和性质,掌握反应原理以及原电池的结构特点是解题的关键。
12.【答案】B
【解析】【解答】A.CH4→CO,化合价由-4价→+2价,上升6价,则1molCH4参加反应共转移6mol电子,A不符合题意;
B.通氧气的一极为正极,则B为正极,A为负极,原电池中阴离子向负极移动,A为负极,所以CO32-向电极A移动,B符合题意;
C.通氧气的一极为正极,则B为正极,A为负极,负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,C不符合题意;
D.B电极上氧气得电子发生还原反应O2+2CO2+4e-=2CO32-,D不符合题意。
故答案为:B。
【分析】通过氧化还原反应而产生电流的装置称为原电池,也可以说是把化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。
13.【答案】D
【解析】【解答】A、锌片比铁片活泼,根据原电池工作原理,锌片作负极,发生氧化反应,故A不符合题意;
B、根据原电池工作原理,电子从负极经外电路流向正极,即从锌片经外电路流向铁片,故B不符合题意;
C、因为环境时弱碱性,因此发生吸氧腐蚀,正极反应式:O2+2H2O+4e-=4OH-,故C不符合题意;
D、此装置保护铁不被腐蚀,根据原理,该装置课用于研究牺牲阳极的阴极保护法,故D符合题意。
故答案为:D
【分析】A、负极为较活泼的金属;
B、电子从负极流向正极;
C、吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀;
D、根据阴极铁不被腐蚀;
14.【答案】D
【解析】【解答】解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C错误;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D正确;
故选D.
【分析】甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
15.【答案】C
【解析】【解答】A.此为原电池,其能量转化形式主要为化学能转化为电能,故A符合题意;
B.由图示可知负极为Fe,正极材料Fe3O4,故B符合题意;
C.负极发生的反应为失电子的氧化反应,故C不符合题意;
D.该原电池的总反应可表示为NO3-+3Fe+2H++H2O= NH4+ +Fe3O4,故D符合题意;
故答案为:C。
【分析】构成的原电池中,铁失电子作负极生成亚铁离子;硝酸根离子在正极上得电子生成铵根离子,结合原电池原理来解答。
16.【答案】B
【解析】【解答】放电时,Cl2/CCl4为正极,反应为Cl2+2e-=2Cl-, NaTi2(PO4)3/Na3Ti2(PO4)3/钛电极为负极,反应为Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+ , 则充电时,Cl2/CCl4为阳极,连接N型半导体为正极,NaTi2(PO4)3/Na3Ti2(PO4)3/钛电极为阴极,连接P型半导体为负极;
A.结合分析,可以知道N型半导体为正极,P型半导体为负极,A错误;
B.充电时,a电极的反应为其放电时的逆反应,即NaTi2(PO4)3+2Na+ +2e-=Na3Ti2(PO4)3,B正确;
C.充电过程中,反应为2Cl--2e-=Cl2,NaTi2(PO4)3+2Na+ +2e-=Na3Ti2(PO4)3,Cl-和Na+消耗,NaCl溶液浓度减小,C错误;
D.Cl2+2e-=2Cl-,则每转移1mol电子有1mol Cl-移向a电极,D错误。
故答案为:B
【分析】A、电池的负极在充电时作为阴极,正极作为阳极,分别连接外接电源的负极和正极;
B、充电和放电的反应互为逆反应,可以利用放电时的反应判断;
C、溶液浓度的变化可以根据其溶质或者溶剂的物质的量变化判断;
D、结合化学计量数之比等于物质的量之比判断电荷和离子的物质的量。
17.【答案】(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) OH=-2215.0kJ/mol
(2)负极;CH3OH-6e-+H2O=CO2+6H+;13
(3)N2+8H++6e-=2NH4+;合成氨是放热的氧化还原反应;氯化铵
【解析】【解答】(1)丙烷燃烧的化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),由图像可知,当反应生成1molH2O(l)时放出的热量为553.75kJ/mol,因此反应生成4molH2O(l)时放出的热量为553.75kJ/mol×4=2215.0kJ/mol,因此该反应的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0kJ/mol;
(2)①由图可知,电子由电极c移动电极b,而在原电池中,电子由负极流向正极,因此c电极为负极;CH3OH在负极发生失电子的氧化反应,生成CO2,反应过程中,碳元素由-2价变为+4价,失去6个电子,电解质溶液中使用质子交换膜,只允许H+通过,因此c电极的电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
②0.56L氧气的物质的量,反应过程中转移电子数为0.025mol×4=0.1mol;电解饱和NaCl溶液时,阴极的电极反应式为2H2O+2e-=2OH-+H2↑,因此反应生成n(OH-)=0.1mol,则溶液中,因此溶液的pH=13;
(3)利用N2和H2进行的固氮反应为N2+3H2=2NH3,正极发生的是得电子的还原反应,因此正极的电极反应式为N2+8H++6e-=2NH4+,负极的电极反应式为3H2-6e-=6H+;因此可得A为NH4Cl;该反应能设计成原电池是由于合成氨的过程为放热的氧化还原反应;
【分析】(1)根据丙烷燃烧生成H2O和CO2,书写反应的化学方程式,结合生成H2O的量计算反应热;
(2)①根据电子移动方向确定正负极;根据化合价变化确定电极反应式;
②根据得失电子守恒进行计算;
(3)酸性条件下,利用N2和H2进行的固氮反应为N2+3H2+2H+=2NH4+,据此结合氧化还原反应和电化学知识进行分析;
18.【答案】(1)-746.5
(2)270;向右;CD;增大反应物浓度;增大压强
(3)CO-2e +4OH =CO32-+2H2O
(4)B
【解析】【解答】(1) 所求反应2NO(g)+2CO(g)=N2(g)+2CO2(g),用盖斯定律知其等于②×2-①-③,ΔH=ΔH2-ΔH1-ΔH3,可得ΔH=-746.5 kJ·mol 1,答案ΔH=-746.5 kJ·mol 1。(2)列出“三段式”:
2NO(g)+ 2CO(g) N2(g)+ 2CO2(g)
起始(mol) 2a+0.2 2a+0.1 0 0
转化(mol) 2a 2a a 2a
平衡(mol) 0.2 0.1 a 2a
依题意得:0.2+0.1+a+2a=0.8(2a+0.2+2a+0.1),解得:a=0.3
平衡时 0.2 0.2 0.3 0.6
①该反应的平衡常数 。平衡后在此基础上再向容器中充入2a mol的N2、0.2 mol的NO时,各物质的浓度变成了0.4、0.2、0.9、0.6。 ,Q
B.增大压强加入催化剂,可以加快化学反应速率,增大压强使平衡向着气体体积减小的方向移动,正向移动,NO的转化率增大,B项正确;
C.升高温度可以加快反应速率,但是该反应为放热反应,会减小NO的转化率,加入N2,反应逆向移动,NO转化率降低,C项错误;
D.及时将产物移走,可以增加NO的转化率,但是不能增加反应速率。答案为B。
【分析】(1)盖斯定律的主要内容是:反应热只与反应的始终态有关,而与反应经过的途径无关;
(2)①向容器中充入2a mol的N2、0.2mol的NO相当于增大了反应物的浓度,反应会向正方向进行;
②判断正逆反应达到平衡的标志是正反应和逆反应的速率达到相等;
(3)阳极失去电子,发生的是氧化反应,即一氧化碳失去电子结合氢氧根生成碳酸根和水;
(4)改变反应速率的方法有:温度、催化剂和反应物的浓度等。
19.【答案】(1)放出;5.5
(2)Zn﹣2e﹣=Zn2+;Zn;负;氧化
【解析】【解答】解:(1)氢气和碘反应生成2molHI时,旧键断裂吸收能量的值为:436kJ+151kJ=587kJ,新键生成释放能量为:299kJ×2=598kJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,放出的热量为:598KJ﹣587kJ=11kJ,生成1molHI放出5.5kJ,故答案为:放出;5.5;(2)甲中锌失电子作负极,则负极的电极反应为:Zn﹣2e﹣=Zn2+;溶液中阴离子向负极移动;乙中Al发生钝化,铜易与浓硝酸反应,铜在负极失电子被氧化,
故答案为:Zn﹣2e﹣=Zn2+;Zn;负;氧化.
【分析】(1)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应;(2)甲中锌失电子作负极;溶液中阴离子向负极移动;乙中Al发生钝化,铜易与浓硝酸反应,铜在负极失电子被氧化.
20.【答案】(1)B;CH4+10OH--8e-= CO32-+7H2O
(2)A
(3)11.2;2.0
【解析】【解答】(1) 根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以B处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,
故答案为:B;CH4-8e-+10OH-═CO32-+7H2O;(2)原电池中,阳离子通常向正极移动,所以K+向A极移动,
故答案为:A;(3) KNO3和Cu(NO3)2的混合溶液中,阳极上的电极反应式:4OH--4e-=2H2O+O2↑,当产生22.4L即1mol(标准状况)氧气时,转移电子是4mol,根据转移电子数守恒,可知原电池中甲烷转移4mol电子,根据电极反应式可知,甲烷中的碳元素的化合价由-4升高到+4,则n(CH4)=0.5mol,即标况下为11.2L;阴极上先发生电极反应:Cu2++2e-=Cu,然后是:2H++2e-=H2↑,在阴极上生成1mol的氢气时,转移电子是2mol,所以铜离子共得到电子是2mol,根据电子得失守恒:n(Cu2+)=1mol;再根据溶液中电荷守恒,在500 mL KNO3和Cu(NO3)2的混合溶液中存在关系:2c(Cu2+)+c(K+)=c(NO3-),可以求出c(K+)=2 mol·L-1 。
【分析】(1)根据原电池的工作原理及电极反应方程式书写分析解答;
(2)原电池中阳离子向正极方向移动;
(3)根据电解原理、电子守恒进行计算。
21.【答案】(1)556
(2)>;0.375
(3)ad
(4)bd
(5)B;氧化;1.2
【解析】【解答】(1)该反应△H=1598kJ/mol×2-1072kJ/mol-496kJ/mol=+556kJ/mol,则分解需吸收556kJ的能量,故答案为:556;
(2)t1时刻之后CO2的浓度继续降低,CH3OH的浓度继续增大,说明t1时刻反应未达到平衡状态,则此时v(正)> v(逆);在0min到4min时间段,CO2的浓度变化为1.00mol/L-0.50mol/L=0.50mol/L,则,故答案为:>;0.375;
(3)a.升高温度,反应速率加快,a项正确;
b.扩大容器体积,各物质的浓度减小,反应速率减小,b项不正确;
c.充入一定量氦气,体积不变,各物质的浓度也不变,反应速率不变,c项不正确;
d.加入催化剂能够增大反应速率,d项正确;
故答案为:ad;
(4)a.反应速率之比等于化学计量数之比,当v正(H2)=3v逆(CH3OH)时,反应才达到平衡状态,a项不正确;
b.H2的物质的量不再变化,说明正逆反应速率相等,反应达到平衡状态,b项正确;
c.该反应中容器内气体的总质量一直保持不变,不能说明反应达到平衡状态,c项不正确;
d.单位时间内,每生成1mol CH3OH,同时生成3mol H2,正逆反应速率相等,反应达到平衡状态,d项正确;
e.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1任何时候均成立,因此c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1不能判断反应是否达到平衡状态,e项不正确;
故答案为:bd;
(5)根据甲醇燃料电池的工作原理图可知,电子是从左边沿外接导线流向右边,CH3OH在反应中是还原剂,故可判断该电池工作时,CH3OH从B通入,为原电池负极,发生氧化反应,电极反应式为CH3OH-6e-+8OH-=+5H2O;根据负极反应式,当有32gCH3OH反应时,转移电子为6mol,所以当有6.4 g CH3OH完全反应时,转移电子物质的量应是1.2 mol,故答案为:B;氧化;1.2。
【分析】(1)△H=反应物总键能-生成物总键能;
(2)反应未达到平衡,此时正反应速率大于逆反应速率;
(3)增大化学反应速率的方法:升高温度,增大反应物的浓度,加入催化剂,增大接触面积,气体的反应压缩体积;
(4)化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
(5)燃料电池中,燃料由负极进入,发生氧化反应。
