2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 (共27张PPT)3-2-1分子晶体
文档属性
| 名称 | 2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 (共27张PPT)3-2-1分子晶体 |  | |
| 格式 | pptx | ||
| 文件大小 | 18.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:34:03 | ||
图片预览






文档简介
(共27张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时 分子晶体
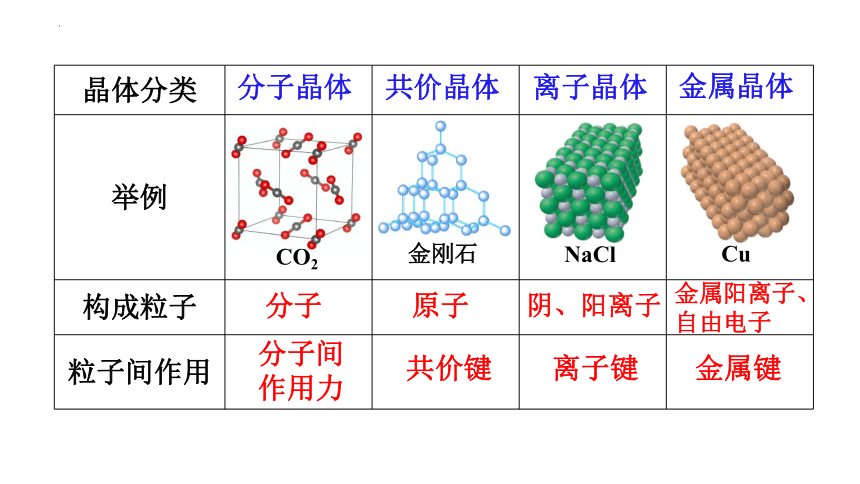
晶体分类
举例
构成粒子
粒子间作用
离子晶体
共价晶体
分子晶体
金属晶体
CO2
NaCl
Cu
金刚石
分子
原子
阴、阳离子
金属阳离子、自由电子
分子间作用力
共价键
离子键
金属键
一、分子晶体
1、概念:
只含分子的晶体称为分子晶体。
2、构成粒子及粒子间的相互作用
分子
分子间作用力
分子晶体
构成粒子:
粒子间的作用力:
分子内各原子间:
共价键
稀有气体是单原子分子,无化学键,只有分子间作用力。
(稀有气体除外)
所有分子晶体中是否均存在化学键?为什么?
3、典型的分子晶体
(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX···
(2)部分非金属单质:
X2(卤素)、O2、H2、S8、P4、C60、稀有气体等
(B、Si、金刚石等除外)
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等
注意:SiO2 是共价晶体!
(4)几乎所有的酸: H2SO4、HNO3、H3PO4、H2SiO3等
(5)绝大多数有机物:乙醇、冰醋酸、蔗糖等
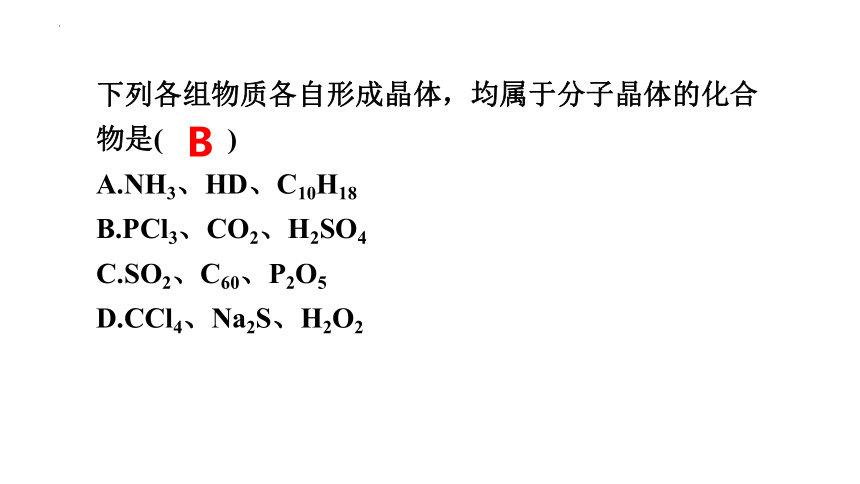
下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H18
B.PCl3、CO2、H2SO4
C.SO2、C60、P2O5
D.CCl4、Na2S、H2O2
B
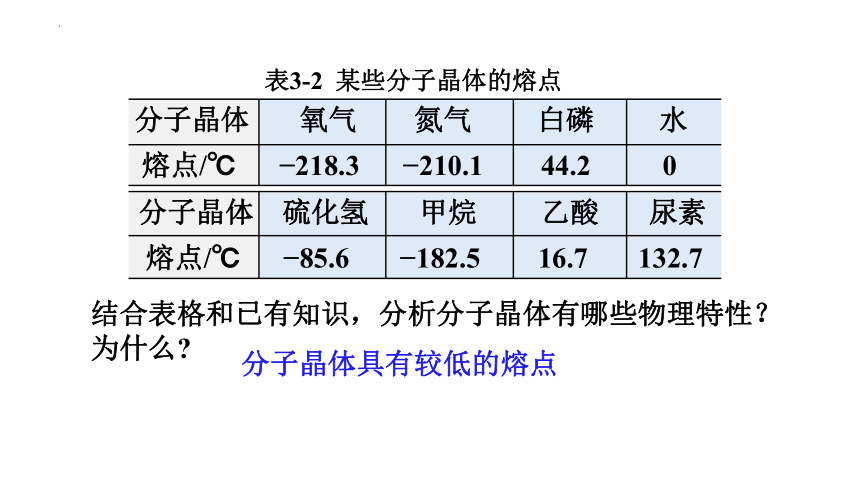
表3-2 某些分子晶体的熔点
分子晶体 氧气 氮气 白磷 水
熔点/℃ 218.3 210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ 85.6 182.5 16.7 132.7
结合表格和已有知识,分析分子晶体有哪些物理特性?为什么
分子晶体具有较低的熔点
4、分子晶体的物理性质
(1)熔、沸点较低,硬度小
分子晶体熔化时破坏的是分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,且硬度较小。
(2)不导电
(3)溶解性遵循“相似相溶”原理
构成分子晶体的微粒都是分子,在熔融状态下没有产生自由移动的离子。
1、正误判断
(1)组成分子晶体的微粒是分子,在分子晶体中一定存在共价键和分子间作用力 ( )
(2)分子晶体熔化时一定破坏范德华力,有些分子晶体还会破坏氢键 ( )
(3)分子晶体熔化或溶于水均不导电 ( )
(4)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大( )
(5)水分子间存在着氢键,故水分子较稳定( )
(6)H2SO4为强电解质,硫酸晶体是能导电的( )
(7)SiCl4晶体是分子晶体,熔点高于CCl4( )
×
√
×
×
×
×
√
知识回顾
熔沸点的比较:
(1)分子间作用力越强,熔沸点越高。
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高。
②若分子间存在氢键,则分子间作用力较大,熔沸点较高。
如熔沸点:I2 > Br2 > Cl2 > F2
如熔沸点:H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
(2)相对分子质量相近时,分子极性越大,熔沸点越高。
(3)有机物的同分异构体中,支链数越多,熔沸点越低。
如沸点:正戊烷>异戊烷>新戊烷
如沸点:CO>N2
适用于分子晶体
2、下列性质适合于分子晶体的是( )
①熔点1 070 ℃,易溶于水,水溶液导电
②熔点10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3
A.①② B.①③ C.②③ D.②④
C
晶体是由内部微粒(原子、离子或分子)在三维空间里呈周期性重复排列而构成的具有规则几何外形的固体。
那么构成分子晶体的内部微粒——分子,是以怎样的方式有序排列的呢?
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
0
1
4
3
2
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
12
分子密堆积
冰的结构
3、冰晶体中,每个水分子周围有____个紧邻的水分子;
4、和干冰晶体一样吗?若不一样,可能的原因是什么?
流
交
与
考
思
1
2
3
4
4
水分子间存在氢键,氢键具有方向性,每个H2O都与4个相邻的H2O相互吸引,构成四面体。
分子非密堆积
5、分子晶体的微粒堆积方式
密堆积 非密堆积
微粒间作用力
空间 特点
举例
范德华力
通常每个分子周围
最多有12个紧邻的分子
如:C60、干冰 、I2、O2
范德华力、氢键
每个分子周围紧邻的分子数小于12
如:HF 、NH3、冰
CO2
O2
C60
冰的结构
想
想
一
1、冰晶体中1 mol H2O最多有______mol 氢键。
2
想
想
一
2、冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
由于氢键的方向性,使冰晶体中每个H2O与四面体顶角方向的4个相邻H2O相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,冰会浮在水面上。
想
想
一
3、为什么水在4℃时的密度最大?
T/℃ 0℃ 4℃ 20℃ 100℃
ρ/g·cm-3 0.999841 1.000000 0.998203 0.958354
当冰刚刚融化为液体水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。
想
想
一
4、H2S和水分子结构相似,但H2S晶体中,一个H2S分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
H2S晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个H2S分子周围有12分紧邻分子。
冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的四个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
科学 技术 社会
天然气水合物——一种潜在的能源
20世纪末,科学家发现海底存在大量天然气水合物晶体。其主要气体成分是甲烷,称甲烷水合物,外形像冰,在常温常压下会迅速分解释放出甲烷又称“可燃冰”。
干冰易升华
2Mg + CO2 = 2MgO + C
点燃
镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成
资料卡片P80
1. 下列有关分子晶体的说法一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积
B
2、 正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。下列有关说法正确的是( )
A.正硼酸晶体不属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
D
3、据报道,科研人员应用计算机模拟出结构类似C60的物质N60。已知:
①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;
②N—N的键能为167 kJ·mol-1。
请回答下列问题:
(1)N60分子组成的晶体为____晶体,其熔、沸点比N2
____(填“高”或“低”),原因是____________________
分子
高
N60、N2均为分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时 分子晶体
晶体分类
举例
构成粒子
粒子间作用
离子晶体
共价晶体
分子晶体
金属晶体
CO2
NaCl
Cu
金刚石
分子
原子
阴、阳离子
金属阳离子、自由电子
分子间作用力
共价键
离子键
金属键
一、分子晶体
1、概念:
只含分子的晶体称为分子晶体。
2、构成粒子及粒子间的相互作用
分子
分子间作用力
分子晶体
构成粒子:
粒子间的作用力:
分子内各原子间:
共价键
稀有气体是单原子分子,无化学键,只有分子间作用力。
(稀有气体除外)
所有分子晶体中是否均存在化学键?为什么?
3、典型的分子晶体
(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX···
(2)部分非金属单质:
X2(卤素)、O2、H2、S8、P4、C60、稀有气体等
(B、Si、金刚石等除外)
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等
注意:SiO2 是共价晶体!
(4)几乎所有的酸: H2SO4、HNO3、H3PO4、H2SiO3等
(5)绝大多数有机物:乙醇、冰醋酸、蔗糖等
下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H18
B.PCl3、CO2、H2SO4
C.SO2、C60、P2O5
D.CCl4、Na2S、H2O2
B
表3-2 某些分子晶体的熔点
分子晶体 氧气 氮气 白磷 水
熔点/℃ 218.3 210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ 85.6 182.5 16.7 132.7
结合表格和已有知识,分析分子晶体有哪些物理特性?为什么
分子晶体具有较低的熔点
4、分子晶体的物理性质
(1)熔、沸点较低,硬度小
分子晶体熔化时破坏的是分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,且硬度较小。
(2)不导电
(3)溶解性遵循“相似相溶”原理
构成分子晶体的微粒都是分子,在熔融状态下没有产生自由移动的离子。
1、正误判断
(1)组成分子晶体的微粒是分子,在分子晶体中一定存在共价键和分子间作用力 ( )
(2)分子晶体熔化时一定破坏范德华力,有些分子晶体还会破坏氢键 ( )
(3)分子晶体熔化或溶于水均不导电 ( )
(4)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大( )
(5)水分子间存在着氢键,故水分子较稳定( )
(6)H2SO4为强电解质,硫酸晶体是能导电的( )
(7)SiCl4晶体是分子晶体,熔点高于CCl4( )
×
√
×
×
×
×
√
知识回顾
熔沸点的比较:
(1)分子间作用力越强,熔沸点越高。
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高。
②若分子间存在氢键,则分子间作用力较大,熔沸点较高。
如熔沸点:I2 > Br2 > Cl2 > F2
如熔沸点:H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
(2)相对分子质量相近时,分子极性越大,熔沸点越高。
(3)有机物的同分异构体中,支链数越多,熔沸点越低。
如沸点:正戊烷>异戊烷>新戊烷
如沸点:CO>N2
适用于分子晶体
2、下列性质适合于分子晶体的是( )
①熔点1 070 ℃,易溶于水,水溶液导电
②熔点10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3
A.①② B.①③ C.②③ D.②④
C
晶体是由内部微粒(原子、离子或分子)在三维空间里呈周期性重复排列而构成的具有规则几何外形的固体。
那么构成分子晶体的内部微粒——分子,是以怎样的方式有序排列的呢?
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
0
1
4
3
2
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
干冰晶胞
1、每个干冰晶胞中有____个CO2分子;
2、每个CO2分子周围等距紧邻的CO2分子有____个。
4
流
交
与
考
思
用假想的直线将晶体中的微粒中心连接起来
x
y
z
12
分子密堆积
冰的结构
3、冰晶体中,每个水分子周围有____个紧邻的水分子;
4、和干冰晶体一样吗?若不一样,可能的原因是什么?
流
交
与
考
思
1
2
3
4
4
水分子间存在氢键,氢键具有方向性,每个H2O都与4个相邻的H2O相互吸引,构成四面体。
分子非密堆积
5、分子晶体的微粒堆积方式
密堆积 非密堆积
微粒间作用力
空间 特点
举例
范德华力
通常每个分子周围
最多有12个紧邻的分子
如:C60、干冰 、I2、O2
范德华力、氢键
每个分子周围紧邻的分子数小于12
如:HF 、NH3、冰
CO2
O2
C60
冰的结构
想
想
一
1、冰晶体中1 mol H2O最多有______mol 氢键。
2
想
想
一
2、冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
由于氢键的方向性,使冰晶体中每个H2O与四面体顶角方向的4个相邻H2O相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,冰会浮在水面上。
想
想
一
3、为什么水在4℃时的密度最大?
T/℃ 0℃ 4℃ 20℃ 100℃
ρ/g·cm-3 0.999841 1.000000 0.998203 0.958354
当冰刚刚融化为液体水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。
想
想
一
4、H2S和水分子结构相似,但H2S晶体中,一个H2S分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
H2S晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个H2S分子周围有12分紧邻分子。
冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的四个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
科学 技术 社会
天然气水合物——一种潜在的能源
20世纪末,科学家发现海底存在大量天然气水合物晶体。其主要气体成分是甲烷,称甲烷水合物,外形像冰,在常温常压下会迅速分解释放出甲烷又称“可燃冰”。
干冰易升华
2Mg + CO2 = 2MgO + C
点燃
镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成
资料卡片P80
1. 下列有关分子晶体的说法一定正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积
B
2、 正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。下列有关说法正确的是( )
A.正硼酸晶体不属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
D
3、据报道,科研人员应用计算机模拟出结构类似C60的物质N60。已知:
①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;
②N—N的键能为167 kJ·mol-1。
请回答下列问题:
(1)N60分子组成的晶体为____晶体,其熔、沸点比N2
____(填“高”或“低”),原因是____________________
分子
高
N60、N2均为分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
