2023-2024学年高二下学期化学人教版(2019)选择性必修2课件(共22张PPT) 1-1-1能层与能级
文档属性
| 名称 | 2023-2024学年高二下学期化学人教版(2019)选择性必修2课件(共22张PPT) 1-1-1能层与能级 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:31:13 | ||
图片预览



文档简介
(共22张PPT)
第一章 原子结构与性质
第一节 原子结构
第1课时 能层与能级 原子光谱
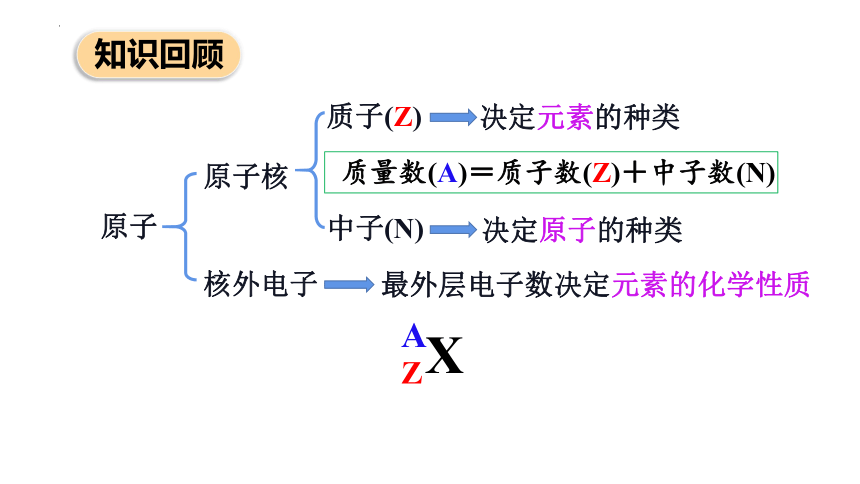
原子核
核外电子
原子
知识回顾
质子(Z)
中子(N)
X
A
Z
质量数(A)=质子数(Z)+中子数(N)
决定元素的种类
决定原子的种类
最外层电子数决定元素的化学性质
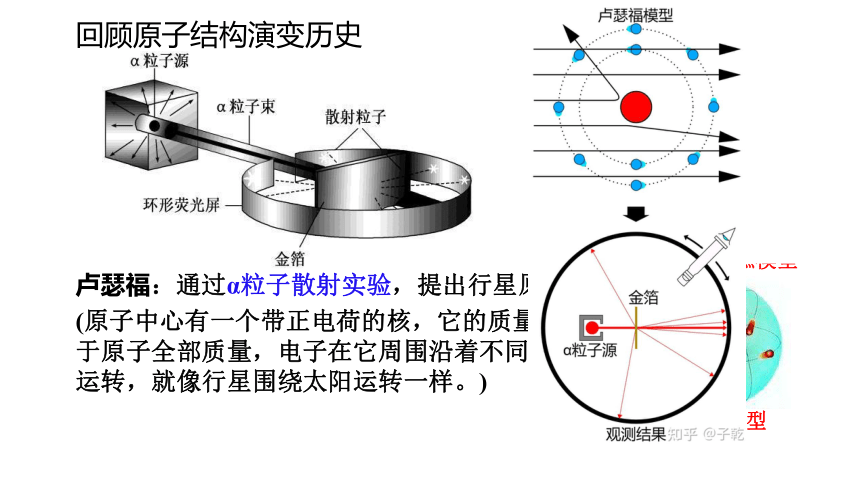
卢瑟福:通过α粒子散射实验,提出行星原子模型。
(原子中心有一个带正电荷的核,它的质量几乎等于原子全部质量,电子在它周围沿着不同的轨道运转,就像行星围绕太阳运转一样。)
行星模型
道尔顿:提出原子概念,并认为原子结构是坚实、不可再分的实心球。
实心球模型
汤姆孙:发现电子,并认为原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子中和了正电荷。
葡萄干蛋糕模型
回顾原子结构演变历史
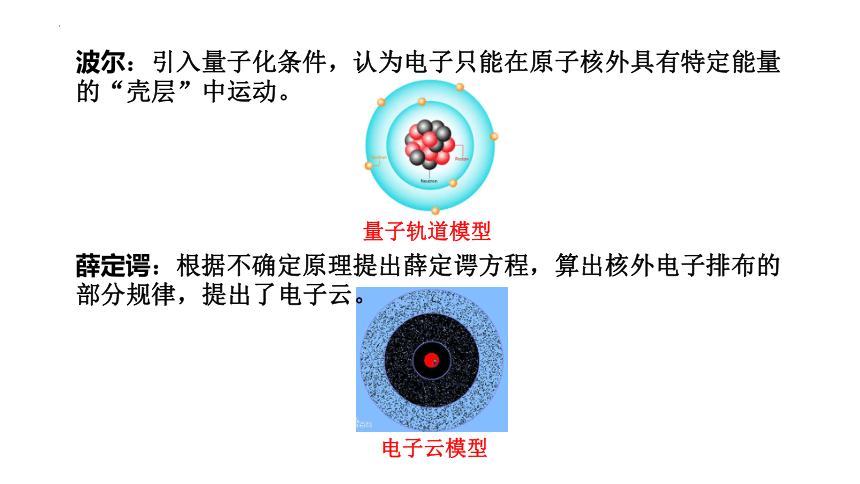
量子轨道模型
电子云模型
波尔:引入量子化条件,认为电子只能在原子核外具有特定能量的“壳层”中运动。
薛定谔:根据不确定原理提出薛定谔方程,算出核外电子排布的部分规律,提出了电子云。
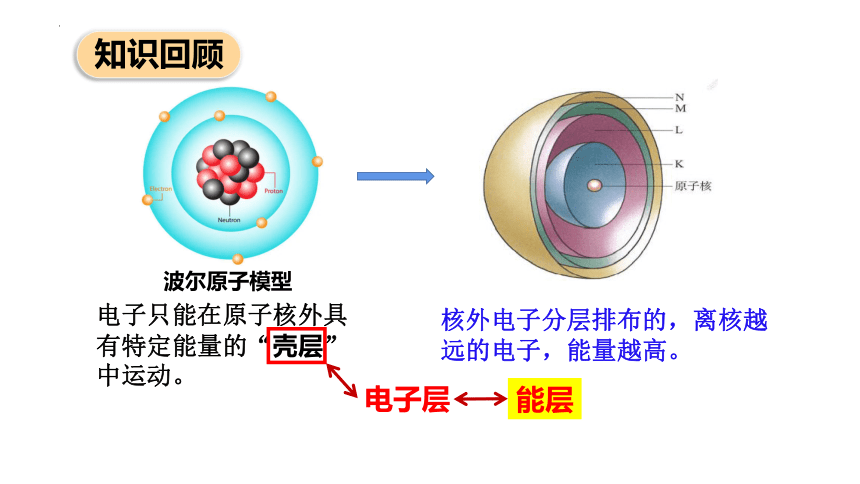
核外电子分层排布的,离核越远的电子,能量越高。
知识回顾
波尔原子模型
电子只能在原子核外具有特定能量的“壳层”中运动。
电子层
能层
任务一:认识能层
能层:多电子原子核外电子的能量是不同的,核外电子按能量不同分成能层。
能层 一 二 三 四 五 六 七
符号
最多可容纳电子数
K L M N O P Q
第 n 层最多可容纳的电子数为 2n2
2 8 18 32 50 72 98
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
能层的高低顺序为:
离原子核越近,能量越低。
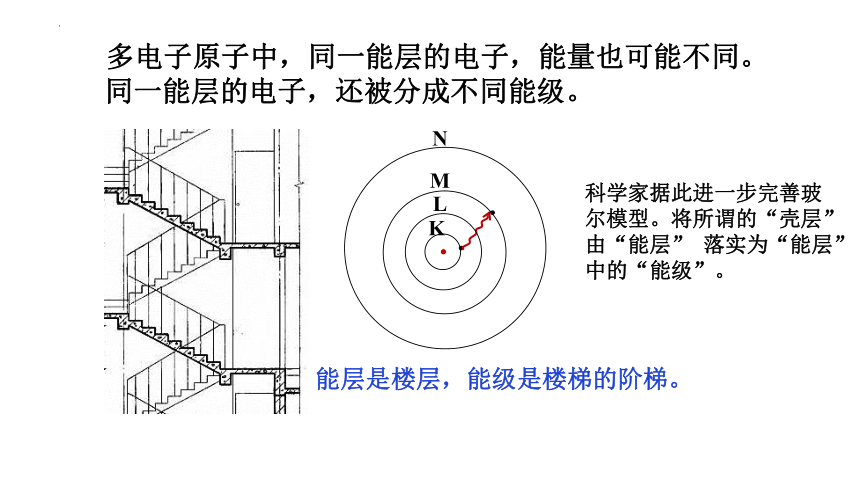
多电子原子中,同一能层的电子,能量也可能不同。
同一能层的电子,还被分成不同能级。
能层是楼层,能级是楼梯的阶梯。
K
L
M
N
科学家据此进一步完善玻尔模型。将所谓的“壳层”由“能层” 落实为“能层”中的“能级”。
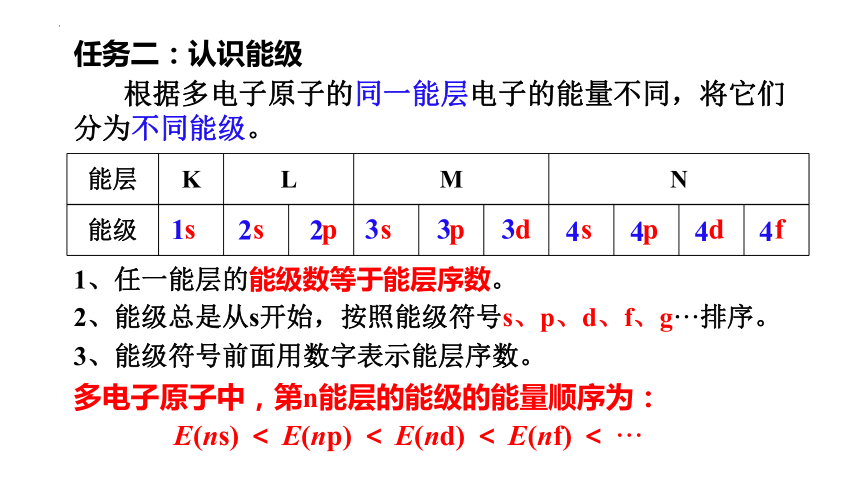
任务二:认识能级
能层 K L M N
根据多电子原子的同一能层电子的能量不同,将它们分为不同能级。
1、任一能层的能级数等于能层序数。
2、能级总是从s开始,按照能级符号s、p、d、f、g···排序。
3、能级符号前面用数字表示能层序数。
能级
s s p s p d s p d f
1
2 2
3 3 3
4 4 4 4
多电子原子中,第n能层的能级的能量顺序为:
E(ns) < E(np) < E(nd) < E(nf) < ···
任务二:认识能级
能层 K L M N
最多电子数
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数
根据多电子原子的同一能层电子的能量不同,将它们分为不同能级。
2 8 18 32
2
2
6
2
6
10
2
6
10
14
4、s、p、d、f ···能级可容纳的最多电子数依次为自然数奇数序列1,3,5,7···的2倍。
交
与
考
思
流
(2)第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?
第五能层最多容纳50个电子,分别容纳在五个能级中:
5s 5p 5d 5f 5g
2 6 10 14 18
1、(1)3d、4d、5d能级所能容纳的最多电子数是否相同?
相同
2、(1)以s能级为例,不同能层的s能级间能量有何关系?
交
与
考
思
流
(2)同一能层不同能级间能量有何关系?
E(1s)<E(2s)<E(3s)<E(4s)……
E(ns)<E(np)<E(nd)<E(nf)……
1、判断正误
(1)2d表示L层上的d能级( )
(2)同一原子中,1s、2s、3s电子的能量逐渐减小( )
(3)4s、4p、4d、4f能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f) ( )
×
×
√
2、下列能级符号错误的是( )A. 5p B. 3f C. 2s D. 4d
B
3、下列有关认识中正确的是( )
A. 各能层的能级都是从 s 能级开始至 f 能级结束
B. 各能层含有的能级数为 n-1
C. 各能层含有的电子数为 2n2
D. 在同一能层不同能级上的电子,其能量肯定不同
D
问题:研究核外电子排布的实验依据是什么?
光谱:按照一定能量次序排列的光带
可见光光谱:可以被人眼观察到的光带
紫外光光谱
红外光光谱
研究发现,每种元素的原子也会有特定的光谱现象。
氢原子光谱
对氢气放电管通电,氢气会解离成气态氢原子,继续通电,氢原子会发出紫色的光。当产生的光透过棱镜,就会得到一条由4条颜色不同的谱线组成的光谱。
不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
E0
E1
E2
E3
En
基态能级
激发态能级
吸收能量
电子跃迁
释放能量
电子跃迁
处于最低能量状态的原子叫做基态原子。基态原子吸收能量后,它的电子会跃迁到较高能级变为激发态原子。
电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量。
光(辐射)是电子跃迁释放能量的重要形式。光的波长可用两个轨道的能量差计算。
电子的跃迁是物理变化!
任务三:认识原子光谱
不同原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种原子的发射光谱或吸收光谱,总称原子光谱。
一种元素有一种原子光谱,一种原子光谱对应着一种元素,所以,可以用光谱分析法鉴定元素。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
暗背景+亮线+线状不连续
亮背景+暗线+线状不连续
同种元素发射光谱中的彩色亮线和吸收光谱中的暗线处于相同位置。
电子跃迁的形式
(1)电子吸收能量→从低能级跃迁至较高能级→吸收光谱。
(2)电子从高能级跃迁到低能级→释放能量→发射光谱。
原子光谱的应用1:发现新元素
He 氦
原子光谱的应用2:检验元素
焰色试验
基态原子吸收能量,电子从基态跃迁到激发态后,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将能量以光的形式释放出来。
焰色试验属于发射光谱。
原子光谱的应用3:焰火、激光、荧光、LED灯光
充有氖气的霓虹灯能发出红光:通电后在电场作用下,放电管里氖原子中的电子吸收能量后跃迁到能量较高的能级,且处在能量较高的能级上的电子会很快地以光的形式释放能量而跃迁回能量较低的能级上,该光的波长恰好处于可见光区域中的红色波段。
1、下列叙述正确的是( )A.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动B.处于最低能量的原子叫激发态原子C.电子仅在激发态跃迁到基态时才会产生原子光谱D.利用光谱上的特征谱线,可以鉴定元素,也可以发现元素
D
2、电子由3d能级跃迁至4p能级时,可通过光谱仪得到( )
A.电子的运动轨迹图像 B.原子的吸收光谱
C.电子体积大小的图像 D.原子的发射光谱
B
第一章 原子结构与性质
第一节 原子结构
第1课时 能层与能级 原子光谱
原子核
核外电子
原子
知识回顾
质子(Z)
中子(N)
X
A
Z
质量数(A)=质子数(Z)+中子数(N)
决定元素的种类
决定原子的种类
最外层电子数决定元素的化学性质
卢瑟福:通过α粒子散射实验,提出行星原子模型。
(原子中心有一个带正电荷的核,它的质量几乎等于原子全部质量,电子在它周围沿着不同的轨道运转,就像行星围绕太阳运转一样。)
行星模型
道尔顿:提出原子概念,并认为原子结构是坚实、不可再分的实心球。
实心球模型
汤姆孙:发现电子,并认为原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子中和了正电荷。
葡萄干蛋糕模型
回顾原子结构演变历史
量子轨道模型
电子云模型
波尔:引入量子化条件,认为电子只能在原子核外具有特定能量的“壳层”中运动。
薛定谔:根据不确定原理提出薛定谔方程,算出核外电子排布的部分规律,提出了电子云。
核外电子分层排布的,离核越远的电子,能量越高。
知识回顾
波尔原子模型
电子只能在原子核外具有特定能量的“壳层”中运动。
电子层
能层
任务一:认识能层
能层:多电子原子核外电子的能量是不同的,核外电子按能量不同分成能层。
能层 一 二 三 四 五 六 七
符号
最多可容纳电子数
K L M N O P Q
第 n 层最多可容纳的电子数为 2n2
2 8 18 32 50 72 98
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
能层的高低顺序为:
离原子核越近,能量越低。
多电子原子中,同一能层的电子,能量也可能不同。
同一能层的电子,还被分成不同能级。
能层是楼层,能级是楼梯的阶梯。
K
L
M
N
科学家据此进一步完善玻尔模型。将所谓的“壳层”由“能层” 落实为“能层”中的“能级”。
任务二:认识能级
能层 K L M N
根据多电子原子的同一能层电子的能量不同,将它们分为不同能级。
1、任一能层的能级数等于能层序数。
2、能级总是从s开始,按照能级符号s、p、d、f、g···排序。
3、能级符号前面用数字表示能层序数。
能级
s s p s p d s p d f
1
2 2
3 3 3
4 4 4 4
多电子原子中,第n能层的能级的能量顺序为:
E(ns) < E(np) < E(nd) < E(nf) < ···
任务二:认识能级
能层 K L M N
最多电子数
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数
根据多电子原子的同一能层电子的能量不同,将它们分为不同能级。
2 8 18 32
2
2
6
2
6
10
2
6
10
14
4、s、p、d、f ···能级可容纳的最多电子数依次为自然数奇数序列1,3,5,7···的2倍。
交
与
考
思
流
(2)第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?
第五能层最多容纳50个电子,分别容纳在五个能级中:
5s 5p 5d 5f 5g
2 6 10 14 18
1、(1)3d、4d、5d能级所能容纳的最多电子数是否相同?
相同
2、(1)以s能级为例,不同能层的s能级间能量有何关系?
交
与
考
思
流
(2)同一能层不同能级间能量有何关系?
E(1s)<E(2s)<E(3s)<E(4s)……
E(ns)<E(np)<E(nd)<E(nf)……
1、判断正误
(1)2d表示L层上的d能级( )
(2)同一原子中,1s、2s、3s电子的能量逐渐减小( )
(3)4s、4p、4d、4f能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f) ( )
×
×
√
2、下列能级符号错误的是( )A. 5p B. 3f C. 2s D. 4d
B
3、下列有关认识中正确的是( )
A. 各能层的能级都是从 s 能级开始至 f 能级结束
B. 各能层含有的能级数为 n-1
C. 各能层含有的电子数为 2n2
D. 在同一能层不同能级上的电子,其能量肯定不同
D
问题:研究核外电子排布的实验依据是什么?
光谱:按照一定能量次序排列的光带
可见光光谱:可以被人眼观察到的光带
紫外光光谱
红外光光谱
研究发现,每种元素的原子也会有特定的光谱现象。
氢原子光谱
对氢气放电管通电,氢气会解离成气态氢原子,继续通电,氢原子会发出紫色的光。当产生的光透过棱镜,就会得到一条由4条颜色不同的谱线组成的光谱。
不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
E0
E1
E2
E3
En
基态能级
激发态能级
吸收能量
电子跃迁
释放能量
电子跃迁
处于最低能量状态的原子叫做基态原子。基态原子吸收能量后,它的电子会跃迁到较高能级变为激发态原子。
电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量。
光(辐射)是电子跃迁释放能量的重要形式。光的波长可用两个轨道的能量差计算。
电子的跃迁是物理变化!
任务三:认识原子光谱
不同原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种原子的发射光谱或吸收光谱,总称原子光谱。
一种元素有一种原子光谱,一种原子光谱对应着一种元素,所以,可以用光谱分析法鉴定元素。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
暗背景+亮线+线状不连续
亮背景+暗线+线状不连续
同种元素发射光谱中的彩色亮线和吸收光谱中的暗线处于相同位置。
电子跃迁的形式
(1)电子吸收能量→从低能级跃迁至较高能级→吸收光谱。
(2)电子从高能级跃迁到低能级→释放能量→发射光谱。
原子光谱的应用1:发现新元素
He 氦
原子光谱的应用2:检验元素
焰色试验
基态原子吸收能量,电子从基态跃迁到激发态后,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将能量以光的形式释放出来。
焰色试验属于发射光谱。
原子光谱的应用3:焰火、激光、荧光、LED灯光
充有氖气的霓虹灯能发出红光:通电后在电场作用下,放电管里氖原子中的电子吸收能量后跃迁到能量较高的能级,且处在能量较高的能级上的电子会很快地以光的形式释放能量而跃迁回能量较低的能级上,该光的波长恰好处于可见光区域中的红色波段。
1、下列叙述正确的是( )A.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动B.处于最低能量的原子叫激发态原子C.电子仅在激发态跃迁到基态时才会产生原子光谱D.利用光谱上的特征谱线,可以鉴定元素,也可以发现元素
D
2、电子由3d能级跃迁至4p能级时,可通过光谱仪得到( )
A.电子的运动轨迹图像 B.原子的吸收光谱
C.电子体积大小的图像 D.原子的发射光谱
B
