2023-2024学年高二下学期化学人教版(2019)选择性必修2课件(共25张PPT) 1-1-4泡利原理、洪特规则、能量最低原理
文档属性
| 名称 | 2023-2024学年高二下学期化学人教版(2019)选择性必修2课件(共25张PPT) 1-1-4泡利原理、洪特规则、能量最低原理 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:32:50 | ||
图片预览



文档简介
(共25张PPT)
第一章 原子结构与性质
第一节 原子结构
第4课时 泡利原理、洪特规则、能量最低原理
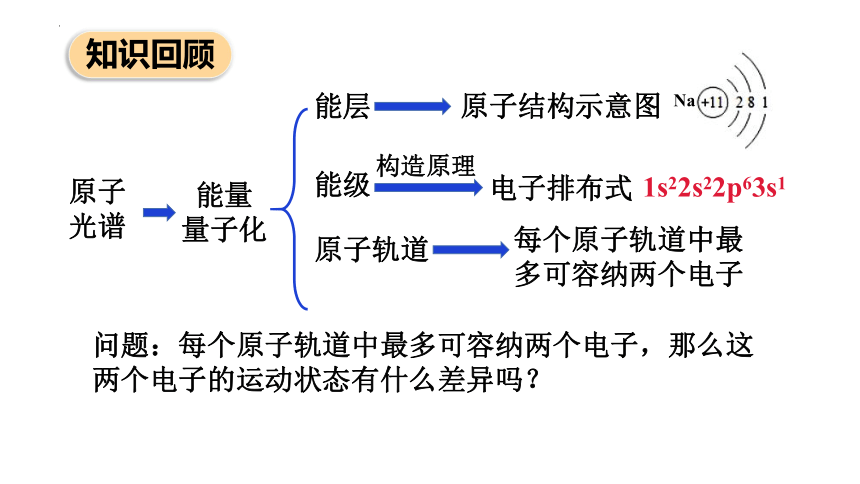
原子
光谱
能量
量子化
能级
知识回顾
能层
原子结构示意图
构造原理
问题:每个原子轨道中最多可容纳两个电子,那么这两个电子的运动状态有什么差异吗?
原子轨道
电子排布式
Na
1s22s22p63s1
每个原子轨道中最多可容纳两个电子
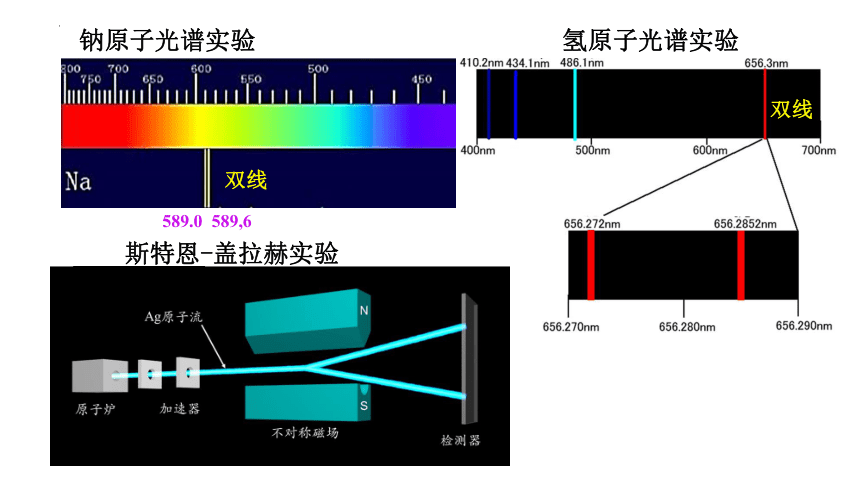
钠原子光谱实验
589.0 589,6
双线
氢原子光谱实验
双线
斯特恩-盖拉赫实验
地球公转示意图
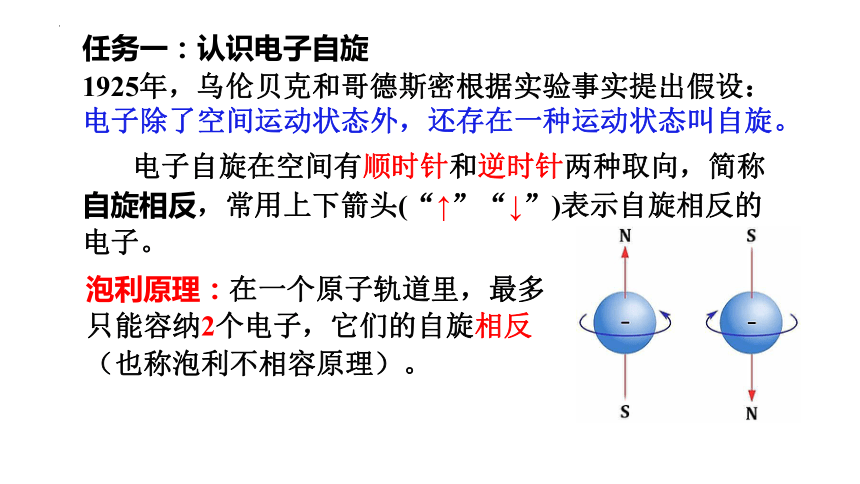
1925年,乌伦贝克和哥德斯密根据实验事实提出假设:
电子除了空间运动状态外,还存在一种运动状态叫自旋。
任务一:认识电子自旋
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(“↑”“↓”)表示自旋相反的电子。
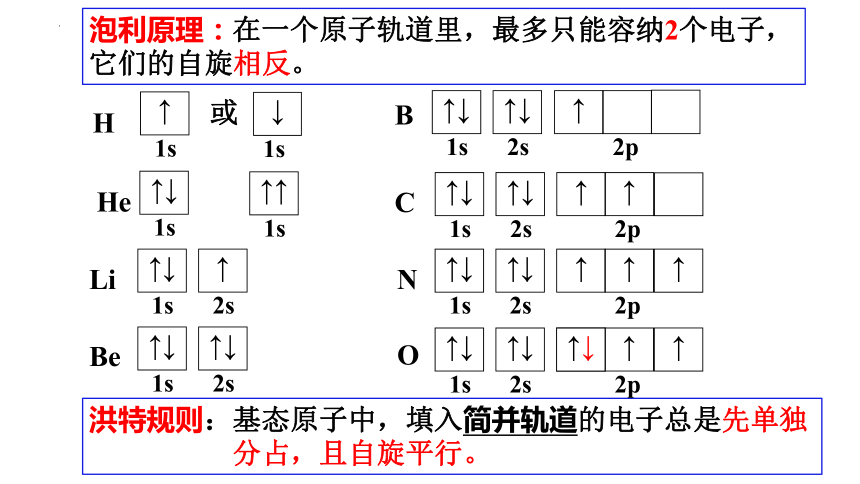
泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反(也称泡利不相容原理)。
任务一:认识电子自旋
1925年,乌伦贝克和哥德斯密根据实验事实提出假设:
电子除了空间运动状态外,还存在一种运动状态叫自旋。
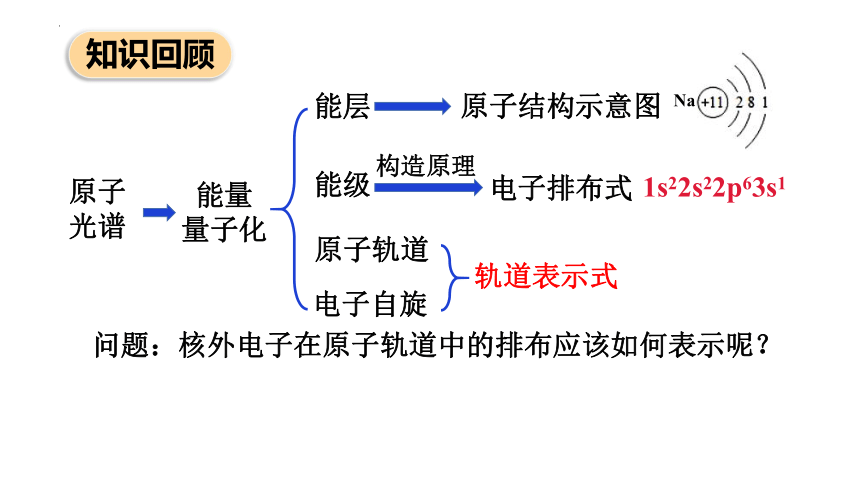
原子
光谱
能量
量子化
能级
知识回顾
能层
原子结构示意图
构造原理
原子轨道
电子排布式
Na
1s22s22p63s1
电子自旋
问题:核外电子在原子轨道中的排布应该如何表示呢?
轨道表示式
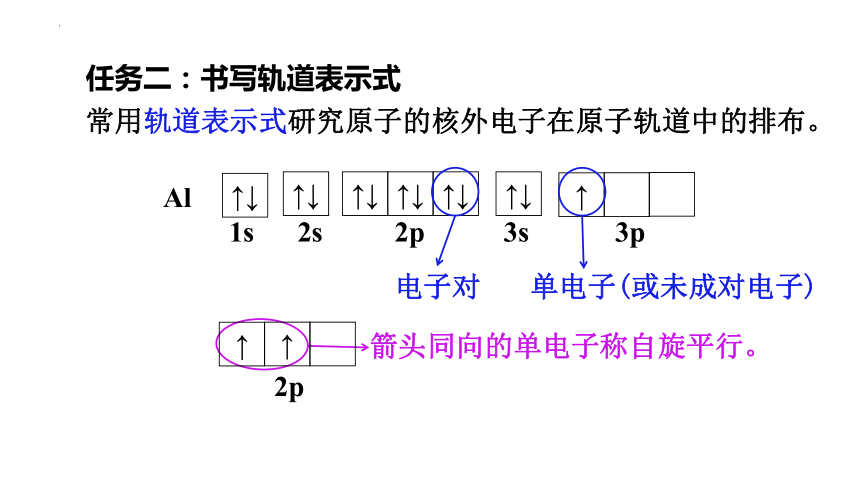
任务二:书写轨道表示式
常用轨道表示式研究原子的核外电子在原子轨道中的排布。
1、用方框(或圆圈)表示原子轨道,能量相同的原子轨道(简并轨道)的方框相连。
2、各轨道按照离核由近到远,从左到右依次排列,且在方框的下方用能级符号表示轨道所属能级。
3、用箭头表示处于特定自旋方向的电子。
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
Al
↑
任务二:书写轨道表示式
常用轨道表示式研究原子的核外电子在原子轨道中的排布。
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
Al
↑
电子对
单电子(或未成对电子)
箭头同向的单电子称自旋平行。
↑
↑
2p
H
He
↑↓
1s
↑↑
1s
Li
Be
↑↓
1s
↑
2s
↑↓
1s
↑↓
2s
问题:轨道表示式按照什么规则书写呢?
泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反。
↑
1s
↓
1s
或
B
C
N
↑↓
1s
↑↓
2s
↑
2p
↑↓
1s
↑↓
2s
↑
2p
↑
洪特规则:基态原子中,填入简并轨道的电子总是先单独 分占,且自旋平行。
↑↓
1s
↑↓
2s
↑
2p
↑
↑
O
↑↓
1s
↑↓
2s
↑
2p
↑
↑
↑↓
写写9-18号原子的轨道表示式。
Ne 1s22s22p6
F 1s22s22p5
Mg 1s22s22p63s2
Na 1s22s22p63s1
↑↓ ↑↓ ↑↓ ↑↓ ↑
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p
1s 2s 2p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s
Al 1s22s22p63s23p1
Ar 1s22s22p63s23p6
Cl 1s22s22p63s23p5
S 1s22s22p63s23p4
P 1s22s22p63s23p3
Si 1s22s22p63s23p2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p
Ca [Ar]4s2
K [Ar]4s1
V [Ar]3d34s2
Ti [Ar]3d24s2
Sc [Ar]3d14s2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
Cr [Ar]3d54s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s
Co [Ar]3d74s2
Fe [Ar]3d64s2
Mn [Ar]3d54s2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
Ni [Ar]4s2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
Zn [Ar]3d104s2
Cu [Ar]3d104s1
Ga [Ar]3d104s24p1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s 4p
Ge 1s22s22p63s23p63d104s24p2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p 3d 4s 4p
Kr 1s22s22p63s23p63d104s24p6
Br 1s22s22p63s23p63d104s24p5
As 1s22s22p63s23p63d104s24p3
Se 1s22s22p63s23p63d104s24p4
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s 4p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p 3d 4s 4p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s 4p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p 3d 4s 4p
洪特规则不仅适用于基态原子,也适用于基态离子。
试写出Fe3+和Cl-的轨道表示式。
Fe3+
Cl-
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d
[Ar]3d5
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p
[Ne]3s23p6
Cr [Ar]3d54s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s
Cu [Ar]3d104s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s
光谱实验发现,能量相同的简并轨道在全满、半满和全空条件时,体系能量较低,原子较稳定。
Cr [Ar]3d54s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s
3d简并轨道半满
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
3d简并轨道没有半满或全满
Cr [Ar]3d44s2
Cu [Ar]3d104s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
3d简并轨道全满
3d简并轨道没有半满或全满
Cu [Ar]3d94s2
能量最低原理 :
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
实际上,整个原子的能量是由核电荷数、电子数和电子状态三个因素共同决定。
当相邻能级能量差别不大时,有1-2个电子填入能量稍高的能级可能反而降低电子排斥能,进而使原子整体能量最低。例如,所有副族元素的基态原子。
基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
1.下列轨道表示式中哪个是氧的基态原子?为什么?
A.
B.
C.
2.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是_____,违反泡利原理的是_____。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:
④Fe:1s22s22p63s23p63d64s2 ⑤Mg2+:1s22s22p6
⑥C:
①④⑤
②
③
⑥
任务三:总结基态原子核外电子排布的表示方法
表示方法 以硫(S)为例
原子结构示意图
电子式
电子排布式 电子排布式
简化电子排布式
价电子排布式
轨道表示式 轨道表示式
价电子轨道表示式
1s22s22p63s23p4
[Ne]3s23p4
3s23p4
1.下列化学用语的表达正确的是( )
A.原子核内有10个中子的氧原子:
B.氯原子的结构示意图:
C.Fe3+的最外层电子排布式:3s23p63d5
D.基态铜原子的价层电子轨道表示式:
C
2.按要求完成下列填空:
(1)11Na的电子排布式为____________;
(2)20Ca的价层电子排布式为____;
(3)35Br-的离子结构示意图为__________;
(4)8O的轨道表示式为__________________________;
(5)9F的价层轨道表示式为____________________。
1s22s22p63s1
4s2
第一章 原子结构与性质
第一节 原子结构
第4课时 泡利原理、洪特规则、能量最低原理
原子
光谱
能量
量子化
能级
知识回顾
能层
原子结构示意图
构造原理
问题:每个原子轨道中最多可容纳两个电子,那么这两个电子的运动状态有什么差异吗?
原子轨道
电子排布式
Na
1s22s22p63s1
每个原子轨道中最多可容纳两个电子
钠原子光谱实验
589.0 589,6
双线
氢原子光谱实验
双线
斯特恩-盖拉赫实验
地球公转示意图
1925年,乌伦贝克和哥德斯密根据实验事实提出假设:
电子除了空间运动状态外,还存在一种运动状态叫自旋。
任务一:认识电子自旋
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(“↑”“↓”)表示自旋相反的电子。
泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反(也称泡利不相容原理)。
任务一:认识电子自旋
1925年,乌伦贝克和哥德斯密根据实验事实提出假设:
电子除了空间运动状态外,还存在一种运动状态叫自旋。
原子
光谱
能量
量子化
能级
知识回顾
能层
原子结构示意图
构造原理
原子轨道
电子排布式
Na
1s22s22p63s1
电子自旋
问题:核外电子在原子轨道中的排布应该如何表示呢?
轨道表示式
任务二:书写轨道表示式
常用轨道表示式研究原子的核外电子在原子轨道中的排布。
1、用方框(或圆圈)表示原子轨道,能量相同的原子轨道(简并轨道)的方框相连。
2、各轨道按照离核由近到远,从左到右依次排列,且在方框的下方用能级符号表示轨道所属能级。
3、用箭头表示处于特定自旋方向的电子。
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
Al
↑
任务二:书写轨道表示式
常用轨道表示式研究原子的核外电子在原子轨道中的排布。
↑↓
1s 2s 2p 3s 3p
↑↓
↑↓
↑↓
↑↓
↑↓
Al
↑
电子对
单电子(或未成对电子)
箭头同向的单电子称自旋平行。
↑
↑
2p
H
He
↑↓
1s
↑↑
1s
Li
Be
↑↓
1s
↑
2s
↑↓
1s
↑↓
2s
问题:轨道表示式按照什么规则书写呢?
泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反。
↑
1s
↓
1s
或
B
C
N
↑↓
1s
↑↓
2s
↑
2p
↑↓
1s
↑↓
2s
↑
2p
↑
洪特规则:基态原子中,填入简并轨道的电子总是先单独 分占,且自旋平行。
↑↓
1s
↑↓
2s
↑
2p
↑
↑
O
↑↓
1s
↑↓
2s
↑
2p
↑
↑
↑↓
写写9-18号原子的轨道表示式。
Ne 1s22s22p6
F 1s22s22p5
Mg 1s22s22p63s2
Na 1s22s22p63s1
↑↓ ↑↓ ↑↓ ↑↓ ↑
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p
1s 2s 2p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s
Al 1s22s22p63s23p1
Ar 1s22s22p63s23p6
Cl 1s22s22p63s23p5
S 1s22s22p63s23p4
P 1s22s22p63s23p3
Si 1s22s22p63s23p2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p
Ca [Ar]4s2
K [Ar]4s1
V [Ar]3d34s2
Ti [Ar]3d24s2
Sc [Ar]3d14s2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
Cr [Ar]3d54s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s
Co [Ar]3d74s2
Fe [Ar]3d64s2
Mn [Ar]3d54s2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
Ni [Ar]4s2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
Zn [Ar]3d104s2
Cu [Ar]3d104s1
Ga [Ar]3d104s24p1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s 4p
Ge 1s22s22p63s23p63d104s24p2
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p 3d 4s 4p
Kr 1s22s22p63s23p63d104s24p6
Br 1s22s22p63s23p63d104s24p5
As 1s22s22p63s23p63d104s24p3
Se 1s22s22p63s23p63d104s24p4
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s 4p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
1s 2s 2p 3s 3p 3d 4s 4p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s 4p
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p 3d 4s 4p
洪特规则不仅适用于基态原子,也适用于基态离子。
试写出Fe3+和Cl-的轨道表示式。
Fe3+
Cl-
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d
[Ar]3d5
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
1s 2s 2p 3s 3p
[Ne]3s23p6
Cr [Ar]3d54s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s
Cu [Ar]3d104s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s
光谱实验发现,能量相同的简并轨道在全满、半满和全空条件时,体系能量较低,原子较稳定。
Cr [Ar]3d54s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑ ↑
1s 2s 2p 3s 3p 3d 4s
3d简并轨道半满
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
3d简并轨道没有半满或全满
Cr [Ar]3d44s2
Cu [Ar]3d104s1
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
1s 2s 2p 3s 3p 3d 4s
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑↓
1s 2s 2p 3s 3p 3d 4s
3d简并轨道全满
3d简并轨道没有半满或全满
Cu [Ar]3d94s2
能量最低原理 :
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
实际上,整个原子的能量是由核电荷数、电子数和电子状态三个因素共同决定。
当相邻能级能量差别不大时,有1-2个电子填入能量稍高的能级可能反而降低电子排斥能,进而使原子整体能量最低。例如,所有副族元素的基态原子。
基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
1.下列轨道表示式中哪个是氧的基态原子?为什么?
A.
B.
C.
2.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是_____,违反泡利原理的是_____。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:
④Fe:1s22s22p63s23p63d64s2 ⑤Mg2+:1s22s22p6
⑥C:
①④⑤
②
③
⑥
任务三:总结基态原子核外电子排布的表示方法
表示方法 以硫(S)为例
原子结构示意图
电子式
电子排布式 电子排布式
简化电子排布式
价电子排布式
轨道表示式 轨道表示式
价电子轨道表示式
1s22s22p63s23p4
[Ne]3s23p4
3s23p4
1.下列化学用语的表达正确的是( )
A.原子核内有10个中子的氧原子:
B.氯原子的结构示意图:
C.Fe3+的最外层电子排布式:3s23p63d5
D.基态铜原子的价层电子轨道表示式:
C
2.按要求完成下列填空:
(1)11Na的电子排布式为____________;
(2)20Ca的价层电子排布式为____;
(3)35Br-的离子结构示意图为__________;
(4)8O的轨道表示式为__________________________;
(5)9F的价层轨道表示式为____________________。
1s22s22p63s1
4s2
