2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 2-2-1多样的分子空间结构(共21张PPT)
文档属性
| 名称 | 2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 2-2-1多样的分子空间结构(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:29:08 | ||
图片预览




文档简介
(共21张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 多样的分子空间结构
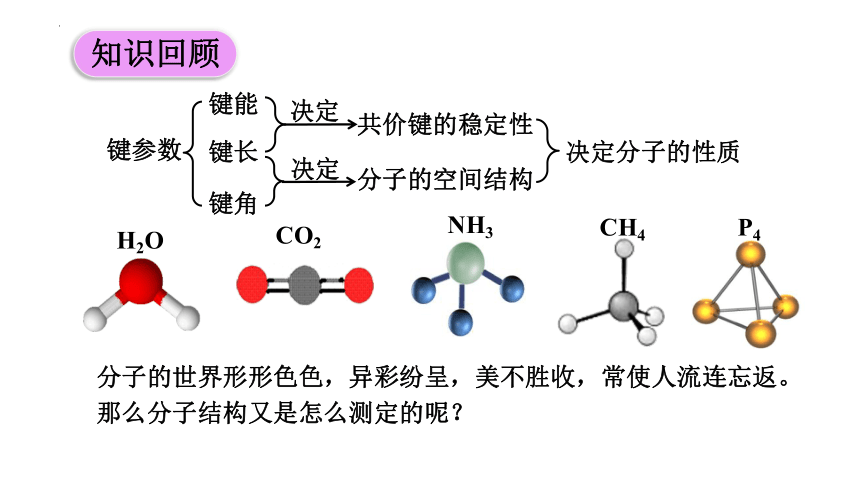
键参数
键能
键长
键角
决定
共价键的稳定性
决定
分子的空间结构
决定分子的性质
知识回顾
H2O
CO2
NH3
CH4
P4
分子的世界形形色色,异彩纷呈,美不胜收,常使人流连忘返。那么分子结构又是怎么测定的呢?
一、分子结构的测定
早年的科学家主要靠对物质的化学性质进行系统总结得出规律后推测分子的结构。如今,科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、晶体X射线衍射等。
红外光谱仪
X射线衍射仪
测定化学键或官能团
测定键长、键角等
分子中的原子不是固定不动的,而是不断地振动着的,共价键也有细微的伸缩。
分子的空间结构是分子中的原子处于平衡位置时的模型。
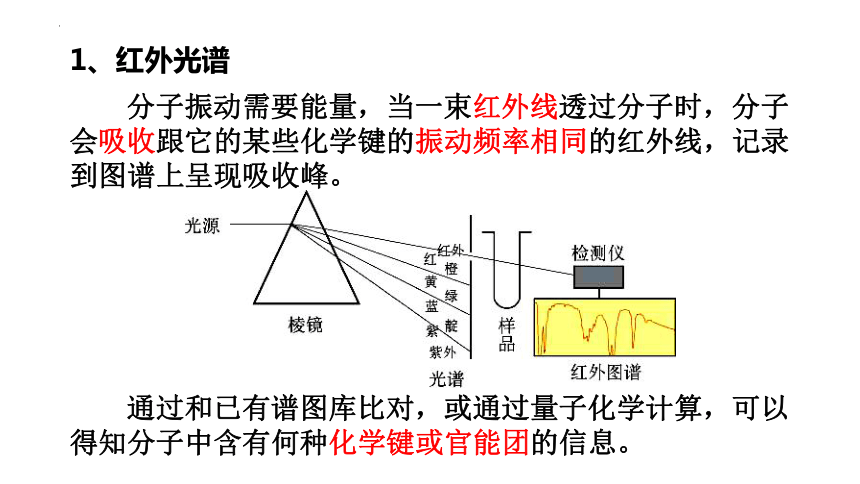
分子振动需要能量,当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
1、红外光谱
通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
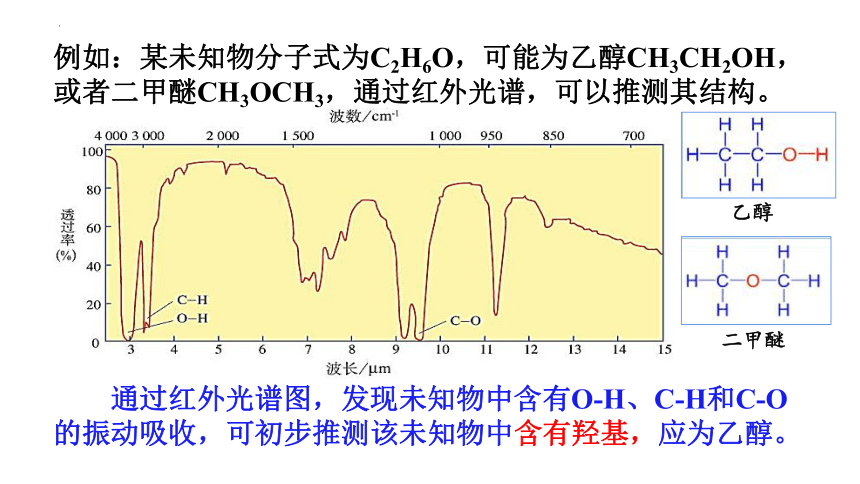
例如:某未知物分子式为C2H6O,可能为乙醇CH3CH2OH,或者二甲醚CH3OCH3,通过红外光谱,可以推测其结构。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基,应为乙醇。
二甲醚
乙醇
有机物的同分异构现象是普遍且复杂的,知道分子式后可以通过红外光谱进一步知道其中含有怎样的官能团。
那如何测定分子的相对分子质量呢?
阅读课本42页:用质谱法测定分子的相对分子质量。
质谱仪
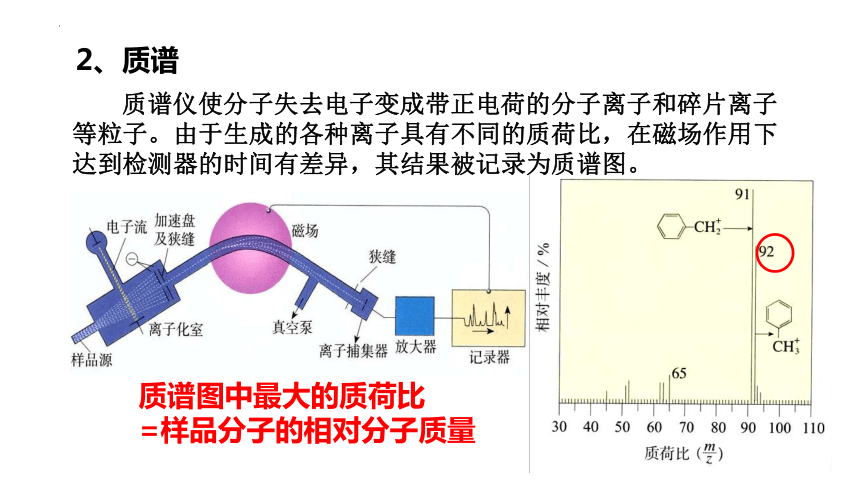
2、质谱
质谱仪使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的各种离子具有不同的质荷比,在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
质谱图中最大的质荷比
=样品分子的相对分子质量
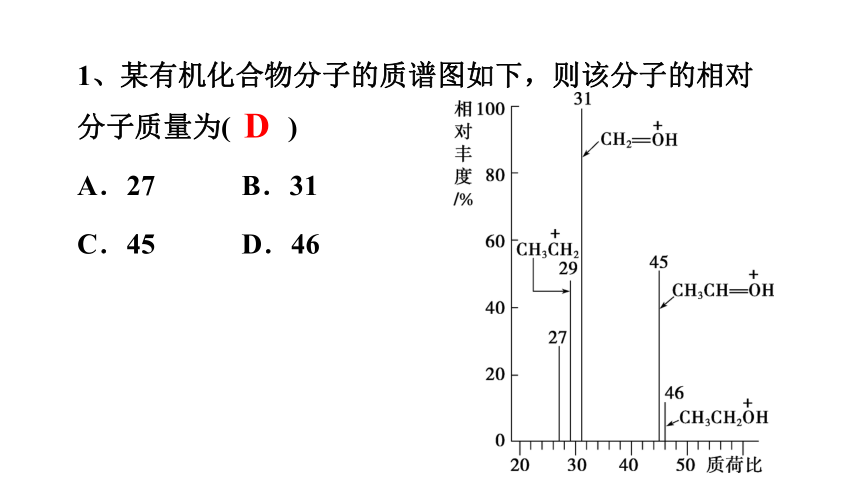
1、某有机化合物分子的质谱图如下,则该分子的相对分子质量为( )
A.27 B.31
C.45 D.46
D
2、某有机化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H、O—H、C—O的振动吸收,质谱显示该有机物的相对分子质量是60,则该有机物的结构简式是( )
A.CH3CH2OCH3 B.CH3CH(OH)CH3
C.CH3CH2OH D.CH3COOH
B
3、下列说法错误的是( )
A、原子光谱上的特征谱线可以确定组成分子元素
B、红外光谱法是用高能电子流等轰击样品分子,使分子失去电子变成带正电荷的分子离子和碎片离子等微粒
C、质谱法具有快速、微量、精确的测定有机物相对分子质量的物理方法
D、通过红外光谱法可以测知有机物所含的官能团
B
大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
二、多样的分子空间结构
1、单原子分子(主要指稀有气体):不存在分子的空间结构问题。
2、双原子分子的空间结构:直线形,例如O2、HCl等。
O2
HCl
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型
CO2
H2O
O=C=O
180°
直线形
V形
105°
3、三原子分子的空间结构:直线形或V形
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型
甲醛CH2O
NH3
4、四原子分子的空间结构:平面三角形或三角锥形
平面三角形
三角锥形
107°
BF3
平面正三角形
120°
四原子分子的其他空间结构
乙炔 H-C≡C-H
直线形
键角180°
白磷P4
正四面体形
60°
H2O2 H-O-O-H
H2O2分子不是直线形,两个H原子犹如在半展开的书的两页上,两个氧原子则在书的夹缝上。
5、五原子分子的空间结构:四面体形
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型
CH4
正四面体形
CH4、CX4和SiH4分子的空间结构都是正四面体形,CH3Cl、CH2Cl2、CHCl3则是四面体形。
109°28'
H
:
C
H
:
:
:
H
H
C6H6
C60
其他多原子分子
正八面体形
PCl5
三角双锥形
分子空间结构与其稳定性有关。
又如,椅式C6H12 比 船式 C6H12稳定。
108°
例如,S8像顶皇冠,如果把其中一个向上的硫原子倒转向下,尽管也可以存在,却不如皇冠式稳定。
问题:根据元素周期律并结合本节所学知识,你能推断出PCl3、SiCl4分子的空间结构吗?
等电子体原理:
原子总数、价电子总数相同的分子或离子具有相似的化学键特征,形成分子的空间结构相似。
①同主族变换:如CO2与CS2、CF4与CCl4的等电子体。
②左右移位补偿:如N2与CO,CO32-、NO3-与SO3是等电子体。
PCl3分子的空间结构为三角锥形,SiCl4分子的空间结构为正四面体形。
下列说法正确的是( )
A.CS2分子的立体构型是V形
B.NF3分子的立体构型是四面体形
C.键长、键角不同是导致分子构型不同的主要原因
D.正四面体形分子一定是五原子分子
C
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 多样的分子空间结构
键参数
键能
键长
键角
决定
共价键的稳定性
决定
分子的空间结构
决定分子的性质
知识回顾
H2O
CO2
NH3
CH4
P4
分子的世界形形色色,异彩纷呈,美不胜收,常使人流连忘返。那么分子结构又是怎么测定的呢?
一、分子结构的测定
早年的科学家主要靠对物质的化学性质进行系统总结得出规律后推测分子的结构。如今,科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、晶体X射线衍射等。
红外光谱仪
X射线衍射仪
测定化学键或官能团
测定键长、键角等
分子中的原子不是固定不动的,而是不断地振动着的,共价键也有细微的伸缩。
分子的空间结构是分子中的原子处于平衡位置时的模型。
分子振动需要能量,当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
1、红外光谱
通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
例如:某未知物分子式为C2H6O,可能为乙醇CH3CH2OH,或者二甲醚CH3OCH3,通过红外光谱,可以推测其结构。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基,应为乙醇。
二甲醚
乙醇
有机物的同分异构现象是普遍且复杂的,知道分子式后可以通过红外光谱进一步知道其中含有怎样的官能团。
那如何测定分子的相对分子质量呢?
阅读课本42页:用质谱法测定分子的相对分子质量。
质谱仪
2、质谱
质谱仪使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的各种离子具有不同的质荷比,在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
质谱图中最大的质荷比
=样品分子的相对分子质量
1、某有机化合物分子的质谱图如下,则该分子的相对分子质量为( )
A.27 B.31
C.45 D.46
D
2、某有机化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H、O—H、C—O的振动吸收,质谱显示该有机物的相对分子质量是60,则该有机物的结构简式是( )
A.CH3CH2OCH3 B.CH3CH(OH)CH3
C.CH3CH2OH D.CH3COOH
B
3、下列说法错误的是( )
A、原子光谱上的特征谱线可以确定组成分子元素
B、红外光谱法是用高能电子流等轰击样品分子,使分子失去电子变成带正电荷的分子离子和碎片离子等微粒
C、质谱法具有快速、微量、精确的测定有机物相对分子质量的物理方法
D、通过红外光谱法可以测知有机物所含的官能团
B
大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
二、多样的分子空间结构
1、单原子分子(主要指稀有气体):不存在分子的空间结构问题。
2、双原子分子的空间结构:直线形,例如O2、HCl等。
O2
HCl
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型
CO2
H2O
O=C=O
180°
直线形
V形
105°
3、三原子分子的空间结构:直线形或V形
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型
甲醛CH2O
NH3
4、四原子分子的空间结构:平面三角形或三角锥形
平面三角形
三角锥形
107°
BF3
平面正三角形
120°
四原子分子的其他空间结构
乙炔 H-C≡C-H
直线形
键角180°
白磷P4
正四面体形
60°
H2O2 H-O-O-H
H2O2分子不是直线形,两个H原子犹如在半展开的书的两页上,两个氧原子则在书的夹缝上。
5、五原子分子的空间结构:四面体形
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型
CH4
正四面体形
CH4、CX4和SiH4分子的空间结构都是正四面体形,CH3Cl、CH2Cl2、CHCl3则是四面体形。
109°28'
H
:
C
H
:
:
:
H
H
C6H6
C60
其他多原子分子
正八面体形
PCl5
三角双锥形
分子空间结构与其稳定性有关。
又如,椅式C6H12 比 船式 C6H12稳定。
108°
例如,S8像顶皇冠,如果把其中一个向上的硫原子倒转向下,尽管也可以存在,却不如皇冠式稳定。
问题:根据元素周期律并结合本节所学知识,你能推断出PCl3、SiCl4分子的空间结构吗?
等电子体原理:
原子总数、价电子总数相同的分子或离子具有相似的化学键特征,形成分子的空间结构相似。
①同主族变换:如CO2与CS2、CF4与CCl4的等电子体。
②左右移位补偿:如N2与CO,CO32-、NO3-与SO3是等电子体。
PCl3分子的空间结构为三角锥形,SiCl4分子的空间结构为正四面体形。
下列说法正确的是( )
A.CS2分子的立体构型是V形
B.NF3分子的立体构型是四面体形
C.键长、键角不同是导致分子构型不同的主要原因
D.正四面体形分子一定是五原子分子
C
