2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 2-3-1共价键的极性(共15张PPT)
文档属性
| 名称 | 2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 2-3-1共价键的极性(共15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:29:59 | ||
图片预览


文档简介
(共15张PPT)
第二章 分子结构与性质
第三节 分子结构与物质性质
第1课时 共价键的极性
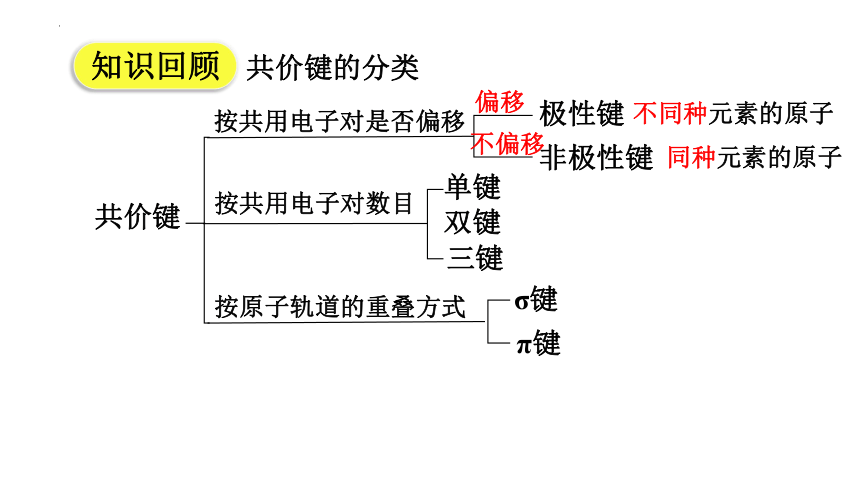
共价键的分类
共价键
按共用电子对是否偏移
按共用电子对数目
极性键
非极性键
单键
双键
三键
按原子轨道的重叠方式
知识回顾
σ键
π键
偏移
不偏移
不同种元素的原子
同种元素的原子
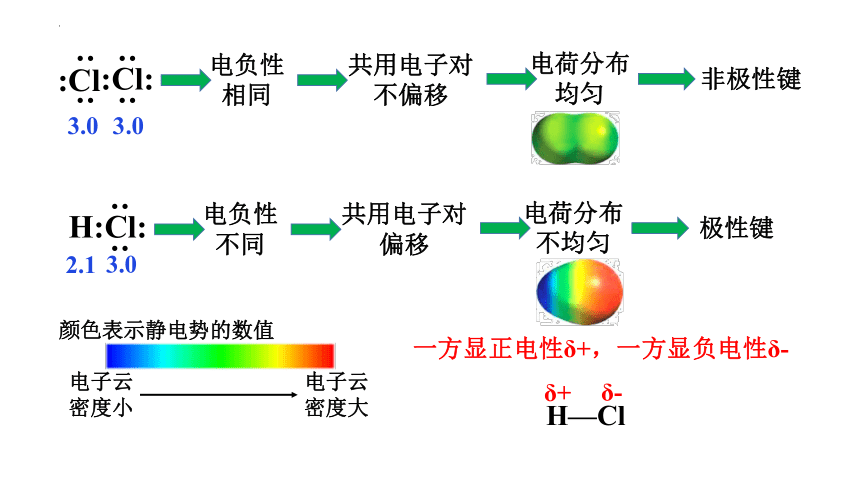
为什么同种元素的共用电子对不偏移,而不同种元素的共用电子对发生偏移
不同元素的原子对共用电子对的吸引力不同,即元素的电负性不同。
2.1
3.0
3.0
3.0
H:Cl:
: :
:Cl:
: :
:Cl
: :
电负性相同
共用电子对不偏移
电荷分布均匀
非极性键
电负性不同
共用电子对偏移
电荷分布不均匀
极性键
电子云
密度大
电子云
密度小
颜色表示静电势的数值
一方显正电性δ+,一方显负电性δ-
H—Cl
δ+
δ-
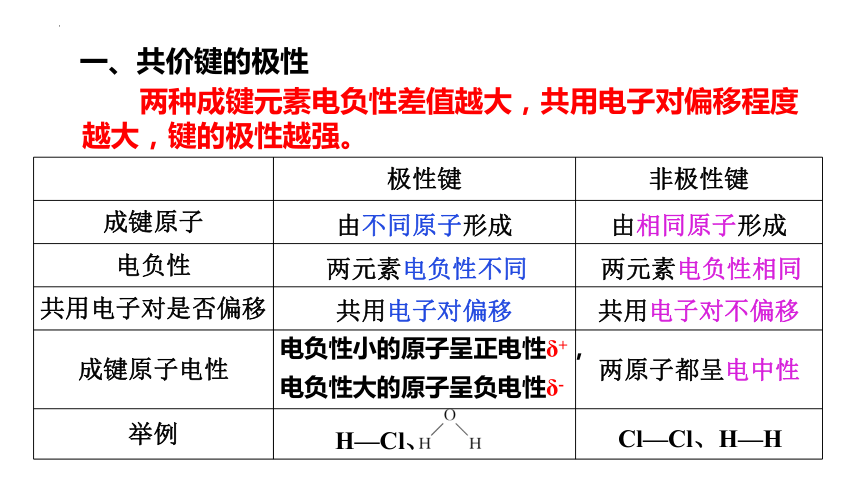
一、共价键的极性
共用电子对发生偏移时,使化学键产生了呈正电性(δ+)和呈负电性(δ-)两极。
极性键 非极性键
成键原子
电负性
共用电子对是否偏移
成键原子电性
举例
由不同原子形成 由相同原子形成
两元素电负性不同 两元素电负性相同
共用电子对偏移 共用电子对不偏移
电负性大的原子呈负电性δ-
电负性小的原子呈正电性δ+,
两原子都呈电中性
H—Cl、
Cl—Cl、H—H
两种成键元素电负性差值越大,共用电子对偏移程度越大,键的极性越强。
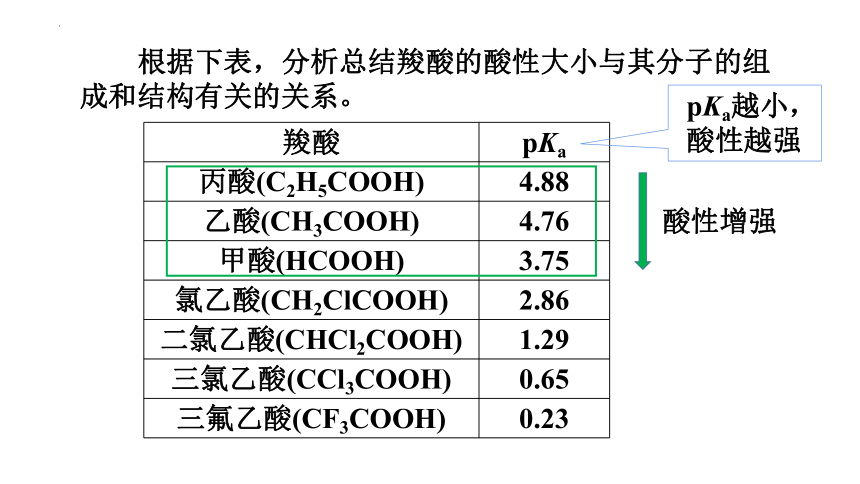
根据下表,分析总结羧酸的酸性大小与其分子的组成和结构有关的关系。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
酸性增强
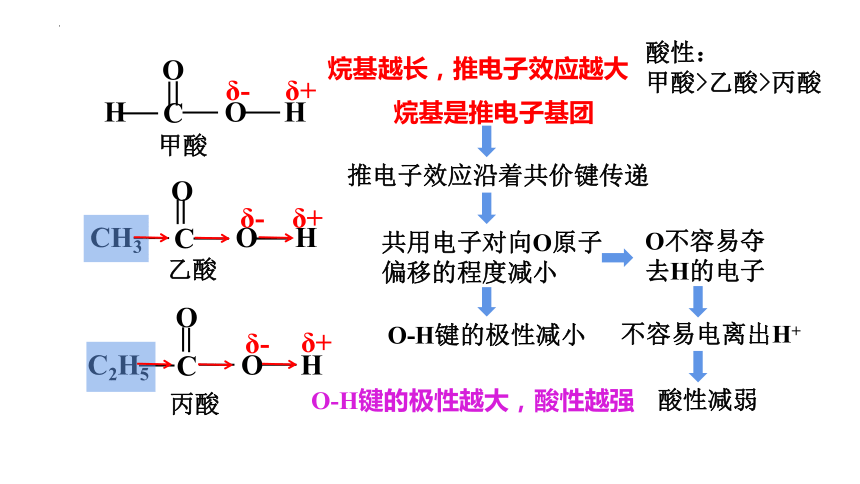
δ+
δ-
δ+
δ-
H
O
H
O
C
甲酸
δ+
δ-
CH3
O
H
O
C
乙酸
C2H5
O
H
O
C
丙酸
不容易电离出H+
烷基是推电子基团
推电子效应沿着共价键传递
共用电子对向O原子偏移的程度减小
烷基越长,推电子效应越大
O-H键的极性减小
O不容易夺去H的电子
酸性减弱
酸性:
甲酸>乙酸>丙酸
O-H键的极性越大,酸性越强
根据下表,分析总结羧酸的酸性大小与其分子的组成和结构有关的关系。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
酸性增强
卤素原子
是吸电子基团
共用电子对偏移的程度增大
O-H键的极性增大
酸性增强
卤素原子的数目越多,羧酸的酸性越强。
一氯乙酸、二氯乙酸、三氯乙酸的表面静电势图
根据下表,分析总结羧酸的酸性大小与其分子的组成和结构有关的关系。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
电负性:F > Cl
三氟乙酸中的
O-H键极性更大
三氟乙酸的酸性更强
1、烷基是推电子基团,烷基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
二、键的极性对化学性质的影响
随着烷基加长,酸性的差异越来越小。
2、卤素原子是吸电子基团,卤素原子越多,吸电子效应越大,使羧基中的羟基的极性越大,羧酸的酸性越强。
CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。
2Na+2H-O-H=2NaOH+H2↑
2Na+2CH3CH2-O-H→2CH3CH2ONa+H2↑
水与钠反应更剧烈,由于烷基是推电子基团,使醇分子中的O-H键的极性小于水分子中的氢氧键的极性,相较于水,乙醇分子中的O-H键不容易断裂。
CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。
1.下列各组分子中,按共价键极性由强到弱排序正确的是( )
A.CH4 NH3 H2O HF
B.HF H2O NH3 CH4
C.H2O HF CH4 NH3
D.HF H2O CH4 NH3
B
2.CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在____(填“吸”或“推”)电子基团,这种基团是________。
吸
—CHO
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是_______。
推
—CH3
第二章 分子结构与性质
第三节 分子结构与物质性质
第1课时 共价键的极性
共价键的分类
共价键
按共用电子对是否偏移
按共用电子对数目
极性键
非极性键
单键
双键
三键
按原子轨道的重叠方式
知识回顾
σ键
π键
偏移
不偏移
不同种元素的原子
同种元素的原子
为什么同种元素的共用电子对不偏移,而不同种元素的共用电子对发生偏移
不同元素的原子对共用电子对的吸引力不同,即元素的电负性不同。
2.1
3.0
3.0
3.0
H:Cl:
: :
:Cl:
: :
:Cl
: :
电负性相同
共用电子对不偏移
电荷分布均匀
非极性键
电负性不同
共用电子对偏移
电荷分布不均匀
极性键
电子云
密度大
电子云
密度小
颜色表示静电势的数值
一方显正电性δ+,一方显负电性δ-
H—Cl
δ+
δ-
一、共价键的极性
共用电子对发生偏移时,使化学键产生了呈正电性(δ+)和呈负电性(δ-)两极。
极性键 非极性键
成键原子
电负性
共用电子对是否偏移
成键原子电性
举例
由不同原子形成 由相同原子形成
两元素电负性不同 两元素电负性相同
共用电子对偏移 共用电子对不偏移
电负性大的原子呈负电性δ-
电负性小的原子呈正电性δ+,
两原子都呈电中性
H—Cl、
Cl—Cl、H—H
两种成键元素电负性差值越大,共用电子对偏移程度越大,键的极性越强。
根据下表,分析总结羧酸的酸性大小与其分子的组成和结构有关的关系。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
酸性增强
δ+
δ-
δ+
δ-
H
O
H
O
C
甲酸
δ+
δ-
CH3
O
H
O
C
乙酸
C2H5
O
H
O
C
丙酸
不容易电离出H+
烷基是推电子基团
推电子效应沿着共价键传递
共用电子对向O原子偏移的程度减小
烷基越长,推电子效应越大
O-H键的极性减小
O不容易夺去H的电子
酸性减弱
酸性:
甲酸>乙酸>丙酸
O-H键的极性越大,酸性越强
根据下表,分析总结羧酸的酸性大小与其分子的组成和结构有关的关系。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
酸性增强
卤素原子
是吸电子基团
共用电子对偏移的程度增大
O-H键的极性增大
酸性增强
卤素原子的数目越多,羧酸的酸性越强。
一氯乙酸、二氯乙酸、三氯乙酸的表面静电势图
根据下表,分析总结羧酸的酸性大小与其分子的组成和结构有关的关系。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa越小,
酸性越强
电负性:F > Cl
三氟乙酸中的
O-H键极性更大
三氟乙酸的酸性更强
1、烷基是推电子基团,烷基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
二、键的极性对化学性质的影响
随着烷基加长,酸性的差异越来越小。
2、卤素原子是吸电子基团,卤素原子越多,吸电子效应越大,使羧基中的羟基的极性越大,羧酸的酸性越强。
CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。
2Na+2H-O-H=2NaOH+H2↑
2Na+2CH3CH2-O-H→2CH3CH2ONa+H2↑
水与钠反应更剧烈,由于烷基是推电子基团,使醇分子中的O-H键的极性小于水分子中的氢氧键的极性,相较于水,乙醇分子中的O-H键不容易断裂。
CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?试从键的极性角度解释原因。
1.下列各组分子中,按共价键极性由强到弱排序正确的是( )
A.CH4 NH3 H2O HF
B.HF H2O NH3 CH4
C.H2O HF CH4 NH3
D.HF H2O CH4 NH3
B
2.CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在____(填“吸”或“推”)电子基团,这种基团是________。
吸
—CHO
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是_______。
推
—CH3
