化学人教版(2019)必修第一册3.1.3铁盐与亚铁盐(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.3铁盐与亚铁盐(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 47.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 14:32:48 | ||
图片预览







文档简介
(共20张PPT)
第一节 铁及其化合物 课时3
第三章 铁 金属材料
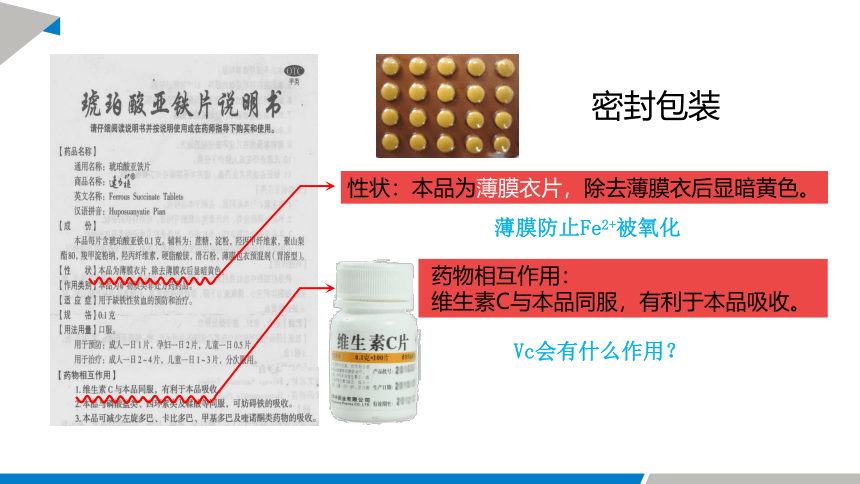
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
密封包装
薄膜防止Fe2+被氧化
Vc会有什么作用?
性状:本品为薄膜衣片,除去薄膜衣后显暗黄色。
药物相互作用:
维生素C与本品同服,有利于本品吸收。
1.通过实验探究,掌握Fe2+与Fe3+的检验方法及Fe2+与Fe3+的转化关系。
2.通过分析Fe、FeSO4、Fe2(SO4)3三种物质中核心元素铁的价态特征,能预测物质的性质,并能建构Fe、Fe2+、Fe3+的转化关系模型。
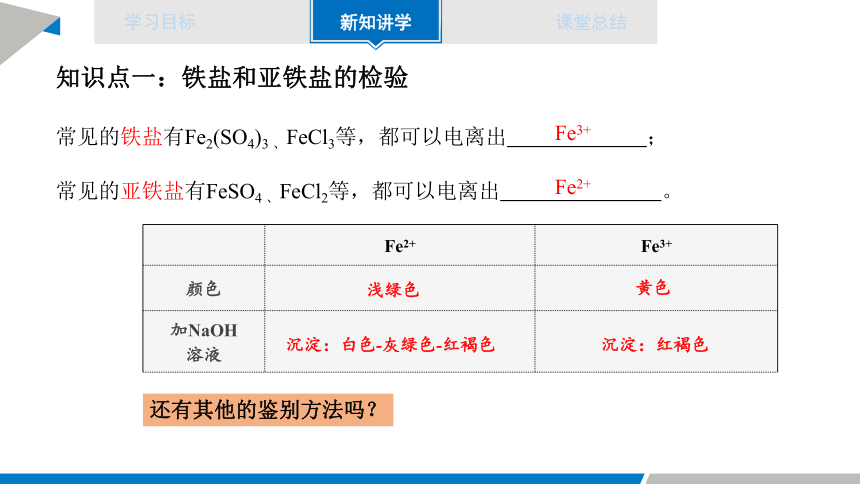
知识点一:铁盐和亚铁盐的检验
常见的铁盐有Fe2(SO4)3 、FeCl3等,都可以电离出 ;
Fe3+
常见的亚铁盐有FeSO4 、FeCl2等,都可以电离出 。
Fe2+
Fe2+ Fe3+
颜色
加NaOH 溶液
浅绿色
黄色
沉淀:白色-灰绿色-红褐色
沉淀:红褐色
还有其他的鉴别方法吗?
【实验3-2】在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN(硫氰化钾)溶液。观察并记录实验现象。
视频
现象
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无明显变化
Fe3+ + 3SCN- = Fe(SCN)3
血红色
总结:可用KSCN溶液来检验Fe3+的存在
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液后变红的是( )
A.FeS B.Fe2O3 C.FeCl3 D.FeSO4
2.只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开的试剂是( )
A.BaCl2溶液 B.FeCl2溶液
C.FeCl3溶液 D.Fe(NO3)3溶液
C
BC
练一练
知识点二:铁盐和亚铁盐的相互转换
【实验3-3】观察实验现象,并分析现象产生的原因(用离子方程式表示)。
视频
向氯化铁溶液中加入铁粉:
溶液的黄色褪去
再加入硫氰化钾溶液:
溶液无明显变化
原因:
Fe + 2Fe3+ = 3Fe2+
向上层清液滴加氯水:
溶液变为血红色
原因:
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧化剂
还原剂
Fe2+
Fe3+
根据【实验3-3】请你设计实验验证Vc的作用
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
学以致用
我们知道证明某溶液中含Fe3+可以加硫氰化钾溶液,那么如何证明某溶液中含有Fe2+呢?
学以致用
取少量待测液于试管中,滴入硫氰酸钾溶液无现象,再加入氯水,溶液呈红色,说明含有Fe2+(氯水可以换为H2O2)。
(1)Fe、FeSO4、和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂?举例写出相应反应的化学方程式,并加以说明。
思考与讨论
①Fe单质的化合价为0,化合价只能升高,因此只具有还原性。
如:Fe+H2SO4 === FeSO4;
2Fe+3Cl2 === 2FeCl3
②FeSO4中的Fe2+化合价为+2价,化合价既可以升高为+3价又能降低为0价,因此FeSO4既有还原性又有氧化性。
如:2FeSO4+H2SO4+H2O2==Fe2(SO4)3+2H2O,
Zn+FeSO4===ZnSO4+Fe
视频
③Fe2(SO4)3中的Fe3+化合价为+3价,化合价能降低,因此Fe2(SO4)3具有氧化性。
如:Fe2(SO4)3+Cu===2FeSO4+CuSO4
视频
氧化性
还原性
还原性
氧化性
Fe
Fe2+
Fe3+
氧化剂
( H+、Cu2+等)
还原剂
(C、CO等)
氧化剂
(Cl2、KMnO4 、H2O2等)
还原剂
(Zn、Fe、Cu等)
还原剂
(C、CO等)
氧化剂(Cl2等)
(2)请你用图示的方法归纳Fe、Fe2+和Fe3+三者之间的相互转化关系,并与同学讨论。
1.Fe只具有还原性,可被弱氧化剂(H+、Cu2+、Fe3+、I2、S等)氧化为Fe2+;被强氧化剂[O2、Cl2、Br2、HNO3、KMnO4(H+)等]氧化为Fe3+。
2.Fe2+既有氧化性,又有还原性。可被强氧化剂[Cl2、Br2、O2、ClO-、KMnO4(H+)、HNO3、H2O2等]氧化为Fe3+;可被还原剂(Al、Zn、CO、C等)还原为Fe。
3.Fe3+具有氧化性,可被弱还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。
【小结】
0
学以致用
阅读教材P70的内容,回答下列问题:
(1)利用覆铜板制作图案的原理的是什么?
(2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”?
(1)Cu + 2Fe3+ = 2Fe2+ + Cu2+
(2)先加入适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加入氯水等氧化剂,实现FeCl3溶液的再生。
1.下列离子方程式书写正确的是: ( )
A.氯化亚铁溶液中通入氯气: 2Fe2+ + Cl2 = 2Fe3++2Cl-
B.铜粉加入到氯化铁溶液中:Cu+ Fe3+ = Fe2++Cu2+
C.铁片加入到稀盐酸溶中: Fe + 2H+ = Fe3+ + H2↑
D.铁棒伸入到硫酸铜溶液中 : 2Fe + 3Cu2+ = 2Fe3+ + 3Cu
A
练一练
试回答:(1)B的化学式:________D的化学式:_____
(2)写出由E转变成F的化学方程式:_______________________________。
(3)常用______________检验G中的阳离子,
其现象为__________________________。
(4)向G溶液加入A的有关反应的离子方程式为______________________。
2.已知有以下物质相互转化
FeCl2
KCl
4Fe(OH)2+2H2O+O2===4Fe(OH)3
KSCN溶液
棕黄色溶液变为红色溶液
2Fe3++Fe===3Fe2+
3.选择合适试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+; 乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂选取正确的一项是( )
甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C NaOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
4.除去括号中的杂质,应选用的试剂分别为
(1)FeCl2溶液(FeCl3) ;
(2)FeCl3溶液(FeCl2) ;
(3)FeCl2溶液 (CuCl2) 。
Fe粉
氯水
Fe粉
铁的重要化合物
铁盐
亚铁盐
溶液为棕黄色
具有氧化性
检验:KSCN溶液,显血红色
溶液为浅绿色
既有氧化性又有还原性
第一节 铁及其化合物 课时3
第三章 铁 金属材料
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
密封包装
薄膜防止Fe2+被氧化
Vc会有什么作用?
性状:本品为薄膜衣片,除去薄膜衣后显暗黄色。
药物相互作用:
维生素C与本品同服,有利于本品吸收。
1.通过实验探究,掌握Fe2+与Fe3+的检验方法及Fe2+与Fe3+的转化关系。
2.通过分析Fe、FeSO4、Fe2(SO4)3三种物质中核心元素铁的价态特征,能预测物质的性质,并能建构Fe、Fe2+、Fe3+的转化关系模型。
知识点一:铁盐和亚铁盐的检验
常见的铁盐有Fe2(SO4)3 、FeCl3等,都可以电离出 ;
Fe3+
常见的亚铁盐有FeSO4 、FeCl2等,都可以电离出 。
Fe2+
Fe2+ Fe3+
颜色
加NaOH 溶液
浅绿色
黄色
沉淀:白色-灰绿色-红褐色
沉淀:红褐色
还有其他的鉴别方法吗?
【实验3-2】在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN(硫氰化钾)溶液。观察并记录实验现象。
视频
现象
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无明显变化
Fe3+ + 3SCN- = Fe(SCN)3
血红色
总结:可用KSCN溶液来检验Fe3+的存在
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液后变红的是( )
A.FeS B.Fe2O3 C.FeCl3 D.FeSO4
2.只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开的试剂是( )
A.BaCl2溶液 B.FeCl2溶液
C.FeCl3溶液 D.Fe(NO3)3溶液
C
BC
练一练
知识点二:铁盐和亚铁盐的相互转换
【实验3-3】观察实验现象,并分析现象产生的原因(用离子方程式表示)。
视频
向氯化铁溶液中加入铁粉:
溶液的黄色褪去
再加入硫氰化钾溶液:
溶液无明显变化
原因:
Fe + 2Fe3+ = 3Fe2+
向上层清液滴加氯水:
溶液变为血红色
原因:
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧化剂
还原剂
Fe2+
Fe3+
根据【实验3-3】请你设计实验验证Vc的作用
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
学以致用
我们知道证明某溶液中含Fe3+可以加硫氰化钾溶液,那么如何证明某溶液中含有Fe2+呢?
学以致用
取少量待测液于试管中,滴入硫氰酸钾溶液无现象,再加入氯水,溶液呈红色,说明含有Fe2+(氯水可以换为H2O2)。
(1)Fe、FeSO4、和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂?举例写出相应反应的化学方程式,并加以说明。
思考与讨论
①Fe单质的化合价为0,化合价只能升高,因此只具有还原性。
如:Fe+H2SO4 === FeSO4;
2Fe+3Cl2 === 2FeCl3
②FeSO4中的Fe2+化合价为+2价,化合价既可以升高为+3价又能降低为0价,因此FeSO4既有还原性又有氧化性。
如:2FeSO4+H2SO4+H2O2==Fe2(SO4)3+2H2O,
Zn+FeSO4===ZnSO4+Fe
视频
③Fe2(SO4)3中的Fe3+化合价为+3价,化合价能降低,因此Fe2(SO4)3具有氧化性。
如:Fe2(SO4)3+Cu===2FeSO4+CuSO4
视频
氧化性
还原性
还原性
氧化性
Fe
Fe2+
Fe3+
氧化剂
( H+、Cu2+等)
还原剂
(C、CO等)
氧化剂
(Cl2、KMnO4 、H2O2等)
还原剂
(Zn、Fe、Cu等)
还原剂
(C、CO等)
氧化剂(Cl2等)
(2)请你用图示的方法归纳Fe、Fe2+和Fe3+三者之间的相互转化关系,并与同学讨论。
1.Fe只具有还原性,可被弱氧化剂(H+、Cu2+、Fe3+、I2、S等)氧化为Fe2+;被强氧化剂[O2、Cl2、Br2、HNO3、KMnO4(H+)等]氧化为Fe3+。
2.Fe2+既有氧化性,又有还原性。可被强氧化剂[Cl2、Br2、O2、ClO-、KMnO4(H+)、HNO3、H2O2等]氧化为Fe3+;可被还原剂(Al、Zn、CO、C等)还原为Fe。
3.Fe3+具有氧化性,可被弱还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。
【小结】
0
学以致用
阅读教材P70的内容,回答下列问题:
(1)利用覆铜板制作图案的原理的是什么?
(2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”?
(1)Cu + 2Fe3+ = 2Fe2+ + Cu2+
(2)先加入适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加入氯水等氧化剂,实现FeCl3溶液的再生。
1.下列离子方程式书写正确的是: ( )
A.氯化亚铁溶液中通入氯气: 2Fe2+ + Cl2 = 2Fe3++2Cl-
B.铜粉加入到氯化铁溶液中:Cu+ Fe3+ = Fe2++Cu2+
C.铁片加入到稀盐酸溶中: Fe + 2H+ = Fe3+ + H2↑
D.铁棒伸入到硫酸铜溶液中 : 2Fe + 3Cu2+ = 2Fe3+ + 3Cu
A
练一练
试回答:(1)B的化学式:________D的化学式:_____
(2)写出由E转变成F的化学方程式:_______________________________。
(3)常用______________检验G中的阳离子,
其现象为__________________________。
(4)向G溶液加入A的有关反应的离子方程式为______________________。
2.已知有以下物质相互转化
FeCl2
KCl
4Fe(OH)2+2H2O+O2===4Fe(OH)3
KSCN溶液
棕黄色溶液变为红色溶液
2Fe3++Fe===3Fe2+
3.选择合适试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+; 乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂选取正确的一项是( )
甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C NaOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
4.除去括号中的杂质,应选用的试剂分别为
(1)FeCl2溶液(FeCl3) ;
(2)FeCl3溶液(FeCl2) ;
(3)FeCl2溶液 (CuCl2) 。
Fe粉
氯水
Fe粉
铁的重要化合物
铁盐
亚铁盐
溶液为棕黄色
具有氧化性
检验:KSCN溶液,显血红色
溶液为浅绿色
既有氧化性又有还原性
