2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 3-3-3晶体类型的比较+过渡晶体、混合型晶体 课件(28张PPT)
文档属性
| 名称 | 2023-2024学年高二下学期化学人教版(2019)选择性必修2课件 3-3-3晶体类型的比较+过渡晶体、混合型晶体 课件(28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 00:00:00 | ||
图片预览




文档简介
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第3课时 过渡晶体与混合型晶体
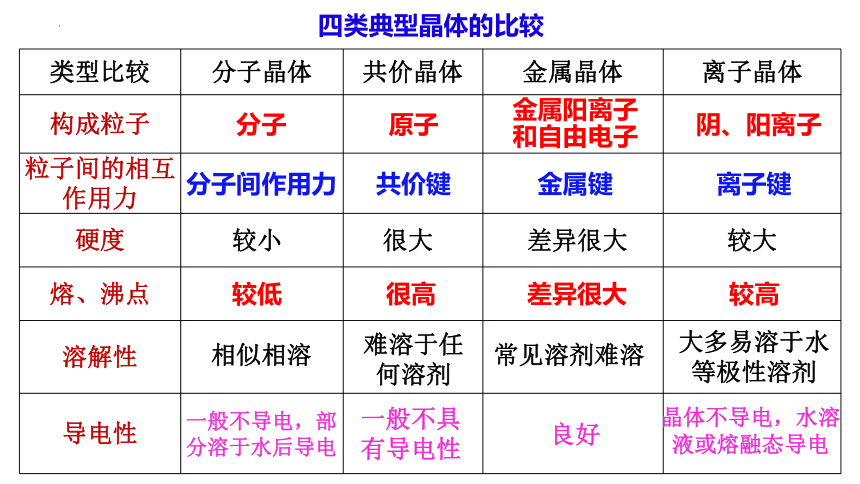
{5940675A-B579-460E-94D1-54222C63F5DA}类型比较
分子晶体
共价晶体
金属晶体
离子晶体
构成粒子
粒子间的相互作用力
硬度
熔、沸点
溶解性
导电性
四类典型晶体的比较
分子
原子
金属阳离子和自由电子
阴、阳离子
分子间作用力
共价键
金属键
离子键
较小
很大
差异很大
较大
较低
相似相溶
很高
差异很大
较高
难溶于任何溶剂
常见溶剂难溶
大多易溶于水等极性溶剂
一般不导电,部分溶于水后导电
一般不具有导电性
良好
晶体不导电,水溶液或熔融态导电
离子晶体:活泼金属的 、 [如KOH、Ba(OH)2等]
和绝大多数的 。
分子晶体:大多数___________(除金刚石、石墨、晶体硼、
晶体硅等外)、非金属氢化物、___________(除
SiO2外)、几乎所有的___、绝大多数______(除
有机盐外)。
非金属氧化物
非金属单质
酸
有机物
共价晶体:单质有_________________________;
化合物有________________________。
金刚石、硼、硅、锗、灰锡等
碳化硅、SiO2等
金属晶体:金属单质(除____、_____外)与______。
锗 灰锡
合金
氧化物
强碱
盐
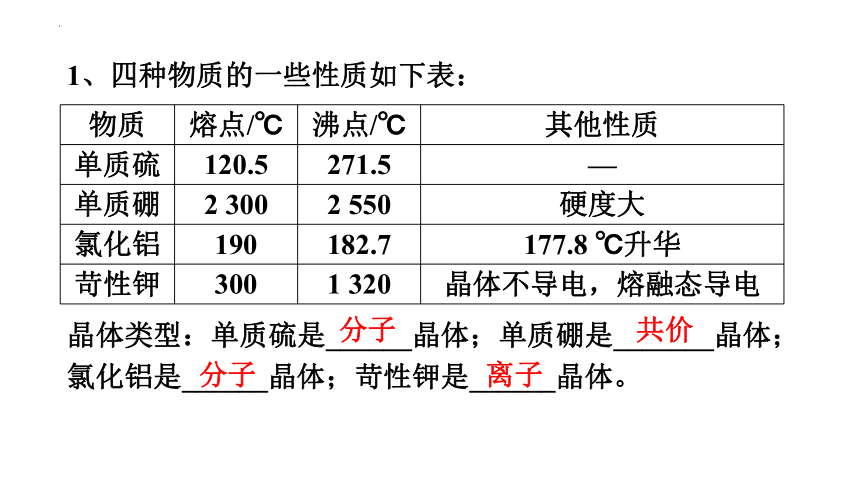
1、四种物质的一些性质如下表:
物质
熔点/℃
沸点/℃
其他性质
单质硫
120.5
271.5
—
单质硼
2 300
2 550
硬度大
氯化铝
190
182.7
177.8 ℃升华
苛性钾
300
1 320
晶体不导电,熔融态导电
晶体类型:单质硫是______晶体;单质硼是_______晶体;氯化铝是______晶体;苛性钾是______晶体。
分子
共价
分子
离子
2、下列每组物质发生状态变化时所克服的粒子间的相互作用属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
C
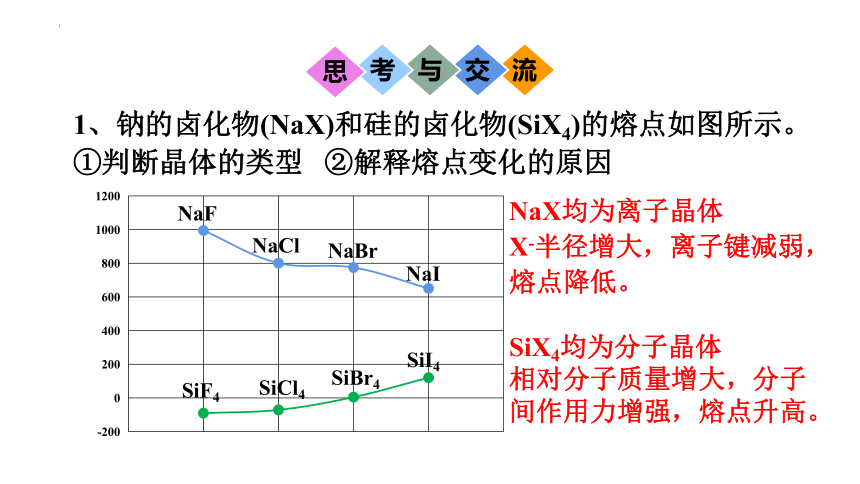
1、钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示。
①判断晶体的类型 ②解释熔点变化的原因
流
交
与
考
思
NaX均为离子晶体
X-半径增大,离子键减弱,熔点降低。
SiX4均为分子晶体
相对分子质量增大,分子间作用力增强,熔点升高。
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
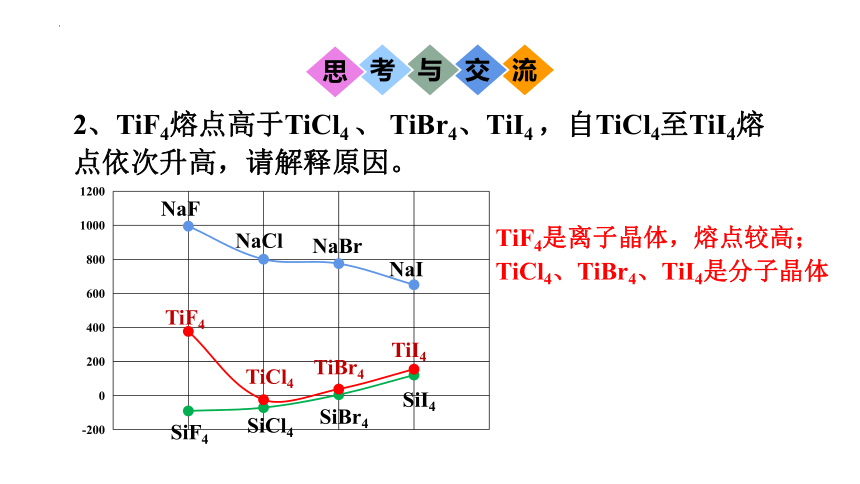
2、TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
流
交
与
考
思
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
TiF4是离子晶体,熔点较高;
TiCl4、TiBr4、TiI4是分子晶体
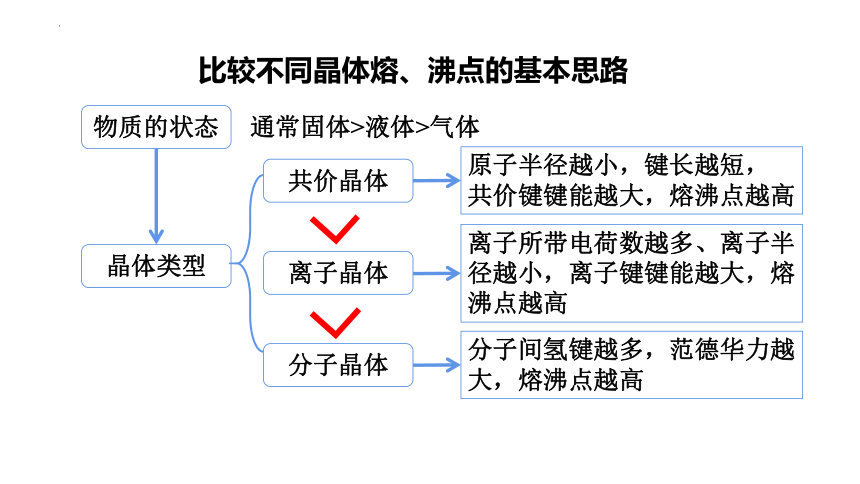
比较不同晶体熔、沸点的基本思路
物质的状态
晶体类型
通常固体>液体>气体
共价晶体
离子晶体
分子晶体
原子半径越小,键长越短,
共价键键能越大,熔沸点越高
离子所带电荷数越多、离子半径越小,离子键键能越大,熔沸点越高
分子间氢键越多,范德华力越大,熔沸点越高
比较不同晶体熔、沸点的基本思路
首先看物质的状态:一般情况下是固体>液体>气体;
再看物质所属晶体类型:共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),
同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
1、下列各组物质的沸点按由低到高的顺序排列的是( )
A.NH3、CH4、NaCl、Na
B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2
D.Li、Na、K、Rb、Cs
C
2、下列有关性质的比较正确的是( )
①硬度:BaO>CaO>MgO
②水溶性:CH3CH2OH>CH3CH2OCH2CH3
③沸点:HCl>HF
④熔点:NaCl>MgO
⑤分子或离子中键角:H2O⑥沸点:H2O>HF>NH3
⑦熔点:金刚石>生铁>纯铁>钠
⑧熔点:二氧化硅>NaCl>I2>冰
A.①②⑥⑧ B.①②⑤⑥⑧ C.②④⑤⑥ D.②⑤⑥⑧
D
Fe
金刚石
干冰
NaCl
Fe
1、判断下列晶体类型。
2、晶体类型之间存在绝对的界限吗?
共价晶体 分子晶体 离子晶体 金属晶体
纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
一、过渡晶体
离子键、共价键、金属键等都是化学键的典型模型,但是,原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
过渡晶体的性质偏向某一晶体类型时,通常当作该晶体类型处理。
第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的百分数/%
62
50
41
33
这些晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键;晶体既不是纯粹的离子晶体,也不是纯粹的共价晶体,是离子晶体与共价晶体之间的过渡晶体。
第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的百分数/%
62
50
41
33
1、Na2O、MgO、Al2O3、SiO2中离子键成分为何逐渐减少?
?
原因:与氧元素的电负性的差值逐渐减小
2、请推测P2O5、SO3、Cl2O7的离子键成分变化趋势?
变化趋势:百分数小于33,且逐渐减少
电负性差值越大,离子键的百分数越大,一般当电负性的差值大于1.7时,离子键的百分数大于50%,可认为是离子晶体。
第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
氧化物
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
离子键的百分数/%
62
50
41
33
离子键的百分数大于50%,当作离子晶体处理
离子键的百分数小于50%,偏向共价晶体,当作共价晶体处理
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体 共价晶体 分子晶体
离子键成分的百分数更小,是分子晶体
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?
想
想
一
同:熔点均较高
异:金刚石硬度很高、不导电,石墨质软、能导电
你认为是什么造成了这种差异?
结构决定性质
试解释石墨的性质与结构的关系。
石墨是层状结构。
碳原子均采取sp2杂化,形成平面六元并环结构。
层内C原子以共价键结合,
层间靠范德华力维系。
石墨熔点高
层内碳原子之间形成共价键,作用力强。
石墨质软
层与层之间靠较弱的范德华力维系,容易滑动,可作润滑剂。
石墨能导电
未参与杂化的p轨道形成离域大π键,电子可在层内运动。
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,所以石墨的导电性只能沿石墨平面方向。
类似共价晶体
类似分子晶体
类似金属晶体
二、混合型晶体
既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体。
例如:石墨晶体内既有共价键,又有类似金属键的离域大π键,还有范德华力,兼具共价晶体、分子晶体和金属晶体的特征。
1.正误判断
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅局限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)Al2O3晶体中存在离子键,属于离子晶体( )
√
×
×
√
×
2.石墨晶体是层状结构(如图),以下有关石墨晶体的说法正确的一组是( )
①石墨是混合型晶体
②石墨中的C为sp2杂化
③石墨熔、沸点都比金刚石低
④石墨中碳原子数和C—C数之比为1∶2
⑤石墨和金刚石的硬度相同
⑥石墨层内导电性和层间导电性不同
⑦每个六元环完全占有的碳原子数是2
A.全对 B.除④外 C.除③④⑤外 D.除⑤⑥⑦外
C
熔点:石墨>金刚石
2∶3
石墨质软,金刚石的硬度大
3.石墨的熔点为什么高于金刚石?
提示 金刚石中碳原子形成共价键,石墨中碳原子除形成共价键外,还形成大π键,且石墨中C—C的键长更短、键能更大,故石墨的熔点高于金刚石。
4.碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化方式分别为____、____。
同素异形体
sp3
sp2
(3)C60属于_____晶体,石墨属于_______晶体。
分子
混合型
(4)石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm。其原因是金刚石中只存在C—C间的___键,而石墨层内的C—C间不仅存在___键,还有_______________键。
σ
σ
π(或大π或p-p π)
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如SiO44?、Si2O76?、(SiO3)612??(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分Si被Al取代则得到铝硅酸盐。
?
单链
双链
硅酸盐
资料卡片
纳米晶体是晶体颗粒尺寸在纳米(10-9 m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性。仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。金属铅的晶粒大小与熔点的关系如下表。
科学 · 技术 · 社会
纳米晶体
{8A107856-5554-42FB-B03E-39F5DBC370BA}r/nm
5
10
20
40
60
80
100
120
140
160
180
200
T/K
34.7
144
294
420
473
502
520
533
542
549
554
559
晶体颗粒小于200 nm时,晶粒越小,金属铅的熔点越低。因此,我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm(或者250 nm)时,其熔点会发生变化。
纳米晶体不同于大块晶体特性的原因:
晶体的表面积增大
{8A107856-5554-42FB-B03E-39F5DBC370BA}r/nm
5
10
20
40
60
80
100
120
140
160
180
200
T/K
34.7
144
294
420
473
502
520
533
542
549
554
559
第三节 金属晶体与离子晶体
第3课时 过渡晶体与混合型晶体
{5940675A-B579-460E-94D1-54222C63F5DA}类型比较
分子晶体
共价晶体
金属晶体
离子晶体
构成粒子
粒子间的相互作用力
硬度
熔、沸点
溶解性
导电性
四类典型晶体的比较
分子
原子
金属阳离子和自由电子
阴、阳离子
分子间作用力
共价键
金属键
离子键
较小
很大
差异很大
较大
较低
相似相溶
很高
差异很大
较高
难溶于任何溶剂
常见溶剂难溶
大多易溶于水等极性溶剂
一般不导电,部分溶于水后导电
一般不具有导电性
良好
晶体不导电,水溶液或熔融态导电
离子晶体:活泼金属的 、 [如KOH、Ba(OH)2等]
和绝大多数的 。
分子晶体:大多数___________(除金刚石、石墨、晶体硼、
晶体硅等外)、非金属氢化物、___________(除
SiO2外)、几乎所有的___、绝大多数______(除
有机盐外)。
非金属氧化物
非金属单质
酸
有机物
共价晶体:单质有_________________________;
化合物有________________________。
金刚石、硼、硅、锗、灰锡等
碳化硅、SiO2等
金属晶体:金属单质(除____、_____外)与______。
锗 灰锡
合金
氧化物
强碱
盐
1、四种物质的一些性质如下表:
物质
熔点/℃
沸点/℃
其他性质
单质硫
120.5
271.5
—
单质硼
2 300
2 550
硬度大
氯化铝
190
182.7
177.8 ℃升华
苛性钾
300
1 320
晶体不导电,熔融态导电
晶体类型:单质硫是______晶体;单质硼是_______晶体;氯化铝是______晶体;苛性钾是______晶体。
分子
共价
分子
离子
2、下列每组物质发生状态变化时所克服的粒子间的相互作用属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
C
1、钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示。
①判断晶体的类型 ②解释熔点变化的原因
流
交
与
考
思
NaX均为离子晶体
X-半径增大,离子键减弱,熔点降低。
SiX4均为分子晶体
相对分子质量增大,分子间作用力增强,熔点升高。
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
2、TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
流
交
与
考
思
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
TiF4是离子晶体,熔点较高;
TiCl4、TiBr4、TiI4是分子晶体
比较不同晶体熔、沸点的基本思路
物质的状态
晶体类型
通常固体>液体>气体
共价晶体
离子晶体
分子晶体
原子半径越小,键长越短,
共价键键能越大,熔沸点越高
离子所带电荷数越多、离子半径越小,离子键键能越大,熔沸点越高
分子间氢键越多,范德华力越大,熔沸点越高
比较不同晶体熔、沸点的基本思路
首先看物质的状态:一般情况下是固体>液体>气体;
再看物质所属晶体类型:共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),
同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
1、下列各组物质的沸点按由低到高的顺序排列的是( )
A.NH3、CH4、NaCl、Na
B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2
D.Li、Na、K、Rb、Cs
C
2、下列有关性质的比较正确的是( )
①硬度:BaO>CaO>MgO
②水溶性:CH3CH2OH>CH3CH2OCH2CH3
③沸点:HCl>HF
④熔点:NaCl>MgO
⑤分子或离子中键角:H2O
⑦熔点:金刚石>生铁>纯铁>钠
⑧熔点:二氧化硅>NaCl>I2>冰
A.①②⑥⑧ B.①②⑤⑥⑧ C.②④⑤⑥ D.②⑤⑥⑧
D
Fe
金刚石
干冰
NaCl
Fe
1、判断下列晶体类型。
2、晶体类型之间存在绝对的界限吗?
共价晶体 分子晶体 离子晶体 金属晶体
纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
一、过渡晶体
离子键、共价键、金属键等都是化学键的典型模型,但是,原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
过渡晶体的性质偏向某一晶体类型时,通常当作该晶体类型处理。
第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的百分数/%
62
50
41
33
这些晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键;晶体既不是纯粹的离子晶体,也不是纯粹的共价晶体,是离子晶体与共价晶体之间的过渡晶体。
第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的百分数/%
62
50
41
33
1、Na2O、MgO、Al2O3、SiO2中离子键成分为何逐渐减少?
?
原因:与氧元素的电负性的差值逐渐减小
2、请推测P2O5、SO3、Cl2O7的离子键成分变化趋势?
变化趋势:百分数小于33,且逐渐减少
电负性差值越大,离子键的百分数越大,一般当电负性的差值大于1.7时,离子键的百分数大于50%,可认为是离子晶体。
第三周期元素的氧化物中,化学键中离子键成分的百分数如下表:
氧化物
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
离子键的百分数/%
62
50
41
33
离子键的百分数大于50%,当作离子晶体处理
离子键的百分数小于50%,偏向共价晶体,当作共价晶体处理
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体 共价晶体 分子晶体
离子键成分的百分数更小,是分子晶体
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?
想
想
一
同:熔点均较高
异:金刚石硬度很高、不导电,石墨质软、能导电
你认为是什么造成了这种差异?
结构决定性质
试解释石墨的性质与结构的关系。
石墨是层状结构。
碳原子均采取sp2杂化,形成平面六元并环结构。
层内C原子以共价键结合,
层间靠范德华力维系。
石墨熔点高
层内碳原子之间形成共价键,作用力强。
石墨质软
层与层之间靠较弱的范德华力维系,容易滑动,可作润滑剂。
石墨能导电
未参与杂化的p轨道形成离域大π键,电子可在层内运动。
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,所以石墨的导电性只能沿石墨平面方向。
类似共价晶体
类似分子晶体
类似金属晶体
二、混合型晶体
既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体。
例如:石墨晶体内既有共价键,又有类似金属键的离域大π键,还有范德华力,兼具共价晶体、分子晶体和金属晶体的特征。
1.正误判断
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅局限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)Al2O3晶体中存在离子键,属于离子晶体( )
√
×
×
√
×
2.石墨晶体是层状结构(如图),以下有关石墨晶体的说法正确的一组是( )
①石墨是混合型晶体
②石墨中的C为sp2杂化
③石墨熔、沸点都比金刚石低
④石墨中碳原子数和C—C数之比为1∶2
⑤石墨和金刚石的硬度相同
⑥石墨层内导电性和层间导电性不同
⑦每个六元环完全占有的碳原子数是2
A.全对 B.除④外 C.除③④⑤外 D.除⑤⑥⑦外
C
熔点:石墨>金刚石
2∶3
石墨质软,金刚石的硬度大
3.石墨的熔点为什么高于金刚石?
提示 金刚石中碳原子形成共价键,石墨中碳原子除形成共价键外,还形成大π键,且石墨中C—C的键长更短、键能更大,故石墨的熔点高于金刚石。
4.碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化方式分别为____、____。
同素异形体
sp3
sp2
(3)C60属于_____晶体,石墨属于_______晶体。
分子
混合型
(4)石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm。其原因是金刚石中只存在C—C间的___键,而石墨层内的C—C间不仅存在___键,还有_______________键。
σ
σ
π(或大π或p-p π)
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如SiO44?、Si2O76?、(SiO3)612??(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分Si被Al取代则得到铝硅酸盐。
?
单链
双链
硅酸盐
资料卡片
纳米晶体是晶体颗粒尺寸在纳米(10-9 m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性。仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。金属铅的晶粒大小与熔点的关系如下表。
科学 · 技术 · 社会
纳米晶体
{8A107856-5554-42FB-B03E-39F5DBC370BA}r/nm
5
10
20
40
60
80
100
120
140
160
180
200
T/K
34.7
144
294
420
473
502
520
533
542
549
554
559
晶体颗粒小于200 nm时,晶粒越小,金属铅的熔点越低。因此,我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm(或者250 nm)时,其熔点会发生变化。
纳米晶体不同于大块晶体特性的原因:
晶体的表面积增大
{8A107856-5554-42FB-B03E-39F5DBC370BA}r/nm
5
10
20
40
60
80
100
120
140
160
180
200
T/K
34.7
144
294
420
473
502
520
533
542
549
554
559
