微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用 课件 (共22张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用 课件 (共22张PPT)2023-2024学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 30.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 16:43:48 | ||
图片预览






文档简介
(共22张PPT)
海带提碘与海水提溴
体验元素性质递变规律的实际应用
微
项
目
3.通过方案的设计与实施,培养学生科学探究与创新意识、科学态度与社会责任意识的化学核心素养。
1.通过海带提碘活动和海水提溴工艺流程的设计,建立真实复杂系统中物质富集、分离、提取的基本思路。
2.通过海带提碘活动和海水提溴工艺流程的设计,体会元素周期律、元素周期表在解决实际问题中的价值。
学 习 · 目 标
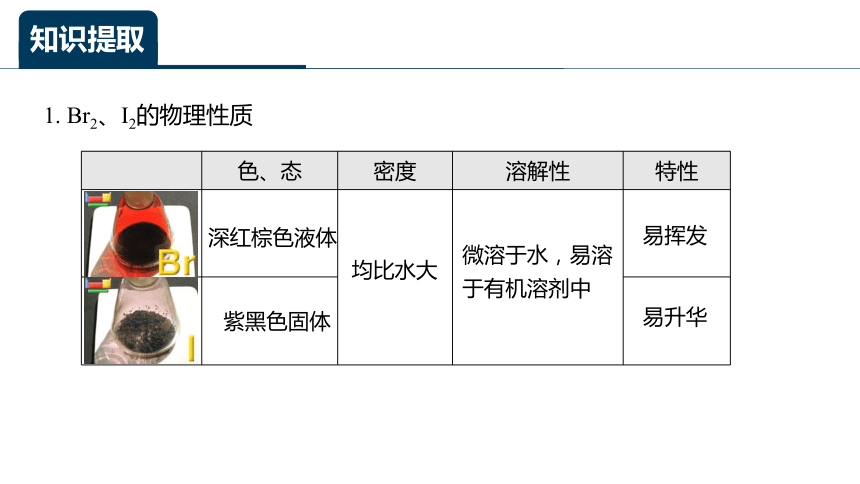
1. Br2、I2的物理性质
色、态 密度 溶解性 特性
溴
碘
深红棕色液体
紫黑色固体
均比水大
易挥发
易升华
微溶于水,易溶于有机溶剂中
知识提取
2. 卤族元素化学性质的递变规律(F→I)
④单质与氢气反应的能力:
知识提取
(2)递变性
>
>
>
①单质氧化性:F2 Cl2 Br2 I2
②卤离子还原性:F- Cl- Br - I-
<
<
<
③气态氢化物稳定性:HF HCl HBr HI
(1)相似性
卤素原子最外层电子数都为7,都能形成气态氢化物(通式为HX),最高价氧化物对应的水化物化学式为HXO4(F除外),单质具有氧化性
逐渐减弱
>
>
>
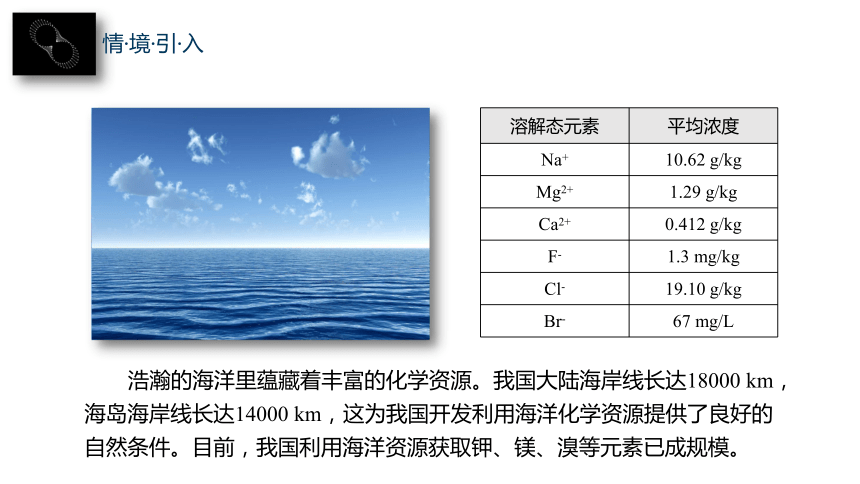
溶解态元素 平均浓度
Na+ 10.62 g/kg
Mg2+ 1.29 g/kg
Ca2+ 0.412 g/kg
F- 1.3 mg/kg
Cl- 19.10 g/kg
Br- 67 mg/L
浩瀚的海洋里蕴藏着丰富的化学资源。我国大陆海岸线长达18000 km,海岛海岸线长达14000 km,这为我国开发利用海洋化学资源提供了良好的自然条件。目前,我国利用海洋资源获取钾、镁、溴等元素已成规模。
情·境·引·入
项目活动 1
海带提碘
海带、紫菜等藻类植物中含有丰富的碘元素,其中,海带产量高、价格低,常用作提取碘单质的原料。碘元素在海带中以碘化物的形式存在。灼烧干海带可以分解除去其中的有机物。灼烧后得到的海带灰中,除了存在可溶性碘化物外,还存在多种可溶性无机盐。
项目活动 1
海带提碘
1.如何证明海带灰溶液中含有I- ?为了将 I- 转化成I2,可用选用哪些化学试剂?选择的依据是什么?
2.设计实验方案,并用流程图表示从海带灰中提取碘单质得到含碘单质溶液的实验流程。
项目活动 1
海带提碘
1.如何证明海带灰溶液中含有I- ?为了将 I- 转化成I2,可用选用哪些化学试剂?选择的依据是什么?
①AgNO3溶液和稀HNO3
②氯水和淀粉溶液
③氯水和CCl4溶液
中学常见的氧化剂:酸性高锰酸钾溶液、重铬酸钾溶液、浓硫酸、硝酸、溴水、氯水、次氯酸溶液、双氧水等
可选用:酸性高锰酸钾溶液、Cl2、双氧水、硝酸等
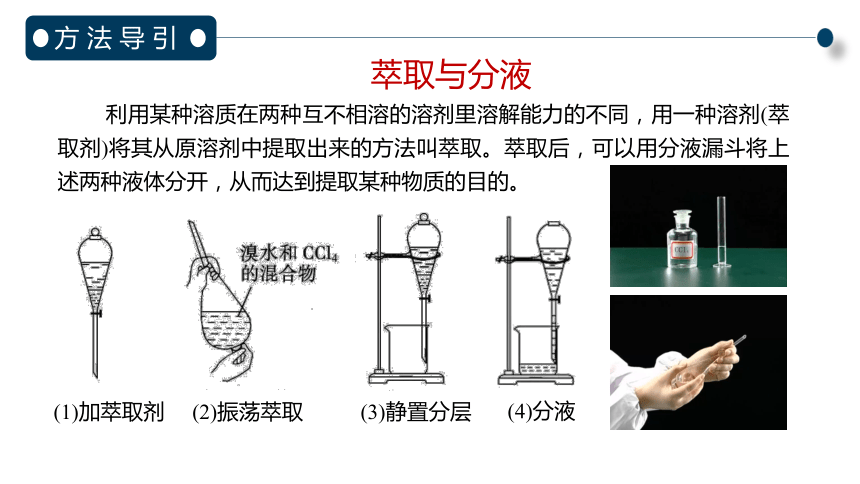
萃取与分液
方 法 导 引
利用某种溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂(萃取剂)将其从原溶剂中提取出来的方法叫萃取。萃取后,可以用分液漏斗将上述两种液体分开,从而达到提取某种物质的目的。
(1)加萃取剂
(2)振荡萃取
(3)静置分层
(4)分液
萃取与分液
(1)加萃取剂
萃取剂必须具备三个条件:
①萃取剂和原溶剂互不相溶、不反应
②萃取剂和溶质互不发生反应
③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度
方 法 导 引
萃取与分液
(1)加萃取剂
(2)振荡萃取
(3)静置分层
(4)分液
①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出
④上层液体要从上口倒出,保证上层液体尽量少的沾附下层液体
方 法 导 引
物质分离提纯的基本思路
1. 物质分离和提纯的基本原则
①“不增”:不引入新的杂质
②“不减”:不减少被提纯物质
③“易分离”:被提纯物质与杂质易分离
④“易复原”:被提纯物质易复原
知识提取
2. 物质分离和提纯的要求
①“过量” :为除尽杂质,除杂试剂要过量
②“后除前”:后加入的试剂要把前面过量的试剂除尽
3. 物质分离和提纯的基本方法
①物理方法:过滤法、蒸发结晶法、蒸馏法、升华法、萃取分液法等
②化学方法:沉淀法、洗气法、酸碱法、氧化还原法、电解法、离子交换法等
知识提取
物质分离提纯的基本思路
项目活动成果展示
浸 取
过 滤
氧 化
海
带
海
带
灰
含I- 的水溶液
固体残留物
含I2 的水溶液
I2 的CCl4溶液
水 溶 液
萃 取
1.第①步灼烧海带需要哪些仪器?
2.第②步获取含I-溶液的操作名称是什么?
4.第④步实验操作的名称是什么?如何从I2 的CCl4溶液进一步提取碘单质呢?
灼烧
①
水
②
氯水
③
CCl4
④
3.第③步发生的反应是什么?
I2的沸点 184℃
CCl4的沸点 76.8℃
反萃取法提取碘单质
在“海带提碘”的实验中,通常以四氯化碳为萃取剂对碘单质进行萃取、富集。那么,如何将碘单质从碘的四氯化碳溶液中提取出来呢?要解决这一问题,可以采用反萃取法,具体步骤如下:
拓
视
野
展
浓NaOH溶液
水层:
含I- 、IO3-
四氯化碳
I2 的CCl4
溶液
45%的
H2SO4溶液
含I2 的
悬浊液
过滤
碘单质
①加入浓NaOH溶液时发生的反应为3I2+6OH- === 5I-+IO3-+3H2O
②加入45%的H2SO4溶液时发生的反应为5I-+IO3-+6H+===3I2+3H2O
I2的CCl4溶液
海带
海带灰
海带灰
悬浊液
含I-溶液
含I2 溶液
灼烧
浸取
氧化
过滤
萃取
待分离体系
目标物
杂质
选择
物理方法
化学方法
分析
性
质
差
异
分离提纯方法
规 律 总 结
物质分离提纯的基本思路
项目活动 2
海水提溴
溴是海水中重要的非金属元素。地球上99%的溴元素以Br - 的形式存在于海水中,人们把溴称为“海洋元素”。目前,从海水中提取的溴占世界溴年产量的1/3左右。苦卤是海水制盐业的副产品,其中含有高浓度的K+、Mg2+、Br-和等,是从海水中提取溴的主要原料。
请用流程图表示你设计的从苦卤中提取溴单质的实验方案。
海洋元素
方案设计
苦卤(Br-)
含Br2溶液
CCl4
Br2的CCl4溶液
蒸馏
Br2单质
常见氧化剂价格(万元/吨)
氧化剂 Cl2 KMnO4
价格 20.15 43.40
Br2的沸点 58.76℃
CCl4的沸点 76.8℃
氧化剂
项目活动 2
海水提溴
空 气 吹 出 法
浓缩
氧化
富集
提取
海水晒盐和海水淡化的过程中副产物 Br - 得到浓缩
向经酸化、浓缩的海水中通入氯气,将Br -氧化为Br2
通入热空气和水蒸气用SO2吸收剂吸收
再用氯气将HBr氧化得到产品溴
为什么往海水中鼓入热空气或水蒸气可获得粗溴?在实验室中怎样从溴水中提取溴?
项目活动 2
海水提溴
空 气 吹 出 法
海水
苦卤
提取粗盐
①硫酸酸化
②氯气氧化
含Br2的海水
③通入空气和水蒸气
吸收塔
④通入吸收剂SO2
⑤氯气氧化
溴水混合物
⑥蒸馏
溴单质
②:2Br -+Cl2 === 2Cl-+Br2
④:SO2 + Br2+2H2O === 2Br - ++ 4H+
产品的富集
含Br2的空气
项目活动成果展示
1. 完善自己设计的“海带提碘”和“海水提溴”的流程图和方案,展示交流。
2. 提炼、概括物质分离和提纯的基本思路;以小组为单位,交流、分享对元素周期律、元素周期表在物质分离和提纯中应用价值的体会。
通电
海带提碘 ①流程:海带→灼烧→浸泡→过滤→氧化→提纯
②主要反应:2KI+Cl2===2KCl+I2
海水提溴 ①方法:在经酸化的浓缩海水中,用氯气氧化溴离子使之成为溴单质
②主要反应:2NaBr+Cl2===2NaCl+Br2
制取氯气 ①常利用电解饱和食盐水制取氯气
②2NaCl+2H2O === 2NaOH+H2↑+Cl2↑
相同点:将卤离子(Cl-、Br-、I-)氧化
为卤单质
不同点:工业上制取氯气常用电解法,
提取碘单质和溴单质常用氧化
剂氧化法
概 括 · 整 合
物质转化
资源
海水(Br -)
海带(I-)
产品
Br2
I2
待分离
体系
杂质
含量
目标物
分离提纯
纯度
问题
富集
浓度问题
概 括 · 整 合
海带提碘与海水提溴
体验元素性质递变规律的实际应用
微
项
目
3.通过方案的设计与实施,培养学生科学探究与创新意识、科学态度与社会责任意识的化学核心素养。
1.通过海带提碘活动和海水提溴工艺流程的设计,建立真实复杂系统中物质富集、分离、提取的基本思路。
2.通过海带提碘活动和海水提溴工艺流程的设计,体会元素周期律、元素周期表在解决实际问题中的价值。
学 习 · 目 标
1. Br2、I2的物理性质
色、态 密度 溶解性 特性
溴
碘
深红棕色液体
紫黑色固体
均比水大
易挥发
易升华
微溶于水,易溶于有机溶剂中
知识提取
2. 卤族元素化学性质的递变规律(F→I)
④单质与氢气反应的能力:
知识提取
(2)递变性
>
>
>
①单质氧化性:F2 Cl2 Br2 I2
②卤离子还原性:F- Cl- Br - I-
<
<
<
③气态氢化物稳定性:HF HCl HBr HI
(1)相似性
卤素原子最外层电子数都为7,都能形成气态氢化物(通式为HX),最高价氧化物对应的水化物化学式为HXO4(F除外),单质具有氧化性
逐渐减弱
>
>
>
溶解态元素 平均浓度
Na+ 10.62 g/kg
Mg2+ 1.29 g/kg
Ca2+ 0.412 g/kg
F- 1.3 mg/kg
Cl- 19.10 g/kg
Br- 67 mg/L
浩瀚的海洋里蕴藏着丰富的化学资源。我国大陆海岸线长达18000 km,海岛海岸线长达14000 km,这为我国开发利用海洋化学资源提供了良好的自然条件。目前,我国利用海洋资源获取钾、镁、溴等元素已成规模。
情·境·引·入
项目活动 1
海带提碘
海带、紫菜等藻类植物中含有丰富的碘元素,其中,海带产量高、价格低,常用作提取碘单质的原料。碘元素在海带中以碘化物的形式存在。灼烧干海带可以分解除去其中的有机物。灼烧后得到的海带灰中,除了存在可溶性碘化物外,还存在多种可溶性无机盐。
项目活动 1
海带提碘
1.如何证明海带灰溶液中含有I- ?为了将 I- 转化成I2,可用选用哪些化学试剂?选择的依据是什么?
2.设计实验方案,并用流程图表示从海带灰中提取碘单质得到含碘单质溶液的实验流程。
项目活动 1
海带提碘
1.如何证明海带灰溶液中含有I- ?为了将 I- 转化成I2,可用选用哪些化学试剂?选择的依据是什么?
①AgNO3溶液和稀HNO3
②氯水和淀粉溶液
③氯水和CCl4溶液
中学常见的氧化剂:酸性高锰酸钾溶液、重铬酸钾溶液、浓硫酸、硝酸、溴水、氯水、次氯酸溶液、双氧水等
可选用:酸性高锰酸钾溶液、Cl2、双氧水、硝酸等
萃取与分液
方 法 导 引
利用某种溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂(萃取剂)将其从原溶剂中提取出来的方法叫萃取。萃取后,可以用分液漏斗将上述两种液体分开,从而达到提取某种物质的目的。
(1)加萃取剂
(2)振荡萃取
(3)静置分层
(4)分液
萃取与分液
(1)加萃取剂
萃取剂必须具备三个条件:
①萃取剂和原溶剂互不相溶、不反应
②萃取剂和溶质互不发生反应
③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度
方 法 导 引
萃取与分液
(1)加萃取剂
(2)振荡萃取
(3)静置分层
(4)分液
①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出
④上层液体要从上口倒出,保证上层液体尽量少的沾附下层液体
方 法 导 引
物质分离提纯的基本思路
1. 物质分离和提纯的基本原则
①“不增”:不引入新的杂质
②“不减”:不减少被提纯物质
③“易分离”:被提纯物质与杂质易分离
④“易复原”:被提纯物质易复原
知识提取
2. 物质分离和提纯的要求
①“过量” :为除尽杂质,除杂试剂要过量
②“后除前”:后加入的试剂要把前面过量的试剂除尽
3. 物质分离和提纯的基本方法
①物理方法:过滤法、蒸发结晶法、蒸馏法、升华法、萃取分液法等
②化学方法:沉淀法、洗气法、酸碱法、氧化还原法、电解法、离子交换法等
知识提取
物质分离提纯的基本思路
项目活动成果展示
浸 取
过 滤
氧 化
海
带
海
带
灰
含I- 的水溶液
固体残留物
含I2 的水溶液
I2 的CCl4溶液
水 溶 液
萃 取
1.第①步灼烧海带需要哪些仪器?
2.第②步获取含I-溶液的操作名称是什么?
4.第④步实验操作的名称是什么?如何从I2 的CCl4溶液进一步提取碘单质呢?
灼烧
①
水
②
氯水
③
CCl4
④
3.第③步发生的反应是什么?
I2的沸点 184℃
CCl4的沸点 76.8℃
反萃取法提取碘单质
在“海带提碘”的实验中,通常以四氯化碳为萃取剂对碘单质进行萃取、富集。那么,如何将碘单质从碘的四氯化碳溶液中提取出来呢?要解决这一问题,可以采用反萃取法,具体步骤如下:
拓
视
野
展
浓NaOH溶液
水层:
含I- 、IO3-
四氯化碳
I2 的CCl4
溶液
45%的
H2SO4溶液
含I2 的
悬浊液
过滤
碘单质
①加入浓NaOH溶液时发生的反应为3I2+6OH- === 5I-+IO3-+3H2O
②加入45%的H2SO4溶液时发生的反应为5I-+IO3-+6H+===3I2+3H2O
I2的CCl4溶液
海带
海带灰
海带灰
悬浊液
含I-溶液
含I2 溶液
灼烧
浸取
氧化
过滤
萃取
待分离体系
目标物
杂质
选择
物理方法
化学方法
分析
性
质
差
异
分离提纯方法
规 律 总 结
物质分离提纯的基本思路
项目活动 2
海水提溴
溴是海水中重要的非金属元素。地球上99%的溴元素以Br - 的形式存在于海水中,人们把溴称为“海洋元素”。目前,从海水中提取的溴占世界溴年产量的1/3左右。苦卤是海水制盐业的副产品,其中含有高浓度的K+、Mg2+、Br-和等,是从海水中提取溴的主要原料。
请用流程图表示你设计的从苦卤中提取溴单质的实验方案。
海洋元素
方案设计
苦卤(Br-)
含Br2溶液
CCl4
Br2的CCl4溶液
蒸馏
Br2单质
常见氧化剂价格(万元/吨)
氧化剂 Cl2 KMnO4
价格 20.15 43.40
Br2的沸点 58.76℃
CCl4的沸点 76.8℃
氧化剂
项目活动 2
海水提溴
空 气 吹 出 法
浓缩
氧化
富集
提取
海水晒盐和海水淡化的过程中副产物 Br - 得到浓缩
向经酸化、浓缩的海水中通入氯气,将Br -氧化为Br2
通入热空气和水蒸气用SO2吸收剂吸收
再用氯气将HBr氧化得到产品溴
为什么往海水中鼓入热空气或水蒸气可获得粗溴?在实验室中怎样从溴水中提取溴?
项目活动 2
海水提溴
空 气 吹 出 法
海水
苦卤
提取粗盐
①硫酸酸化
②氯气氧化
含Br2的海水
③通入空气和水蒸气
吸收塔
④通入吸收剂SO2
⑤氯气氧化
溴水混合物
⑥蒸馏
溴单质
②:2Br -+Cl2 === 2Cl-+Br2
④:SO2 + Br2+2H2O === 2Br - ++ 4H+
产品的富集
含Br2的空气
项目活动成果展示
1. 完善自己设计的“海带提碘”和“海水提溴”的流程图和方案,展示交流。
2. 提炼、概括物质分离和提纯的基本思路;以小组为单位,交流、分享对元素周期律、元素周期表在物质分离和提纯中应用价值的体会。
通电
海带提碘 ①流程:海带→灼烧→浸泡→过滤→氧化→提纯
②主要反应:2KI+Cl2===2KCl+I2
海水提溴 ①方法:在经酸化的浓缩海水中,用氯气氧化溴离子使之成为溴单质
②主要反应:2NaBr+Cl2===2NaCl+Br2
制取氯气 ①常利用电解饱和食盐水制取氯气
②2NaCl+2H2O === 2NaOH+H2↑+Cl2↑
相同点:将卤离子(Cl-、Br-、I-)氧化
为卤单质
不同点:工业上制取氯气常用电解法,
提取碘单质和溴单质常用氧化
剂氧化法
概 括 · 整 合
物质转化
资源
海水(Br -)
海带(I-)
产品
Br2
I2
待分离
体系
杂质
含量
目标物
分离提纯
纯度
问题
富集
浓度问题
概 括 · 整 合
