2024届高考化学一轮复习教案 18 第四章 第15讲 无机非金属材料(含解析)
文档属性
| 名称 | 2024届高考化学一轮复习教案 18 第四章 第15讲 无机非金属材料(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 22:49:17 | ||
图片预览




文档简介
INCLUDEPICTURE "1-4章.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\1-4章.TIF" \* MERGEFORMATINET
第15讲 无机非金属材料
[课程标准] 1.了解硅酸盐材料及新型无机非金属材料的性质和用途。2.掌握硅和二氧化硅的性质及应用,了解高纯硅的制备。
考点一 硅和二氧化硅
INCLUDEPICTURE "要点梳理.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\要点梳理.TIF" \* MERGEFORMATINET
一、硅单质
1.存在:硅单质主要有晶体和无定形两大类。
2.物理性质:带有金属光泽的灰黑色固体,熔点高,硬度大,有脆性。
3.化学性质
(1)常温下不活泼,一般不与其他物质反应,但可以与氟气、氢氟酸、碱反应,反应的化学方程式分别为:
与氟气:Si+2F2===SiF4;
与氢氟酸:Si+4HF===SiF4↑+2H2↑;
与碱:Si+2NaOH+H2O===Na2SiO3+2H2↑。
(2)在加热或者点燃的条件下可以与氢气、氧气、氯气等反应,与氧气反应的化学方程式为Si+O2SiO2。
4.硅的工业制法及提纯
涉及的化学方程式:
①SiO2+2CSi+2CO↑;
②Si+3HClSiHCl3+H2;
③SiHCl3+H2Si+3HCl。
5.用途
(1)良好的半导体材料;
(2)太阳能电池;
(3)计算机芯片。
二、二氧化硅
1.存在
(1)自然界中,碳元素既有游离态,又有化合态,而硅元素仅有化合态,主要以氧化物和硅酸盐的形式存在。
(2)天然SiO2有晶体和无定形两种,统称硅石。
2.物理性质:熔点高,硬度大,难溶于水。
3.化学性质
(1)SiO2可以与碱反应,生成硅酸盐,如与氢氧化钠反应的化学方程式为SiO2+2NaOH===Na2SiO3+H2O。
(2)在高温条件下可以与碳酸盐反应,如与碳酸钙反应的化学方程式为SiO2+CaCO3CaSiO3+CO2↑。
(3)在高温条件下,能够与碱性氧化物反应,如与氧化钙反应的化学方程式为SiO2+CaOCaSiO3。
(4)常温下与氢氟酸反应的化学方程式为SiO2+4HF===SiF4↑+2H2O。
4.用途:光导纤维、光学仪器等。
[正误辨析]
(1)工业上用焦炭和二氧化硅制取粗硅时生成粗硅和CO2气体( )
(2)Si是半导体材料,可用作太阳能电池( )
(3)SiO2与NaOH溶液反应生成盐和水,也可以和氢氟酸反应,所以SiO2是两性氧化物 ( )
(4)因为热稳定性:CH4>SiH4,所以非金属性:C>Si( )
(5)SiO2能与HF反应,因此可用HF刻蚀玻璃( )
学生用书?第69页
(6)NaOH溶液不能用玻璃瓶盛放( )
(7)高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”( )
(8)SiO2是H2SiO3的酸酐,所以SiO2和水反应生成H2SiO3( )
答案: (1)× (2)√ (3)× (4)√ (5)√ (6)× (7)√ (8)×
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\核心突破.TIF" \* MERGEFORMATINET
硅的制备与提纯
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式:
________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出化学反应方程式: _______________________________________________
________________________________________________________________________;
H2还原SiHCl3过程中若混有O2,可能引起的后果是_______________________________。
(2)化学研究性学习小组在探究硅的制取方法时,从资料查阅到下列信息:
Ⅰ.Mg在高温条件下可与SiO2反应;
Ⅱ.金属硅化物与稀H2SO4反应生成硫酸盐和SiH4;
Ⅲ.SiH4在空气中自燃。
他们根据信息进行实验,当用足量稀H2SO4溶解第Ⅰ步实验获得的固体产物时,发现有爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。
①第Ⅰ步实验发生反应的化学方程式是_______________________________________
________________________________________________________________________。
②用稀H2SO4溶解第Ⅰ步实验获得的固体产物时,产生爆鸣声和火花的原因是________________________________________________________________________
________________________________________________________________________。
答案: (1)①SiHCl3+H2Si+3HCl
②SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸
(2)①2Mg+SiO22MgO+Si、2Mg+SiMg2Si
②硅化镁与稀硫酸反应生成的SiH4可自燃,即发生反应Mg2Si+2H2SO4===2MgSO4+SiH4↑,SiH4+2O2===SiO2+2H2O
考点二 无机非金属材料
INCLUDEPICTURE "要点梳理.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\要点梳理.TIF" \* MERGEFORMATINET
一、硅酸盐材料
1.陶瓷
陶瓷以黏土(主要成分为含水的铝硅酸盐)为主要原料,经高温烧结而成的。
2.玻璃
普通玻璃的主要成分为Na2SiO3、CaSiO3和SiO2,它是以纯碱、石灰石和石英砂为主要原料,经混合、粉碎,在玻璃窑中熔融,发生复杂的物理变化和化学变化而制得的。玻璃可用于生产建筑材料、光学仪器和各种器皿,还可制造玻璃纤维,用于高强度复合材料等。
3.水泥
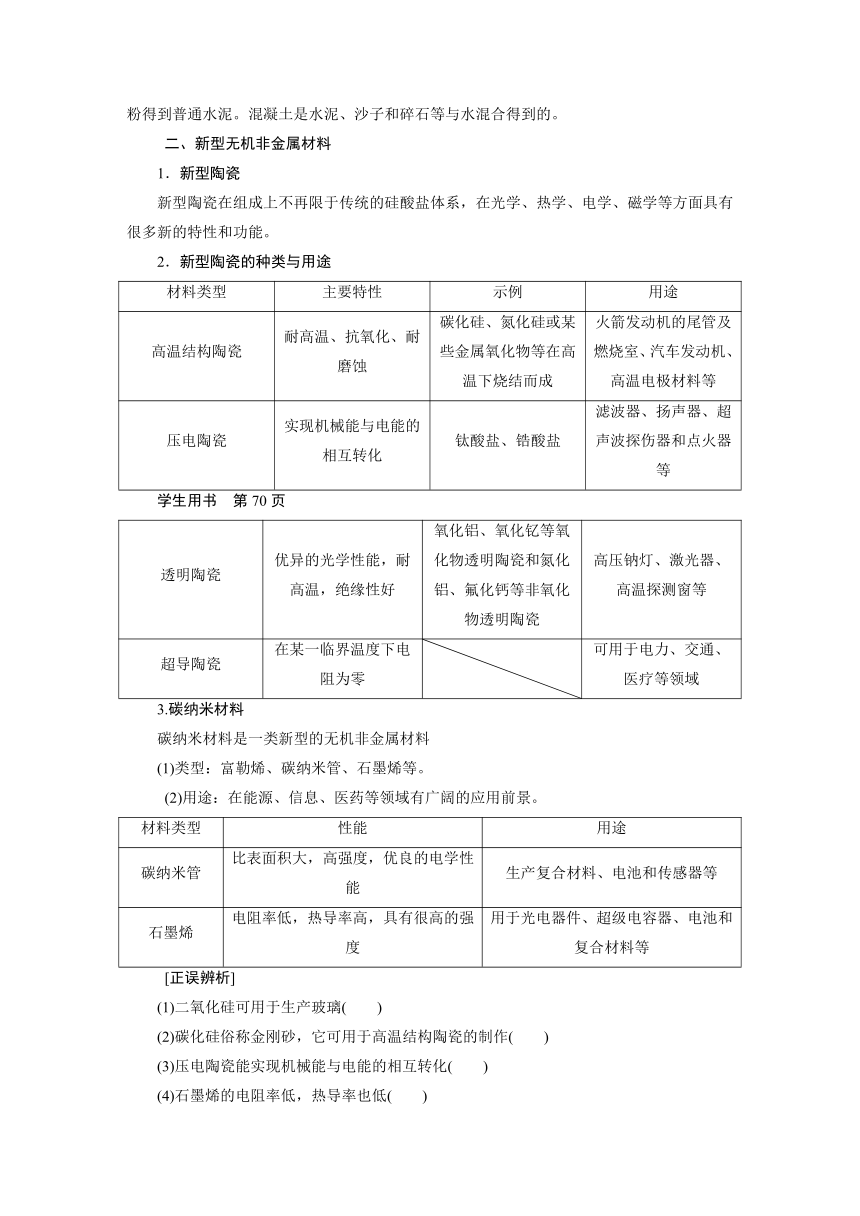
普通硅酸盐水泥的主要原料是黏土和石灰石,二者与其他辅料经混合、研磨后在水泥回转窑中煅烧,发生复杂的物理变化和化学变化,加入适量石膏调节水泥硬化速率,再研成细粉得到普通水泥。混凝土是水泥、沙子和碎石等与水混合得到的。
二、新型无机非金属材料
1.新型陶瓷
新型陶瓷在组成上不再限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能。
2.新型陶瓷的种类与用途
材料类型 主要特性 示例 用途
高温结构陶瓷 耐高温、抗氧化、耐磨蚀 碳化硅、氮化硅或某些金属氧化物等在高温下烧结而成 火箭发动机的尾管及燃烧室、汽车发动机、高温电极材料等
压电陶瓷 实现机械能与电能的相互转化 钛酸盐、锆酸盐 滤波器、扬声器、超声波探伤器和点火器等
学生用书?第70页
透明陶瓷 优异的光学性能,耐高温,绝缘性好 氧化铝、氧化钇等氧化物透明陶瓷和氮化铝、氟化钙等非氧化物透明陶瓷 高压钠灯、激光器、高温探测窗等
超导陶瓷 在某一临界温度下电阻为零 可用于电力、交通、医疗等领域
3.碳纳米材料
碳纳米材料是一类新型的无机非金属材料
(1)类型:富勒烯、碳纳米管、石墨烯等。
(2)用途:在能源、信息、医药等领域有广阔的应用前景。
材料类型 性能 用途
碳纳米管 比表面积大,高强度,优良的电学性能 生产复合材料、电池和传感器等
石墨烯 电阻率低,热导率高,具有很高的强度 用于光电器件、超级电容器、电池和复合材料等
[正误辨析]
(1)二氧化硅可用于生产玻璃( )
(2)碳化硅俗称金刚砂,它可用于高温结构陶瓷的制作( )
(3)压电陶瓷能实现机械能与电能的相互转化( )
(4)石墨烯的电阻率低,热导率也低( )
(5)传统的无机非金属材料均为硅酸盐材料( )
答案: (1)√ (2)√ (3)√ (4)× (5)×
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\核心突破.TIF" \* MERGEFORMATINET
一、传统无机非金属材料
1.(2022·河南焦作一模)下列有关玻璃的说法中正确的是( )
A.普通玻璃的原料是烧碱、石英、石灰石
B.普通玻璃和石英玻璃都属于硅酸盐产品
C.制备普通玻璃时的反应有Na2CO3+SiO2CO2↑+Na2SiO3
D.普通玻璃用于镶嵌建筑物的门窗、墙面,但其不具有保温和防辐射等特征
C [A.制造普通玻璃的主要原料:纯碱、石灰石和石英,A项错误;B.石英玻璃的主要成分是二氧化硅,B项错误;C.制造普通玻璃的主要原料:纯碱、石灰石和石英,则反应有Na2CO3+SiO2CO2↑+Na2SiO3,C项正确;D.普通玻璃具有透光、隔热、隔声、耐磨、耐气候变化的性能,有的还有保温、吸热、防辐射等特征,D项错误。]
2.玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是( )
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
C [陶瓷是人类最早使用的硅酸盐制品,A项错误;纯碱、石灰石和石英是制玻璃的原料,而制水泥的原料是黏土和石灰石,B项错误;硅酸盐制品性质稳定、熔点高,C项正确;沙子的主要成分是SiO2,黏土的主要成分是硅酸盐,D项错误。]
二、新型无机非金属材料
3.在20世纪90年代末,科学家发现碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是( )
A.金刚石和石墨的熔点肯定比C60高
B.熔点:C60<C70<C90
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于共价晶体;C60、C70、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
D [金刚石属于共价晶体,石墨属于混合晶体,C60属于分子晶体,因此金刚石和石墨的熔点肯定要比C60高,故A正确;分子晶体的相对分子质量越大,熔点越高,因此熔点:C60<C70<C90,故B正确;球碳分子、管状碳分子和洋葱状碳分子都是碳元素形成的不同单质,所以均为碳的同素异形体,故C正确;金刚石属于共价晶体,不存在分子,C60、C70、管状碳分子和洋葱状碳分子都是分子晶体,以分子形式存在,都是碳元素形成的不同单质,互为同素异形体,故D错误。]
4.(2022·全国高三专题练习)硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(2)一种工业用硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1 420 ℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的主要工艺流程如下:
学生用书?第71页
①净化N2和H2时,铜屑的作用是__________________________________________,
硅胶的作用是____________________________________________________________。
②在氮化炉中发生反应3SiO2(s)+2N2(g)===Si3N4(s)+3O2(g) ΔH=-727.5 kJ·mol-1,开始时,严格控制氮气的流速以控制温度的原因是________________________________
________________________________________________________________________;
体系中要通入适量的氢气是为了____________________________________________
________________________________________________________________________。
③X可能是________(填“盐酸”“硝酸”“硫酸”或“氢氟酸”)。
解析: (1)根据原子个数守恒可写出化学方程式3SiCl4+2N2+6H2===Si3N4+12HCl。(2)①由于氧气和水蒸气都能腐蚀氮化硅,而氮气和氢气中含有水蒸气和氧气,所以铜屑的作用是除去氧气,硅胶的作用是除去水蒸气。②因为该反应是放热反应,如果温度过高,局部过热,会导致硅熔化成团,阻碍与N2的接触;通入氢气能将体系中的氧气转化为水蒸气,而易被除去。③由于工业用硅中含有铜的氧化物,在反应中氧化铜能被还原生成铜,因此要除去铜应该选择硝酸,盐酸和硫酸不能溶解铜,氢氟酸能腐蚀氮化硅。
答案: (1)3SiCl4+2N2+6H2===Si3N4+12HCl (2)①除去原料气中的氧气 除去生成的水蒸气 ②该反应是放热反应,防止局部过热,导致硅熔化成团,阻碍与N2的接触 将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽) ③硝酸
真题演练 明确考向
1.正误判断,正确的打“√”,错误的打“×”
(1)(2022·浙江卷8A)晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维( )
(2)(2022·广东卷2B)飞船返回舱表层材料中的玻璃纤维属于天然有机高分子( )
(3)(2022·广东卷12A)用焦炭和石英砂制取粗硅,SiO2可制作光导纤维( )
(4)(2022·河北卷3A)制造5G芯片的氮化铝晶圆属于无机非金属材料( )
(5)(2022·湖南卷2D)石灰石是制造玻璃和水泥的主要原料之一( )
(6)(2022·江苏卷7B)单晶硅熔点高,所以可用作半导体材料( )
(7)(2022·辽宁卷1A)冰壶主材料花岗岩属于无机非金属材料( )
(8)(2022·辽宁卷1B)火炬“飞扬”使用的碳纤维属于有机高分子材料( )
答案: (1)× (2)× (3)√ (4)√ (5)√ (6)× (7)√ (8)×
2.(2022·河北卷)定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )
A.传统陶瓷是典型的绝缘材料
B.陶瓷主要成分为MgO和SiO2
C.陶瓷烧制的过程为物理变化
D.白瓷的白色是因铁含量较高
A [A.陶瓷是良好的绝缘体,传统陶瓷是典型的绝缘材料,常用于高压变压器的开关外包装和器件,A正确;B.陶瓷的主要成分为硅酸盐,而不是SiO2和MgO,B错误;C.陶瓷烧制过程发生复杂化学反应,有新物质生成,属于化学变化,C错误;D.由于Fe2+、Fe3+和铁的氧化物均有颜色,故陶瓷中含铁量越多,陶瓷的颜色越深,白瓷的白色是因为铁含量较低甚至几乎不含铁,D错误。]
3.(2022·广东卷)广东一直是我国对外交流的重要窗口,馆藏文物是其历史见证。下列文物主要由硅酸盐制成的是( )
文物
选项 A.南宋鎏金饰品 B.蒜头纹银盒 C.广彩瓷咖啡杯 D.铜镀金钟座
C [A.鎏金饰品是用金汞合金制成的金泥涂饰器物的表面,经过烘烤,汞蒸发而金固结于器物上的一种传统工艺,其中不含硅酸盐,故A项不符合题意;B.蒜头纹银盒中主要成分为金属银,其中不含硅酸盐,故B项不符合题意;C.广彩瓷咖啡杯主要由陶瓷制成,其主要成分为硅酸盐,故C项符合题意;D.铜镀金钟座是铜和金等制得,其中不含硅酸盐,故D项不符合题意。]
4.(2021·浙江1月选考,21)铝硅酸盐型分子筛中有许多笼状空穴和通道(如图),其骨架的基本结构单元是硅氧四面体和铝氧四面体,化学组成可表示为
Ma[(AlO2)x·(SiO2)y]·zH2O(M代表金属离子)。
下列推测不正确的是( )
A.常采用水玻璃、偏铝酸钠在强酸溶液中反应后结晶制得分子筛
B.若a=x/2,则M为二价阳离子
C.调节y/x(硅铝比)的值,可以改变分子筛骨架的热稳定性
D.分子筛中的笼状空穴和通道,可用于筛分分子
A [A.偏铝酸钠在强酸性溶液中不能稳定存在,容易形成Al3+,不可以利用偏铝酸钠在强酸性溶液中制备分子筛,A错误;B.设M的化合价为m,则根据正负化合价代数和为0计算,m×+x×(-1)=0,解得m=+2,B正确;C.调节硅铝比可以改变分子筛的空间结构,从而改变分子筛的热稳定性,C正确;D.调节硅铝比可以调节分子筛的孔径,根据分子筛孔径的大小可以筛分不同大小的分子,D正确。]
5.(全国卷Ⅱ,26节选)水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
________________________________________________________________________,
还可使用________代替硝酸。
(2)沉淀A的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
解析: (1)水泥熟料中的CaO和铁、铝、镁等金属的氧化物均能溶于盐酸,加入硝酸能将水泥样品中可能含有的Fe2+氧化为Fe3+,为了不引入新杂质,还可用H2O2代替硝酸。(2)根据图示流程可知,不溶于盐酸和硝酸的沉淀A为SiO2(或H2SiO3),SiO2(或H2SiO3)能溶于弱酸氢氟酸,生成SiF4和H2O。
答案: (1)将样品中可能存在的Fe2+氧化为Fe3+ H2O2
(2)SiO2(或H2SiO3) SiO2+4HF===SiF4↑+2H2O(或H2SiO3+4HF===SiF4↑+3H2O)
课时精练(十五) 无机非金属材料
(本栏目内容,在学生用书中以独立形式分册装订!)
1.文物是传承文化的重要载体,下列主要成分不是硅酸盐的文物是( )
A.简牍 B.陶彩绘女舞俑 C.霁红釉瓷碗 D.梅瓶
A [简牍主要成分为植物纤维,A符合题意;陶彩绘女舞俑,为陶制品,为硅酸盐材料,B不符合题意;霁红釉瓷碗,材料为陶瓷,为硅酸盐材料,C不符合题意;梅瓶是瓷器,为硅酸盐材料,D不符合题意。]
2.(2022·上海三模)由于石墨烯独特的结构,在石墨烯薄膜上施加较低的电压(1~10 V)即可产生较高的热量,平昌冬奥会“北京8分钟”主创团队用石墨烯制作了20 ℃能发热4 h的智能服饰,向世界展现了新时代的中国形象,下列说法中错误的是( )
A.石墨烯是能导热的金属材料
B.石墨烯属于单质
C.石墨烯能导电
D.在石墨烯薄膜上施加电压,使电能转化为热能
A [A.石墨烯属于碳单质,是能够导热的非金属材料,A错误;B.石墨烯是碳的单质,B正确;C.石墨烯属于碳单质,碳单质具有良好的导电性,可以导电,C正确;D.根据题干信息可知,在石墨烯薄膜上施加较低的电压(1~10 V)即可产生较高的热量,使电能转化为热能,D正确。]
3.(2022·河南省濮阳市高三模拟)2022年2月在北京举办的冬季奥运会中,使用了许多功能各异的材料,下列有关材料的描述中不正确的是( )
A.陶瓷、玻璃、水泥属于传统的无机非金属材料
B.石墨烯、富勒烯和碳纳米管属于新型有机非金属材料
C.硅是应用最为广泛的半导体材料
D.通讯中使用的光导纤维,主要成分为SiO2
B [玻璃、陶瓷、水泥的主要成分是硅酸盐类,都属于传统的无机非金属材料,A正确;碳纳米管、富勒烯和石墨烯都是新型无机非金属材料,B不正确;晶体硅导电性介于导体与绝缘体之间,是应用最广泛的良好的半导体材料,C正确;光导纤维的主要成分是二氧化硅,D正确。]
4.下列有关硅材料的说法正确的是( )
A.光纤的主要成分是高纯度的单质硅
B.金刚砂的主要成分是二氧化硅
C.28 g硅含有6.02×1023个电子
D.28Si、29Si、30Si是不同的核素
D [光纤的主要成分是二氧化硅,A错误;金刚砂的主要成分是碳化硅,B错误;28 g硅的物质的量是1 mol,其中含有14×6.02×1023个电子,C错误;28Si、29Si、30Si的质子数相同,但中子数不同,是不同的核素,且互为同位素,D正确。]
5.生产生活中的各种“玻璃”的说法正确的是( )
A.钢化玻璃和普通玻璃成分不相同,但都属于硅酸盐产品
B.有机玻璃的主要成分聚甲基丙烯酸甲酯属于天然有机高分子材料
C.“水玻璃”的主要成分是硅酸钠的水溶液,可用作矿物胶
D.石英玻璃熔点高、硬度大,可制作加热NaOH、Na2CO3等固体的仪器
C [钢化玻璃是将普通玻璃高温后骤降温度得到,二者成分相同,都属于硅酸盐产品,A错误;有机玻璃属于有机合成高分子材料,B错误;“水玻璃”的主要成分是硅酸钠的水溶液,可用作矿物胶,C正确;石英玻璃主要成分是二氧化硅,属于酸性氧化物,会与NaOH、Na2CO3等碱性物质发生反应,所以不能制作加热NaOH、Na2CO3等固体的仪器,D错误。]
6.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窖中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是( )
A.粘土是制作砖瓦和陶瓷的主要原料
B.“燃薪举火”使粘土发生复杂的物理和化学变化
C.沙子和粘土的主要成分均为硅酸盐
D.烧制后自然冷却成红瓦,浇水冷却成青瓦
C [制作砖瓦和陶瓷的主要原料是粘土,故A正确;粘土的主要成分均为硅酸盐,灼烧使粘土发生复杂的物理和化学变化,故B正确;沙子的主要成分是二氧化硅,粘土的主要成分为硅酸盐,故C错误;浇水转釉(主要为青色),与造砖同法,所以烧制后自然冷却成红瓦,浇水冷却成青瓦,故D正确。]
7.高纯度晶硅是典型的无机非金属材料,又称“半导体”材料。它的发现和使用曾引起计算机的一场“革命”。可以按下列方法制备:
SiO2Si(粗)SiHCl3Si(纯)
下列说法不正确的是( )
A.步骤①的化学方程式为SiO2+CSi+CO2↑
B.步骤①中每生成1 mol Si转移4 mol电子
C.高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
A [二氧化硅高温下与C反应生成CO气体,即步骤①的化学方程式为SiO2+2CSi+2CO↑,故A错误;步骤①中Si的化合价降低4,则每生成1 mol Si转移电子数为4 mol,故B正确;高纯硅是半导体材料,是制造集成电路、太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料,故C正确;沸点相差30 ℃以上的两种液体可以采用蒸馏(或分馏)的方法分离,故D正确。]
8.水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:
下列说法正确的是( )
A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B.操作A与操作B完全相同
C.该流程中硅元素的化合价发生改变
D.反应器中发生的复分解反应为SiO2+2NaOH===Na2SiO3+H2O
A [稻壳灰来源广泛价格低廉,活性炭具有吸附性,有较高的经济价值,A正确;操作A为过滤,操作B为蒸发浓缩,是两种不同的操作,B错误;二氧化硅中,硅元素的化合价是+4价,硅酸钠中,硅元素的化合价是+4价,所以该流程中硅元素的化合价没有发生改变,C错误;复分解反应是指由两种化合物相互交换成分,生成另外两种新的化合物的反应,反应SiO2+2NaOH===Na2SiO3+H2O不属于复分解反应,D错误。]
9.(2022·江苏模拟预测)“十四五”工作报告强调,中国将加速建设新能源供给消化吸纳体系。硅基能源逐步取代碳基能源的革命,必须举全国之力破解芯片技术受制于人的困局。以下说法不正确的是( )
A.碳基能源主要指煤、石油、天然气,我国的煤炭资源储量优于石油
B.硅在地壳中的含量仅次于氧,从沙滩到用户,硅发生了还原反应
C.半导体工艺中一般需要在晶硅中掺杂第ⅢA族与第ⅤA族元素
D.半导体工艺中用刻蚀剂——电子级氟化氢可加压保存在玻璃罐体中
D [A.碳基能源主要指煤、石油、天然气,我国的煤炭储量及开发技术均优于石油,A说法正确;B.硅在地壳中的含量仅次于氧,从沙滩到用户,硅由SiO2转化为硅单质,化合价下降,发生了还原反应,B说法正确;C.晶硅中掺杂第ⅢA族与第ⅤA族元素,形成PN结,在接通电源或受光的激发,自由电子可向空穴方向移动(单向移动) (见图),
C说法正确;D.氟化氢可与玻璃容器中二氧化硅发生反应,故D说法错误。]
10.(2022·天津市和平区三模)制造芯片用到高纯硅,用SiHCl3(沸点:31.85 ℃,SiHCl3遇水会剧烈反应,易自燃)与过量H2在1 100~1 200 ℃反应制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法不正确的是( )
A.整个实验的关键是控温、检查装置气密性和排尽装置中的空气
B.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、温度高于32 ℃的温水
C.实验时,先打开装有稀硫酸仪器的活塞,收集尾气验纯,再预热装置Ⅳ石英管
D.尾气处理可直接通入NaOH溶液中
D [由实验装置可知,Ⅰ中Zn与稀硫酸反应生成氢气,Ⅱ中浓硫酸干燥氢气,Ⅲ中汽化的SiHCl3与过量H2混合,Ⅳ中高温下反应制备高纯硅,且SiHCl3遇水发生反应SiHCl3+3H2O===H2SiO3+H2↑+3HCl。A项,SiHCl3的沸点为31.85 ℃,且易自燃,因而整个实验的关键是控温、检查装置气密性和排尽装置中的空气,故A正确;B项,装置Ⅱ中浓H2SO4可干燥氢气,Ⅲ中盛装温度高于32 ℃的温水,目的是使滴入烧瓶中的SiHCl3汽化,与氢气反应,故B正确;C项,实验时应先打开装有稀硫酸仪器的活塞制取氢气,用氢气将装置内的空气排出,收集尾气验纯,再预热装置Ⅳ石英管,防止氢气不纯加热易爆炸,故C正确;D项,SiHCl3与氢气在1 100~1 200 ℃反应制备高纯硅,因而处理尾气时,应该在通入NaOH溶液前加上防倒吸装置,故D错误。]
11.(2022·浙江省选考模拟)硅胶吸附剂的结构示意图如图所示,常用作干燥剂。在其中添加CoCl2可使其指示吸水量的多少来决定硅胶是否失效,原理如下:CoCl2(蓝色)===CoCl2·6H2O(粉红色),失效的硅胶可加热再生,下列说法错误的是( )
A.当硅胶变粉红色说明硅胶失效了
B.SiO2是酸性氧化物,硅胶可干燥HF和Cl2等酸性气体
C.失效的硅胶再生时加热的温度不宜过高
D.当硅胶遇到大量的水分子时,与硅羟基形成了过多氢键从而失去吸附力
B [由题中信息可知,硅胶吸水后,会变成粉红色的CoCl2·6H2O,故变成粉红色后则说明硅胶失效了,A正确;二氧化硅可以和HF反应,故硅胶不能干燥HF,B错误;温度过高会因显色剂逐步氧化而失去显色作用,C正确;由硅胶结构可知,硅胶用作干燥剂,是通过硅羟基和水分子之间形成氢键而达到吸水的目的,故当硅胶遇到大量的水分子时,与硅羟基形成了过多氢键从而失去吸附力,D正确。]
12.中国努力争取2060年前实现碳中和。利用NaOH溶液喷淋捕捉空气中的CO2,反应过程如图所示。下列说法错误的是( )
A.捕捉室中NaOH溶液喷成雾状有利于吸收CO2
B.环节a中物质分离的基本操作是蒸发结晶
C.反应过程中CaO和NaOH是可循环的物质
D.可用Na2CO3溶液代替NaOH溶液捕捉CO2
B [利用NaOH溶液实现“碳捕获”吸收器中,NaOH溶液用喷淋方式加入,增大反应物之间的接触面积,充分吸收二氧化碳,环节a中,氧化钙与水反应生成氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,Na2CO3发生反应的化学方程式为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,CaCO3需从溶液中过滤出来再高温煅烧,生成的CO2循环使用。A项,NaOH溶液喷成雾状,可增大反应接触面积,提高CO2吸收率,A正确;B项,环节a为Na2CO3和Ca(OH)2反应生成CaCO3,需从溶液中过滤出来再高温煅烧,故基本操作不是蒸发结晶,B错误;C项,NaOH和CaO在流程中既有消耗,也有生成,可循环利用,C正确;D项,Na2CO3可以和CO2反应,因此可用Na2CO3溶液代替NaOH溶液,D正确。]
13.硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为____________________;
(2)常温下,不能与R单质发生反应的是________(填字母);
A.CuCl2溶液 .Fe2O3
C.浓硫酸 .Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式_________
________________________________________________________________________。
(4)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮元素的化合价为________。
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由: __________________
________________________________________________________________________。
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:
________SiO2+________C+________N2________Si3N4+________CO
(7)如果上述反应在10 L的密闭容器中进行,一段时间后测得气体密度增加了2.8 g/L,则制得的Si3N4质量为________。
解析: 一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24,M为+1价,R为+3价,则说明M为Na,R为Al。(1)该硅酸盐中同周期元素是Na、Al、Si,根据同周期从左向右原子半径逐渐减小,则原子半径由大到小的顺序为r(Na)>r(Al)>r(Si);(2)常温下,铝与氯化铜反应生成氯化铝和铜单质,铝与氧化铁常温不反应,铝常温下与浓硫酸发生钝化反应,铝常温下与碳酸钠不反应,因此不能与R单质发生反应的是BD;(3)M、R两种元素的最高价氧化物对应的水化物分别为氢氧化钠和氢氧化铝,两者反应的离子方程式OH-+Al(OH)3===AlO+2H2O;(4)Si3N4晶体中只有极性共价键,氮非金属性比硅强,硅为+4价,根据化合物为电中性,则氮元素的化合价为-3;(5)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。C3N4的结构与Si3N4相似,说明两者都是共价晶体,碳原子半径比硅原子半径小,键长短,键能大,则C3N4熔点比Si3N4熔点高;(6)碳化合价由0价变为+2价,氮化合价由0价变为-3价,则碳升高2个价态,Si3N4降低12个价态,因此碳系数配6,Si3N4系数配1,根据硅和氮守恒配SiO2系数为3,N2系数为2,再根据碳守恒配CO系数为6,则为3SiO2+6C+2N21Si3N4+6CO,其电子转移为 (或);(7)根据反应方程式3SiO2+6C+2N2Si3N4+6CO分析得到气体质量增加112 g,则生成1 mol Si3N4即140 g,如果上述反应在10 L的密闭容器中进行,一段时间后测得气体密度增加了2.8 g/L,则气体质量增加了28 g,则制得的Si3N4质量为=35 g。
答案: (1)r(Na)>r(Al)>r(Si) (2)BD
(3)OH-+Al(OH)3===AlO+2H2O (4)-3
(5)C3N4熔点比Si3N4熔点高,原因为两者都是共价晶体,碳原子半径比硅原子半径小,键长短,键能大,因此C3N4熔点比Si3N4熔点高
(6)3SiO2+6C+2N2Si3N得到4×3e-4+6C失去6×2e-O
(或3SiO2+6C+2N212e-Si3N4+6CO) (7)35 g
14.Ⅰ.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
SiO2Si(粗)SiHCl3Si(纯)
(1)写出步骤①的化学方程式: _____________________________________________
________________________________________________________________________。
(2)步骤②经过冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3的主要化学操作的名称是________;SiHCl3和SiCl4一样,遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,试写出其水解的化学方程式:________________________________________________________________________
________________________________________________________________________。
Ⅱ.白炭黑(SiO2·H2O)广泛应用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg6(Si4O10)(OH)8]来制取,其主要工艺流程如图所示:
(3)蛇纹石用氧化物形式可表示为__________________________________________。
(4)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法:
①________________________________________________________________________;
②________________________________________________________________________
(任举两种)。
(5)过滤Ⅰ得到的滤液的主要成分是____________________________________________。
(6)滤液与盐酸反应的主要离子方程式为_____________________________________
________________________________________________________________________。
(7)洗涤时,如何证明产品已洗涤干净? ____________________________________
________________________________________________________________________。
解析: (2)SiHCl3(沸点33.0 ℃)、SiCl4(沸点57.6 ℃)、HCl(沸点-84.7 ℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏;SiHCl3水解生成硅酸、氢气和氯化氢,反应方程式为:SiHCl3+3H2O===H2SiO3+H2↑+3HCl↑;(3)用氧化物形式表示复杂硅酸盐的化学式时,应先用金属性强弱顺序书写氧化物,中间用“·”隔开,再写非金属氧化物,H2O放在最后,因此Mg6Si4O10(OH)8用氧化物形式表示为6MgO·4SiO2·4H2O。
答案: Ⅰ.(1)SiO2+2CSi+2CO↑ (2)蒸馏(或分馏) SiHCl3+3H2O===H2SiO3+H2↑+3HCl↑ Ⅱ.(3)6MgO·4SiO2·4H2O (4)适当升高温度 连续搅拌(或适当延长停留时间、选择合适的氢氧化钠浓度等) (5)水玻璃(或硅酸钠溶液或硅酸钠和氢氧化钠溶液) (6)SiO+2H+===H2SiO3↓ (7)取少许最后一次洗涤液,滴入1~2滴AgNO3溶液,若不出现白色浑浊,表示已洗涤干净
学生用书?第72页
第15讲 无机非金属材料
[课程标准] 1.了解硅酸盐材料及新型无机非金属材料的性质和用途。2.掌握硅和二氧化硅的性质及应用,了解高纯硅的制备。
考点一 硅和二氧化硅
INCLUDEPICTURE "要点梳理.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\要点梳理.TIF" \* MERGEFORMATINET
一、硅单质
1.存在:硅单质主要有晶体和无定形两大类。
2.物理性质:带有金属光泽的灰黑色固体,熔点高,硬度大,有脆性。
3.化学性质
(1)常温下不活泼,一般不与其他物质反应,但可以与氟气、氢氟酸、碱反应,反应的化学方程式分别为:
与氟气:Si+2F2===SiF4;
与氢氟酸:Si+4HF===SiF4↑+2H2↑;
与碱:Si+2NaOH+H2O===Na2SiO3+2H2↑。
(2)在加热或者点燃的条件下可以与氢气、氧气、氯气等反应,与氧气反应的化学方程式为Si+O2SiO2。
4.硅的工业制法及提纯
涉及的化学方程式:
①SiO2+2CSi+2CO↑;
②Si+3HClSiHCl3+H2;
③SiHCl3+H2Si+3HCl。
5.用途
(1)良好的半导体材料;
(2)太阳能电池;
(3)计算机芯片。
二、二氧化硅
1.存在
(1)自然界中,碳元素既有游离态,又有化合态,而硅元素仅有化合态,主要以氧化物和硅酸盐的形式存在。
(2)天然SiO2有晶体和无定形两种,统称硅石。
2.物理性质:熔点高,硬度大,难溶于水。
3.化学性质
(1)SiO2可以与碱反应,生成硅酸盐,如与氢氧化钠反应的化学方程式为SiO2+2NaOH===Na2SiO3+H2O。
(2)在高温条件下可以与碳酸盐反应,如与碳酸钙反应的化学方程式为SiO2+CaCO3CaSiO3+CO2↑。
(3)在高温条件下,能够与碱性氧化物反应,如与氧化钙反应的化学方程式为SiO2+CaOCaSiO3。
(4)常温下与氢氟酸反应的化学方程式为SiO2+4HF===SiF4↑+2H2O。
4.用途:光导纤维、光学仪器等。
[正误辨析]
(1)工业上用焦炭和二氧化硅制取粗硅时生成粗硅和CO2气体( )
(2)Si是半导体材料,可用作太阳能电池( )
(3)SiO2与NaOH溶液反应生成盐和水,也可以和氢氟酸反应,所以SiO2是两性氧化物 ( )
(4)因为热稳定性:CH4>SiH4,所以非金属性:C>Si( )
(5)SiO2能与HF反应,因此可用HF刻蚀玻璃( )
学生用书?第69页
(6)NaOH溶液不能用玻璃瓶盛放( )
(7)高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”( )
(8)SiO2是H2SiO3的酸酐,所以SiO2和水反应生成H2SiO3( )
答案: (1)× (2)√ (3)× (4)√ (5)√ (6)× (7)√ (8)×
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\核心突破.TIF" \* MERGEFORMATINET
硅的制备与提纯
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式:
________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出化学反应方程式: _______________________________________________
________________________________________________________________________;
H2还原SiHCl3过程中若混有O2,可能引起的后果是_______________________________。
(2)化学研究性学习小组在探究硅的制取方法时,从资料查阅到下列信息:
Ⅰ.Mg在高温条件下可与SiO2反应;
Ⅱ.金属硅化物与稀H2SO4反应生成硫酸盐和SiH4;
Ⅲ.SiH4在空气中自燃。
他们根据信息进行实验,当用足量稀H2SO4溶解第Ⅰ步实验获得的固体产物时,发现有爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。
①第Ⅰ步实验发生反应的化学方程式是_______________________________________
________________________________________________________________________。
②用稀H2SO4溶解第Ⅰ步实验获得的固体产物时,产生爆鸣声和火花的原因是________________________________________________________________________
________________________________________________________________________。
答案: (1)①SiHCl3+H2Si+3HCl
②SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸
(2)①2Mg+SiO22MgO+Si、2Mg+SiMg2Si
②硅化镁与稀硫酸反应生成的SiH4可自燃,即发生反应Mg2Si+2H2SO4===2MgSO4+SiH4↑,SiH4+2O2===SiO2+2H2O
考点二 无机非金属材料
INCLUDEPICTURE "要点梳理.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\要点梳理.TIF" \* MERGEFORMATINET
一、硅酸盐材料
1.陶瓷
陶瓷以黏土(主要成分为含水的铝硅酸盐)为主要原料,经高温烧结而成的。
2.玻璃
普通玻璃的主要成分为Na2SiO3、CaSiO3和SiO2,它是以纯碱、石灰石和石英砂为主要原料,经混合、粉碎,在玻璃窑中熔融,发生复杂的物理变化和化学变化而制得的。玻璃可用于生产建筑材料、光学仪器和各种器皿,还可制造玻璃纤维,用于高强度复合材料等。
3.水泥
普通硅酸盐水泥的主要原料是黏土和石灰石,二者与其他辅料经混合、研磨后在水泥回转窑中煅烧,发生复杂的物理变化和化学变化,加入适量石膏调节水泥硬化速率,再研成细粉得到普通水泥。混凝土是水泥、沙子和碎石等与水混合得到的。
二、新型无机非金属材料
1.新型陶瓷
新型陶瓷在组成上不再限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能。
2.新型陶瓷的种类与用途
材料类型 主要特性 示例 用途
高温结构陶瓷 耐高温、抗氧化、耐磨蚀 碳化硅、氮化硅或某些金属氧化物等在高温下烧结而成 火箭发动机的尾管及燃烧室、汽车发动机、高温电极材料等
压电陶瓷 实现机械能与电能的相互转化 钛酸盐、锆酸盐 滤波器、扬声器、超声波探伤器和点火器等
学生用书?第70页
透明陶瓷 优异的光学性能,耐高温,绝缘性好 氧化铝、氧化钇等氧化物透明陶瓷和氮化铝、氟化钙等非氧化物透明陶瓷 高压钠灯、激光器、高温探测窗等
超导陶瓷 在某一临界温度下电阻为零 可用于电力、交通、医疗等领域
3.碳纳米材料
碳纳米材料是一类新型的无机非金属材料
(1)类型:富勒烯、碳纳米管、石墨烯等。
(2)用途:在能源、信息、医药等领域有广阔的应用前景。
材料类型 性能 用途
碳纳米管 比表面积大,高强度,优良的电学性能 生产复合材料、电池和传感器等
石墨烯 电阻率低,热导率高,具有很高的强度 用于光电器件、超级电容器、电池和复合材料等
[正误辨析]
(1)二氧化硅可用于生产玻璃( )
(2)碳化硅俗称金刚砂,它可用于高温结构陶瓷的制作( )
(3)压电陶瓷能实现机械能与电能的相互转化( )
(4)石墨烯的电阻率低,热导率也低( )
(5)传统的无机非金属材料均为硅酸盐材料( )
答案: (1)√ (2)√ (3)√ (4)× (5)×
INCLUDEPICTURE "核心突破.TIF" INCLUDEPICTURE "E:\\2024《金版新学案》高三总复习 新教材 化学 人教版(双选)B\\图片\\1\\核心突破.TIF" \* MERGEFORMATINET
一、传统无机非金属材料
1.(2022·河南焦作一模)下列有关玻璃的说法中正确的是( )
A.普通玻璃的原料是烧碱、石英、石灰石
B.普通玻璃和石英玻璃都属于硅酸盐产品
C.制备普通玻璃时的反应有Na2CO3+SiO2CO2↑+Na2SiO3
D.普通玻璃用于镶嵌建筑物的门窗、墙面,但其不具有保温和防辐射等特征
C [A.制造普通玻璃的主要原料:纯碱、石灰石和石英,A项错误;B.石英玻璃的主要成分是二氧化硅,B项错误;C.制造普通玻璃的主要原料:纯碱、石灰石和石英,则反应有Na2CO3+SiO2CO2↑+Na2SiO3,C项正确;D.普通玻璃具有透光、隔热、隔声、耐磨、耐气候变化的性能,有的还有保温、吸热、防辐射等特征,D项错误。]
2.玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是( )
A.玻璃是人类最早使用的硅酸盐制品
B.制水泥的原料为纯碱、石灰石和石英
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
C [陶瓷是人类最早使用的硅酸盐制品,A项错误;纯碱、石灰石和石英是制玻璃的原料,而制水泥的原料是黏土和石灰石,B项错误;硅酸盐制品性质稳定、熔点高,C项正确;沙子的主要成分是SiO2,黏土的主要成分是硅酸盐,D项错误。]
二、新型无机非金属材料
3.在20世纪90年代末,科学家发现碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是( )
A.金刚石和石墨的熔点肯定比C60高
B.熔点:C60<C70<C90
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于共价晶体;C60、C70、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
D [金刚石属于共价晶体,石墨属于混合晶体,C60属于分子晶体,因此金刚石和石墨的熔点肯定要比C60高,故A正确;分子晶体的相对分子质量越大,熔点越高,因此熔点:C60<C70<C90,故B正确;球碳分子、管状碳分子和洋葱状碳分子都是碳元素形成的不同单质,所以均为碳的同素异形体,故C正确;金刚石属于共价晶体,不存在分子,C60、C70、管状碳分子和洋葱状碳分子都是分子晶体,以分子形式存在,都是碳元素形成的不同单质,互为同素异形体,故D错误。]
4.(2022·全国高三专题练习)硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(2)一种工业用硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1 420 ℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的主要工艺流程如下:
学生用书?第71页
①净化N2和H2时,铜屑的作用是__________________________________________,
硅胶的作用是____________________________________________________________。
②在氮化炉中发生反应3SiO2(s)+2N2(g)===Si3N4(s)+3O2(g) ΔH=-727.5 kJ·mol-1,开始时,严格控制氮气的流速以控制温度的原因是________________________________
________________________________________________________________________;
体系中要通入适量的氢气是为了____________________________________________
________________________________________________________________________。
③X可能是________(填“盐酸”“硝酸”“硫酸”或“氢氟酸”)。
解析: (1)根据原子个数守恒可写出化学方程式3SiCl4+2N2+6H2===Si3N4+12HCl。(2)①由于氧气和水蒸气都能腐蚀氮化硅,而氮气和氢气中含有水蒸气和氧气,所以铜屑的作用是除去氧气,硅胶的作用是除去水蒸气。②因为该反应是放热反应,如果温度过高,局部过热,会导致硅熔化成团,阻碍与N2的接触;通入氢气能将体系中的氧气转化为水蒸气,而易被除去。③由于工业用硅中含有铜的氧化物,在反应中氧化铜能被还原生成铜,因此要除去铜应该选择硝酸,盐酸和硫酸不能溶解铜,氢氟酸能腐蚀氮化硅。
答案: (1)3SiCl4+2N2+6H2===Si3N4+12HCl (2)①除去原料气中的氧气 除去生成的水蒸气 ②该反应是放热反应,防止局部过热,导致硅熔化成团,阻碍与N2的接触 将体系中的氧气转化为水蒸气,而易被除去(或将整个体系中空气排尽) ③硝酸
真题演练 明确考向
1.正误判断,正确的打“√”,错误的打“×”
(1)(2022·浙江卷8A)晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维( )
(2)(2022·广东卷2B)飞船返回舱表层材料中的玻璃纤维属于天然有机高分子( )
(3)(2022·广东卷12A)用焦炭和石英砂制取粗硅,SiO2可制作光导纤维( )
(4)(2022·河北卷3A)制造5G芯片的氮化铝晶圆属于无机非金属材料( )
(5)(2022·湖南卷2D)石灰石是制造玻璃和水泥的主要原料之一( )
(6)(2022·江苏卷7B)单晶硅熔点高,所以可用作半导体材料( )
(7)(2022·辽宁卷1A)冰壶主材料花岗岩属于无机非金属材料( )
(8)(2022·辽宁卷1B)火炬“飞扬”使用的碳纤维属于有机高分子材料( )
答案: (1)× (2)× (3)√ (4)√ (5)√ (6)× (7)√ (8)×
2.(2022·河北卷)定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )
A.传统陶瓷是典型的绝缘材料
B.陶瓷主要成分为MgO和SiO2
C.陶瓷烧制的过程为物理变化
D.白瓷的白色是因铁含量较高
A [A.陶瓷是良好的绝缘体,传统陶瓷是典型的绝缘材料,常用于高压变压器的开关外包装和器件,A正确;B.陶瓷的主要成分为硅酸盐,而不是SiO2和MgO,B错误;C.陶瓷烧制过程发生复杂化学反应,有新物质生成,属于化学变化,C错误;D.由于Fe2+、Fe3+和铁的氧化物均有颜色,故陶瓷中含铁量越多,陶瓷的颜色越深,白瓷的白色是因为铁含量较低甚至几乎不含铁,D错误。]
3.(2022·广东卷)广东一直是我国对外交流的重要窗口,馆藏文物是其历史见证。下列文物主要由硅酸盐制成的是( )
文物
选项 A.南宋鎏金饰品 B.蒜头纹银盒 C.广彩瓷咖啡杯 D.铜镀金钟座
C [A.鎏金饰品是用金汞合金制成的金泥涂饰器物的表面,经过烘烤,汞蒸发而金固结于器物上的一种传统工艺,其中不含硅酸盐,故A项不符合题意;B.蒜头纹银盒中主要成分为金属银,其中不含硅酸盐,故B项不符合题意;C.广彩瓷咖啡杯主要由陶瓷制成,其主要成分为硅酸盐,故C项符合题意;D.铜镀金钟座是铜和金等制得,其中不含硅酸盐,故D项不符合题意。]
4.(2021·浙江1月选考,21)铝硅酸盐型分子筛中有许多笼状空穴和通道(如图),其骨架的基本结构单元是硅氧四面体和铝氧四面体,化学组成可表示为
Ma[(AlO2)x·(SiO2)y]·zH2O(M代表金属离子)。
下列推测不正确的是( )
A.常采用水玻璃、偏铝酸钠在强酸溶液中反应后结晶制得分子筛
B.若a=x/2,则M为二价阳离子
C.调节y/x(硅铝比)的值,可以改变分子筛骨架的热稳定性
D.分子筛中的笼状空穴和通道,可用于筛分分子
A [A.偏铝酸钠在强酸性溶液中不能稳定存在,容易形成Al3+,不可以利用偏铝酸钠在强酸性溶液中制备分子筛,A错误;B.设M的化合价为m,则根据正负化合价代数和为0计算,m×+x×(-1)=0,解得m=+2,B正确;C.调节硅铝比可以改变分子筛的空间结构,从而改变分子筛的热稳定性,C正确;D.调节硅铝比可以调节分子筛的孔径,根据分子筛孔径的大小可以筛分不同大小的分子,D正确。]
5.(全国卷Ⅱ,26节选)水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
________________________________________________________________________,
还可使用________代替硝酸。
(2)沉淀A的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
解析: (1)水泥熟料中的CaO和铁、铝、镁等金属的氧化物均能溶于盐酸,加入硝酸能将水泥样品中可能含有的Fe2+氧化为Fe3+,为了不引入新杂质,还可用H2O2代替硝酸。(2)根据图示流程可知,不溶于盐酸和硝酸的沉淀A为SiO2(或H2SiO3),SiO2(或H2SiO3)能溶于弱酸氢氟酸,生成SiF4和H2O。
答案: (1)将样品中可能存在的Fe2+氧化为Fe3+ H2O2
(2)SiO2(或H2SiO3) SiO2+4HF===SiF4↑+2H2O(或H2SiO3+4HF===SiF4↑+3H2O)
课时精练(十五) 无机非金属材料
(本栏目内容,在学生用书中以独立形式分册装订!)
1.文物是传承文化的重要载体,下列主要成分不是硅酸盐的文物是( )
A.简牍 B.陶彩绘女舞俑 C.霁红釉瓷碗 D.梅瓶
A [简牍主要成分为植物纤维,A符合题意;陶彩绘女舞俑,为陶制品,为硅酸盐材料,B不符合题意;霁红釉瓷碗,材料为陶瓷,为硅酸盐材料,C不符合题意;梅瓶是瓷器,为硅酸盐材料,D不符合题意。]
2.(2022·上海三模)由于石墨烯独特的结构,在石墨烯薄膜上施加较低的电压(1~10 V)即可产生较高的热量,平昌冬奥会“北京8分钟”主创团队用石墨烯制作了20 ℃能发热4 h的智能服饰,向世界展现了新时代的中国形象,下列说法中错误的是( )
A.石墨烯是能导热的金属材料
B.石墨烯属于单质
C.石墨烯能导电
D.在石墨烯薄膜上施加电压,使电能转化为热能
A [A.石墨烯属于碳单质,是能够导热的非金属材料,A错误;B.石墨烯是碳的单质,B正确;C.石墨烯属于碳单质,碳单质具有良好的导电性,可以导电,C正确;D.根据题干信息可知,在石墨烯薄膜上施加较低的电压(1~10 V)即可产生较高的热量,使电能转化为热能,D正确。]
3.(2022·河南省濮阳市高三模拟)2022年2月在北京举办的冬季奥运会中,使用了许多功能各异的材料,下列有关材料的描述中不正确的是( )
A.陶瓷、玻璃、水泥属于传统的无机非金属材料
B.石墨烯、富勒烯和碳纳米管属于新型有机非金属材料
C.硅是应用最为广泛的半导体材料
D.通讯中使用的光导纤维,主要成分为SiO2
B [玻璃、陶瓷、水泥的主要成分是硅酸盐类,都属于传统的无机非金属材料,A正确;碳纳米管、富勒烯和石墨烯都是新型无机非金属材料,B不正确;晶体硅导电性介于导体与绝缘体之间,是应用最广泛的良好的半导体材料,C正确;光导纤维的主要成分是二氧化硅,D正确。]
4.下列有关硅材料的说法正确的是( )
A.光纤的主要成分是高纯度的单质硅
B.金刚砂的主要成分是二氧化硅
C.28 g硅含有6.02×1023个电子
D.28Si、29Si、30Si是不同的核素
D [光纤的主要成分是二氧化硅,A错误;金刚砂的主要成分是碳化硅,B错误;28 g硅的物质的量是1 mol,其中含有14×6.02×1023个电子,C错误;28Si、29Si、30Si的质子数相同,但中子数不同,是不同的核素,且互为同位素,D正确。]
5.生产生活中的各种“玻璃”的说法正确的是( )
A.钢化玻璃和普通玻璃成分不相同,但都属于硅酸盐产品
B.有机玻璃的主要成分聚甲基丙烯酸甲酯属于天然有机高分子材料
C.“水玻璃”的主要成分是硅酸钠的水溶液,可用作矿物胶
D.石英玻璃熔点高、硬度大,可制作加热NaOH、Na2CO3等固体的仪器
C [钢化玻璃是将普通玻璃高温后骤降温度得到,二者成分相同,都属于硅酸盐产品,A错误;有机玻璃属于有机合成高分子材料,B错误;“水玻璃”的主要成分是硅酸钠的水溶液,可用作矿物胶,C正确;石英玻璃主要成分是二氧化硅,属于酸性氧化物,会与NaOH、Na2CO3等碱性物质发生反应,所以不能制作加热NaOH、Na2CO3等固体的仪器,D错误。]
6.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窖中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是( )
A.粘土是制作砖瓦和陶瓷的主要原料
B.“燃薪举火”使粘土发生复杂的物理和化学变化
C.沙子和粘土的主要成分均为硅酸盐
D.烧制后自然冷却成红瓦,浇水冷却成青瓦
C [制作砖瓦和陶瓷的主要原料是粘土,故A正确;粘土的主要成分均为硅酸盐,灼烧使粘土发生复杂的物理和化学变化,故B正确;沙子的主要成分是二氧化硅,粘土的主要成分为硅酸盐,故C错误;浇水转釉(主要为青色),与造砖同法,所以烧制后自然冷却成红瓦,浇水冷却成青瓦,故D正确。]
7.高纯度晶硅是典型的无机非金属材料,又称“半导体”材料。它的发现和使用曾引起计算机的一场“革命”。可以按下列方法制备:
SiO2Si(粗)SiHCl3Si(纯)
下列说法不正确的是( )
A.步骤①的化学方程式为SiO2+CSi+CO2↑
B.步骤①中每生成1 mol Si转移4 mol电子
C.高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
A [二氧化硅高温下与C反应生成CO气体,即步骤①的化学方程式为SiO2+2CSi+2CO↑,故A错误;步骤①中Si的化合价降低4,则每生成1 mol Si转移电子数为4 mol,故B正确;高纯硅是半导体材料,是制造集成电路、太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料,故C正确;沸点相差30 ℃以上的两种液体可以采用蒸馏(或分馏)的方法分离,故D正确。]
8.水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:
下列说法正确的是( )
A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B.操作A与操作B完全相同
C.该流程中硅元素的化合价发生改变
D.反应器中发生的复分解反应为SiO2+2NaOH===Na2SiO3+H2O
A [稻壳灰来源广泛价格低廉,活性炭具有吸附性,有较高的经济价值,A正确;操作A为过滤,操作B为蒸发浓缩,是两种不同的操作,B错误;二氧化硅中,硅元素的化合价是+4价,硅酸钠中,硅元素的化合价是+4价,所以该流程中硅元素的化合价没有发生改变,C错误;复分解反应是指由两种化合物相互交换成分,生成另外两种新的化合物的反应,反应SiO2+2NaOH===Na2SiO3+H2O不属于复分解反应,D错误。]
9.(2022·江苏模拟预测)“十四五”工作报告强调,中国将加速建设新能源供给消化吸纳体系。硅基能源逐步取代碳基能源的革命,必须举全国之力破解芯片技术受制于人的困局。以下说法不正确的是( )
A.碳基能源主要指煤、石油、天然气,我国的煤炭资源储量优于石油
B.硅在地壳中的含量仅次于氧,从沙滩到用户,硅发生了还原反应
C.半导体工艺中一般需要在晶硅中掺杂第ⅢA族与第ⅤA族元素
D.半导体工艺中用刻蚀剂——电子级氟化氢可加压保存在玻璃罐体中
D [A.碳基能源主要指煤、石油、天然气,我国的煤炭储量及开发技术均优于石油,A说法正确;B.硅在地壳中的含量仅次于氧,从沙滩到用户,硅由SiO2转化为硅单质,化合价下降,发生了还原反应,B说法正确;C.晶硅中掺杂第ⅢA族与第ⅤA族元素,形成PN结,在接通电源或受光的激发,自由电子可向空穴方向移动(单向移动) (见图),
C说法正确;D.氟化氢可与玻璃容器中二氧化硅发生反应,故D说法错误。]
10.(2022·天津市和平区三模)制造芯片用到高纯硅,用SiHCl3(沸点:31.85 ℃,SiHCl3遇水会剧烈反应,易自燃)与过量H2在1 100~1 200 ℃反应制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法不正确的是( )
A.整个实验的关键是控温、检查装置气密性和排尽装置中的空气
B.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、温度高于32 ℃的温水
C.实验时,先打开装有稀硫酸仪器的活塞,收集尾气验纯,再预热装置Ⅳ石英管
D.尾气处理可直接通入NaOH溶液中
D [由实验装置可知,Ⅰ中Zn与稀硫酸反应生成氢气,Ⅱ中浓硫酸干燥氢气,Ⅲ中汽化的SiHCl3与过量H2混合,Ⅳ中高温下反应制备高纯硅,且SiHCl3遇水发生反应SiHCl3+3H2O===H2SiO3+H2↑+3HCl。A项,SiHCl3的沸点为31.85 ℃,且易自燃,因而整个实验的关键是控温、检查装置气密性和排尽装置中的空气,故A正确;B项,装置Ⅱ中浓H2SO4可干燥氢气,Ⅲ中盛装温度高于32 ℃的温水,目的是使滴入烧瓶中的SiHCl3汽化,与氢气反应,故B正确;C项,实验时应先打开装有稀硫酸仪器的活塞制取氢气,用氢气将装置内的空气排出,收集尾气验纯,再预热装置Ⅳ石英管,防止氢气不纯加热易爆炸,故C正确;D项,SiHCl3与氢气在1 100~1 200 ℃反应制备高纯硅,因而处理尾气时,应该在通入NaOH溶液前加上防倒吸装置,故D错误。]
11.(2022·浙江省选考模拟)硅胶吸附剂的结构示意图如图所示,常用作干燥剂。在其中添加CoCl2可使其指示吸水量的多少来决定硅胶是否失效,原理如下:CoCl2(蓝色)===CoCl2·6H2O(粉红色),失效的硅胶可加热再生,下列说法错误的是( )
A.当硅胶变粉红色说明硅胶失效了
B.SiO2是酸性氧化物,硅胶可干燥HF和Cl2等酸性气体
C.失效的硅胶再生时加热的温度不宜过高
D.当硅胶遇到大量的水分子时,与硅羟基形成了过多氢键从而失去吸附力
B [由题中信息可知,硅胶吸水后,会变成粉红色的CoCl2·6H2O,故变成粉红色后则说明硅胶失效了,A正确;二氧化硅可以和HF反应,故硅胶不能干燥HF,B错误;温度过高会因显色剂逐步氧化而失去显色作用,C正确;由硅胶结构可知,硅胶用作干燥剂,是通过硅羟基和水分子之间形成氢键而达到吸水的目的,故当硅胶遇到大量的水分子时,与硅羟基形成了过多氢键从而失去吸附力,D正确。]
12.中国努力争取2060年前实现碳中和。利用NaOH溶液喷淋捕捉空气中的CO2,反应过程如图所示。下列说法错误的是( )
A.捕捉室中NaOH溶液喷成雾状有利于吸收CO2
B.环节a中物质分离的基本操作是蒸发结晶
C.反应过程中CaO和NaOH是可循环的物质
D.可用Na2CO3溶液代替NaOH溶液捕捉CO2
B [利用NaOH溶液实现“碳捕获”吸收器中,NaOH溶液用喷淋方式加入,增大反应物之间的接触面积,充分吸收二氧化碳,环节a中,氧化钙与水反应生成氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,Na2CO3发生反应的化学方程式为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,CaCO3需从溶液中过滤出来再高温煅烧,生成的CO2循环使用。A项,NaOH溶液喷成雾状,可增大反应接触面积,提高CO2吸收率,A正确;B项,环节a为Na2CO3和Ca(OH)2反应生成CaCO3,需从溶液中过滤出来再高温煅烧,故基本操作不是蒸发结晶,B错误;C项,NaOH和CaO在流程中既有消耗,也有生成,可循环利用,C正确;D项,Na2CO3可以和CO2反应,因此可用Na2CO3溶液代替NaOH溶液,D正确。]
13.硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为____________________;
(2)常温下,不能与R单质发生反应的是________(填字母);
A.CuCl2溶液 .Fe2O3
C.浓硫酸 .Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式_________
________________________________________________________________________。
(4)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮元素的化合价为________。
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由: __________________
________________________________________________________________________。
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:
________SiO2+________C+________N2________Si3N4+________CO
(7)如果上述反应在10 L的密闭容器中进行,一段时间后测得气体密度增加了2.8 g/L,则制得的Si3N4质量为________。
解析: 一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24,M为+1价,R为+3价,则说明M为Na,R为Al。(1)该硅酸盐中同周期元素是Na、Al、Si,根据同周期从左向右原子半径逐渐减小,则原子半径由大到小的顺序为r(Na)>r(Al)>r(Si);(2)常温下,铝与氯化铜反应生成氯化铝和铜单质,铝与氧化铁常温不反应,铝常温下与浓硫酸发生钝化反应,铝常温下与碳酸钠不反应,因此不能与R单质发生反应的是BD;(3)M、R两种元素的最高价氧化物对应的水化物分别为氢氧化钠和氢氧化铝,两者反应的离子方程式OH-+Al(OH)3===AlO+2H2O;(4)Si3N4晶体中只有极性共价键,氮非金属性比硅强,硅为+4价,根据化合物为电中性,则氮元素的化合价为-3;(5)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。C3N4的结构与Si3N4相似,说明两者都是共价晶体,碳原子半径比硅原子半径小,键长短,键能大,则C3N4熔点比Si3N4熔点高;(6)碳化合价由0价变为+2价,氮化合价由0价变为-3价,则碳升高2个价态,Si3N4降低12个价态,因此碳系数配6,Si3N4系数配1,根据硅和氮守恒配SiO2系数为3,N2系数为2,再根据碳守恒配CO系数为6,则为3SiO2+6C+2N21Si3N4+6CO,其电子转移为 (或);(7)根据反应方程式3SiO2+6C+2N2Si3N4+6CO分析得到气体质量增加112 g,则生成1 mol Si3N4即140 g,如果上述反应在10 L的密闭容器中进行,一段时间后测得气体密度增加了2.8 g/L,则气体质量增加了28 g,则制得的Si3N4质量为=35 g。
答案: (1)r(Na)>r(Al)>r(Si) (2)BD
(3)OH-+Al(OH)3===AlO+2H2O (4)-3
(5)C3N4熔点比Si3N4熔点高,原因为两者都是共价晶体,碳原子半径比硅原子半径小,键长短,键能大,因此C3N4熔点比Si3N4熔点高
(6)3SiO2+6C+2N2Si3N得到4×3e-4+6C失去6×2e-O
(或3SiO2+6C+2N212e-Si3N4+6CO) (7)35 g
14.Ⅰ.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
SiO2Si(粗)SiHCl3Si(纯)
(1)写出步骤①的化学方程式: _____________________________________________
________________________________________________________________________。
(2)步骤②经过冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3的主要化学操作的名称是________;SiHCl3和SiCl4一样,遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,试写出其水解的化学方程式:________________________________________________________________________
________________________________________________________________________。
Ⅱ.白炭黑(SiO2·H2O)广泛应用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg6(Si4O10)(OH)8]来制取,其主要工艺流程如图所示:
(3)蛇纹石用氧化物形式可表示为__________________________________________。
(4)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法:
①________________________________________________________________________;
②________________________________________________________________________
(任举两种)。
(5)过滤Ⅰ得到的滤液的主要成分是____________________________________________。
(6)滤液与盐酸反应的主要离子方程式为_____________________________________
________________________________________________________________________。
(7)洗涤时,如何证明产品已洗涤干净? ____________________________________
________________________________________________________________________。
解析: (2)SiHCl3(沸点33.0 ℃)、SiCl4(沸点57.6 ℃)、HCl(沸点-84.7 ℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏;SiHCl3水解生成硅酸、氢气和氯化氢,反应方程式为:SiHCl3+3H2O===H2SiO3+H2↑+3HCl↑;(3)用氧化物形式表示复杂硅酸盐的化学式时,应先用金属性强弱顺序书写氧化物,中间用“·”隔开,再写非金属氧化物,H2O放在最后,因此Mg6Si4O10(OH)8用氧化物形式表示为6MgO·4SiO2·4H2O。
答案: Ⅰ.(1)SiO2+2CSi+2CO↑ (2)蒸馏(或分馏) SiHCl3+3H2O===H2SiO3+H2↑+3HCl↑ Ⅱ.(3)6MgO·4SiO2·4H2O (4)适当升高温度 连续搅拌(或适当延长停留时间、选择合适的氢氧化钠浓度等) (5)水玻璃(或硅酸钠溶液或硅酸钠和氢氧化钠溶液) (6)SiO+2H+===H2SiO3↓ (7)取少许最后一次洗涤液,滴入1~2滴AgNO3溶液,若不出现白色浑浊,表示已洗涤干净
学生用书?第72页
同课章节目录
