3.2.2铝和铝合金课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2.2铝和铝合金课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 21:11:39 | ||
图片预览






文档简介
(共17张PPT)
第三章 铁 金属材料
第二节 金属材料
第二课时 铝和氧化铝
1.结合日常生活,认识Al与O2反应及Al与NaOH溶液反应的产物和本质,丰富对金属多样性的认识,体会实验对认识和研究物质性质的重要作用。
2.通过实验探究,认识氧化铝的两性,培养学生“变化观念与科学探究”的核心素养。
3. 了解铝合金的特性和用途,培养学生“科学态度与社会责任”的核心素养。
核心素养
情境导学
铝的化学性质比铁活泼,为什么我们通常看见铁生锈而没有看到铝生锈?
铝在常温下就能与空气中的氧气发生反应,表面生成一层致密的氧化物薄膜,阻止了铝生锈,起着保护内部金属的作用。而铁与氧气反应生成的铁锈是疏松多孔的结构,不能起到保护的作用。
1.存在
任务一:铝的性质
铝是地壳中含量最多的金属元素,自然界中的铝全部以化合态存在,铝土矿(Al2O3)。
2.物理性质
颜色 状态 硬度 导电性 导热性 延展性 密度 熔点 沸点
银白色有金属光泽
固体
较小
良好
良好
良好
较小,2.7g/cm3
较低,660℃
2467℃
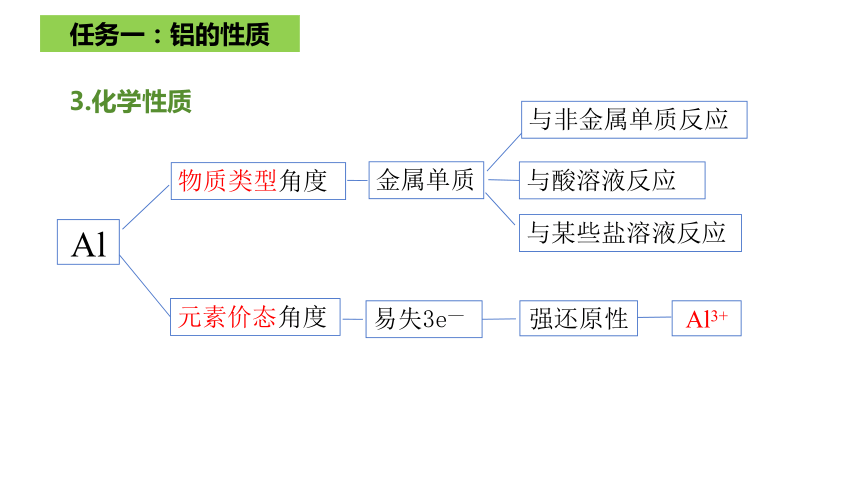
强还原性
与非金属单质反应
与酸溶液反应
与某些盐溶液反应
Al
物质类型角度
元素价态角度
易失3e—
金属单质
任务一:铝的性质
3.化学性质
Al3+
任务一:铝的性质
1. 铝与非金属反应
3.化学性质
4Al+3O2===2Al2O3
4Al+3O2===2Al2O3
点燃
2Al+3Cl2===2AlCl3
点燃
① Al与O2:
② Al与Cl2:
2Al+6H+=2Al3++3H2↑
任务一:铝的性质
3.化学性质
3. 铝与盐溶液反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
2Al + 3Fe2+ = 2Al3+ + 3Fe
铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声
2. 铝与强酸反应
任务一:铝的性质
3.化学性质
2Al+2NaOH+6H2O=== 2Na[Al(OH)4]+3H2↑
(2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑)
(四羟基合铝酸钠)
试管①中一开始无气泡产生,一段时间后,铝片溶解;有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡。将点燃的木条放在试管口,都有爆鸣声
4. 铝与强碱反应
Al2O3难溶于水的白色固体,无臭、无味、质极硬
熔点:2054℃
沸点:2980℃
氧化铝即为刚玉,自然界中红宝石、蓝宝石的主成份皆为氧化铝。
红宝石即红刚玉,是铬(主要为Cr2O3)含量≥0.1%的刚玉,主要成分是氧化铝(Al2O3),一般呈红色故得名。
蓝宝石(Sapphire)是除红宝石之外的刚玉宝石的通称,主要成分是氧化铝(Al2O3)。蓝宝石可以有粉红、黄、绿、白等颜色,甚至在同一颗石有多种颜色,其中蓝色的蓝宝石是由于其中混有少量钛(Ti)和铁(Fe)杂质所致,
任务二:氧化铝的性质
1.物理性质
教材延伸
铝箔在空气中加热,不燃烧,铝箔只熔化成液体但不滴落。其原因是:铝箔表面生成的高熔点的氧化铝包裹住内部熔化的铝,使其不滴落。
任务二:氧化铝的性质
2.化学性质
Al2O3+6HCl===2AlCl3+3H2O
Al2O3+6H+===2Al3++3H2O
Al2O3+2NaOH+3H2O===2Na[Al(OH)4]
( Al2O3+2OH-+3H2O===2[Al(OH)4]- )
(四羟基合铝酸钠)
1. 氧化铝与强酸反应
2. 氧化铝与强碱反应
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
【深化理解】铝和NaOH溶液反应分析:
铝与NaOH溶液反应,可以认为是分两步进行的。
(1)铝与水反应: 2Al+6H2O=2Al(OH)3+3H2↑
(2)氢氧化铝与氢氧化钠反应: 2Al(OH)3+2NaOH=2Na[Al(OH)4]
2Al(OH)3+2NaOH=2Na[Al(OH)4]
Al(OH)3+3HCl=AlCl3+3H2O
2Al(OH)3=Al2O3+3H2O
氢氧化铝是一种白色固体,难溶于水;
属于两性氢氧化物;
受热易分解;
不与弱碱反应。
【思考1】为什么铝合金的器皿不能过长时间存储酸或碱的溶液
【思考2】若要除去铁粉中的少量铝粉,可采用什么方法
【思考3】(1)等物质的量的铝分别与足量的氢氧化钠溶液和盐酸反应,消耗HCl和NaOH的物质的量之比是______,生成H2的体积之比是______ (气体在相同状况下测定)。
(2)足量的铝粉与等浓度、等体积的盐酸和NaOH溶液反应,生成H2的体积之比是________(气体在相同状况下测定)。
由于铝和氧化铝能跟酸、碱反应,因此铝制餐具不宜用来蒸煮或长期存放酸性、碱性食物。
在混合物中加过量NaOH溶液,铝和碱反应溶解,过滤得铁。
3:1
1:1
1:3
课题小结
meiyangyang8602
铝是地壳中含量最多的金属。向铝中加入少量的合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金。铝合金是目前用途广泛的合金之一。例如,硬铝的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
任务三:铝合金
【当堂训练】
1.化学与工业、生活密切相关,下列说法错误的是( )
A.水果罐头中常加入维生素C作抗氧化剂
B.氯气、臭氧、二氧化氯都可用于自来水的消毒
C.氯气能使湿润的有色布条褪色,因此氯气有漂白性
D.高温下铝粉与氧化铁的反应可用来焊接钢轨
2.将一块铝箔用砂纸仔细打磨后,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不燃烧,也不滴落,移去酒精灯,待固体冷却后将其投入氢氧化钠溶液,固体最终消失并有气体生成。关于这一实验的下列叙述正确的是( )
A.该实验说明金属铝密度小、熔点低,化学性质稳定
B.加热不燃烧说明铝制品性质稳定,可长期存放各种物质
C.不滴落是因为Al表面生成了Al2O3,Al2O3熔点远高于金属铝,可做耐火材料
D.Al和Al2O3都可以和酸反应,也可以和氢氧化钠溶液反应,都具有两性
C
氯气能与水反应生成HClO,HClO具有强氧化性能漂白有色布条
C
铝是活泼的金属
加热时铝更易被氧化生成氧化铝
Al和Al2O3都可以和酸反应,也可以和氢氧化钠溶液反应,但只有Al2O3具有两性,铝的两性为金属性和非金属性,不是酸性和碱性,所以说铝不是两性金属
3. 探究铝的性质实验
Ⅰ Ⅱ
现象:立即产生气泡 现象:开始没气泡一段时间后产生气泡
下列说法不正确的是( )
A.从元素化合价角度看,产生的气体只能是H2 B.实验Ⅰ证明NaOH是氧化剂
C.实验Ⅱ说明Al2O3具有酸性氧化物的性质
D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同
B
4. 某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( )
A
5.下列各物质既能与强酸反应,又能与强碱反应的是( )
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3 ⑥Al(OH)3
A. ①③⑤⑥ B.②③④⑥ C.①③④ D.①④⑤⑥
D
第三章 铁 金属材料
第二节 金属材料
第二课时 铝和氧化铝
1.结合日常生活,认识Al与O2反应及Al与NaOH溶液反应的产物和本质,丰富对金属多样性的认识,体会实验对认识和研究物质性质的重要作用。
2.通过实验探究,认识氧化铝的两性,培养学生“变化观念与科学探究”的核心素养。
3. 了解铝合金的特性和用途,培养学生“科学态度与社会责任”的核心素养。
核心素养
情境导学
铝的化学性质比铁活泼,为什么我们通常看见铁生锈而没有看到铝生锈?
铝在常温下就能与空气中的氧气发生反应,表面生成一层致密的氧化物薄膜,阻止了铝生锈,起着保护内部金属的作用。而铁与氧气反应生成的铁锈是疏松多孔的结构,不能起到保护的作用。
1.存在
任务一:铝的性质
铝是地壳中含量最多的金属元素,自然界中的铝全部以化合态存在,铝土矿(Al2O3)。
2.物理性质
颜色 状态 硬度 导电性 导热性 延展性 密度 熔点 沸点
银白色有金属光泽
固体
较小
良好
良好
良好
较小,2.7g/cm3
较低,660℃
2467℃
强还原性
与非金属单质反应
与酸溶液反应
与某些盐溶液反应
Al
物质类型角度
元素价态角度
易失3e—
金属单质
任务一:铝的性质
3.化学性质
Al3+
任务一:铝的性质
1. 铝与非金属反应
3.化学性质
4Al+3O2===2Al2O3
4Al+3O2===2Al2O3
点燃
2Al+3Cl2===2AlCl3
点燃
① Al与O2:
② Al与Cl2:
2Al+6H+=2Al3++3H2↑
任务一:铝的性质
3.化学性质
3. 铝与盐溶液反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
2Al + 3Fe2+ = 2Al3+ + 3Fe
铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声
2. 铝与强酸反应
任务一:铝的性质
3.化学性质
2Al+2NaOH+6H2O=== 2Na[Al(OH)4]+3H2↑
(2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑)
(四羟基合铝酸钠)
试管①中一开始无气泡产生,一段时间后,铝片溶解;有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡。将点燃的木条放在试管口,都有爆鸣声
4. 铝与强碱反应
Al2O3难溶于水的白色固体,无臭、无味、质极硬
熔点:2054℃
沸点:2980℃
氧化铝即为刚玉,自然界中红宝石、蓝宝石的主成份皆为氧化铝。
红宝石即红刚玉,是铬(主要为Cr2O3)含量≥0.1%的刚玉,主要成分是氧化铝(Al2O3),一般呈红色故得名。
蓝宝石(Sapphire)是除红宝石之外的刚玉宝石的通称,主要成分是氧化铝(Al2O3)。蓝宝石可以有粉红、黄、绿、白等颜色,甚至在同一颗石有多种颜色,其中蓝色的蓝宝石是由于其中混有少量钛(Ti)和铁(Fe)杂质所致,
任务二:氧化铝的性质
1.物理性质
教材延伸
铝箔在空气中加热,不燃烧,铝箔只熔化成液体但不滴落。其原因是:铝箔表面生成的高熔点的氧化铝包裹住内部熔化的铝,使其不滴落。
任务二:氧化铝的性质
2.化学性质
Al2O3+6HCl===2AlCl3+3H2O
Al2O3+6H+===2Al3++3H2O
Al2O3+2NaOH+3H2O===2Na[Al(OH)4]
( Al2O3+2OH-+3H2O===2[Al(OH)4]- )
(四羟基合铝酸钠)
1. 氧化铝与强酸反应
2. 氧化铝与强碱反应
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
【深化理解】铝和NaOH溶液反应分析:
铝与NaOH溶液反应,可以认为是分两步进行的。
(1)铝与水反应: 2Al+6H2O=2Al(OH)3+3H2↑
(2)氢氧化铝与氢氧化钠反应: 2Al(OH)3+2NaOH=2Na[Al(OH)4]
2Al(OH)3+2NaOH=2Na[Al(OH)4]
Al(OH)3+3HCl=AlCl3+3H2O
2Al(OH)3=Al2O3+3H2O
氢氧化铝是一种白色固体,难溶于水;
属于两性氢氧化物;
受热易分解;
不与弱碱反应。
【思考1】为什么铝合金的器皿不能过长时间存储酸或碱的溶液
【思考2】若要除去铁粉中的少量铝粉,可采用什么方法
【思考3】(1)等物质的量的铝分别与足量的氢氧化钠溶液和盐酸反应,消耗HCl和NaOH的物质的量之比是______,生成H2的体积之比是______ (气体在相同状况下测定)。
(2)足量的铝粉与等浓度、等体积的盐酸和NaOH溶液反应,生成H2的体积之比是________(气体在相同状况下测定)。
由于铝和氧化铝能跟酸、碱反应,因此铝制餐具不宜用来蒸煮或长期存放酸性、碱性食物。
在混合物中加过量NaOH溶液,铝和碱反应溶解,过滤得铁。
3:1
1:1
1:3
课题小结
meiyangyang8602
铝是地壳中含量最多的金属。向铝中加入少量的合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金。铝合金是目前用途广泛的合金之一。例如,硬铝的密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
任务三:铝合金
【当堂训练】
1.化学与工业、生活密切相关,下列说法错误的是( )
A.水果罐头中常加入维生素C作抗氧化剂
B.氯气、臭氧、二氧化氯都可用于自来水的消毒
C.氯气能使湿润的有色布条褪色,因此氯气有漂白性
D.高温下铝粉与氧化铁的反应可用来焊接钢轨
2.将一块铝箔用砂纸仔细打磨后,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不燃烧,也不滴落,移去酒精灯,待固体冷却后将其投入氢氧化钠溶液,固体最终消失并有气体生成。关于这一实验的下列叙述正确的是( )
A.该实验说明金属铝密度小、熔点低,化学性质稳定
B.加热不燃烧说明铝制品性质稳定,可长期存放各种物质
C.不滴落是因为Al表面生成了Al2O3,Al2O3熔点远高于金属铝,可做耐火材料
D.Al和Al2O3都可以和酸反应,也可以和氢氧化钠溶液反应,都具有两性
C
氯气能与水反应生成HClO,HClO具有强氧化性能漂白有色布条
C
铝是活泼的金属
加热时铝更易被氧化生成氧化铝
Al和Al2O3都可以和酸反应,也可以和氢氧化钠溶液反应,但只有Al2O3具有两性,铝的两性为金属性和非金属性,不是酸性和碱性,所以说铝不是两性金属
3. 探究铝的性质实验
Ⅰ Ⅱ
现象:立即产生气泡 现象:开始没气泡一段时间后产生气泡
下列说法不正确的是( )
A.从元素化合价角度看,产生的气体只能是H2 B.实验Ⅰ证明NaOH是氧化剂
C.实验Ⅱ说明Al2O3具有酸性氧化物的性质
D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同
B
4. 某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( )
A
5.下列各物质既能与强酸反应,又能与强碱反应的是( )
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3 ⑥Al(OH)3
A. ①③⑤⑥ B.②③④⑥ C.①③④ D.①④⑤⑥
D
