第10章金属检测题(含解析)2023-2024学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第10章金属检测题(含解析)2023-2024学年九年级化学京改版(2013)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 307.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 21:05:03 | ||
图片预览



文档简介
第10章 金属 检测题
一、单选题
1.高温下向24.0gFe2O3中通入CO一段时间后,停止加热,冷却测得剩余固体为20.0g。向剩余固体中加入280.2g足量的稀H2SO4充分反应,固体全部溶解,得到300.0g浅绿色溶液。以下说法不正确的是( )
A.向20.0g剩余固体中加入足量的稀H2SO4产生0.2gH2
B.高温时发生的反应为Fe2O3+2COFe+FeO+CO2
C.浅绿色溶液中FeSO4的质量分数为15.2%
D.高温下所得CO2气体的质量为11.0g
2.下列物质不能由金属和盐酸直接反应制得的是
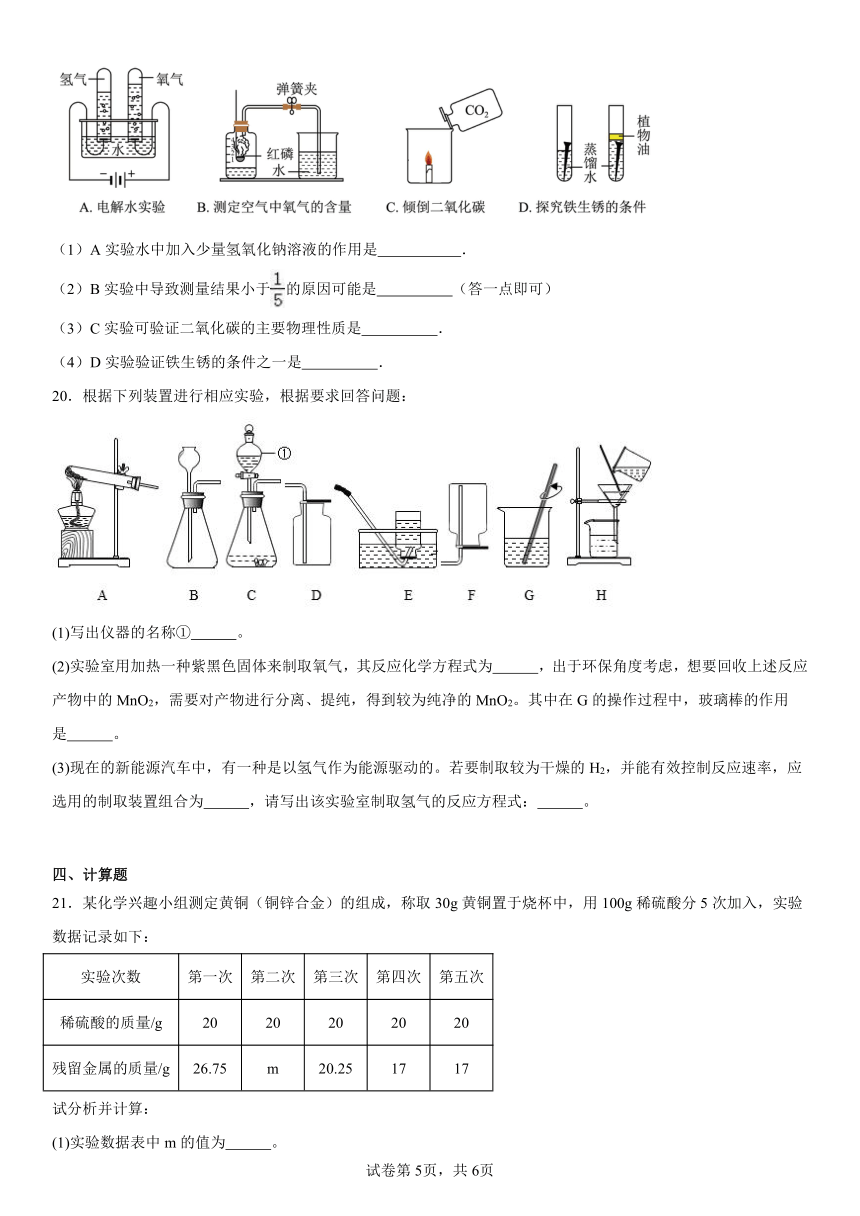
①CuCl2 ②FeCl2 ③MgCl2 ④FeCl3.
A.①② B.①④ C.①③ D.②④
3.下列推理正确的是
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.置换反应中一定有单质生成,因此有单质生成的反应一定是置换反应
C.元素是具有相同核电荷数的一类原子的总称,因此同种元素核电荷数一定相同
D.原子核是由质子和中子构成的,则所有的原子核中一定都含有质子和中子
4.证据推理是化学学科核心素养的重要内容,下列推理合理的是( )
A.氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
B.单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质
C.置换反应生成单质和化合物,所以生成单质和化合物的反应一定为置换反应
D.铝比铁活泼,所以铝制品比铁制品更易受到腐蚀
5.小红同学为探究X、Y、Z三种金属(都不是Ag)的活动性顺序,做了如下实验:
(1)把X和Y分别放入稀H2SO4中,X溶解并产生H2,Y不反应;
(2)把Y和Z分别放入AgNO3溶液中,在Y表面有Ag析出,而Z没有变化;
根据以上实验事实,下列金属活动性顺序由强到弱排列正确的是
A.X>Y>(H)>Z B.X>Y>H>Z
C.X>Y>Z>Ag D.X>(H)>Y>Z
6.推理、归纳是有效的学习方法之一,下列有关推理归纳正确的是
A.物质与氧气的反应一定是氧化反应,氧化反应一定是物质与氧气的反应
B.由一种分子构成的物质一定是纯净物,纯净物一定由一种分子构成
C.化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化
D.置换反应中一定生成单质和化合物,有单质和化合物生成的反应一定是置换反应
7.为了探究生活中钢铁生锈的原因,实验组用普通铁钉、纯铁钉同时进行如图的四组实验,一段时间后,只在实验Ⅰ中观察到了红褐色的锈斑,其他均无明显变化。下列说法合理的是
A.Ⅰ和Ⅱ对比说明铁制品锈蚀需要水 B.Ⅰ和Ⅳ对比说明普通铁钉比纯铁钉更容易锈蚀
C.Ⅰ和Ⅲ对比说明铁制品锈蚀需要氧气 D.Ⅱ和Ⅲ对比说明铁制品锈蚀需要氧气和水
8.黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A.a点时,锌有剩余
B.c点时,硫酸没有完全参与反应
C.该黄铜中锌的质量分数为44%
D.所用稀硫酸的溶质质量分数为8.29%
9.物质的性质决定用途,下列因果关系不成立的是
A.因为磷燃烧能产生白烟,所以可用于制造烟雾弹
B.因为金属钨的熔点高,所以被用来制作灯泡的灯丝
C.因为氧气具有可燃性,所以可以用来作燃料
D.因为氮气化学性质不活泼,所以可以用于食品包装袋内防腐
10.某化学兴趣小组探究铁生锈实验,取一块废旧铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中、在锥形瓶中加入3~4mL浓食盐水,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,下列说法中错误的是
A.浓食盐水的作用是加快铁丝网生锈
B.水中滴加红墨水,便于观察实验现象
C.实验过程中,烧杯中的导管口会冒气泡
D.一段时间后,铁丝表面出现红棕色物质
11.对下列现象的解释或结论不正确的是( )
A.春季的洛阳,花香满城是因为分子在不断运动
B.铁制品在潮湿的空气中容易生锈是因为铁能与氧气、水蒸气发生缓慢氧化
C.配制一定量5%的氯化钠溶液,量取水时仰视读数会使所得溶液浓度偏大
D.煤球制成蜂窝状后燃烧更旺是因为增大了煤与空气的接触面积
12.金属材料在生产和生活中有着广泛的应用。下列属于合金的是
A.黄铜 B.氧化铁 C.黄金 D.纯铝
二、填空题
13.金属具有很多的共同的 。例如,常温下它们都是 (汞除外),有金属光泽,大多数能导 和 ,有延展性,密度 ,熔点 。
14.铁与硫酸铜溶液反应
15.生活中处处有化学。
(1)2022年3月,王亚平在天宫课堂实验中将油和水混合振荡,得到了不分层的油水混合物,叶光富根据转动形成向心力,又实现了油和水的分离。请判断王亚平得到的不分层的油水混合物 (填“是”或“不是”)溶液。
(2)发热小能手暖宝宝(成分有铁粉、活性炭、氯化钠等)使用过程中将 能转化为热能。
16.如图为 CO 还原氧化铜的微型装置图。则 A 处 V 形管内的现象为 ,化学方程式为 ;B 处V 形管内的溶液变浑浊, 化学方程式为 ; 将尾气点燃, 化学方程式为 。
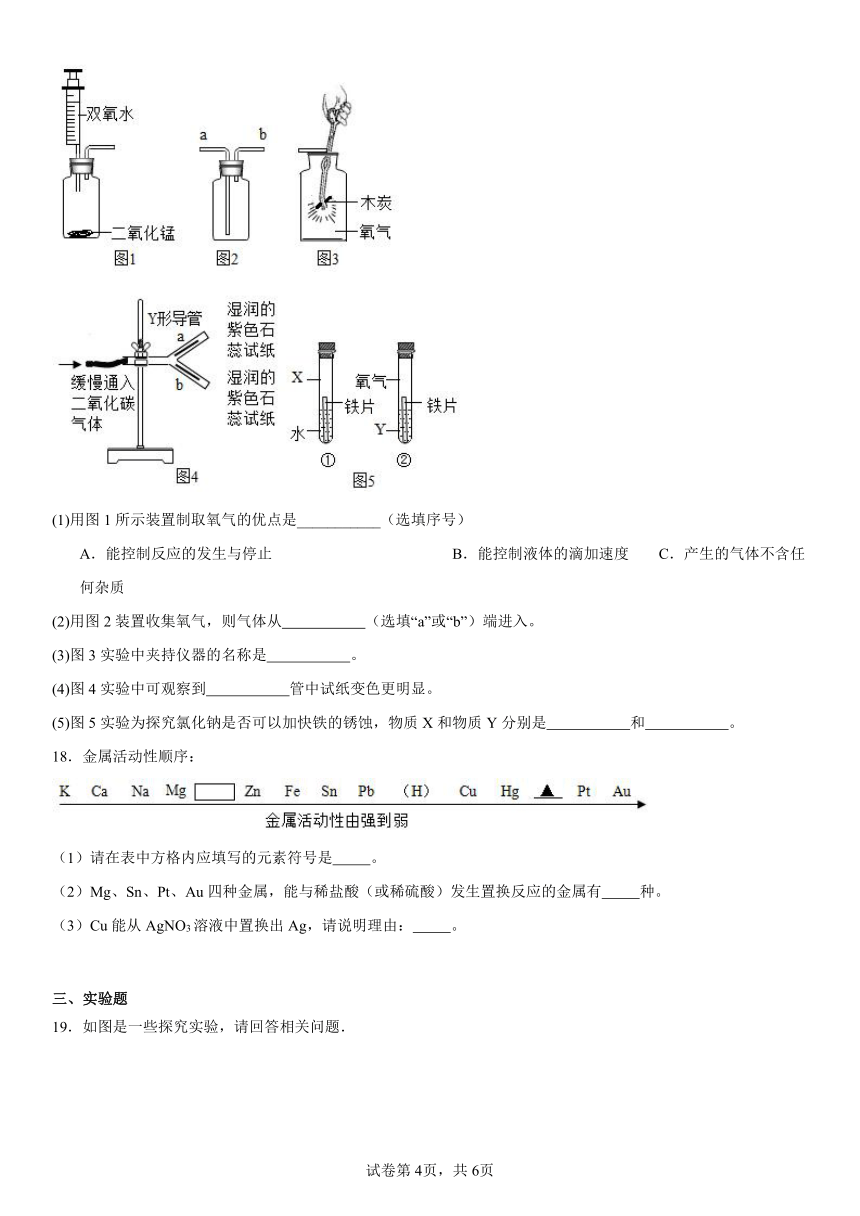
17.化学是以实验为基础的学科,根据图示实验回答下列问题。
(1)用图1所示装置制取氧气的优点是___________(选填序号)
A.能控制反应的发生与停止 B.能控制液体的滴加速度 C.产生的气体不含任何杂质
(2)用图2装置收集氧气,则气体从 (选填“a”或“b”)端进入。
(3)图3实验中夹持仪器的名称是 。
(4)图4实验中可观察到 管中试纸变色更明显。
(5)图5实验为探究氯化钠是否可以加快铁的锈蚀,物质X和物质Y分别是 和 。
18.金属活动性顺序:
(1)请在表中方格内应填写的元素符号是 。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有 种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由: 。
三、实验题
19.如图是一些探究实验,请回答相关问题.
(1)A实验水中加入少量氢氧化钠溶液的作用是 .
(2)B实验中导致测量结果小于的原因可能是 (答一点即可)
(3)C实验可验证二氧化碳的主要物理性质是 .
(4)D实验验证铁生锈的条件之一是 .
20.根据下列装置进行相应实验,根据要求回答问题:
(1)写出仪器的名称① 。
(2)实验室用加热一种紫黑色固体来制取氧气,其反应化学方程式为 ,出于环保角度考虑,想要回收上述反应产物中的MnO2,需要对产物进行分离、提纯,得到较为纯净的MnO2。其中在G的操作过程中,玻璃棒的作用是 。
(3)现在的新能源汽车中,有一种是以氢气作为能源驱动的。若要制取较为干燥的H2,并能有效控制反应速率,应选用的制取装置组合为 ,请写出该实验室制取氢气的反应方程式: 。
四、计算题
21.某化学兴趣小组测定黄铜(铜锌合金)的组成,称取30g黄铜置于烧杯中,用100g稀硫酸分5次加入,实验数据记录如下:
实验次数 第一次 第二次 第三次 第四次 第五次
稀硫酸的质量/g 20 20 20 20 20
残留金属的质量/g 26.75 m 20.25 17 17
试分析并计算:
(1)实验数据表中m的值为 。
(2)计算恰好完全反应时所得溶液的溶质质量分数。(精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、剩余固体为20.0g。向剩余固体中加入280.2g足量的稀H2SO4充分反应,固体全部溶解,得到300.0g浅绿色溶液,根据质量守恒定律可得,生成的氢气的质量为20.0g+280.0g-300.0g=0.2g,正确;
B、高温时发生反应为Fe2O3+2CO2Fe+3CO2,而非Fe2O3+2CO Fe+FeO+2CO2,错误;
C、根据铁元素守恒可得关系式为Fe∽FeSO4.设浅绿色溶液中FeSO4的质量分数为x
x=15.2%,正确;
D、设生成的二氧化碳的质量为y
y=11.0g,正确。
故选B。
2.B
【详解】①铜在金属活动性顺序中排在氢的后面,铜不与酸反应,故①错误;
②铁和盐酸反应生成氯化亚铁和氢气,故②正确;
③镁和盐酸反应生成氯化镁和氢气,故③正确;
④铁和盐酸反应生成氯化亚铁和氢气,不会生成氯化铁,故④错误。
故选B。
3.C
【详解】A、只含有一种元素的物质不一定是单质,例如氧气和臭氧组成的混合物,错误;
B、有单质生成的反应不一定是置换反应,例如水电解生成氢气和氧气,错误;
C、元素是具有相同核电荷数的一类原子的总称,因此同种元素核电荷数一定相同,正确;
D、不是所有的原子核中一定都含有质子和中子,例如有些氢原子核内没有中子,错误。
故选C。
4.B
【详解】A、氧化物中含有氧元素,但含有氧元素的化合物不一定是氧化物,如氢氧化钠含有氧元素,但属于碱,选项错误;
B、单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质,选项正确;
C、置换反应生成单质和化合物,但生成单质和化合物的反应不一定为置换反应,如过氧化氢分解生成水和氧气,是分解反应,选项错误;
D、铝比铁活泼,铝在常温下容易与空气中的氧气反应形成致密的氧化铝保护膜,阻止铝的进一步锈蚀,铝制品比铁制品更耐腐蚀,选项错误。
故选B。
5.D
【详解】(1)“把X和Y分别放入稀H2SO4中,X溶解并产生H2,Y不反应”,说明X的金属活动性排在氢的前面,Y的金属活动性顺序排在氢的后面。
(2)“把Y和Z分别放入AgNO3溶液中,在Y表面有Ag析出,而Z没有变化”,说明Y的活动性应排在Ag的前面,而Z在Ag的后面。
由上述分析可知,X、Y、Z三种金属活动性顺序由强到弱排列为X>(H)>Y>Z;
故选D。
6.C
【详解】A、物质与氧气的反应一定是氧化反应,但是氧化反应不一定是物质与氧气的反应,如氢气还原氧化铜,不符合题意;
B、由一种分子构成的物质一定是纯净物,但是纯净物不一定由一种分子构成,如铁由原子构成,不符合题意;
C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化,符合题意;
D、置换反应中一定生成单质和化合物,有单质和化合物生成的反应不一定是置换反应,如氯酸钾分解生成氯化钾和氧气,属于分解反应,不符合题意。
故选C。
7.B
【详解】A、实验Ⅰ中铁钉与氧气和蒸馏水接触,生锈;实验Ⅱ中铁钉只与蒸馏水接触,不生锈,说明铁制品锈蚀需要氧气,故A错误;
B、实验Ⅰ中普通铁钉与氧气和蒸馏水接触,生锈;实验Ⅳ中纯铁钉与氧气和蒸馏水接触,不生锈,说明普通铁钉比纯铁钉更容易锈蚀,故B正确;
C、实验Ⅰ中铁钉与氧气和蒸馏水接触,生锈;实验Ⅲ铁钉只与氧气接触,不生锈,说明铁制品锈蚀需要水,故C错误;
D、实验Ⅱ中铁钉只与蒸馏水接触,铁钉不生锈;实验Ⅲ铁钉与氧气接触,不生锈,两组实验变量不唯一,无法对比得出结论,故D错误;
故选B。
8.D
【分析】黄铜是铜锌合金,向该黄铜中滴加稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,随着稀硫酸的加入,固体质量逐渐减小,待锌与稀硫酸完全反应后,固体质量不再变化,最后剩余固体的质量就是黄铜中铜的质量。
【详解】A、由图可知,a点时,固体质量还在减少,说明锌未完全反应,锌有剩余,不符合题意;
B、由图可知,c点时,稀硫酸过量,硫酸没有完全参与反应,不符合题意;
C、剩余固体的质量就是黄铜中铜的质量,即黄铜中铜的质量为5.6g,则黄铜中锌的质量为:10.0g-5.6g=4.4g,故该黄铜中锌的质量分数为,不符合题意;
D、解:设所用稀硫酸的溶质质量分数为x
x=9.8% ,符合题意;故选D。
9.C
【详解】A、磷燃烧能产生大量的白烟,可用于制作烟幕弹,故选项说法正确。
B、金属钨熔点高,制成的灯丝不易熔断,可用来制造灯泡中的灯丝,故选项说法正确。
C、氧气能支持燃烧,能作助燃剂,但氧气不具有可燃性,不能作燃料,故选项说法错误。
D、氮气化学性质不活泼,可用于食品包装袋内防腐,故选项说法正确。
故选:C。
10.C
【详解】A.铁在食盐水中生锈速度会加快,该选项说法正确;
B.由于铁与氧气和水共同接触时会生锈,则装置中由于氧气的减少而压强较小,则烧杯中的水会倒吸入锥形瓶中,则水中滴加红墨水,便于观察实验现象,该选项说法正确;
C.实验过程中,锥形瓶中的氧气被消耗,压强减小,烧杯中的水会沿导管倒吸入锥形瓶中,该选项说法不正确;
D.铁锈是红棕色,则一段时间后,铁丝表面出现红棕色物质,该选项说法正确,
故选C。
11.C
【详解】A、花香满城是因为分子在不断运动,向四周扩散,使人们闻到花香,正确;B、铁制品在潮湿的空气中容易生锈是因为铁能与氧气、水蒸气发生缓慢氧化,正确;C、量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,导致溶液浓度偏小,选项错误;D、煤球制成蜂窝状后燃烧更旺是因为增大了煤与空气的接触面积,正确。故选C。
12.A
【详解】A、黄铜是铜、锌等形成的合金,选项正确;
B、氧化铁是一种氧化物,不是合金,选项错误;
C、黄金是金属单质,是一种纯净物,不是合金,选项错误;
D、纯铝是金属单质,是一种纯净物,不是合金,选项错误;
故选A。
【点睛】合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金概念有三个特点:①一定是混合物;②合金中各成分都是以单质形式存在;③合金中至少有一种金属。
13. 物理性质 固体 导电 导热 较大 较高
【详解】分析本题,后面举例的内容都是金属的物理性质,故前面填物理性质;金属在常温下大都是固体(汞除外),大多数的金属具有导电性、导热性和延展性,密度比较大,熔点比较高;
14.
【详解】铁与硫酸铜反应生成硫酸亚铁和铜,反应方程式为:
15.(1)不是
(2)化学
【详解】(1)溶液是均一、稳定的混合物,油水混合物不是均一,稳定的,不属于溶液,是乳浊液;
(2)暖宝宝使用过程中是铁与氧气、水接触发生化学反应放出热量,该过程发生化学反应是将化学能转化为热能。
16. 黑色粉末变红
【详解】A处一氧化碳和氧化铜在加热的条件下反应生成铜和二氧化碳,氧化铜是黑色的,铜是红色的,故装置玻璃管里可观察到的现象是黑色粉末变红;反应的化学方程式是:;
B处二氧化碳和澄清石灰水反应生成碳酸钙和水,反应的化学方程式是:;
尾气处理是一氧化碳的燃烧生成二氧化碳,反应的化学方程式是:。
17.(1)B
(2)a
(3)坩埚钳
(4)b
(5) 氧气 NaCl溶液
【分析】(1)
用图1所示装置制取氧气的优点是可以通用注射器活塞控制液体的滴加速率来控制反应速率,但不能控制反应的发生与停止,故选B。
(2)
氧气密度大于空气,用图2装置收集氧气,则气体应长进短出,从a端进入。
(3)
图3实验中夹持仪器的名称是坩埚钳。
(4)
二氧化碳密度大于空气,和水反应生成碳酸能使湿润红色石蕊试纸变红色;故图4实验中可观察到b管中试纸变色更明显。
(5)
铁生锈是铁和氧气、水共同作用的结果。图5实验为探究氯化钠是否可以加快铁的锈蚀,则控制变量为氯化钠溶液,故物质X和物质Y分别是氧气和氯化钠溶液。
18. Al 2 铜的金属活动性比银强
【详解】(1)金属活动性顺序为:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,故表中方格内应填写的元素符号是:Al;
(2)在金属活动性顺序里,Mg、Sn位于氢之前,能与稀盐酸(或稀硫酸)发生置换反应,Pt、Au位于氢之后,不与稀盐酸或(稀硫酸)发生置换反应,故能与稀盐酸发生置换反应的金属有2种;
(3)Cu能从AgNO3溶液中置换出Ag,因为铜的金属活动性比银强。
【点睛】金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;位于氢前面的金属能置换出盐酸、稀硫酸中的氢;位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
19. 增强水的导电性 红磷的量不足(合理即可) 密度比空气大 与氧气接触
【详解】(1)A实验是电解水试验,水中加入少量氢氧化钠溶液的作用是:增强水的导电性;
(2)B实验是测定空气中氧气的体积分数,导致测量结果小于1/5的原因可能是:红磷的量不足、装置漏气等;
(3)C实验中由蜡烛的熄灭可验证二氧化碳的主要物理性质是密度比空气大;
(4)D实验中有氧气的铁钉生锈,没有氧气的铁钉不生锈,验证铁生锈的条件之一是:与氧气接触。
20.(1)分液漏斗
(2) 搅拌,加速溶解
(3) CF/FC
【详解】(1)仪器的名称①是分液漏斗;
(2)紫黑色固体为高锰酸钾,受热分解生成锰酸钾、二氧化锰和氧气,反应化学方程式为;在G的操作过程中,玻璃棒起搅拌,加速溶解的作用;
(3)实验室选用锌粒和稀硫酸反应制取氢气的,同时生成硫酸锌,属于固液常温型反应,发生装置可选用B或C,但C中分液漏斗可以控制稀硫酸的添加量,从而能有效控制反应速率;用排空气法可以收集干燥的气体,氢气密度比空气小,故可用向下排空气法收集,所以制取装置组合为CF;反应的化学方程式为。
21.(1)23.5
(2)由(1)的分析可知,每加入20g稀硫酸,参加反应的锌的质量为3.25g,第四次加入20g稀硫酸,参加反应的锌的质量为:20.25g-17g=3.25g,第五次加入20g稀硫酸,残留金属的质量不再变化,说明第四次锌和稀硫酸恰好完全反应。
解:设锌和稀硫酸反应生成硫酸锌的质量为x,生成氢气的质量为y
x=32.2g
y=0.4g
恰好完全反应时所得溶液的溶质质量分数为:
答:恰好完全反应时所得溶液的溶质质量分数为34.8%
【详解】(1)黄铜中的锌与稀硫酸反应生成硫酸锌和氢气,铜和稀硫酸不反应,由表中数据可知,第一次加入20g稀硫酸,参加反应的锌的质量为:30g-26.75g=3.25g,第三次加入20g稀硫酸,参加反应的锌的总质量为30g-20.25g=9.75g=3.25g×3,说明每加入20g稀硫酸,参加反应的锌的质量为3.25g,故m=26.75-3.25=23.5;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.高温下向24.0gFe2O3中通入CO一段时间后,停止加热,冷却测得剩余固体为20.0g。向剩余固体中加入280.2g足量的稀H2SO4充分反应,固体全部溶解,得到300.0g浅绿色溶液。以下说法不正确的是( )
A.向20.0g剩余固体中加入足量的稀H2SO4产生0.2gH2
B.高温时发生的反应为Fe2O3+2COFe+FeO+CO2
C.浅绿色溶液中FeSO4的质量分数为15.2%
D.高温下所得CO2气体的质量为11.0g
2.下列物质不能由金属和盐酸直接反应制得的是
①CuCl2 ②FeCl2 ③MgCl2 ④FeCl3.
A.①② B.①④ C.①③ D.②④
3.下列推理正确的是
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.置换反应中一定有单质生成,因此有单质生成的反应一定是置换反应
C.元素是具有相同核电荷数的一类原子的总称,因此同种元素核电荷数一定相同
D.原子核是由质子和中子构成的,则所有的原子核中一定都含有质子和中子
4.证据推理是化学学科核心素养的重要内容,下列推理合理的是( )
A.氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
B.单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质
C.置换反应生成单质和化合物,所以生成单质和化合物的反应一定为置换反应
D.铝比铁活泼,所以铝制品比铁制品更易受到腐蚀
5.小红同学为探究X、Y、Z三种金属(都不是Ag)的活动性顺序,做了如下实验:
(1)把X和Y分别放入稀H2SO4中,X溶解并产生H2,Y不反应;
(2)把Y和Z分别放入AgNO3溶液中,在Y表面有Ag析出,而Z没有变化;
根据以上实验事实,下列金属活动性顺序由强到弱排列正确的是
A.X>Y>(H)>Z B.X>Y>H>Z
C.X>Y>Z>Ag D.X>(H)>Y>Z
6.推理、归纳是有效的学习方法之一,下列有关推理归纳正确的是
A.物质与氧气的反应一定是氧化反应,氧化反应一定是物质与氧气的反应
B.由一种分子构成的物质一定是纯净物,纯净物一定由一种分子构成
C.化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化
D.置换反应中一定生成单质和化合物,有单质和化合物生成的反应一定是置换反应
7.为了探究生活中钢铁生锈的原因,实验组用普通铁钉、纯铁钉同时进行如图的四组实验,一段时间后,只在实验Ⅰ中观察到了红褐色的锈斑,其他均无明显变化。下列说法合理的是
A.Ⅰ和Ⅱ对比说明铁制品锈蚀需要水 B.Ⅰ和Ⅳ对比说明普通铁钉比纯铁钉更容易锈蚀
C.Ⅰ和Ⅲ对比说明铁制品锈蚀需要氧气 D.Ⅱ和Ⅲ对比说明铁制品锈蚀需要氧气和水
8.黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A.a点时,锌有剩余
B.c点时,硫酸没有完全参与反应
C.该黄铜中锌的质量分数为44%
D.所用稀硫酸的溶质质量分数为8.29%
9.物质的性质决定用途,下列因果关系不成立的是
A.因为磷燃烧能产生白烟,所以可用于制造烟雾弹
B.因为金属钨的熔点高,所以被用来制作灯泡的灯丝
C.因为氧气具有可燃性,所以可以用来作燃料
D.因为氮气化学性质不活泼,所以可以用于食品包装袋内防腐
10.某化学兴趣小组探究铁生锈实验,取一块废旧铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中、在锥形瓶中加入3~4mL浓食盐水,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,下列说法中错误的是
A.浓食盐水的作用是加快铁丝网生锈
B.水中滴加红墨水,便于观察实验现象
C.实验过程中,烧杯中的导管口会冒气泡
D.一段时间后,铁丝表面出现红棕色物质
11.对下列现象的解释或结论不正确的是( )
A.春季的洛阳,花香满城是因为分子在不断运动
B.铁制品在潮湿的空气中容易生锈是因为铁能与氧气、水蒸气发生缓慢氧化
C.配制一定量5%的氯化钠溶液,量取水时仰视读数会使所得溶液浓度偏大
D.煤球制成蜂窝状后燃烧更旺是因为增大了煤与空气的接触面积
12.金属材料在生产和生活中有着广泛的应用。下列属于合金的是
A.黄铜 B.氧化铁 C.黄金 D.纯铝
二、填空题
13.金属具有很多的共同的 。例如,常温下它们都是 (汞除外),有金属光泽,大多数能导 和 ,有延展性,密度 ,熔点 。
14.铁与硫酸铜溶液反应
15.生活中处处有化学。
(1)2022年3月,王亚平在天宫课堂实验中将油和水混合振荡,得到了不分层的油水混合物,叶光富根据转动形成向心力,又实现了油和水的分离。请判断王亚平得到的不分层的油水混合物 (填“是”或“不是”)溶液。
(2)发热小能手暖宝宝(成分有铁粉、活性炭、氯化钠等)使用过程中将 能转化为热能。
16.如图为 CO 还原氧化铜的微型装置图。则 A 处 V 形管内的现象为 ,化学方程式为 ;B 处V 形管内的溶液变浑浊, 化学方程式为 ; 将尾气点燃, 化学方程式为 。
17.化学是以实验为基础的学科,根据图示实验回答下列问题。
(1)用图1所示装置制取氧气的优点是___________(选填序号)
A.能控制反应的发生与停止 B.能控制液体的滴加速度 C.产生的气体不含任何杂质
(2)用图2装置收集氧气,则气体从 (选填“a”或“b”)端进入。
(3)图3实验中夹持仪器的名称是 。
(4)图4实验中可观察到 管中试纸变色更明显。
(5)图5实验为探究氯化钠是否可以加快铁的锈蚀,物质X和物质Y分别是 和 。
18.金属活动性顺序:
(1)请在表中方格内应填写的元素符号是 。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有 种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由: 。
三、实验题
19.如图是一些探究实验,请回答相关问题.
(1)A实验水中加入少量氢氧化钠溶液的作用是 .
(2)B实验中导致测量结果小于的原因可能是 (答一点即可)
(3)C实验可验证二氧化碳的主要物理性质是 .
(4)D实验验证铁生锈的条件之一是 .
20.根据下列装置进行相应实验,根据要求回答问题:
(1)写出仪器的名称① 。
(2)实验室用加热一种紫黑色固体来制取氧气,其反应化学方程式为 ,出于环保角度考虑,想要回收上述反应产物中的MnO2,需要对产物进行分离、提纯,得到较为纯净的MnO2。其中在G的操作过程中,玻璃棒的作用是 。
(3)现在的新能源汽车中,有一种是以氢气作为能源驱动的。若要制取较为干燥的H2,并能有效控制反应速率,应选用的制取装置组合为 ,请写出该实验室制取氢气的反应方程式: 。
四、计算题
21.某化学兴趣小组测定黄铜(铜锌合金)的组成,称取30g黄铜置于烧杯中,用100g稀硫酸分5次加入,实验数据记录如下:
实验次数 第一次 第二次 第三次 第四次 第五次
稀硫酸的质量/g 20 20 20 20 20
残留金属的质量/g 26.75 m 20.25 17 17
试分析并计算:
(1)实验数据表中m的值为 。
(2)计算恰好完全反应时所得溶液的溶质质量分数。(精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、剩余固体为20.0g。向剩余固体中加入280.2g足量的稀H2SO4充分反应,固体全部溶解,得到300.0g浅绿色溶液,根据质量守恒定律可得,生成的氢气的质量为20.0g+280.0g-300.0g=0.2g,正确;
B、高温时发生反应为Fe2O3+2CO2Fe+3CO2,而非Fe2O3+2CO Fe+FeO+2CO2,错误;
C、根据铁元素守恒可得关系式为Fe∽FeSO4.设浅绿色溶液中FeSO4的质量分数为x
x=15.2%,正确;
D、设生成的二氧化碳的质量为y
y=11.0g,正确。
故选B。
2.B
【详解】①铜在金属活动性顺序中排在氢的后面,铜不与酸反应,故①错误;
②铁和盐酸反应生成氯化亚铁和氢气,故②正确;
③镁和盐酸反应生成氯化镁和氢气,故③正确;
④铁和盐酸反应生成氯化亚铁和氢气,不会生成氯化铁,故④错误。
故选B。
3.C
【详解】A、只含有一种元素的物质不一定是单质,例如氧气和臭氧组成的混合物,错误;
B、有单质生成的反应不一定是置换反应,例如水电解生成氢气和氧气,错误;
C、元素是具有相同核电荷数的一类原子的总称,因此同种元素核电荷数一定相同,正确;
D、不是所有的原子核中一定都含有质子和中子,例如有些氢原子核内没有中子,错误。
故选C。
4.B
【详解】A、氧化物中含有氧元素,但含有氧元素的化合物不一定是氧化物,如氢氧化钠含有氧元素,但属于碱,选项错误;
B、单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质,选项正确;
C、置换反应生成单质和化合物,但生成单质和化合物的反应不一定为置换反应,如过氧化氢分解生成水和氧气,是分解反应,选项错误;
D、铝比铁活泼,铝在常温下容易与空气中的氧气反应形成致密的氧化铝保护膜,阻止铝的进一步锈蚀,铝制品比铁制品更耐腐蚀,选项错误。
故选B。
5.D
【详解】(1)“把X和Y分别放入稀H2SO4中,X溶解并产生H2,Y不反应”,说明X的金属活动性排在氢的前面,Y的金属活动性顺序排在氢的后面。
(2)“把Y和Z分别放入AgNO3溶液中,在Y表面有Ag析出,而Z没有变化”,说明Y的活动性应排在Ag的前面,而Z在Ag的后面。
由上述分析可知,X、Y、Z三种金属活动性顺序由强到弱排列为X>(H)>Y>Z;
故选D。
6.C
【详解】A、物质与氧气的反应一定是氧化反应,但是氧化反应不一定是物质与氧气的反应,如氢气还原氧化铜,不符合题意;
B、由一种分子构成的物质一定是纯净物,但是纯净物不一定由一种分子构成,如铁由原子构成,不符合题意;
C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化,符合题意;
D、置换反应中一定生成单质和化合物,有单质和化合物生成的反应不一定是置换反应,如氯酸钾分解生成氯化钾和氧气,属于分解反应,不符合题意。
故选C。
7.B
【详解】A、实验Ⅰ中铁钉与氧气和蒸馏水接触,生锈;实验Ⅱ中铁钉只与蒸馏水接触,不生锈,说明铁制品锈蚀需要氧气,故A错误;
B、实验Ⅰ中普通铁钉与氧气和蒸馏水接触,生锈;实验Ⅳ中纯铁钉与氧气和蒸馏水接触,不生锈,说明普通铁钉比纯铁钉更容易锈蚀,故B正确;
C、实验Ⅰ中铁钉与氧气和蒸馏水接触,生锈;实验Ⅲ铁钉只与氧气接触,不生锈,说明铁制品锈蚀需要水,故C错误;
D、实验Ⅱ中铁钉只与蒸馏水接触,铁钉不生锈;实验Ⅲ铁钉与氧气接触,不生锈,两组实验变量不唯一,无法对比得出结论,故D错误;
故选B。
8.D
【分析】黄铜是铜锌合金,向该黄铜中滴加稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,随着稀硫酸的加入,固体质量逐渐减小,待锌与稀硫酸完全反应后,固体质量不再变化,最后剩余固体的质量就是黄铜中铜的质量。
【详解】A、由图可知,a点时,固体质量还在减少,说明锌未完全反应,锌有剩余,不符合题意;
B、由图可知,c点时,稀硫酸过量,硫酸没有完全参与反应,不符合题意;
C、剩余固体的质量就是黄铜中铜的质量,即黄铜中铜的质量为5.6g,则黄铜中锌的质量为:10.0g-5.6g=4.4g,故该黄铜中锌的质量分数为,不符合题意;
D、解:设所用稀硫酸的溶质质量分数为x
x=9.8% ,符合题意;故选D。
9.C
【详解】A、磷燃烧能产生大量的白烟,可用于制作烟幕弹,故选项说法正确。
B、金属钨熔点高,制成的灯丝不易熔断,可用来制造灯泡中的灯丝,故选项说法正确。
C、氧气能支持燃烧,能作助燃剂,但氧气不具有可燃性,不能作燃料,故选项说法错误。
D、氮气化学性质不活泼,可用于食品包装袋内防腐,故选项说法正确。
故选:C。
10.C
【详解】A.铁在食盐水中生锈速度会加快,该选项说法正确;
B.由于铁与氧气和水共同接触时会生锈,则装置中由于氧气的减少而压强较小,则烧杯中的水会倒吸入锥形瓶中,则水中滴加红墨水,便于观察实验现象,该选项说法正确;
C.实验过程中,锥形瓶中的氧气被消耗,压强减小,烧杯中的水会沿导管倒吸入锥形瓶中,该选项说法不正确;
D.铁锈是红棕色,则一段时间后,铁丝表面出现红棕色物质,该选项说法正确,
故选C。
11.C
【详解】A、花香满城是因为分子在不断运动,向四周扩散,使人们闻到花香,正确;B、铁制品在潮湿的空气中容易生锈是因为铁能与氧气、水蒸气发生缓慢氧化,正确;C、量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,导致溶液浓度偏小,选项错误;D、煤球制成蜂窝状后燃烧更旺是因为增大了煤与空气的接触面积,正确。故选C。
12.A
【详解】A、黄铜是铜、锌等形成的合金,选项正确;
B、氧化铁是一种氧化物,不是合金,选项错误;
C、黄金是金属单质,是一种纯净物,不是合金,选项错误;
D、纯铝是金属单质,是一种纯净物,不是合金,选项错误;
故选A。
【点睛】合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金概念有三个特点:①一定是混合物;②合金中各成分都是以单质形式存在;③合金中至少有一种金属。
13. 物理性质 固体 导电 导热 较大 较高
【详解】分析本题,后面举例的内容都是金属的物理性质,故前面填物理性质;金属在常温下大都是固体(汞除外),大多数的金属具有导电性、导热性和延展性,密度比较大,熔点比较高;
14.
【详解】铁与硫酸铜反应生成硫酸亚铁和铜,反应方程式为:
15.(1)不是
(2)化学
【详解】(1)溶液是均一、稳定的混合物,油水混合物不是均一,稳定的,不属于溶液,是乳浊液;
(2)暖宝宝使用过程中是铁与氧气、水接触发生化学反应放出热量,该过程发生化学反应是将化学能转化为热能。
16. 黑色粉末变红
【详解】A处一氧化碳和氧化铜在加热的条件下反应生成铜和二氧化碳,氧化铜是黑色的,铜是红色的,故装置玻璃管里可观察到的现象是黑色粉末变红;反应的化学方程式是:;
B处二氧化碳和澄清石灰水反应生成碳酸钙和水,反应的化学方程式是:;
尾气处理是一氧化碳的燃烧生成二氧化碳,反应的化学方程式是:。
17.(1)B
(2)a
(3)坩埚钳
(4)b
(5) 氧气 NaCl溶液
【分析】(1)
用图1所示装置制取氧气的优点是可以通用注射器活塞控制液体的滴加速率来控制反应速率,但不能控制反应的发生与停止,故选B。
(2)
氧气密度大于空气,用图2装置收集氧气,则气体应长进短出,从a端进入。
(3)
图3实验中夹持仪器的名称是坩埚钳。
(4)
二氧化碳密度大于空气,和水反应生成碳酸能使湿润红色石蕊试纸变红色;故图4实验中可观察到b管中试纸变色更明显。
(5)
铁生锈是铁和氧气、水共同作用的结果。图5实验为探究氯化钠是否可以加快铁的锈蚀,则控制变量为氯化钠溶液,故物质X和物质Y分别是氧气和氯化钠溶液。
18. Al 2 铜的金属活动性比银强
【详解】(1)金属活动性顺序为:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,故表中方格内应填写的元素符号是:Al;
(2)在金属活动性顺序里,Mg、Sn位于氢之前,能与稀盐酸(或稀硫酸)发生置换反应,Pt、Au位于氢之后,不与稀盐酸或(稀硫酸)发生置换反应,故能与稀盐酸发生置换反应的金属有2种;
(3)Cu能从AgNO3溶液中置换出Ag,因为铜的金属活动性比银强。
【点睛】金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
在金属活动性顺序里,金属的位置越靠前,它的活动性就越强;位于氢前面的金属能置换出盐酸、稀硫酸中的氢;位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
19. 增强水的导电性 红磷的量不足(合理即可) 密度比空气大 与氧气接触
【详解】(1)A实验是电解水试验,水中加入少量氢氧化钠溶液的作用是:增强水的导电性;
(2)B实验是测定空气中氧气的体积分数,导致测量结果小于1/5的原因可能是:红磷的量不足、装置漏气等;
(3)C实验中由蜡烛的熄灭可验证二氧化碳的主要物理性质是密度比空气大;
(4)D实验中有氧气的铁钉生锈,没有氧气的铁钉不生锈,验证铁生锈的条件之一是:与氧气接触。
20.(1)分液漏斗
(2) 搅拌,加速溶解
(3) CF/FC
【详解】(1)仪器的名称①是分液漏斗;
(2)紫黑色固体为高锰酸钾,受热分解生成锰酸钾、二氧化锰和氧气,反应化学方程式为;在G的操作过程中,玻璃棒起搅拌,加速溶解的作用;
(3)实验室选用锌粒和稀硫酸反应制取氢气的,同时生成硫酸锌,属于固液常温型反应,发生装置可选用B或C,但C中分液漏斗可以控制稀硫酸的添加量,从而能有效控制反应速率;用排空气法可以收集干燥的气体,氢气密度比空气小,故可用向下排空气法收集,所以制取装置组合为CF;反应的化学方程式为。
21.(1)23.5
(2)由(1)的分析可知,每加入20g稀硫酸,参加反应的锌的质量为3.25g,第四次加入20g稀硫酸,参加反应的锌的质量为:20.25g-17g=3.25g,第五次加入20g稀硫酸,残留金属的质量不再变化,说明第四次锌和稀硫酸恰好完全反应。
解:设锌和稀硫酸反应生成硫酸锌的质量为x,生成氢气的质量为y
x=32.2g
y=0.4g
恰好完全反应时所得溶液的溶质质量分数为:
答:恰好完全反应时所得溶液的溶质质量分数为34.8%
【详解】(1)黄铜中的锌与稀硫酸反应生成硫酸锌和氢气,铜和稀硫酸不反应,由表中数据可知,第一次加入20g稀硫酸,参加反应的锌的质量为:30g-26.75g=3.25g,第三次加入20g稀硫酸,参加反应的锌的总质量为30g-20.25g=9.75g=3.25g×3,说明每加入20g稀硫酸,参加反应的锌的质量为3.25g,故m=26.75-3.25=23.5;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
