化学人教版(2019)必修第一册4.1.1原子结构 核素 课件(共45张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.1原子结构 核素 课件(共45张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 21:14:06 | ||
图片预览






文档简介
(共45张PPT)
第1课时 原子结构 核素
素养目标
1.通过原子构成认识质量数的含义,熟悉 中各微粒数间的关系,培养证据推理意识。
2.回顾初中所学原子结构知识,结合电子层模型示意图,了解核外电子能量高低与分层排布的关系。依据稀有气体元素原子的电子层排布,思考并总结出核外电子排布规律,并学会书写常见简单原子的原子结构示意图。培养微观探析、证据推理与模型认知的意识和习惯。
3.通过阅读“科学史话”,了解“原子结构模型的演变”培养创新意识,增强科学探究意识和社会责任感。
4.辨析比较元素、核素、同位素的异同,培养宏观辨识与微观探析的能力。
5.了解核素在人类科技发展中的重要应用,培养科学态度与社会责任。认识化学作为一门自然科学,学科发展的目的是服务于社会。
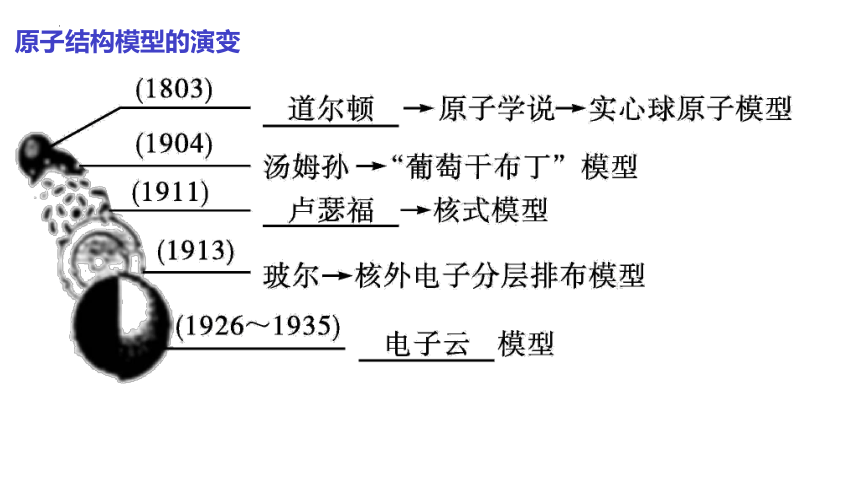
【道尔顿模型】(1803年):
原子是构成物质的基本粒子,
它们是坚实的、不可再分的实心球。
【汤姆孙原子模型】(1897年)
英国科学家汤姆孙研究阴极射线
时发现所有原子中都含有
带负电荷的电子。
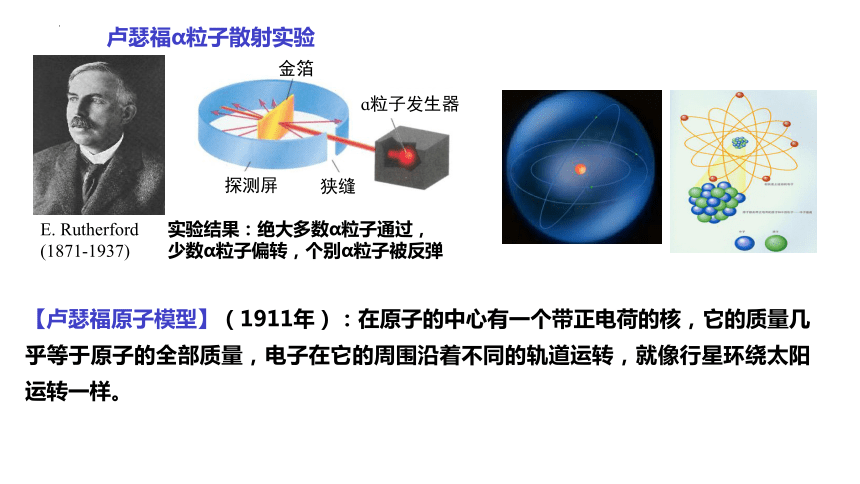
E. Rutherford
(1871-1937)
卢瑟福α粒子散射实验
实验结果:绝大多数α粒子通过,
少数α粒子偏转,个别α粒子被反弹
金箔
探测屏
ɑ粒子发生器
狭缝
【卢瑟福原子模型】(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
【玻尔原子模型】(1913):原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不放出能量,也不吸收能量。
【电子云模型】20世纪初 科学家提出,原子核外电子的运动不遵循经典力学的原理,必须用量子力学模型描述核外电子的运动。即现代量子力学模型(电子云模型)。
原子结构模型的演变
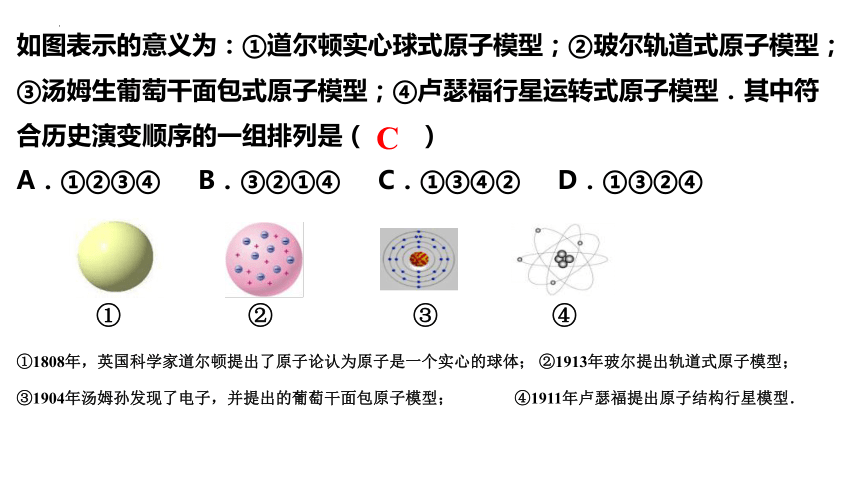
如图表示的意义为:①道尔顿实心球式原子模型;②玻尔轨道式原子模型;③汤姆生葡萄干面包式原子模型;④卢瑟福行星运转式原子模型.其中符合历史演变顺序的一组排列是( )
A.①②③④ B.③②①④ C.①③④② D.①③②④
① ② ③ ④
C
①1808年,英国科学家道尔顿提出了原子论认为原子是一个实心的球体; ②1913年玻尔提出轨道式原子模型;③1904年汤姆孙发现了电子,并提出的葡萄干面包原子模型; ④1911年卢瑟福提出原子结构行星模型.
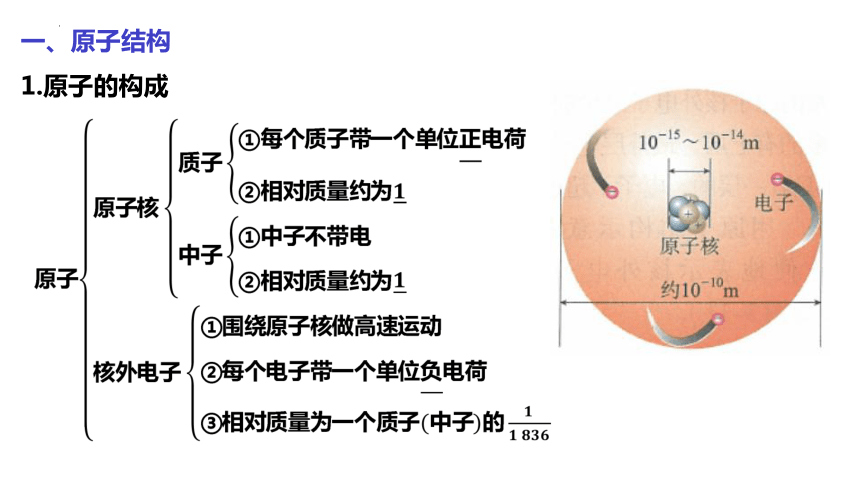
一、原子结构
1.原子的构成
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
原子序数=核电荷数=质子数=核外电子数
原子质量≈原子核质量=质子的质量+中子的质量
相对原子质量≈质子数+中子数=质量数
如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,
那么原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
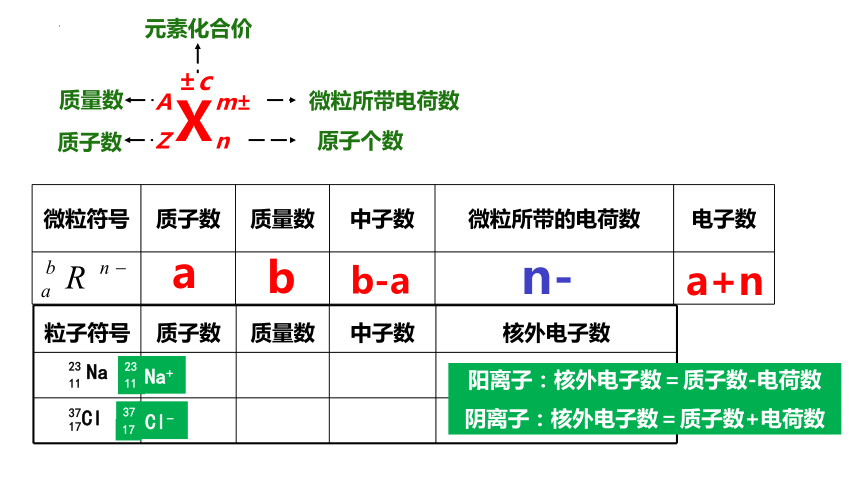
X
A
Z
质量数(A)=质子数(Z)+中子数(N)
质量数:将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
微粒符号 质子数 质量数 中子数 微粒所带的电荷数 电子数
a
b-a
b
n-
a+n
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
粒子符号 质子数 质量数 中子数 核外电子数
Na
11
23
Cl
17
37
Na+
11
23
Cl-
17
37
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
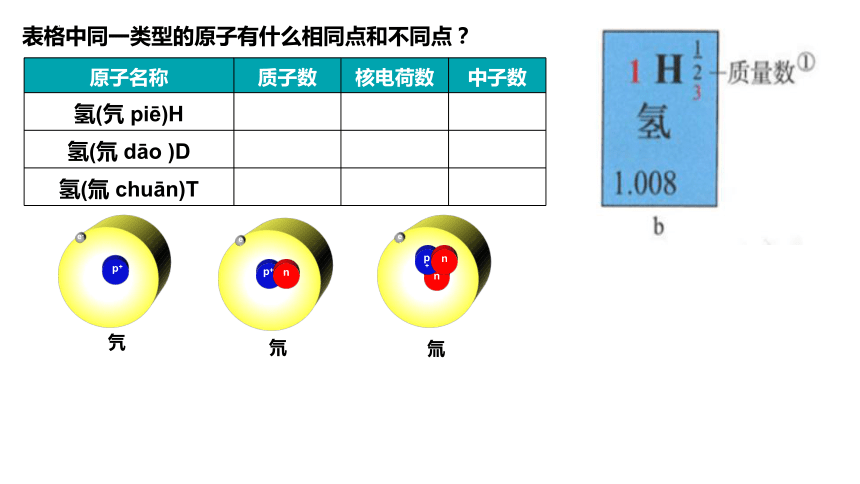
原子名称 质子数 核电荷数 中子数
氢(氕 piē)H
氢(氘 dāo )D
氢(氚 chuān)T
表格中同一类型的原子有什么相同点和不同点?
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
3.原子核外电子的排布规律
(1)电子层的划分
①核外电子的能量及运动区域。
原子结构示意图
(2)核外电子的排布规律
①电子总是尽可能先从内层排起,当一层充满后再填充下一层。
②原子核外各电子层最多容纳2n2个电子。
③原子最外层电子数不能超过8(K层为最外层时不能超过2),次外层电子数不能超过18,倒数第三层电子数不能超过32。
核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
【微思考1】当M层上有电子时,L层上的电子是否已排满
提示 由于L电子层能量比M层低,故电子先排满L层后再排M层;
因此当M层上有电子时,L层上电子已排满。
【微思考2】核外电子排布相同的微粒化学性质一定相同吗
提示 核外电子排布相同的微粒化学性质不一定相同,如Na+与Ne、
F-与Mg2+化学性质不同。
离子结构示意图
离子 核外电子排布特点 举例
阳离子
阴离子
与上周期的
稀有气体排布相同
与同周期的
稀有气体排布相同
【微思考3】M层最多可容纳18个电子,为什么钾原子的核外电子排布不是
提示 核外电子排布规律是相互联系的,不能孤立地应用其中的一项。
如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,
最多可以排布8个电子。
【微思考4】钙的原子结构示意图可表示为 ,对吗
提示 不对,最外层电子数不超过8个,所以应为
特殊关系 对应元素
最外层电子数等于电子层数的元素
最外层电子数是电子层数2倍的元素
最外层电子数是电子层数3倍的元素
最外层电子数等于次外层电子数的一半的元素
最外层电子数等于次外层电子数的元素
最外层电子数等于次外层电子数的2倍的元素
最外层电子数等于次外层电子数的3倍的元素
最外层电子数等于次外层电子数的4倍的元素
最外层电子数是电子层数3倍的元素
内层电子总数是最外层电子数2倍的元素
原子是由居于原子中心的原子核和核外电子构成的。下列有关原子核外电子排布的说法中错误的是( )
A.电子总是先排布在能量最低的电子层里
B.每个电子层最多能容纳的电子数为2n2
C.最外层电子数不超过8个(K层为最外层时不超过2个)
D.S2-的M层电子数是K层电子数的3倍
D
已知R原子有b个中子,R2+核外有a个电子。则R原子的质量数为( )
A.b B.a+b-2
C.a+b+2 D.a+b
解析 R2+核外有a个电子,则R原子的质子数为a+2,质量数为a+b+2。
C
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子层结构相同,则下列关系正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
A
核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1,则下列有关X的说法中不正确的是( )
A.最高正价为+3价
B.其最低负价可能为-1价
C.氢化物易溶于水
D.是活泼的非金属元素
A
某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种原子的原子核内中子的物质的量为( )
C
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
H
1
1
H或D
1
2
H或T
1
3
元素是具有相同质子数(核电荷数)的一类原子的总称。
具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子互称为同位素
(即同一元素的不同核素互称为同位素)
二、核素
1.含义:把具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子互称为同位素
(即同一元素的不同核素互称为同位素)
同位素的特点
①两同:质子数相同、元素相同;
②两不同:中子数不同、原子不同。
③位置:在周期表里占据同一位置。
④结构:质子数相同,中子数不同。
⑤性质:化学性质几乎完全相同,物理性质略有差异。
⑥存在:天然存在的同位素,相互之间保持一定的比率。
天然存在的元素里,不论是游离态还是化合态,各同位素原子所占原子的百分比一般是不变的。
同位素的应用
(1)14C在考古中推断文物的年代;
(2)2H、3H制造氢弹的原料;
(3)235U核反应堆的燃料;
(4)12C相对原子质量的标准原子;
(5)放射性同位素释放的射线可用于育种、
治疗恶性肿瘤等。
【微思考5】质子数相同的微粒一定属于同一种元素吗
提示 不一定,如Ne和H2O。
【微思考6】12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同吗
提示 由于12C和14C的质子数均为6,而中子数分别为6和8,故它们互为同位素,
其物理性质不同,但化学性质几乎完全相同。
【微思考7】16O与18O互为同位素,O2与O3互为同素异形体,同位素与同素异形体有什么区别
①意义不同,同位素是指质子数相同而中子数不同的同一元素的不同原子之间的互称;而同素异形体是指同一元素形成的不同单质。
②所指对象不同,同位素指的是原子,而同素异形体指的是单质。
判断正误:
(1)同种元素的质子数必定相同。( )
(2)不同元素原子的质量数必定不同。( )
(3)凡是核外电子数相同的微粒必定属于同种元素。( )
(4)石墨和金刚石互为同位素。( )
(6)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。( )
答案 (1)√ (2)× (3)× (4)× (5)√ (6)√
下列各组中属于同位素关系的是( )
C
下列叙述正确的是( )
A.3He和4He属于同一种元素,它们互为同位素
B.2H和3H是不同的核素,它们的质子数不相等
C.14C和14N的质量数相等,它们的中子数相等
D.6Li和7Li的电子数相等,中子数相等
A
下列说法正确的是( )
A.同位素的性质几乎完全相同
B.电子数相同的粒子不一定是同一种元素
C.一种元素只能有一种质量数
D.某种元素的相对原子质量取整数,就是其质量数
解析 同位素的化学性质几乎完全相同,故A错误;电子数相同的粒子不一定是同一种元素,如Ne、OH-,故B正确;一种元素可能有多种质量数,故C错误;不同同位素的质量数不同,故D错误。
B
1.元素、核素、同位素、同素异形体的比较
名称 元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只讲种类,不讲个数 化学反应中的最小微粒 化学性质几乎完全相同,因质量数不同,物理性质不同 组成元素相同,性质不同
决定 因素 质子数 (核电荷数) 质子数、中子数 质子数、中子数 组成元素、
分子结构
举例 H、C、O 三种元素 三种核素 互为同位素 O2与O3互为同素异形体
2.元素、核素、同位素、同素异形体之间的联系
【注意】
①在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
②一种元素可以有多种不同的核素,所以元素的种类数目远少于原子的种类数目。
③自然界中,一种元素的各种核素的含量基本保持不变。
④核素之间的转化不属于化学变化。
下列说法正确的是( )
A.金刚石是碳元素的一种核素
C.H2、D2、T2在相同条件下的密度比为1∶2∶3
D.氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,其化学性质不相同
C
医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60中的碳原子化学性质不同 B.核内质子数为8
C.是12C60的同素异形体 D.与12C、13C互为同位素
解析 14C是碳元素的一种核素,原子核内有6个质子。同素异形体是指同种元素组成的不同单质。同位素原子的质子数相同,中子数不同,最外层电子数相同,故化学性质几乎完全相同。
D
“核物理女王”吴健雄,被誉为东方居里夫人。吴健雄用 放射源进行了实验,验证了杨振宁和李政道提出的“弱相互作用中宇称不守恒原理”。下列关于 的叙述中,正确的是( )
A.质子数是27
B.电子数是33
C.质量数是27
D.中子数是60
A
根据微粒中的数量关系,完成下表。
符号 质子数 中子数 质量数 电子数 核电荷数
Al3+ 27 10
S2- 16 16
12 6 6
判断正误,正确的画“√”,错误的画“×”。
(1)所有原子都由质子、中子和核外电子构成。( )
(2)某种氯原子的中子数是18,则其质量数是35,核外电子数是17。( )
(3)某原子M层电子数为L层电子数的4倍。( )
(4)某离子M层和L层电子数均为K层的4倍。( )
(5)离子的核电荷数一定等于其核外电子数。( )
(6)原子核外电子排布,除最外层外其他电子层一定是排满的。( )
×
√
(7)同种元素的原子均有相同的质子数和中子数。( )
(8)质子数相同的粒子属于同一种元素。( ) (9)2H+核外电子数为2。( )
(10)13C和15N核内中子数相差1。( ) (11)H2、D2、T2互为同位素。( ) (12)医学上常说的“放疗”就是利用放射性同位素释放的射线医治疾病。( )
×
√
×
×
×
×
×
×
×
√
核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素有( )
A.1种 B.2种 C.3种 D.4种
B
小结
1.质量关系
(1)质量数(A)=质子数(Z)+中子数(N)。
(2)原子的相对原子质量近似等于其质量数。
2.电性关系
(1)电中性微粒——原子或分子。
核电荷数=核内质子数=核外电子数。
(2)带电离子:质子数≠电子数。
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
第1课时 原子结构 核素
素养目标
1.通过原子构成认识质量数的含义,熟悉 中各微粒数间的关系,培养证据推理意识。
2.回顾初中所学原子结构知识,结合电子层模型示意图,了解核外电子能量高低与分层排布的关系。依据稀有气体元素原子的电子层排布,思考并总结出核外电子排布规律,并学会书写常见简单原子的原子结构示意图。培养微观探析、证据推理与模型认知的意识和习惯。
3.通过阅读“科学史话”,了解“原子结构模型的演变”培养创新意识,增强科学探究意识和社会责任感。
4.辨析比较元素、核素、同位素的异同,培养宏观辨识与微观探析的能力。
5.了解核素在人类科技发展中的重要应用,培养科学态度与社会责任。认识化学作为一门自然科学,学科发展的目的是服务于社会。
【道尔顿模型】(1803年):
原子是构成物质的基本粒子,
它们是坚实的、不可再分的实心球。
【汤姆孙原子模型】(1897年)
英国科学家汤姆孙研究阴极射线
时发现所有原子中都含有
带负电荷的电子。
E. Rutherford
(1871-1937)
卢瑟福α粒子散射实验
实验结果:绝大多数α粒子通过,
少数α粒子偏转,个别α粒子被反弹
金箔
探测屏
ɑ粒子发生器
狭缝
【卢瑟福原子模型】(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
【玻尔原子模型】(1913):原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不放出能量,也不吸收能量。
【电子云模型】20世纪初 科学家提出,原子核外电子的运动不遵循经典力学的原理,必须用量子力学模型描述核外电子的运动。即现代量子力学模型(电子云模型)。
原子结构模型的演变
如图表示的意义为:①道尔顿实心球式原子模型;②玻尔轨道式原子模型;③汤姆生葡萄干面包式原子模型;④卢瑟福行星运转式原子模型.其中符合历史演变顺序的一组排列是( )
A.①②③④ B.③②①④ C.①③④② D.①③②④
① ② ③ ④
C
①1808年,英国科学家道尔顿提出了原子论认为原子是一个实心的球体; ②1913年玻尔提出轨道式原子模型;③1904年汤姆孙发现了电子,并提出的葡萄干面包原子模型; ④1911年卢瑟福提出原子结构行星模型.
一、原子结构
1.原子的构成
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
原子序数=核电荷数=质子数=核外电子数
原子质量≈原子核质量=质子的质量+中子的质量
相对原子质量≈质子数+中子数=质量数
如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,
那么原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
X
A
Z
质量数(A)=质子数(Z)+中子数(N)
质量数:将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
微粒符号 质子数 质量数 中子数 微粒所带的电荷数 电子数
a
b-a
b
n-
a+n
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
粒子符号 质子数 质量数 中子数 核外电子数
Na
11
23
Cl
17
37
Na+
11
23
Cl-
17
37
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
原子名称 质子数 核电荷数 中子数
氢(氕 piē)H
氢(氘 dāo )D
氢(氚 chuān)T
表格中同一类型的原子有什么相同点和不同点?
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
3.原子核外电子的排布规律
(1)电子层的划分
①核外电子的能量及运动区域。
原子结构示意图
(2)核外电子的排布规律
①电子总是尽可能先从内层排起,当一层充满后再填充下一层。
②原子核外各电子层最多容纳2n2个电子。
③原子最外层电子数不能超过8(K层为最外层时不能超过2),次外层电子数不能超过18,倒数第三层电子数不能超过32。
核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
【微思考1】当M层上有电子时,L层上的电子是否已排满
提示 由于L电子层能量比M层低,故电子先排满L层后再排M层;
因此当M层上有电子时,L层上电子已排满。
【微思考2】核外电子排布相同的微粒化学性质一定相同吗
提示 核外电子排布相同的微粒化学性质不一定相同,如Na+与Ne、
F-与Mg2+化学性质不同。
离子结构示意图
离子 核外电子排布特点 举例
阳离子
阴离子
与上周期的
稀有气体排布相同
与同周期的
稀有气体排布相同
【微思考3】M层最多可容纳18个电子,为什么钾原子的核外电子排布不是
提示 核外电子排布规律是相互联系的,不能孤立地应用其中的一项。
如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,
最多可以排布8个电子。
【微思考4】钙的原子结构示意图可表示为 ,对吗
提示 不对,最外层电子数不超过8个,所以应为
特殊关系 对应元素
最外层电子数等于电子层数的元素
最外层电子数是电子层数2倍的元素
最外层电子数是电子层数3倍的元素
最外层电子数等于次外层电子数的一半的元素
最外层电子数等于次外层电子数的元素
最外层电子数等于次外层电子数的2倍的元素
最外层电子数等于次外层电子数的3倍的元素
最外层电子数等于次外层电子数的4倍的元素
最外层电子数是电子层数3倍的元素
内层电子总数是最外层电子数2倍的元素
原子是由居于原子中心的原子核和核外电子构成的。下列有关原子核外电子排布的说法中错误的是( )
A.电子总是先排布在能量最低的电子层里
B.每个电子层最多能容纳的电子数为2n2
C.最外层电子数不超过8个(K层为最外层时不超过2个)
D.S2-的M层电子数是K层电子数的3倍
D
已知R原子有b个中子,R2+核外有a个电子。则R原子的质量数为( )
A.b B.a+b-2
C.a+b+2 D.a+b
解析 R2+核外有a个电子,则R原子的质子数为a+2,质量数为a+b+2。
C
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子层结构相同,则下列关系正确的是( )
A.a=b+m+n B.a=b-m+n
C.a=b+m-n D.a=b-m-n
A
核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1,则下列有关X的说法中不正确的是( )
A.最高正价为+3价
B.其最低负价可能为-1价
C.氢化物易溶于水
D.是活泼的非金属元素
A
某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种原子的原子核内中子的物质的量为( )
C
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N) 1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
H
1
1
H或D
1
2
H或T
1
3
元素是具有相同质子数(核电荷数)的一类原子的总称。
具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子互称为同位素
(即同一元素的不同核素互称为同位素)
二、核素
1.含义:把具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子互称为同位素
(即同一元素的不同核素互称为同位素)
同位素的特点
①两同:质子数相同、元素相同;
②两不同:中子数不同、原子不同。
③位置:在周期表里占据同一位置。
④结构:质子数相同,中子数不同。
⑤性质:化学性质几乎完全相同,物理性质略有差异。
⑥存在:天然存在的同位素,相互之间保持一定的比率。
天然存在的元素里,不论是游离态还是化合态,各同位素原子所占原子的百分比一般是不变的。
同位素的应用
(1)14C在考古中推断文物的年代;
(2)2H、3H制造氢弹的原料;
(3)235U核反应堆的燃料;
(4)12C相对原子质量的标准原子;
(5)放射性同位素释放的射线可用于育种、
治疗恶性肿瘤等。
【微思考5】质子数相同的微粒一定属于同一种元素吗
提示 不一定,如Ne和H2O。
【微思考6】12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同吗
提示 由于12C和14C的质子数均为6,而中子数分别为6和8,故它们互为同位素,
其物理性质不同,但化学性质几乎完全相同。
【微思考7】16O与18O互为同位素,O2与O3互为同素异形体,同位素与同素异形体有什么区别
①意义不同,同位素是指质子数相同而中子数不同的同一元素的不同原子之间的互称;而同素异形体是指同一元素形成的不同单质。
②所指对象不同,同位素指的是原子,而同素异形体指的是单质。
判断正误:
(1)同种元素的质子数必定相同。( )
(2)不同元素原子的质量数必定不同。( )
(3)凡是核外电子数相同的微粒必定属于同种元素。( )
(4)石墨和金刚石互为同位素。( )
(6)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。( )
答案 (1)√ (2)× (3)× (4)× (5)√ (6)√
下列各组中属于同位素关系的是( )
C
下列叙述正确的是( )
A.3He和4He属于同一种元素,它们互为同位素
B.2H和3H是不同的核素,它们的质子数不相等
C.14C和14N的质量数相等,它们的中子数相等
D.6Li和7Li的电子数相等,中子数相等
A
下列说法正确的是( )
A.同位素的性质几乎完全相同
B.电子数相同的粒子不一定是同一种元素
C.一种元素只能有一种质量数
D.某种元素的相对原子质量取整数,就是其质量数
解析 同位素的化学性质几乎完全相同,故A错误;电子数相同的粒子不一定是同一种元素,如Ne、OH-,故B正确;一种元素可能有多种质量数,故C错误;不同同位素的质量数不同,故D错误。
B
1.元素、核素、同位素、同素异形体的比较
名称 元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只讲种类,不讲个数 化学反应中的最小微粒 化学性质几乎完全相同,因质量数不同,物理性质不同 组成元素相同,性质不同
决定 因素 质子数 (核电荷数) 质子数、中子数 质子数、中子数 组成元素、
分子结构
举例 H、C、O 三种元素 三种核素 互为同位素 O2与O3互为同素异形体
2.元素、核素、同位素、同素异形体之间的联系
【注意】
①在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
②一种元素可以有多种不同的核素,所以元素的种类数目远少于原子的种类数目。
③自然界中,一种元素的各种核素的含量基本保持不变。
④核素之间的转化不属于化学变化。
下列说法正确的是( )
A.金刚石是碳元素的一种核素
C.H2、D2、T2在相同条件下的密度比为1∶2∶3
D.氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,其化学性质不相同
C
医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60中的碳原子化学性质不同 B.核内质子数为8
C.是12C60的同素异形体 D.与12C、13C互为同位素
解析 14C是碳元素的一种核素,原子核内有6个质子。同素异形体是指同种元素组成的不同单质。同位素原子的质子数相同,中子数不同,最外层电子数相同,故化学性质几乎完全相同。
D
“核物理女王”吴健雄,被誉为东方居里夫人。吴健雄用 放射源进行了实验,验证了杨振宁和李政道提出的“弱相互作用中宇称不守恒原理”。下列关于 的叙述中,正确的是( )
A.质子数是27
B.电子数是33
C.质量数是27
D.中子数是60
A
根据微粒中的数量关系,完成下表。
符号 质子数 中子数 质量数 电子数 核电荷数
Al3+ 27 10
S2- 16 16
12 6 6
判断正误,正确的画“√”,错误的画“×”。
(1)所有原子都由质子、中子和核外电子构成。( )
(2)某种氯原子的中子数是18,则其质量数是35,核外电子数是17。( )
(3)某原子M层电子数为L层电子数的4倍。( )
(4)某离子M层和L层电子数均为K层的4倍。( )
(5)离子的核电荷数一定等于其核外电子数。( )
(6)原子核外电子排布,除最外层外其他电子层一定是排满的。( )
×
√
(7)同种元素的原子均有相同的质子数和中子数。( )
(8)质子数相同的粒子属于同一种元素。( ) (9)2H+核外电子数为2。( )
(10)13C和15N核内中子数相差1。( ) (11)H2、D2、T2互为同位素。( ) (12)医学上常说的“放疗”就是利用放射性同位素释放的射线医治疾病。( )
×
√
×
×
×
×
×
×
×
√
核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素有( )
A.1种 B.2种 C.3种 D.4种
B
小结
1.质量关系
(1)质量数(A)=质子数(Z)+中子数(N)。
(2)原子的相对原子质量近似等于其质量数。
2.电性关系
(1)电中性微粒——原子或分子。
核电荷数=核内质子数=核外电子数。
(2)带电离子:质子数≠电子数。
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
