1.2 反应热的计算 (共2课时) 课件 (共17张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2 反应热的计算 (共2课时) 课件 (共17张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-12 22:42:10 | ||
图片预览





文档简介
(共17张PPT)
新人教化学选择性必修一《化学反应原理》
第一章 化学反应的热效应
第二节 反应热的计算
第1课时 盖斯定律
在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,但是有些反应热是无法直接测定的。例如,对于化学反应:
C 燃烧时不可能全部生成CO,总有一部分CO2生成,因此该反应的反应热是无法直接测定的。但这个反应热是冶金工业中非常有用的数据,应该如何获得呢?能否利用一些已知反应的反应热来计算其他反应的反应热呢?
【情境引入】
C(s) + 1/2O2(g) = CO (g)
1836年,俄国化学家盖斯,提出了盖斯定律为我们解决了这个问题。
【任务一】盖斯定律
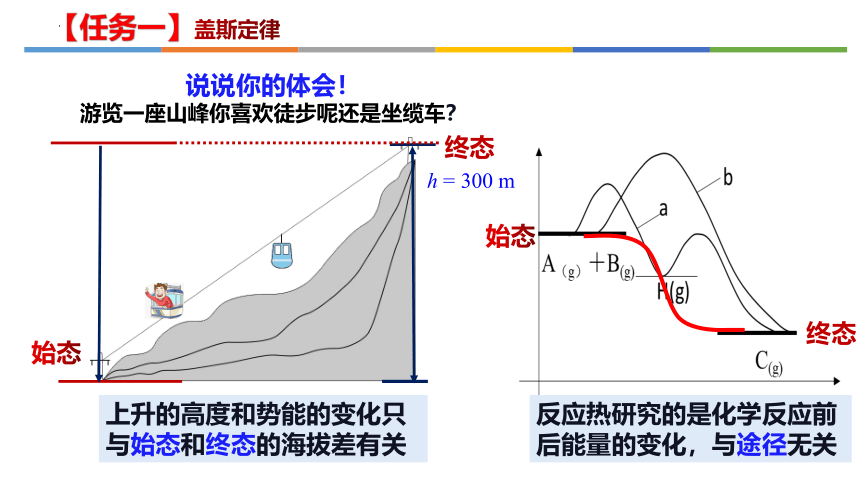
h = 300 m
终态
始态
上升的高度和势能的变化只与始态和终态的海拔差有关
说说你的体会!
游览一座山峰你喜欢徒步呢还是坐缆车?
【任务一】盖斯定律
始态
终态
反应热研究的是化学反应前后能量的变化,与途径无关
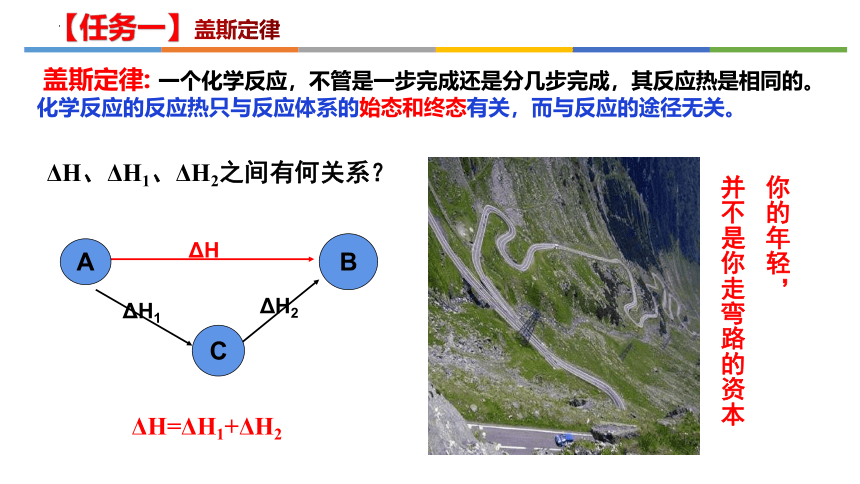
盖斯定律: 一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
【任务一】盖斯定律
ΔH、ΔH1、ΔH2之间有何关系?
B
ΔH
A
ΔH1
ΔH2
C
ΔH=ΔH1+ΔH2
你的年轻,
并不是你走弯路的资本
【典例1】很难直接测得C(s) + 1/2O2(g) = CO (g) 的反应热,但我们可通过
盖斯定律获得它的反应热数据。
已知①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1
应用盖斯定律求解:
ΔH1 = ΔH2 + ΔH3
ΔH3 = ΔH1 – ΔH2
= –393.5kJ/mol – (–283.0kJ/mol)
= –110.5kJ/mol
三者的关系如图
【任务二】盖斯定律应用
【任务二】盖斯定律应用
ΔH3=?除了利用路径法进行图解,还有其他计算方法吗?
C(s) + O2(g) = CO2(g) ΔH1= 393.5 kJ/mol
+)
C(s) + 1/2O2(g) = CO(g) ΔH3=?
CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0 kJ/mol
C(s) + 1/2O2(g) = CO(g) ΔH3= 110.5 kJ/mol
CO可以消去,视为中间产物。
若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和
ΔH3 = ΔH1 ΔH2
= 393.5 kJ/mol ( 283.0 kJ/mol)= 110.5 kJ/mol
1、(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
则制备水煤气的反应③C(s)+H2O(g)=CO(g)+H2(g)的△H等于__________________
____________________________________________________________________________________
(2)已知反应:
①2H2(g) + O2(g) =2 H2O(g) ΔH1
②2 N2(g) + O2(g) = 2NO2(g) ΔH2
③ N2(g) + 3 H2(g) =2NH3(g) ΔH3
则反应2NH3(g) + O2(g) =2NO2(g) + 3H2O(g)的ΔH=_____________________
+131.3 kJ·mol-1
【当堂检测】
确定目标方程式
找出目标方程式中各物质在已知方程式中的位置
将调整好的ΔH 加和
物质变化
能量变化
思维模型
根据目标方程式对已知方程式进行处理
写出目标方程式
2、已知:
①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ·mol-1
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
【解析】①×2+②×4-③=④
ΔH=ΔH1×2+ΔH2×4-ΔH3
=-283.2 kJ·mol-1×2-285.8 kJ·mol-1×4+1 370 kJ·mol-1
=-339.6 kJ·mol-1
【当堂检测】
【任务三】盖斯定律意义
二、盖斯定律在生产和科学研究中的意义
有些反应,因为某些原因,导致反应热难以直接测定,如:
(1)有些反应进行得很慢
(2)有些反应不容易直接发生
(3)有些反应的产品不纯(有副反应发生)
但可以用盖斯定律间接求得。
研究人员提出利用含硫物质的热化学循环实现太阳能的转化与储存,过程如图所示:
图:太阳能的转化与存储过程示意图
(1)写出反应II的热化学方程式:
电能
太阳能
热能
H2SO4分解
H2SO4
SO2催化反应
SO2+H2O
S燃烧
SO2
S
热能
O2
O2
反应I
反应III
反应II
反应I:2H2SO4(1)=2SO2(g)+2H2O(g)+O2(g) H1=+551 kJ/mol
反应II:S(s)+O2(g)=SO2(g) H3=-296 kJ/mol
(2)若将反应I、II和III相加,会得到什么结果?说明什么?
【大展身手】
【2019新课标2】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶等生产。回答下列问题:
已知:
① (g)= (g)+H2(g) ΔH1= +100.3 kJ·mol 1
② H2(g)+ I2(g) =2HI(g) ΔH2= 11.0 kJ·mol 1
对于反应:
③ (g)+ I2(g)= (g)+2HI(g ΔH3=___________kJ·mol 1。
+89.3
焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
试计算CH4(g)=C(s)+2H2(g)的△H
-①+② =目标方程式
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
CO(g)+2H2(g) CH3OH(g) △H1= 。
-99kJ/mol
天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 C2H6(g) C2H4(g) H2(g)
燃烧热ΔH/( kJ·mol 1) -1560 -1411 -286
ΔH=_________kJ·mol 1
+137
已知下列热化学方程式:
① CH3COOH(l)+ 2O2(g) ═2CO2(g)+2H2O(l) ΔH1=﹣870.3 kJ/mol
② C (s) + O2(g)═CO2(g) ΔH2=﹣393.5 kJ/mol
③ H2(g) + 1/2O2(g)═H2O(l) ΔH3=﹣285.8 kJ/mol
则反应 2C(s) +2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH 为( )
A.244.15kJ mol﹣1 B.﹣224.15kJ mol﹣1
C.488.3kJ mol﹣1 D.﹣488.3kJ mol﹣1
新人教化学选择性必修一《化学反应原理》
第一章 化学反应的热效应
第二节 反应热的计算
第1课时 盖斯定律
在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,但是有些反应热是无法直接测定的。例如,对于化学反应:
C 燃烧时不可能全部生成CO,总有一部分CO2生成,因此该反应的反应热是无法直接测定的。但这个反应热是冶金工业中非常有用的数据,应该如何获得呢?能否利用一些已知反应的反应热来计算其他反应的反应热呢?
【情境引入】
C(s) + 1/2O2(g) = CO (g)
1836年,俄国化学家盖斯,提出了盖斯定律为我们解决了这个问题。
【任务一】盖斯定律
h = 300 m
终态
始态
上升的高度和势能的变化只与始态和终态的海拔差有关
说说你的体会!
游览一座山峰你喜欢徒步呢还是坐缆车?
【任务一】盖斯定律
始态
终态
反应热研究的是化学反应前后能量的变化,与途径无关
盖斯定律: 一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
【任务一】盖斯定律
ΔH、ΔH1、ΔH2之间有何关系?
B
ΔH
A
ΔH1
ΔH2
C
ΔH=ΔH1+ΔH2
你的年轻,
并不是你走弯路的资本
【典例1】很难直接测得C(s) + 1/2O2(g) = CO (g) 的反应热,但我们可通过
盖斯定律获得它的反应热数据。
已知①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1
应用盖斯定律求解:
ΔH1 = ΔH2 + ΔH3
ΔH3 = ΔH1 – ΔH2
= –393.5kJ/mol – (–283.0kJ/mol)
= –110.5kJ/mol
三者的关系如图
【任务二】盖斯定律应用
【任务二】盖斯定律应用
ΔH3=?除了利用路径法进行图解,还有其他计算方法吗?
C(s) + O2(g) = CO2(g) ΔH1= 393.5 kJ/mol
+)
C(s) + 1/2O2(g) = CO(g) ΔH3=?
CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0 kJ/mol
C(s) + 1/2O2(g) = CO(g) ΔH3= 110.5 kJ/mol
CO可以消去,视为中间产物。
若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和
ΔH3 = ΔH1 ΔH2
= 393.5 kJ/mol ( 283.0 kJ/mol)= 110.5 kJ/mol
1、(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
则制备水煤气的反应③C(s)+H2O(g)=CO(g)+H2(g)的△H等于__________________
____________________________________________________________________________________
(2)已知反应:
①2H2(g) + O2(g) =2 H2O(g) ΔH1
②2 N2(g) + O2(g) = 2NO2(g) ΔH2
③ N2(g) + 3 H2(g) =2NH3(g) ΔH3
则反应2NH3(g) + O2(g) =2NO2(g) + 3H2O(g)的ΔH=_____________________
+131.3 kJ·mol-1
【当堂检测】
确定目标方程式
找出目标方程式中各物质在已知方程式中的位置
将调整好的ΔH 加和
物质变化
能量变化
思维模型
根据目标方程式对已知方程式进行处理
写出目标方程式
2、已知:
①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ·mol-1
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
【解析】①×2+②×4-③=④
ΔH=ΔH1×2+ΔH2×4-ΔH3
=-283.2 kJ·mol-1×2-285.8 kJ·mol-1×4+1 370 kJ·mol-1
=-339.6 kJ·mol-1
【当堂检测】
【任务三】盖斯定律意义
二、盖斯定律在生产和科学研究中的意义
有些反应,因为某些原因,导致反应热难以直接测定,如:
(1)有些反应进行得很慢
(2)有些反应不容易直接发生
(3)有些反应的产品不纯(有副反应发生)
但可以用盖斯定律间接求得。
研究人员提出利用含硫物质的热化学循环实现太阳能的转化与储存,过程如图所示:
图:太阳能的转化与存储过程示意图
(1)写出反应II的热化学方程式:
电能
太阳能
热能
H2SO4分解
H2SO4
SO2催化反应
SO2+H2O
S燃烧
SO2
S
热能
O2
O2
反应I
反应III
反应II
反应I:2H2SO4(1)=2SO2(g)+2H2O(g)+O2(g) H1=+551 kJ/mol
反应II:S(s)+O2(g)=SO2(g) H3=-296 kJ/mol
(2)若将反应I、II和III相加,会得到什么结果?说明什么?
【大展身手】
【2019新课标2】环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶等生产。回答下列问题:
已知:
① (g)= (g)+H2(g) ΔH1= +100.3 kJ·mol 1
② H2(g)+ I2(g) =2HI(g) ΔH2= 11.0 kJ·mol 1
对于反应:
③ (g)+ I2(g)= (g)+2HI(g ΔH3=___________kJ·mol 1。
+89.3
焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为:
① C(s)+H2O(g)=CO (g)+H2 (g)△H1=+131.5kJ/mol
② CH4(g)+H2O(g)=CO(g)+3H2(g), △H2 =+205.9 kJ/mol
试计算CH4(g)=C(s)+2H2(g)的△H
-①+② =目标方程式
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
CO(g)+2H2(g) CH3OH(g) △H1= 。
-99kJ/mol
天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 C2H6(g) C2H4(g) H2(g)
燃烧热ΔH/( kJ·mol 1) -1560 -1411 -286
ΔH=_________kJ·mol 1
+137
已知下列热化学方程式:
① CH3COOH(l)+ 2O2(g) ═2CO2(g)+2H2O(l) ΔH1=﹣870.3 kJ/mol
② C (s) + O2(g)═CO2(g) ΔH2=﹣393.5 kJ/mol
③ H2(g) + 1/2O2(g)═H2O(l) ΔH3=﹣285.8 kJ/mol
则反应 2C(s) +2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH 为( )
A.244.15kJ mol﹣1 B.﹣224.15kJ mol﹣1
C.488.3kJ mol﹣1 D.﹣488.3kJ mol﹣1
