第三单元《物质构成的奥秘》作业整体设计2023-2024学年度人教版化学九年级上册(含解析)
文档属性
| 名称 | 第三单元《物质构成的奥秘》作业整体设计2023-2024学年度人教版化学九年级上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 573.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 07:30:06 | ||
图片预览




文档简介
九年级化学第三单元作业设计
一、单元信息
基本信息 学科 年级 学期 教材版本 单元名称
化学 九年级 第一学期 人教版 第三单元 物质构成的奥秘
单元组织方式 O自然单元 重组单元
课时信息 序 号 课时名称 对应教材内容
1 第一课时 课题 1 分子和原子 (1)
2 第二课时 课题 1 分子和原子 (2)
3 第三课时 课题 2 原子的结构
4 第四课时 课题 3 元 素 (1)
5 第五课时 课题 3 元 素 (2)
二、单元分析
(一) 课标要求
2011 版课标要求
知道物质是由分子、原子等微小粒子构成的,知道分子是由原子构成的,并从微 观角度解释一些现象;知道物理变化和化学变化的微观本质区别。
了解原子是由质子、中子和电子构成的;了解原子的核外电子是分层排布的;了 解原子结构示意图的含义,并能读懂一些常见原子的原子结构示意图;
了解离子的概念,认识离子是构成物质的一种粒子,初步了解氯化钠等化合物的 形成过程;初步了解相对原子质量的概念,并会查相对原子质量表。
掌握元素的概念;记住一些常见元素的名称和符号;了解元素符号所表示的意义, 学会元素符号的正确写法,初步认识元素周期表。
注意原子质量和相对原子质量的区别。
知道元素的简单分类,能根据原子序数在元素周期表中找到指定的元素。
2
知道同一元素的原子和离子可以相互转化,初步认识核外电子在化学反应中的作 用。
2022 版新课标要求
3.1 物质的组成
初步形成基于元素和分子、原子认识物质及其变化的视角,建立认识物质的宏观 和微观视角之间的关联,知道物质的性质与组成、结构有关。
3.2 元素、分子、原子与物质
3.2.1 元素
认识物质是由元素组成的,知道质子数相同的一类原子属于同种元素,了解在化 学反应中元素的种类是不变的,初步认识元素周期表。
3.2.2 分子、原子
知道物质是由分子、原子等微观粒子构成的;认识原子是由原子核和核外电子构成 的;知道原子可以结合成分子,也可以转变为离子。
3.2.3 物质组成的表示
知道可以用符号表示物质的组成,认识表示分子、原子、离子的符号,知道常见 元素的化合价,学习用化学式表示常见物质组成的方法,认识相对原子质量、相 对分子质量的含义及应用。
(二) 教材分析
本单元的内容有:分子和原子、原子的结构、元素三个课题。它们包括分子和原 子的概念、原子结构模型、核外电子排布观念、离子及离子的形成、相对原子质 量、元素、元素符号、元素符号表示的意义等内容。本单元教材是由宏观世界转 向微观世界的开端,在本书中起到了承前启后的作用;本单元的特点是内容较抽 象,远离学生的生活经验,感性知识不充分,这就给教学带来了一定的困难。课 程标准指出,初中化学基础知识和基本技能是构成学生科学素养的基本要素,是 为学生的终生学习和将来适应现代社会生活打好基础所必需的。化学基础知识和 基本技能还是初中学生进行探究活动的基础和结果,也是对学生进行情感、态度 与价值观教育的重要载体。所以,本单元教材对于学生十分重要,它既是今后学 习的理论基础,又是必不可少的工具。
3
本单元教学的重点:对分子和原子的认识、原子的构成、离子的形成、元素、
元素符号;
本单元教学的难点:用分子和原子的观点解释生活中的一些现象及解释物质
的变化、核外电子排布、元素符号表示的意义。
(三) 学情分析
本单元是物质结构理论的重要开端,是学生从宏观世界进入到微观领域的开
端,微观粒子看不到、摸不着,具有抽象性,不易于理解。九年级学生已具备了 一定的逻辑推理能力,能通过分析一种物质可无限被分割而推理得出物质都是由 不连续的粒子构成的;根据生活中的宏观现象 (如物质的热胀冷缩、扩散现象) 推理得出构成物质的分子 (或原子) 的性质[分子 (或原子) 间有间隔、分子 (或 原子) 是在永不停息运动着的,并能用微粒的观点解释一些生活中常见的现象; 分析“卢瑟福的 a 粒子轰击金箔实验”得出原子的核式结构模型,进一步了解原 子的微观结构、原子的核外电子排布特点及原子结构简图所表示的意义,顺理成 章地得出离子的形成过程,借助离子的形成过程,理清分子、原子、离子、元素 与物质间的关系。
三、单元学习作业目标
1、认识物质是由分子、原子等微粒构成:认识分子、原子的概念和特性。能从不 同层次认识物质的多样性并进行分类,能从原子、分子等水平认识物质的组成、 结构、性质和变化,形成“结构决定性质”的观念,能从宏微结合的视角分析与 解决实际问题
2、学习运用日常生活现象与课本理论相结合的方式,用课本理论来解释日常现象。 充分发挥学生的空间想象能力。
3、学习运用比较、分析、归纳等方法对实验所得信息进行加工让学生具有证据意 识,能够提出可能的假设,通过分析推理加以证实或证伪;建立它们之间的逻辑关 系;并能加以运用,解释各种化学现象,揭示现象的本质和规律
4、对学生进行科学态度教育和辩证地看问题的思想方法教育。
4
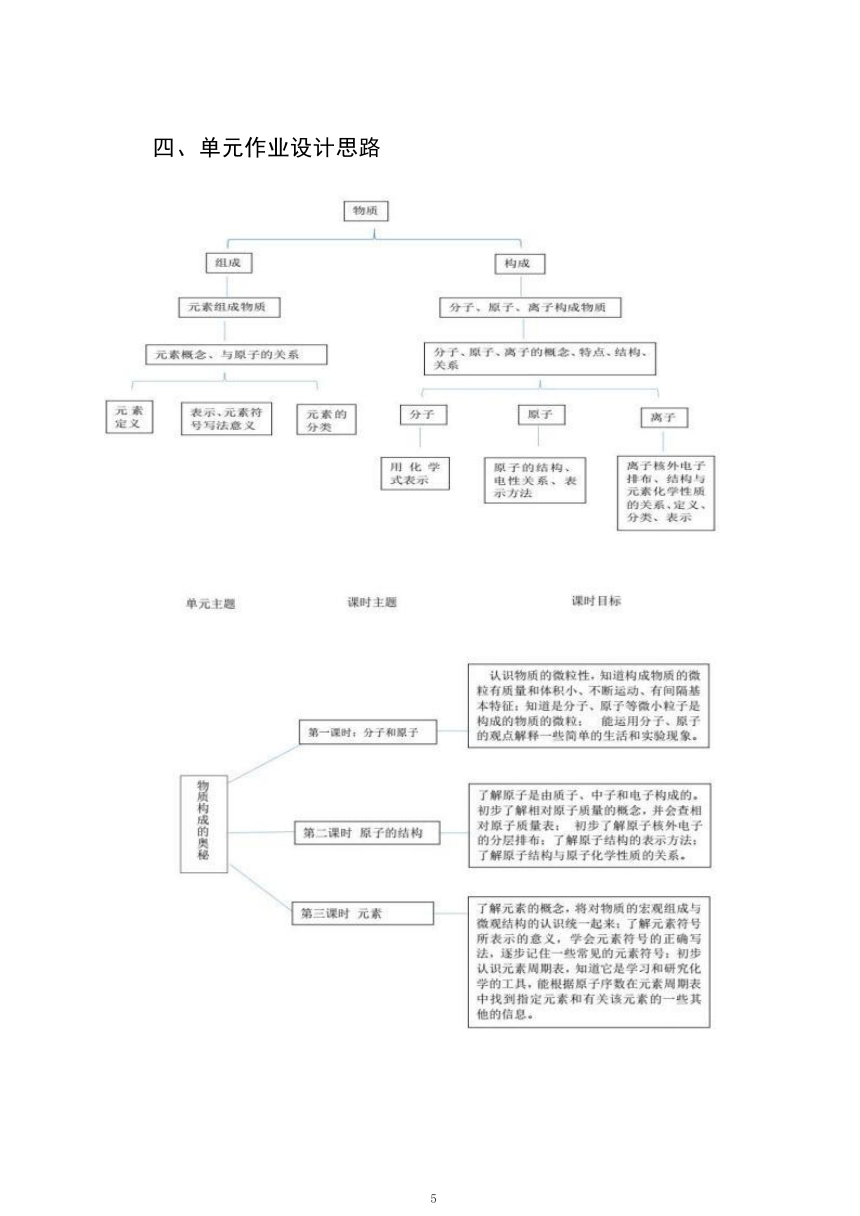
四、单元作业设计思路
5
五、课时作业
第一课时
课时目标:初步形成认识物质及其变化的微观视角;知道物质是由分子、原 子、离子等微观粒子构成的;认识微粒的基本特征;知道分子、原子、离子之间 的关系;认识相对原子质量及其应用。
作业 1 (课前预习作业)
1 、作业内容
(1) 物质是由微小的粒子—— 、 等构成的。
(2) 分子的 和 都很小,我们看不见,摸不着;
分子是不断 ,而且温度越高,运动越 ;分子之间有 ; 同种分子的化学性质 ,不同种分子化学性质 。
2 、时间要求 (2 分钟)
3 、评价设计
答案:(1) 分子;原子 (2) 体积;质量;运动;快;间隔;相同;不同
4 、作业分析与设计意图
(1) 第一题考查物质的微观构成,知道物质由微观粒子分子、原子等构成 的。
(2) 第二题考查分子的特征,能从微观粒子的角度来解释日常生活中常见 的现象。
作业 2 (课后基础性作业)
1 、作业内容
(1) 下列物质中含有氧分子的是 ( )
A.蒸馏水 B.空气 C.高锰酸钾固体 D. 双氧水
6
(2) 八月桂花香,沁人心脾。花香四溢的现象说明 ( )
A.分子的质量很小 B.分子是由原子构成的
C.分子在不停地运动 D.分子之间有一定的间隔
(3) 淀粉溶液遇碘变蓝色。实验表明,无论是固体碘还是碘蒸气,均能使淀粉 溶液变蓝色。这一现象说明( )
A. 同种分子质量相等 B. 同种分子化学性质相同
C. 同种分子体积相等 D. 同种分子运动速度相同
2 、时间要求 (3 分钟 )
3 、评价设计
答案:(1) B (2)C (3)B
4 、作业分析与设计意图
(1) 知道物质是由微观粒子构成的。
(2) 知道分子、原子的特征,并能解释生活中的现象,学以致用。 作业 3 (课后发展性作业)
1 、作业内容
(1) 从分子的角度解释下列现象,其中错误的是( )
A .十里桂花飘香——分子在不停地运动
B .氧气和二氧化碳的化学性质不同——分子构成不同
C .水蒸发为水蒸气,所占体积变大——分子体积变大
D .1 滴水中约含有 1.67×1021 个水分子——分子的质量和体积都很小
(2) 下列关于水受热沸腾、水蒸气遇冷凝结实验的分析中,正确的是 ( )
A.酒精灯加热的作用是让分子从静止开始运动
7
B.实验过程中,分子的种类发生了改变
C.水变成水蒸气时,分子体积增加
D.水变成水蒸气时,分子间间隔增大
2 、时间要求 (1 分钟)
3 、评价设计
答案:(1) C (2) D
4 、作业分析与设计意图
(1) 以分子为例,学生能运用微观粒子的观点来解释生产、生活中的一些常 见现象。
(2) 学习类比的科学方法,培养学生分析、推理问题的能力。
第二课时
作业 1 (课前预习作业)
1 、作业内容
(1) 分子是 ;原子是 ;
化学反应的实质是: 由分子构成的物质在发生化学反应时, 破裂为 , 重新组成为新的 。
(2) 用微观观点 (分子或原子) 解释下列概念
物理变化: 由分子构成的物质在发生物理变化时, 没有变化;
化学变化: 由分子构成的物质在发生化学变化时, 发生了变化,变成的 新的物质 。
2 、时间要求 (3 分钟)
3 、评价设计
答案:(1) 保持物质化学性质的最小粒子;化学变化中的最小粒子;分子;
8
原子;(2) 分子;分子;分子;
4 、作业分析与设计意图
(3) 第一题考查分子、原子的概念及化学反应的实质。
(4) 第二题考查化学反应的微观实质并能做出解释。
作业 2 (课后基础性作业)
1 、作业内容
(1) 原子论和分子学说的创立,奠定了近代化学的基础。分子与原子的本质 区别是( )
A .分子运动速率快,原子运动速率慢
B .分子大,原子小
C .在化学变化中,分子可以再分而原子不可再分
D .分子可以构成物质而原子不可以直接构成物质
(2) 将宏观、微观和化学符号联系在一起是化学学科的特点。某化学反应微 观示意图如图所示,下列叙述错误的是
A .反应前后原子的种类和数目都没有发生改变
B .该反应属于分解反应
C .化学反应前后,催化剂的质量和性质一定不变
D .参加反应的和的分子个数比为 1 :1
2 、时间要求
3 、评价设计
9
答案:(1) C (2) C
4 、作业分析与设计意图
(1) 知道分子、原子的概念及联系。
(2) 知道常见的模型,并能正确的理解和应用。
作业 3 (课后发展性作业)
1 、作业内容
在下面 (1) ~ (4) 事实后的空格内填写有关分子基本特征 (填序号)
A .分子很小 B .分子间有间隔 C .分子在不停运动 D .同种分子性质相同, 不同种分子性质不同
(1) 将 50mL 酒精和 50mL 水混合后,混合液体积小于 100mL。
。
______________
(2) 湿衣服经晾晒一段时间后,会变干。___________。
(3) 一滴水里的水分子个数由 10 亿人数,每人每分钟数 100 个, 日夜不停, 需用三万年才能数完__________。
(4) 小明同学对探究分子性质的实验 (图 1) 进行了改进。如图 2 所示,试 管丁、戌中各有一张每隔 2 厘米滴有一滴酚酞溶液的滤纸条,装有适量浓氨 水的小药瓶固定在橡皮塞上,试管丁中小药瓶上的瓶塞已塞紧,试管戊中的 小药瓶上无瓶塞,关于图 1 、图 2 中的实验有以下说法,其中错误的是
。
_______
10
A .图 2 比图 1 的实验更环保、更节约
B .图 1 和图 2 的实验均能证明分子在不断的运动
C .若将戊浸入冰水中,滤纸条不会变红
D .如果丁中没有小药瓶,图 2 的实验也可达到实验目的
2 、时间要求 (4 分钟)
3 、评价设计
答案:(1) B (2) C (3) A (4) C
4 、作业分析与设计意图
(3) 知道分子是保持化学性质的最小粒子,原子是化学变化中的最小粒子。
(4) 学习模型等科学方法,培养抽象、想像、分析和推理等思维能力。
第三课时
作业 1 (课前预习作业)
1、作业内容
(1) 原子的概念:原子是
(2) 在化学变化时,原子 。
(3) 离子的概念: 。
(4) 原子结构示意图和离子结构示意图。
(5)相对原子质量的概念。
2、时间要求 (3 分钟)
3、评价设计
答案:(1) 化学变化中的最小粒子 (2) 不变 (3) 带电的原子 (4) 略
(5) 略
4、作业分析与设计意图
11
第一题考查原子的概念。
第二题考查分子和原子的区别。
第三题考察离子的概念。
第四题原子和离子结构示意图的区别,
作业 2 (课后基础性作业)
1、作业内容
科学家在宇宙中发现了氢元素的两种新粒子,它们的组成可以用H 和H3 表示, 请回答:
(1) 1 个H 中含有 个质子, 个电子。
写出H3 分子的原子结构示意图。
(2) 某原子中共有 40 个粒子,其中 14 个粒子不带电,则它的相对原子质量是 ()
A.13 B.14 C.40 D.27
(3) 原子中决定相对原子质量大小的是 ( )
12
A 质子数和中子数
C 中子数和电子数
B 质子数和电子数
D 核电荷数和电子数
2、时间要求 (4 分钟)
3、评价设计
答案:(1) 3;2 (2) A (3)A
4、作业分析与设计意图
(1) 第一题考查原子与生活相结合,深入自然界的未知世界。
(2)第二题和第三题考查相对分子质量的概念。
作业 3 (课后发展性作业)
制作原子结构模型,在班里剖析原子结构模型,加深对原子结构概念的理
第四课时
课时目标:初步形成认识物质及其变化的宏观元素视角;知道物质是由元素组成 的;知道元素和原子之间的关系;知道化学反应前后元素不变;初步认识元素周 期表;
作业 1 (课前预习作业)
1、作业内容
(1) 元素的概念:
质子数/核电荷数 中子数 原子种类 元素种类
6 6 12C 碳元素
6 7 13C
6 8 14C
8 8 16O 氧元素
8 9 17O
8 10 18O
所以:元素是 (即 ) 相同的一类原子的总称。
(2) 元素与原子的区别与联系:
名 称 元 素 原 子
区 别 表示一类原子的总称(质子数相同) 只表示种类,不论个数,是宏观概念 原子是微观概念,既表示种类,又 表示数量含义
化学变化中,元素的种类不变,但形 态可能发生变化 化学变化中,原子的种类和数目不 变,但最外层电子数可能发生变化
13
联 系 元素是同一类原子的总称。
(3) 元素的性质:
①在化学变化时,原子的种类不变, 也不会改变。
②元素的化学性质与其原子的核外电子排布,特别是 有关。
(4) 元素的含量:
①地壳中含量排在前 5 位的元素:
②生物细胞中含量排前 4 位的元素:
2、时间要求 (5 分钟)
3、评价设计
答案:(1) 质子数;核电荷数 (3) ①元素 ②最外层电子数
(4) ①O Si Al Fe Ca ②O C H N
知识背景 新知识点 知识点联系 知识点分析 知识拓展迁移
(1) 原子的结构 知道元素 的概念 知道元素、分 子、原子之间 的联系 从组成元素角 度分析 对物质的元素组 成、微粒观熟练 运用
(2) 知道元素 分布 了解部分元素 信息 判断元素性质 熟练运用判断元 素之间的联系
(3) 了解元素 知识 知道元素的化 学性质 能分析判断常 见元素和原子 之间的联系 能从原子结构推 断元素的性质
4、 作业分析与设计意图
第一题考查元素的概念,也是一个难以理解的点。学生在学习相对原子质量 的概念时,已经初步接触过质子数为 6,中子数也为 6 的 12C 原子,所以通过展示 一系列的质子数相同的不同原子,得出元素的概念,将抽象的问题具体化。
14
第二题考查元素的性质,通过预习学生可初步了解,在化学反应中元素是不变 的。将来在新课中,通过实例加深学生对此的理解。
第四题属于识记性的知识,考查元素的存在。
作业 2 (课后基础性作业)
1、作业内容
(1) 化学就在我们身边,生活中接触的“含氟牙膏”、“加碘食盐”、“高钙牛奶”, 其中的“氟、碘、钙”是指 ()
A、原子 B、分子 C、元素 D、离子
(2) 氧元素和钠元素最本质的区别是 ()
A、相对原子质量不同 B、中子数不同
C、中子数和核外电子数之和不同 D、质子数不同
(3) 地壳中含量最多的金属元素 ()
A、O B、Si C、Al D、Fe
2、时间要求(3 分钟)
3、评价设计
知识背景 新知识点 知识点联系 知识点分析 知识拓展迁移
原子的结构 知道元素的本 质区别 知道元素、分 子、原子之间 的区别 从元素角度 分析 对元素的知识熟 练运用
答案:(1) C (2) D (3) C
解析:(1) 错选 A 元素与原子的区别理解不清 (2) 错选 B 元素的概念理解不清
(3) 错选 A 审题或识记知识不准确
4、作业分析与设计意图
15
(1) 知道自然界的物质都是由元素组成的,了解常见物质的元素组成,做到学以 致用。
(2) 知道不同元素之间的本质区别。
(3) 了解地壳中含量最高的几种元素及其存在。同时培养学生仔细审题的习惯, 看清问的是金属元素,还是非金属元素,还是元素。
作业 3 (课后发展性作业)
1、作业内容
(1) 宏观:物质是由元素组成。
例如: 水是由 和 组成。
微观: ①物质是由微观粒子构成。
例如: 水是由 构成。
铁是由 构成。
氯化钠是由 和 构成。
②分子是由原子构成。
例如:水分子是由 和 构成。
③ 一个某分子是由几个某原子构成。
例如:一个水分子是由 和 构成。
(2) . 图 1 是过氧化氢分子分解的示意图,请从所给信息写出你能获得的化学 知识。
16
图 1
(1) 微观上:过氧化氢是由 构成的,1 个过氧化氢分子是 由
构成的。在化学反应前后分子种类 (填“改变”或“不变” ,下 同) ,原子种类 。
(2) 宏观上:过氧化氢是由 组成的,在化学反应前后物质种类 (填“改变”或“不变” ,下同) ,元素种类 。
2、时间要求(8 分钟)
3、评价设计
知识背景 新知识点 知识点联系 知识点分析 知识拓展迁移
(1) 元素的概 念 知道元素的概 念 知道元素的概 念以及与分 子、原子之间 的联系 从元素角度 分析物质组 成 对物质的元素组 成、微粒观熟练 运用
(2) 知道元素分布 了解部分元素 信息 判断元素性 质能分析判 断常见元素 和原子之间 的联系 能从原子结构、 元素组成分析物 质
答案:(1) 氢元素 氧元素
①水分子 铁原子 钠离子 氯离子 ②氢原子 氧原子 ③ 2 个氢原子 1 个氧原子
(2) ①过氧化氢分子 2 个氢原子和 2 个氧原子 改变 不变
②氢元素和氧元素 改变 不变
4、作业分析与设计意图
第一题,主要是以模型的方式,建立认识物质成分宏、微视角之间的关联, 帮助学生学会描述物质。
17
(
非
金属元
)
第二题,是在第一题的基础上,借助图像模型,帮助学生更加形象的描述物 质,同时形成“在化学变化中元素不变”的观念。
第五课时
作业 1 (课前预习作业)
1、作业内容
(1) 元素符号的书写:
氢 氦 锂 铍 硼 碳 氮 氧 氟 氖
钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
(2) 元素符号的意义:
①宏观上,表示一种 ,微观上,表示一个 。如:H:表示氢元素、1
个氢原子。
②元素符号前加系数时,表示的是原子个数,只有 意义。如:2H:表示 2 个 氢原子。
(3) 元素的分类:
(
金属元素
)
(
固态非金属元
)
元 素
(
气
态非金属元
)
(
液态非金属元
)
18
(4) 元素周期表:
结构:
①横行 (也叫周期):共有 个横行。
②纵列 (也叫族):共有 个族。(8、9、10 三个纵列共同组成一个族) 单元格提供的信息:
原子序数= 质子数=
元素符号= 元素名称=
相对原子质量=
2、时间要求 (8 分钟)
3、评价设计
答案:(1) H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
(2) ①元素 原子 ②微观
(4) ① 7 ② 16 6 6 C 碳 12.01
4、作业分析与设计意图
(1) 记住并能正确书写一些常见元素的名称和符号,并能进行简单的分类。 通过预习初步了解元素符号的宏观和微观两个方面的意义。
(2) 初步认识元素周期表。
作业 2 (课后基础性作业)
1、作业内容
(1) 用化学符号表示。
19
2 个氯原子: 4 个钠离子: 铁元素:
(2) 某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中。该元素的 原子结构示意图为 ,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该原子核外有 个电子层。
(3) 稀土有“工业的维生素”的美誉。钇是一种重要的稀土元素,下列说法中错 误的是 ( )
A.钇属于金属元素
B.钇的原子序数是 39
C.钇的相对原子质量是 88.91 g
D.钇原子的核外电子数为 39
2、时间要求 (5 分钟)
3、评价设计
答案:(1) 2Cl 4Na+ Fe (2) 20 金属 4 (3) C
4、作业分析与设计意图
(1) 正确书写化学符号。
(2) 能根据原子结构示意图,判断元素的一些基本信息。
(3) 根据元素周期表中的单元格,获取基本信息的能力。
作业 3 (课后发展性作业)
20
1、作业内容
(1) 对于下列化学用语,有关说法不正确的是 ( )
21
① H
② 2Fe2+
③
(
④
)
A.①表示氢元素或一个氢原子
B.②表示两个亚铁离子
C.③表示氧原子的结构示意图
D.④中铁的相对原子质量是 55.85g
(2) 2021 年 4 月 13 日, 日本打算将含有氚等放射性物质的核废水排入太平洋的 决定遭到全世界的反对。氚又叫超重氢,会发生β衰变,其原子核内有 1 个质子,
2 个中子,下列有关氚的说法不正确的是 ( )
A.氚的相对原子质量为 3
B.氚的结构示意图为
C.氚原子和氢原子属于同一种元素
D.氚位于元素周期表的第二周期
(3) 硅和锗都是良好的半导体材料。已知锗原子序数为 32,相对原子质量为 72.59。以下说法错误的是 ( )
A.硅为非金属
B.硅的相对原子质量为 28.09
C.①为 72.59
D.锗原子是由原子核和核外电子构成的
2、时间要求 (2 分钟)
3、评价设计
答案: (1) D (2) D (3) C
4、作业分析与设计意图
(1) 引导学生建立宏观物质、微观粒子和符号三者间的关系,这是学习化学所必 需的。能通过符号,获取基本的信息。
(2) 根据元素周期表中的单元格,获取基本信息的能力。
六、单元质量检测作业
( 一) 单元质量检测作业内容
作业 1:
1.下列是一些微观粒子结构示意图,有关叙述正确的是 ( )
A. ②⑤为同一周期元素的原子
B. ①②的元素在周期表的同一族
C. ①③④⑤是具有相对稳定结构的原子
D. ②③属于同种元素的同种粒子
22
2.原子序数为 94 的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数
之和为 239,下列关于该原子的说法不正确的是( )
A. 中子数为 145 B. 核外电子数为 94
C. 质子数为 94 D. 核电荷数为 239
3.镉属于重金属,会危害人体健康。2013 年 5 月 16 日,广州市食品药品监管 公布的结果显示,抽检大米四成镉超标。这里的镉可理解为 ( )
A. 镉元素 B. 镉单质 C. 镉离子 D. 镉原子
4.2013 年 1 月 19 日,首个《国际防治汞污染公约》发布。图为元素汞的信息, 从图中获得的信息正确的一项是 ( )
A. 汞属于非金属元素 B. 汞的核电荷数为 80
C. 汞的相对原子质量为 200.6g D. 在化学反应中,汞原子容易得到
电子
5.如图是元素周期表中某元素信息示意图,由图所获取的信息正确的是 ( )
A. 该元素为金属元素 B. 该元素的相对原子质量为 35.453g
C. 该元素位于元素周期表的第三周期 D. 该元素在化学反应中容易
失去电子
6.下图是三种微粒的结构示意图,有关它们的说法正确的是 ( )
23
A. 三种微粒的核外电子排布相同 B. 三种微粒对应原子的最外层电 子数相同
C. 三种微粒属于同种元素的微粒 D. 三种微粒都是原子 7.铱的某种原子在工业中应用广泛,铱元素的信息如图所示,下列说法错误
的是 ( )
A. 元素符号为 Ir B. 属于非金属元素
C. 原子核外的电子数为 77 D. 相对原子质量为 192.2
8.原子结构示意图可以方便简明地表示原子核外电子的排布,元素周期表是
我们学习化学的重要工具。请根据图片信息判断下列说法不正确的是 ( )
A. 钙元素的原子序数是 20 B. 钙元素的离子核外最外层有 2 个电子
C. 钙元素的原子核所带电荷数为 20 D.钙元素的相对原子质量约为 40.08 9.已知一种氧原子,原子核内含有 8 个质子和 10 个中子,则该氧原子核外电子数 为( )
A. 2 B. 8 C. 10 D. 18
24
2、时间要求 (6 分钟)
3、评价设计
1.【答案】A
【解析】在元素周期表中,周期数等于电子层数,②⑤原子都有 3 个电子层,所 以②⑤的元素在周期表的同一周期,A 说法正确;在元素周期表中,族数等于最外 层电子数,①虽然最外层电子数为 2,但属于稳定结构,它和其它稀有气体元素的 原子处在同一族,与镁原子不属于同一族,B 说法错误;①只有一个电子层,且最 外层电子数为 2,③④⑤的最外层电子数都为 8,都是稳定结构,但④质子数不等 于电子数,表示的是离子,而不是原子,C 说法错误;②③的质子数都为 12,属 于同种元素,但一个是原子,一个是离子,D 说法错误。故答案选 A。 2.【答案】D
【解析】在原子,中原子序数=质子数=核外电子数=核电荷数;质子数+中子数=相 对原子质量,故选 D
3.【答案】A
【解析】这里的镉是指镉元素,故选 A
4.【答案】B
【解析】根据元素周期表中的一格中获取的信息,该元素的名称是汞,是唯一一 种常温下是液态的金属元素,故 A 说法错误;根据元素周期表中的一格中获取的 信息,汞的原子序数为 80,根据原子序数=核电荷数可知,汞的核电荷数为 80, 故 B 说法正确;根据元素周期表中的一格中获取的信息,汞的相对原子质量为 200.6,不是 200.6g,因为相对原子质量是个比值,单位是 1,故 C 说法错误;从 汞原子的结构示意图可知,最外层有 2 个电子,在化学反应中易失去电子,故 D 说法错误。故选 B。
5.【答案】C
【解析】A 氯为非金属元素,故错误; B 该元素的相对原子质量为 35.453,故错 误; C 该元素核外有三个电子层,位于元素周期表的第三周期,正确; D 该元素 在化学反应中容易得电子,错误。故选 C。
6.【答案】A
25
【解析】A.由图示的情况可以看出三者的核外电子排布相同,核外都有 10 个电 子,故 A 说法正确; B.在原子中质子数等于核外的电子数,可知第一种元素的 原子核外应该有 8 个电子,其最外层电子数是 6,第二种微粒属于原子,其最外层 电子数是 8,第三个微粒的原子核外应该有 13 个电子,其最外层电子数是 3,故 B 说法错误; C.由微粒的结构示意图可知它们的质子数不同,元素的种类由质子 数决定,所以它们不属于同种元素的微粒,故 C 说法错误; D.由微粒的结构示 意图及核电荷数、质子数与核外电子数的关系,可知第一个图示为阴离子;第二 个图示为原子;第三个图示为阳离子,故 D 说法错误。故答案应选 A。 7.【答案】B
【解析】根据元素周期表所提供的信息可知 A 选项元素符号为 Ir 是正确的叙述; B 选项属于非金属元素是错误的叙述;从名称书写上可知属于金属元素;C 选项原 子核外的电子数为 77 是正确的叙述;D 选项相对原子质量为 192.2 是正确的叙述; 故选 B。
8.【答案】B
【解析】 由原子结构示意图和元素周期表提供的信息可知,A 选项钙元素的原子序 数是 20 是正确的叙述;B 选项钙元素的离子核外最外层有 2 个电子是错误的叙述, 应为钙元素的原子核外最外层有 2 个电子;C 选项钙元素的原子核所带电荷数为 20 是正确的叙述;D 选项钙元素的相对原子质量约为 40.08 是正确的叙述;故选 B。 9.【答案】B
【解析】原子是不显电性的。在原子中,质子数等于核外电子数。所以答案选 B。
4、作业分析与设计意图
(1) 引导学生建立宏观物质、微观粒子和符号三者间的关系,这是学习化学所必 需的。能通过符号,获取基本的信息。
(2) 根据元素周期表中的单元格,获取基本信息的能力。
作业 2:
1.下图是元素周期表的一部分,请根据元素周期表回答下列问题。
26
(1) 从原子结构示意图和周期表可知:周期数________ (选填“>”、“<”或“=”) 原子核外电子层数。
(2) 最外层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素 的化学性质与_______相似。
2.某原子的原子结构示意图如图所示:
(1) 图中x=________,该原子属于________ (填“金属”或“非金属”)原子。
(2) 如下图所示的粒子中,具有相对稳定结构的是________ (填序号)。
2、时间要求 (3 分钟)
3、评价设计
1.【答案】(1) = (2) 氯
27
【解析】从原子结构示意图和周期表可知:周期数等于原子核外电子层数,最外 层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素与氯元素 的最外电子数相等,因此它们的化学性质相似。
2.【答案】(1) 7 非金属 (2) C
【解析】(1) 原子中质子数等于核外电子数,根据原子核外电子数为 35,推出x =7,该原子最外层电子数多于 4,属于非金属原子。(2) 最外层电子数是 8 个电 子的粒子(若第一层为最外层时,电子数是 2 的粒子)具有相对稳定结构,故选 C。
4、作业分析与设计意图
(1) 引导学生建立宏观物质、微观粒子二者之间的关系,这是学习化学所必需的。
(2) 根据元素周期表中的单元格,获取基本信息的能力,属于识记性的知识,考
查元素的存在。
作业 3:
1.实验探究:某化学兴趣小组同学为了研究影响分子运动速率的因素,如下图所 示,玻璃管左、右两端分别放有脱脂棉,注射器中分别装有浓盐酸和浓氨水。浓 氨水挥发出来的氨气 (NH3 ) 和浓盐酸挥发出来的氯化氢气体 (HCl) 能发生反应生 成白色的氯化铵固体。两个注射器同时向脱脂棉靠近里边的部位注入等体积的液
体,过一会,先在 A 处产生大量白烟,然后白烟逐渐充满整个试管。
根据现象回答问题:
(1) A 处形成白烟是因为分子在___________________________ ;
(2) 有同学认为先在 A 处产生白烟是因为氯化氢分子比氨气分子运动速度 __________,已知一个氯化氢分子的质量要大于一个氨气分子的质量,所以可以 说分子的运动速度与其质量成__________比。(填正或反)
2.实验探究
28
(1) 实验方法:如图所示:在 A 烧杯中盛有浓氨水,在盛有 20mL 水的 B 烧杯中 加入 5~6 滴酚酞溶液,从 B 烧杯中取少量溶液置于试管中,向其中滴加浓氨水, 用一个大烧杯罩住 AB 两个小烧杯。
(2) 实验现象:①过一会儿,观察到的现象:试管中的现象
,
_________________________
②AB 烧杯中的现象__________________________________。
(3) 你的猜想:_________________________________________________。
(4) 讨论交流:与小组同学交流你的看法:往装有酚酞溶液的试管中加浓氨水这
样操作的目的_________________________________________________。
2、时间要求 (6 分钟)
3、评价设计
1.【答案】(1) 不停地运动 (2) 慢 反
【解析】 由于浓盐酸中的氯化氢分子和浓氨水中的氨气分子都在不停地运动,所 以会在 A 处形成白烟。形成的白烟在 A 处,离浓盐酸较近,离浓氨水较远,这是 因为氯化氢分子运动速度比氨气分子运动速度慢。已知一个氯化氢分子的质量要 大于一个氨气分子的质量,所以可以说分子的运动速度与其质量成反比。 2.【答案】(2) ①液体变为红色 ;②A无明显变化, B烧杯中酚酞变红;
(3) 分子在不断地运动;(4) 说明浓氨水能使酚酞变红
【解析】浓氨水显碱性能够使无色酚酞变红色,A 烧杯中浓氨水中的氨气分子是不 断运动着的,氨气分子运动到 B 烧杯中,能够使 B 烧杯中的无色酚酞变红,所以 可以观察到 B 烧杯中酚酞变红,这一现象从而也证明了分子是不断运动的。往装 有酚酞溶液的试管中加浓氨水这样操作的目的正是说明浓氨水能使酚酞变红
4. 作业分析与设计意图
29
由宏观世界转向微观世界的开端,起到了承前启后的作用,内容较抽象,远离 学生的生活经验,感性知识不充分,这就给教学带来了一定的困难,通过对分子和 原子的认识,用分子和原子的观点解释生活中的一些现象,巩固学生的化学基础 知识和基本技能,化学基础知识和基本技能还是初中学生进行探究活动的基础和 结果,也是对学生进行情感、态度与价值观教育的重要载体。
(二) 单元质量检测作业属性表
序号 类型 对应单元 作业目标 对应学 难度 来源 完成时间
了解 理解 应用
1 选择题 1、2 √ 易 改编 15 分钟
2 填空题 2、3 √ √ 中等 改编
3 实验与探究 2、3、4 √ √ 较难 改编
一、单元信息
基本信息 学科 年级 学期 教材版本 单元名称
化学 九年级 第一学期 人教版 第三单元 物质构成的奥秘
单元组织方式 O自然单元 重组单元
课时信息 序 号 课时名称 对应教材内容
1 第一课时 课题 1 分子和原子 (1)
2 第二课时 课题 1 分子和原子 (2)
3 第三课时 课题 2 原子的结构
4 第四课时 课题 3 元 素 (1)
5 第五课时 课题 3 元 素 (2)
二、单元分析
(一) 课标要求
2011 版课标要求
知道物质是由分子、原子等微小粒子构成的,知道分子是由原子构成的,并从微 观角度解释一些现象;知道物理变化和化学变化的微观本质区别。
了解原子是由质子、中子和电子构成的;了解原子的核外电子是分层排布的;了 解原子结构示意图的含义,并能读懂一些常见原子的原子结构示意图;
了解离子的概念,认识离子是构成物质的一种粒子,初步了解氯化钠等化合物的 形成过程;初步了解相对原子质量的概念,并会查相对原子质量表。
掌握元素的概念;记住一些常见元素的名称和符号;了解元素符号所表示的意义, 学会元素符号的正确写法,初步认识元素周期表。
注意原子质量和相对原子质量的区别。
知道元素的简单分类,能根据原子序数在元素周期表中找到指定的元素。
2
知道同一元素的原子和离子可以相互转化,初步认识核外电子在化学反应中的作 用。
2022 版新课标要求
3.1 物质的组成
初步形成基于元素和分子、原子认识物质及其变化的视角,建立认识物质的宏观 和微观视角之间的关联,知道物质的性质与组成、结构有关。
3.2 元素、分子、原子与物质
3.2.1 元素
认识物质是由元素组成的,知道质子数相同的一类原子属于同种元素,了解在化 学反应中元素的种类是不变的,初步认识元素周期表。
3.2.2 分子、原子
知道物质是由分子、原子等微观粒子构成的;认识原子是由原子核和核外电子构成 的;知道原子可以结合成分子,也可以转变为离子。
3.2.3 物质组成的表示
知道可以用符号表示物质的组成,认识表示分子、原子、离子的符号,知道常见 元素的化合价,学习用化学式表示常见物质组成的方法,认识相对原子质量、相 对分子质量的含义及应用。
(二) 教材分析
本单元的内容有:分子和原子、原子的结构、元素三个课题。它们包括分子和原 子的概念、原子结构模型、核外电子排布观念、离子及离子的形成、相对原子质 量、元素、元素符号、元素符号表示的意义等内容。本单元教材是由宏观世界转 向微观世界的开端,在本书中起到了承前启后的作用;本单元的特点是内容较抽 象,远离学生的生活经验,感性知识不充分,这就给教学带来了一定的困难。课 程标准指出,初中化学基础知识和基本技能是构成学生科学素养的基本要素,是 为学生的终生学习和将来适应现代社会生活打好基础所必需的。化学基础知识和 基本技能还是初中学生进行探究活动的基础和结果,也是对学生进行情感、态度 与价值观教育的重要载体。所以,本单元教材对于学生十分重要,它既是今后学 习的理论基础,又是必不可少的工具。
3
本单元教学的重点:对分子和原子的认识、原子的构成、离子的形成、元素、
元素符号;
本单元教学的难点:用分子和原子的观点解释生活中的一些现象及解释物质
的变化、核外电子排布、元素符号表示的意义。
(三) 学情分析
本单元是物质结构理论的重要开端,是学生从宏观世界进入到微观领域的开
端,微观粒子看不到、摸不着,具有抽象性,不易于理解。九年级学生已具备了 一定的逻辑推理能力,能通过分析一种物质可无限被分割而推理得出物质都是由 不连续的粒子构成的;根据生活中的宏观现象 (如物质的热胀冷缩、扩散现象) 推理得出构成物质的分子 (或原子) 的性质[分子 (或原子) 间有间隔、分子 (或 原子) 是在永不停息运动着的,并能用微粒的观点解释一些生活中常见的现象; 分析“卢瑟福的 a 粒子轰击金箔实验”得出原子的核式结构模型,进一步了解原 子的微观结构、原子的核外电子排布特点及原子结构简图所表示的意义,顺理成 章地得出离子的形成过程,借助离子的形成过程,理清分子、原子、离子、元素 与物质间的关系。
三、单元学习作业目标
1、认识物质是由分子、原子等微粒构成:认识分子、原子的概念和特性。能从不 同层次认识物质的多样性并进行分类,能从原子、分子等水平认识物质的组成、 结构、性质和变化,形成“结构决定性质”的观念,能从宏微结合的视角分析与 解决实际问题
2、学习运用日常生活现象与课本理论相结合的方式,用课本理论来解释日常现象。 充分发挥学生的空间想象能力。
3、学习运用比较、分析、归纳等方法对实验所得信息进行加工让学生具有证据意 识,能够提出可能的假设,通过分析推理加以证实或证伪;建立它们之间的逻辑关 系;并能加以运用,解释各种化学现象,揭示现象的本质和规律
4、对学生进行科学态度教育和辩证地看问题的思想方法教育。
4
四、单元作业设计思路
5
五、课时作业
第一课时
课时目标:初步形成认识物质及其变化的微观视角;知道物质是由分子、原 子、离子等微观粒子构成的;认识微粒的基本特征;知道分子、原子、离子之间 的关系;认识相对原子质量及其应用。
作业 1 (课前预习作业)
1 、作业内容
(1) 物质是由微小的粒子—— 、 等构成的。
(2) 分子的 和 都很小,我们看不见,摸不着;
分子是不断 ,而且温度越高,运动越 ;分子之间有 ; 同种分子的化学性质 ,不同种分子化学性质 。
2 、时间要求 (2 分钟)
3 、评价设计
答案:(1) 分子;原子 (2) 体积;质量;运动;快;间隔;相同;不同
4 、作业分析与设计意图
(1) 第一题考查物质的微观构成,知道物质由微观粒子分子、原子等构成 的。
(2) 第二题考查分子的特征,能从微观粒子的角度来解释日常生活中常见 的现象。
作业 2 (课后基础性作业)
1 、作业内容
(1) 下列物质中含有氧分子的是 ( )
A.蒸馏水 B.空气 C.高锰酸钾固体 D. 双氧水
6
(2) 八月桂花香,沁人心脾。花香四溢的现象说明 ( )
A.分子的质量很小 B.分子是由原子构成的
C.分子在不停地运动 D.分子之间有一定的间隔
(3) 淀粉溶液遇碘变蓝色。实验表明,无论是固体碘还是碘蒸气,均能使淀粉 溶液变蓝色。这一现象说明( )
A. 同种分子质量相等 B. 同种分子化学性质相同
C. 同种分子体积相等 D. 同种分子运动速度相同
2 、时间要求 (3 分钟 )
3 、评价设计
答案:(1) B (2)C (3)B
4 、作业分析与设计意图
(1) 知道物质是由微观粒子构成的。
(2) 知道分子、原子的特征,并能解释生活中的现象,学以致用。 作业 3 (课后发展性作业)
1 、作业内容
(1) 从分子的角度解释下列现象,其中错误的是( )
A .十里桂花飘香——分子在不停地运动
B .氧气和二氧化碳的化学性质不同——分子构成不同
C .水蒸发为水蒸气,所占体积变大——分子体积变大
D .1 滴水中约含有 1.67×1021 个水分子——分子的质量和体积都很小
(2) 下列关于水受热沸腾、水蒸气遇冷凝结实验的分析中,正确的是 ( )
A.酒精灯加热的作用是让分子从静止开始运动
7
B.实验过程中,分子的种类发生了改变
C.水变成水蒸气时,分子体积增加
D.水变成水蒸气时,分子间间隔增大
2 、时间要求 (1 分钟)
3 、评价设计
答案:(1) C (2) D
4 、作业分析与设计意图
(1) 以分子为例,学生能运用微观粒子的观点来解释生产、生活中的一些常 见现象。
(2) 学习类比的科学方法,培养学生分析、推理问题的能力。
第二课时
作业 1 (课前预习作业)
1 、作业内容
(1) 分子是 ;原子是 ;
化学反应的实质是: 由分子构成的物质在发生化学反应时, 破裂为 , 重新组成为新的 。
(2) 用微观观点 (分子或原子) 解释下列概念
物理变化: 由分子构成的物质在发生物理变化时, 没有变化;
化学变化: 由分子构成的物质在发生化学变化时, 发生了变化,变成的 新的物质 。
2 、时间要求 (3 分钟)
3 、评价设计
答案:(1) 保持物质化学性质的最小粒子;化学变化中的最小粒子;分子;
8
原子;(2) 分子;分子;分子;
4 、作业分析与设计意图
(3) 第一题考查分子、原子的概念及化学反应的实质。
(4) 第二题考查化学反应的微观实质并能做出解释。
作业 2 (课后基础性作业)
1 、作业内容
(1) 原子论和分子学说的创立,奠定了近代化学的基础。分子与原子的本质 区别是( )
A .分子运动速率快,原子运动速率慢
B .分子大,原子小
C .在化学变化中,分子可以再分而原子不可再分
D .分子可以构成物质而原子不可以直接构成物质
(2) 将宏观、微观和化学符号联系在一起是化学学科的特点。某化学反应微 观示意图如图所示,下列叙述错误的是
A .反应前后原子的种类和数目都没有发生改变
B .该反应属于分解反应
C .化学反应前后,催化剂的质量和性质一定不变
D .参加反应的和的分子个数比为 1 :1
2 、时间要求
3 、评价设计
9
答案:(1) C (2) C
4 、作业分析与设计意图
(1) 知道分子、原子的概念及联系。
(2) 知道常见的模型,并能正确的理解和应用。
作业 3 (课后发展性作业)
1 、作业内容
在下面 (1) ~ (4) 事实后的空格内填写有关分子基本特征 (填序号)
A .分子很小 B .分子间有间隔 C .分子在不停运动 D .同种分子性质相同, 不同种分子性质不同
(1) 将 50mL 酒精和 50mL 水混合后,混合液体积小于 100mL。
。
______________
(2) 湿衣服经晾晒一段时间后,会变干。___________。
(3) 一滴水里的水分子个数由 10 亿人数,每人每分钟数 100 个, 日夜不停, 需用三万年才能数完__________。
(4) 小明同学对探究分子性质的实验 (图 1) 进行了改进。如图 2 所示,试 管丁、戌中各有一张每隔 2 厘米滴有一滴酚酞溶液的滤纸条,装有适量浓氨 水的小药瓶固定在橡皮塞上,试管丁中小药瓶上的瓶塞已塞紧,试管戊中的 小药瓶上无瓶塞,关于图 1 、图 2 中的实验有以下说法,其中错误的是
。
_______
10
A .图 2 比图 1 的实验更环保、更节约
B .图 1 和图 2 的实验均能证明分子在不断的运动
C .若将戊浸入冰水中,滤纸条不会变红
D .如果丁中没有小药瓶,图 2 的实验也可达到实验目的
2 、时间要求 (4 分钟)
3 、评价设计
答案:(1) B (2) C (3) A (4) C
4 、作业分析与设计意图
(3) 知道分子是保持化学性质的最小粒子,原子是化学变化中的最小粒子。
(4) 学习模型等科学方法,培养抽象、想像、分析和推理等思维能力。
第三课时
作业 1 (课前预习作业)
1、作业内容
(1) 原子的概念:原子是
(2) 在化学变化时,原子 。
(3) 离子的概念: 。
(4) 原子结构示意图和离子结构示意图。
(5)相对原子质量的概念。
2、时间要求 (3 分钟)
3、评价设计
答案:(1) 化学变化中的最小粒子 (2) 不变 (3) 带电的原子 (4) 略
(5) 略
4、作业分析与设计意图
11
第一题考查原子的概念。
第二题考查分子和原子的区别。
第三题考察离子的概念。
第四题原子和离子结构示意图的区别,
作业 2 (课后基础性作业)
1、作业内容
科学家在宇宙中发现了氢元素的两种新粒子,它们的组成可以用H 和H3 表示, 请回答:
(1) 1 个H 中含有 个质子, 个电子。
写出H3 分子的原子结构示意图。
(2) 某原子中共有 40 个粒子,其中 14 个粒子不带电,则它的相对原子质量是 ()
A.13 B.14 C.40 D.27
(3) 原子中决定相对原子质量大小的是 ( )
12
A 质子数和中子数
C 中子数和电子数
B 质子数和电子数
D 核电荷数和电子数
2、时间要求 (4 分钟)
3、评价设计
答案:(1) 3;2 (2) A (3)A
4、作业分析与设计意图
(1) 第一题考查原子与生活相结合,深入自然界的未知世界。
(2)第二题和第三题考查相对分子质量的概念。
作业 3 (课后发展性作业)
制作原子结构模型,在班里剖析原子结构模型,加深对原子结构概念的理
第四课时
课时目标:初步形成认识物质及其变化的宏观元素视角;知道物质是由元素组成 的;知道元素和原子之间的关系;知道化学反应前后元素不变;初步认识元素周 期表;
作业 1 (课前预习作业)
1、作业内容
(1) 元素的概念:
质子数/核电荷数 中子数 原子种类 元素种类
6 6 12C 碳元素
6 7 13C
6 8 14C
8 8 16O 氧元素
8 9 17O
8 10 18O
所以:元素是 (即 ) 相同的一类原子的总称。
(2) 元素与原子的区别与联系:
名 称 元 素 原 子
区 别 表示一类原子的总称(质子数相同) 只表示种类,不论个数,是宏观概念 原子是微观概念,既表示种类,又 表示数量含义
化学变化中,元素的种类不变,但形 态可能发生变化 化学变化中,原子的种类和数目不 变,但最外层电子数可能发生变化
13
联 系 元素是同一类原子的总称。
(3) 元素的性质:
①在化学变化时,原子的种类不变, 也不会改变。
②元素的化学性质与其原子的核外电子排布,特别是 有关。
(4) 元素的含量:
①地壳中含量排在前 5 位的元素:
②生物细胞中含量排前 4 位的元素:
2、时间要求 (5 分钟)
3、评价设计
答案:(1) 质子数;核电荷数 (3) ①元素 ②最外层电子数
(4) ①O Si Al Fe Ca ②O C H N
知识背景 新知识点 知识点联系 知识点分析 知识拓展迁移
(1) 原子的结构 知道元素 的概念 知道元素、分 子、原子之间 的联系 从组成元素角 度分析 对物质的元素组 成、微粒观熟练 运用
(2) 知道元素 分布 了解部分元素 信息 判断元素性质 熟练运用判断元 素之间的联系
(3) 了解元素 知识 知道元素的化 学性质 能分析判断常 见元素和原子 之间的联系 能从原子结构推 断元素的性质
4、 作业分析与设计意图
第一题考查元素的概念,也是一个难以理解的点。学生在学习相对原子质量 的概念时,已经初步接触过质子数为 6,中子数也为 6 的 12C 原子,所以通过展示 一系列的质子数相同的不同原子,得出元素的概念,将抽象的问题具体化。
14
第二题考查元素的性质,通过预习学生可初步了解,在化学反应中元素是不变 的。将来在新课中,通过实例加深学生对此的理解。
第四题属于识记性的知识,考查元素的存在。
作业 2 (课后基础性作业)
1、作业内容
(1) 化学就在我们身边,生活中接触的“含氟牙膏”、“加碘食盐”、“高钙牛奶”, 其中的“氟、碘、钙”是指 ()
A、原子 B、分子 C、元素 D、离子
(2) 氧元素和钠元素最本质的区别是 ()
A、相对原子质量不同 B、中子数不同
C、中子数和核外电子数之和不同 D、质子数不同
(3) 地壳中含量最多的金属元素 ()
A、O B、Si C、Al D、Fe
2、时间要求(3 分钟)
3、评价设计
知识背景 新知识点 知识点联系 知识点分析 知识拓展迁移
原子的结构 知道元素的本 质区别 知道元素、分 子、原子之间 的区别 从元素角度 分析 对元素的知识熟 练运用
答案:(1) C (2) D (3) C
解析:(1) 错选 A 元素与原子的区别理解不清 (2) 错选 B 元素的概念理解不清
(3) 错选 A 审题或识记知识不准确
4、作业分析与设计意图
15
(1) 知道自然界的物质都是由元素组成的,了解常见物质的元素组成,做到学以 致用。
(2) 知道不同元素之间的本质区别。
(3) 了解地壳中含量最高的几种元素及其存在。同时培养学生仔细审题的习惯, 看清问的是金属元素,还是非金属元素,还是元素。
作业 3 (课后发展性作业)
1、作业内容
(1) 宏观:物质是由元素组成。
例如: 水是由 和 组成。
微观: ①物质是由微观粒子构成。
例如: 水是由 构成。
铁是由 构成。
氯化钠是由 和 构成。
②分子是由原子构成。
例如:水分子是由 和 构成。
③ 一个某分子是由几个某原子构成。
例如:一个水分子是由 和 构成。
(2) . 图 1 是过氧化氢分子分解的示意图,请从所给信息写出你能获得的化学 知识。
16
图 1
(1) 微观上:过氧化氢是由 构成的,1 个过氧化氢分子是 由
构成的。在化学反应前后分子种类 (填“改变”或“不变” ,下 同) ,原子种类 。
(2) 宏观上:过氧化氢是由 组成的,在化学反应前后物质种类 (填“改变”或“不变” ,下同) ,元素种类 。
2、时间要求(8 分钟)
3、评价设计
知识背景 新知识点 知识点联系 知识点分析 知识拓展迁移
(1) 元素的概 念 知道元素的概 念 知道元素的概 念以及与分 子、原子之间 的联系 从元素角度 分析物质组 成 对物质的元素组 成、微粒观熟练 运用
(2) 知道元素分布 了解部分元素 信息 判断元素性 质能分析判 断常见元素 和原子之间 的联系 能从原子结构、 元素组成分析物 质
答案:(1) 氢元素 氧元素
①水分子 铁原子 钠离子 氯离子 ②氢原子 氧原子 ③ 2 个氢原子 1 个氧原子
(2) ①过氧化氢分子 2 个氢原子和 2 个氧原子 改变 不变
②氢元素和氧元素 改变 不变
4、作业分析与设计意图
第一题,主要是以模型的方式,建立认识物质成分宏、微视角之间的关联, 帮助学生学会描述物质。
17
(
非
金属元
)
第二题,是在第一题的基础上,借助图像模型,帮助学生更加形象的描述物 质,同时形成“在化学变化中元素不变”的观念。
第五课时
作业 1 (课前预习作业)
1、作业内容
(1) 元素符号的书写:
氢 氦 锂 铍 硼 碳 氮 氧 氟 氖
钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
(2) 元素符号的意义:
①宏观上,表示一种 ,微观上,表示一个 。如:H:表示氢元素、1
个氢原子。
②元素符号前加系数时,表示的是原子个数,只有 意义。如:2H:表示 2 个 氢原子。
(3) 元素的分类:
(
金属元素
)
(
固态非金属元
)
元 素
(
气
态非金属元
)
(
液态非金属元
)
18
(4) 元素周期表:
结构:
①横行 (也叫周期):共有 个横行。
②纵列 (也叫族):共有 个族。(8、9、10 三个纵列共同组成一个族) 单元格提供的信息:
原子序数= 质子数=
元素符号= 元素名称=
相对原子质量=
2、时间要求 (8 分钟)
3、评价设计
答案:(1) H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
(2) ①元素 原子 ②微观
(4) ① 7 ② 16 6 6 C 碳 12.01
4、作业分析与设计意图
(1) 记住并能正确书写一些常见元素的名称和符号,并能进行简单的分类。 通过预习初步了解元素符号的宏观和微观两个方面的意义。
(2) 初步认识元素周期表。
作业 2 (课后基础性作业)
1、作业内容
(1) 用化学符号表示。
19
2 个氯原子: 4 个钠离子: 铁元素:
(2) 某元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中。该元素的 原子结构示意图为 ,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该原子核外有 个电子层。
(3) 稀土有“工业的维生素”的美誉。钇是一种重要的稀土元素,下列说法中错 误的是 ( )
A.钇属于金属元素
B.钇的原子序数是 39
C.钇的相对原子质量是 88.91 g
D.钇原子的核外电子数为 39
2、时间要求 (5 分钟)
3、评价设计
答案:(1) 2Cl 4Na+ Fe (2) 20 金属 4 (3) C
4、作业分析与设计意图
(1) 正确书写化学符号。
(2) 能根据原子结构示意图,判断元素的一些基本信息。
(3) 根据元素周期表中的单元格,获取基本信息的能力。
作业 3 (课后发展性作业)
20
1、作业内容
(1) 对于下列化学用语,有关说法不正确的是 ( )
21
① H
② 2Fe2+
③
(
④
)
A.①表示氢元素或一个氢原子
B.②表示两个亚铁离子
C.③表示氧原子的结构示意图
D.④中铁的相对原子质量是 55.85g
(2) 2021 年 4 月 13 日, 日本打算将含有氚等放射性物质的核废水排入太平洋的 决定遭到全世界的反对。氚又叫超重氢,会发生β衰变,其原子核内有 1 个质子,
2 个中子,下列有关氚的说法不正确的是 ( )
A.氚的相对原子质量为 3
B.氚的结构示意图为
C.氚原子和氢原子属于同一种元素
D.氚位于元素周期表的第二周期
(3) 硅和锗都是良好的半导体材料。已知锗原子序数为 32,相对原子质量为 72.59。以下说法错误的是 ( )
A.硅为非金属
B.硅的相对原子质量为 28.09
C.①为 72.59
D.锗原子是由原子核和核外电子构成的
2、时间要求 (2 分钟)
3、评价设计
答案: (1) D (2) D (3) C
4、作业分析与设计意图
(1) 引导学生建立宏观物质、微观粒子和符号三者间的关系,这是学习化学所必 需的。能通过符号,获取基本的信息。
(2) 根据元素周期表中的单元格,获取基本信息的能力。
六、单元质量检测作业
( 一) 单元质量检测作业内容
作业 1:
1.下列是一些微观粒子结构示意图,有关叙述正确的是 ( )
A. ②⑤为同一周期元素的原子
B. ①②的元素在周期表的同一族
C. ①③④⑤是具有相对稳定结构的原子
D. ②③属于同种元素的同种粒子
22
2.原子序数为 94 的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数
之和为 239,下列关于该原子的说法不正确的是( )
A. 中子数为 145 B. 核外电子数为 94
C. 质子数为 94 D. 核电荷数为 239
3.镉属于重金属,会危害人体健康。2013 年 5 月 16 日,广州市食品药品监管 公布的结果显示,抽检大米四成镉超标。这里的镉可理解为 ( )
A. 镉元素 B. 镉单质 C. 镉离子 D. 镉原子
4.2013 年 1 月 19 日,首个《国际防治汞污染公约》发布。图为元素汞的信息, 从图中获得的信息正确的一项是 ( )
A. 汞属于非金属元素 B. 汞的核电荷数为 80
C. 汞的相对原子质量为 200.6g D. 在化学反应中,汞原子容易得到
电子
5.如图是元素周期表中某元素信息示意图,由图所获取的信息正确的是 ( )
A. 该元素为金属元素 B. 该元素的相对原子质量为 35.453g
C. 该元素位于元素周期表的第三周期 D. 该元素在化学反应中容易
失去电子
6.下图是三种微粒的结构示意图,有关它们的说法正确的是 ( )
23
A. 三种微粒的核外电子排布相同 B. 三种微粒对应原子的最外层电 子数相同
C. 三种微粒属于同种元素的微粒 D. 三种微粒都是原子 7.铱的某种原子在工业中应用广泛,铱元素的信息如图所示,下列说法错误
的是 ( )
A. 元素符号为 Ir B. 属于非金属元素
C. 原子核外的电子数为 77 D. 相对原子质量为 192.2
8.原子结构示意图可以方便简明地表示原子核外电子的排布,元素周期表是
我们学习化学的重要工具。请根据图片信息判断下列说法不正确的是 ( )
A. 钙元素的原子序数是 20 B. 钙元素的离子核外最外层有 2 个电子
C. 钙元素的原子核所带电荷数为 20 D.钙元素的相对原子质量约为 40.08 9.已知一种氧原子,原子核内含有 8 个质子和 10 个中子,则该氧原子核外电子数 为( )
A. 2 B. 8 C. 10 D. 18
24
2、时间要求 (6 分钟)
3、评价设计
1.【答案】A
【解析】在元素周期表中,周期数等于电子层数,②⑤原子都有 3 个电子层,所 以②⑤的元素在周期表的同一周期,A 说法正确;在元素周期表中,族数等于最外 层电子数,①虽然最外层电子数为 2,但属于稳定结构,它和其它稀有气体元素的 原子处在同一族,与镁原子不属于同一族,B 说法错误;①只有一个电子层,且最 外层电子数为 2,③④⑤的最外层电子数都为 8,都是稳定结构,但④质子数不等 于电子数,表示的是离子,而不是原子,C 说法错误;②③的质子数都为 12,属 于同种元素,但一个是原子,一个是离子,D 说法错误。故答案选 A。 2.【答案】D
【解析】在原子,中原子序数=质子数=核外电子数=核电荷数;质子数+中子数=相 对原子质量,故选 D
3.【答案】A
【解析】这里的镉是指镉元素,故选 A
4.【答案】B
【解析】根据元素周期表中的一格中获取的信息,该元素的名称是汞,是唯一一 种常温下是液态的金属元素,故 A 说法错误;根据元素周期表中的一格中获取的 信息,汞的原子序数为 80,根据原子序数=核电荷数可知,汞的核电荷数为 80, 故 B 说法正确;根据元素周期表中的一格中获取的信息,汞的相对原子质量为 200.6,不是 200.6g,因为相对原子质量是个比值,单位是 1,故 C 说法错误;从 汞原子的结构示意图可知,最外层有 2 个电子,在化学反应中易失去电子,故 D 说法错误。故选 B。
5.【答案】C
【解析】A 氯为非金属元素,故错误; B 该元素的相对原子质量为 35.453,故错 误; C 该元素核外有三个电子层,位于元素周期表的第三周期,正确; D 该元素 在化学反应中容易得电子,错误。故选 C。
6.【答案】A
25
【解析】A.由图示的情况可以看出三者的核外电子排布相同,核外都有 10 个电 子,故 A 说法正确; B.在原子中质子数等于核外的电子数,可知第一种元素的 原子核外应该有 8 个电子,其最外层电子数是 6,第二种微粒属于原子,其最外层 电子数是 8,第三个微粒的原子核外应该有 13 个电子,其最外层电子数是 3,故 B 说法错误; C.由微粒的结构示意图可知它们的质子数不同,元素的种类由质子 数决定,所以它们不属于同种元素的微粒,故 C 说法错误; D.由微粒的结构示 意图及核电荷数、质子数与核外电子数的关系,可知第一个图示为阴离子;第二 个图示为原子;第三个图示为阳离子,故 D 说法错误。故答案应选 A。 7.【答案】B
【解析】根据元素周期表所提供的信息可知 A 选项元素符号为 Ir 是正确的叙述; B 选项属于非金属元素是错误的叙述;从名称书写上可知属于金属元素;C 选项原 子核外的电子数为 77 是正确的叙述;D 选项相对原子质量为 192.2 是正确的叙述; 故选 B。
8.【答案】B
【解析】 由原子结构示意图和元素周期表提供的信息可知,A 选项钙元素的原子序 数是 20 是正确的叙述;B 选项钙元素的离子核外最外层有 2 个电子是错误的叙述, 应为钙元素的原子核外最外层有 2 个电子;C 选项钙元素的原子核所带电荷数为 20 是正确的叙述;D 选项钙元素的相对原子质量约为 40.08 是正确的叙述;故选 B。 9.【答案】B
【解析】原子是不显电性的。在原子中,质子数等于核外电子数。所以答案选 B。
4、作业分析与设计意图
(1) 引导学生建立宏观物质、微观粒子和符号三者间的关系,这是学习化学所必 需的。能通过符号,获取基本的信息。
(2) 根据元素周期表中的单元格,获取基本信息的能力。
作业 2:
1.下图是元素周期表的一部分,请根据元素周期表回答下列问题。
26
(1) 从原子结构示意图和周期表可知:周期数________ (选填“>”、“<”或“=”) 原子核外电子层数。
(2) 最外层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素 的化学性质与_______相似。
2.某原子的原子结构示意图如图所示:
(1) 图中x=________,该原子属于________ (填“金属”或“非金属”)原子。
(2) 如下图所示的粒子中,具有相对稳定结构的是________ (填序号)。
2、时间要求 (3 分钟)
3、评价设计
1.【答案】(1) = (2) 氯
27
【解析】从原子结构示意图和周期表可知:周期数等于原子核外电子层数,最外 层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素与氯元素 的最外电子数相等,因此它们的化学性质相似。
2.【答案】(1) 7 非金属 (2) C
【解析】(1) 原子中质子数等于核外电子数,根据原子核外电子数为 35,推出x =7,该原子最外层电子数多于 4,属于非金属原子。(2) 最外层电子数是 8 个电 子的粒子(若第一层为最外层时,电子数是 2 的粒子)具有相对稳定结构,故选 C。
4、作业分析与设计意图
(1) 引导学生建立宏观物质、微观粒子二者之间的关系,这是学习化学所必需的。
(2) 根据元素周期表中的单元格,获取基本信息的能力,属于识记性的知识,考
查元素的存在。
作业 3:
1.实验探究:某化学兴趣小组同学为了研究影响分子运动速率的因素,如下图所 示,玻璃管左、右两端分别放有脱脂棉,注射器中分别装有浓盐酸和浓氨水。浓 氨水挥发出来的氨气 (NH3 ) 和浓盐酸挥发出来的氯化氢气体 (HCl) 能发生反应生 成白色的氯化铵固体。两个注射器同时向脱脂棉靠近里边的部位注入等体积的液
体,过一会,先在 A 处产生大量白烟,然后白烟逐渐充满整个试管。
根据现象回答问题:
(1) A 处形成白烟是因为分子在___________________________ ;
(2) 有同学认为先在 A 处产生白烟是因为氯化氢分子比氨气分子运动速度 __________,已知一个氯化氢分子的质量要大于一个氨气分子的质量,所以可以 说分子的运动速度与其质量成__________比。(填正或反)
2.实验探究
28
(1) 实验方法:如图所示:在 A 烧杯中盛有浓氨水,在盛有 20mL 水的 B 烧杯中 加入 5~6 滴酚酞溶液,从 B 烧杯中取少量溶液置于试管中,向其中滴加浓氨水, 用一个大烧杯罩住 AB 两个小烧杯。
(2) 实验现象:①过一会儿,观察到的现象:试管中的现象
,
_________________________
②AB 烧杯中的现象__________________________________。
(3) 你的猜想:_________________________________________________。
(4) 讨论交流:与小组同学交流你的看法:往装有酚酞溶液的试管中加浓氨水这
样操作的目的_________________________________________________。
2、时间要求 (6 分钟)
3、评价设计
1.【答案】(1) 不停地运动 (2) 慢 反
【解析】 由于浓盐酸中的氯化氢分子和浓氨水中的氨气分子都在不停地运动,所 以会在 A 处形成白烟。形成的白烟在 A 处,离浓盐酸较近,离浓氨水较远,这是 因为氯化氢分子运动速度比氨气分子运动速度慢。已知一个氯化氢分子的质量要 大于一个氨气分子的质量,所以可以说分子的运动速度与其质量成反比。 2.【答案】(2) ①液体变为红色 ;②A无明显变化, B烧杯中酚酞变红;
(3) 分子在不断地运动;(4) 说明浓氨水能使酚酞变红
【解析】浓氨水显碱性能够使无色酚酞变红色,A 烧杯中浓氨水中的氨气分子是不 断运动着的,氨气分子运动到 B 烧杯中,能够使 B 烧杯中的无色酚酞变红,所以 可以观察到 B 烧杯中酚酞变红,这一现象从而也证明了分子是不断运动的。往装 有酚酞溶液的试管中加浓氨水这样操作的目的正是说明浓氨水能使酚酞变红
4. 作业分析与设计意图
29
由宏观世界转向微观世界的开端,起到了承前启后的作用,内容较抽象,远离 学生的生活经验,感性知识不充分,这就给教学带来了一定的困难,通过对分子和 原子的认识,用分子和原子的观点解释生活中的一些现象,巩固学生的化学基础 知识和基本技能,化学基础知识和基本技能还是初中学生进行探究活动的基础和 结果,也是对学生进行情感、态度与价值观教育的重要载体。
(二) 单元质量检测作业属性表
序号 类型 对应单元 作业目标 对应学 难度 来源 完成时间
了解 理解 应用
1 选择题 1、2 √ 易 改编 15 分钟
2 填空题 2、3 √ √ 中等 改编
3 实验与探究 2、3、4 √ √ 较难 改编
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
