1.1物质的分类及转化 教案 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1物质的分类及转化 教案 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 134.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 00:00:00 | ||
图片预览

文档简介
第一节 物质的分类及转化
(第一课时)
《课程标准解读》
通过对生活实例的反思,提炼分类的意义和方法,并迁移至物质的分类,能对酸、碱、氧化物等常见物质进行更加深入的了解。通过对Fe(OH)3胶体性质的探讨,能从微观粒子尺度和宏观物质性质相结合的角度解释相关自然现象。
【教学目标】
1、了解分类法在日常生活中应用的普遍性和重要性。多角度、多标准对化学知识进行分类,体验分类的重要性。
2、从物质的组成和性质对物质进行分类,为研究物质的通性建立框架,将知识系统化。体验分类在化学、各科学习上的重要性,将“分类思想”灌输于脑中,能够在后面学习中进行实际应用,培养及时分类总结的良好学习习惯。
3、掌握“交叉分类法”、“树状分类法”。形成将生产、生活实践与所学的化学知识相联系的意识。
【教学过程】
【引入】我们在超市能够很轻松找到自己需要的商品,在图书馆能够很快捷的借阅到书籍,是为什么呢?因为超市和图书馆事先根据一定的标准进行分类。在生活中,我们经常采用分类法,使我们更快、更便捷地达到目的,提高工作效率。
【过渡】那么我们该如何对物质进行分类呢?
【讲述】我们在分类的时候首先设定标准,再选择分类的方法。我们对物质的分类常根据物质的组成和性质进行分类。
1、树状分类法:对同一事物进行再分类的方法。
(1)单质:氧气和臭氧,金刚石、石墨和C60,红磷和白磷等,它们均是有同种元素形成的不同单质,它们之间互称为同素异形体。
(2)氧化物:按照组成分为金属氧化物和非金属氧化物,按照性质可认为碱性氧化物和酸性氧化物。大多数金属氧化物属于碱性氧化物(Mn2O7除外),大多数非金属氧化物属于酸性氧化物(CO除外)。
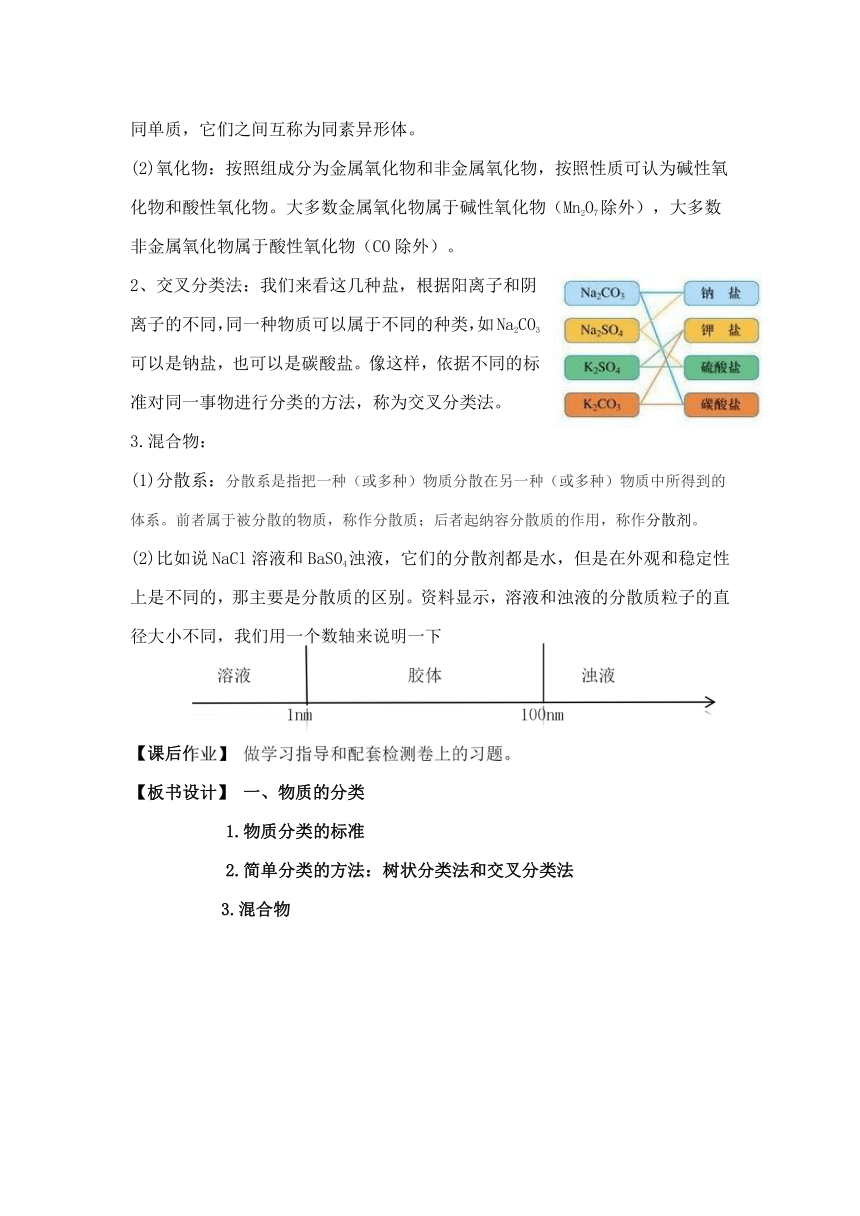
2、交叉分类法:我们来看这几种盐,根据阳离子和阴离子的不同,同一种物质可以属于不同的种类,如Na2CO3可以是钠盐,也可以是碳酸盐。像这样,依据不同的标准对同一事物进行分类的方法,称为交叉分类法。
3.混合物:
(1)分散系:分散系是指把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。前者属于被分散的物质,称作分散质;后者起纳容分散质的作用,称作分散剂。
(2)比如说NaCl溶液和BaSO4浊液,它们的分散剂都是水,但是在外观和稳定性上是不同的,那主要是分散质的区别。资料显示,溶液和浊液的分散质粒子的直径大小不同,我们用一个数轴来说明一下
溶液 胶体 浊液
1nm 100nm
【课后作业】 做学习指导和配套检测卷上的习题。
【板书设计】 一、物质的分类
1.物质分类的标准
2.简单分类的方法:树状分类法和交叉分类法
3.混合物
物质的分类及转化
(第二课时)
《课程标准解读》
认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类;同类物质具有相似的性质,一定条件下各类物质可以相互转化。
【教学目标】
1.熟知酸、碱、盐的性质,会写相关反应的化学方程式,并判断其反应类型。2.认识同类物质具有相似性,学会分析研究物质性质与相互转化的方法,促进“证据推理与模型认知”化学核心素养的发展。
【教学过程】
1.酸的性质
酸的主要化学性质 现象或化学方程式(以稀H2SO4为例) 基本反应类型
与指示剂作用 紫色石蕊溶液遇酸显红色,酚酞溶液遇酸不变色 —
与活泼金属反应(Mg) Mg+H2SO4===MgSO4+H2↑ 置换反应
与碱性氧化物反应(CuO) CuO+H2SO4===CuSO4+H2O 复分解反应
与碱反应(NaOH) 2NaOH+H2SO4===Na2SO4+2H2O 复分解反应
与某些盐反应(Na2CO3) Na2CO3+H2SO4===Na2SO4+CO2↑+H2O 复分解反应
(1)主要化学性质
(2)酸具有相似的化学性质的原因:从微观角度来看,不同的酸溶液中都含有H+。
引导学生完成以下:
碱的性质
盐的性质
【课堂探究】
学生完成各个方程式,并引导学生完成物质性质转化的归类。
单质到盐的转化关系
部分金属单质碱性氧化物碱盐;
部分非金属单质酸性氧化物酸盐
特别提醒:
物质性质的转化归类只适用于能发生的反应,并不是所有的反应都必须遵循总结,总结只是对已知性质的归纳,物质都有其特殊性,性质也其特殊性。
我们要注意矛盾的普遍性与特殊性的辩证关系在化学中的应用。
练习巩固:
单质、氧化物、酸、碱和盐的相互关系,可以用如图简单表示。选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转化用化学方程式表示(所写化学方程式不得重复)。
①C+O2CO2;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ 。
解题锦囊:
属于同一类的物质必定符合同一标准,就会有某一共同的性质,利用一类物质和另一类物质之间的关系,就可以找出物质之间转化的方法
练习巩固:
【课后作业】
《学习指导》配套检测卷。
【板书设计】
【教学反思】
(第一课时)
《课程标准解读》
通过对生活实例的反思,提炼分类的意义和方法,并迁移至物质的分类,能对酸、碱、氧化物等常见物质进行更加深入的了解。通过对Fe(OH)3胶体性质的探讨,能从微观粒子尺度和宏观物质性质相结合的角度解释相关自然现象。
【教学目标】
1、了解分类法在日常生活中应用的普遍性和重要性。多角度、多标准对化学知识进行分类,体验分类的重要性。
2、从物质的组成和性质对物质进行分类,为研究物质的通性建立框架,将知识系统化。体验分类在化学、各科学习上的重要性,将“分类思想”灌输于脑中,能够在后面学习中进行实际应用,培养及时分类总结的良好学习习惯。
3、掌握“交叉分类法”、“树状分类法”。形成将生产、生活实践与所学的化学知识相联系的意识。
【教学过程】
【引入】我们在超市能够很轻松找到自己需要的商品,在图书馆能够很快捷的借阅到书籍,是为什么呢?因为超市和图书馆事先根据一定的标准进行分类。在生活中,我们经常采用分类法,使我们更快、更便捷地达到目的,提高工作效率。
【过渡】那么我们该如何对物质进行分类呢?
【讲述】我们在分类的时候首先设定标准,再选择分类的方法。我们对物质的分类常根据物质的组成和性质进行分类。
1、树状分类法:对同一事物进行再分类的方法。
(1)单质:氧气和臭氧,金刚石、石墨和C60,红磷和白磷等,它们均是有同种元素形成的不同单质,它们之间互称为同素异形体。
(2)氧化物:按照组成分为金属氧化物和非金属氧化物,按照性质可认为碱性氧化物和酸性氧化物。大多数金属氧化物属于碱性氧化物(Mn2O7除外),大多数非金属氧化物属于酸性氧化物(CO除外)。
2、交叉分类法:我们来看这几种盐,根据阳离子和阴离子的不同,同一种物质可以属于不同的种类,如Na2CO3可以是钠盐,也可以是碳酸盐。像这样,依据不同的标准对同一事物进行分类的方法,称为交叉分类法。
3.混合物:
(1)分散系:分散系是指把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。前者属于被分散的物质,称作分散质;后者起纳容分散质的作用,称作分散剂。
(2)比如说NaCl溶液和BaSO4浊液,它们的分散剂都是水,但是在外观和稳定性上是不同的,那主要是分散质的区别。资料显示,溶液和浊液的分散质粒子的直径大小不同,我们用一个数轴来说明一下
溶液 胶体 浊液
1nm 100nm
【课后作业】 做学习指导和配套检测卷上的习题。
【板书设计】 一、物质的分类
1.物质分类的标准
2.简单分类的方法:树状分类法和交叉分类法
3.混合物
物质的分类及转化
(第二课时)
《课程标准解读》
认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类;同类物质具有相似的性质,一定条件下各类物质可以相互转化。
【教学目标】
1.熟知酸、碱、盐的性质,会写相关反应的化学方程式,并判断其反应类型。2.认识同类物质具有相似性,学会分析研究物质性质与相互转化的方法,促进“证据推理与模型认知”化学核心素养的发展。
【教学过程】
1.酸的性质
酸的主要化学性质 现象或化学方程式(以稀H2SO4为例) 基本反应类型
与指示剂作用 紫色石蕊溶液遇酸显红色,酚酞溶液遇酸不变色 —
与活泼金属反应(Mg) Mg+H2SO4===MgSO4+H2↑ 置换反应
与碱性氧化物反应(CuO) CuO+H2SO4===CuSO4+H2O 复分解反应
与碱反应(NaOH) 2NaOH+H2SO4===Na2SO4+2H2O 复分解反应
与某些盐反应(Na2CO3) Na2CO3+H2SO4===Na2SO4+CO2↑+H2O 复分解反应
(1)主要化学性质
(2)酸具有相似的化学性质的原因:从微观角度来看,不同的酸溶液中都含有H+。
引导学生完成以下:
碱的性质
盐的性质
【课堂探究】
学生完成各个方程式,并引导学生完成物质性质转化的归类。
单质到盐的转化关系
部分金属单质碱性氧化物碱盐;
部分非金属单质酸性氧化物酸盐
特别提醒:
物质性质的转化归类只适用于能发生的反应,并不是所有的反应都必须遵循总结,总结只是对已知性质的归纳,物质都有其特殊性,性质也其特殊性。
我们要注意矛盾的普遍性与特殊性的辩证关系在化学中的应用。
练习巩固:
单质、氧化物、酸、碱和盐的相互关系,可以用如图简单表示。选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转化用化学方程式表示(所写化学方程式不得重复)。
①C+O2CO2;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ 。
解题锦囊:
属于同一类的物质必定符合同一标准,就会有某一共同的性质,利用一类物质和另一类物质之间的关系,就可以找出物质之间转化的方法
练习巩固:
【课后作业】
《学习指导》配套检测卷。
【板书设计】
【教学反思】
