1.1 课时2 构造原理与电子排布式 课件(共24张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1 课时2 构造原理与电子排布式 课件(共24张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 543.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 12:09:00 | ||
图片预览





文档简介
(共24张PPT)
第一章 原子结构与性质
第一节 原子结构 课时2
1.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2.会书写1~36号元素基态原子核外电子的排布式。
原子结构
同一能层里的e-能量一样吗?
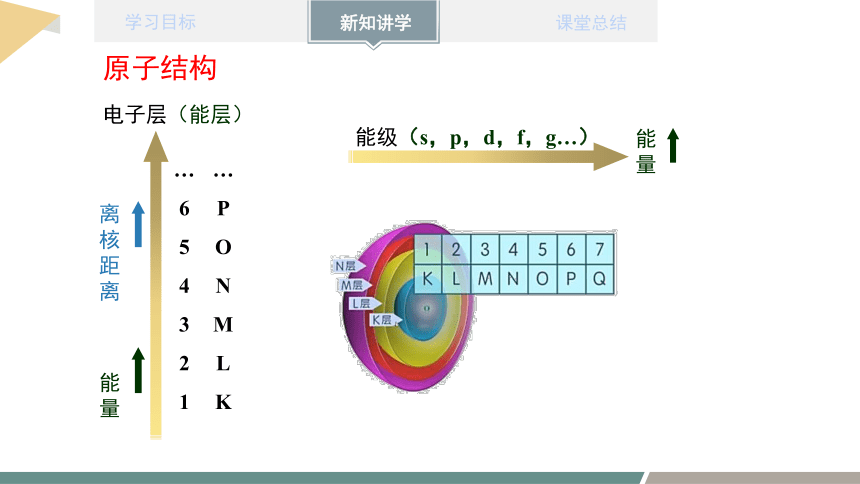
电子层(能层)
离核距离
能量
…654321
…PONMLK
原子结构
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
原子结构
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
s
s p
s p d
s p d f
s p d f g
…
每层最多容纳e-数:2n2
······
2+6+10=18
2+6=8
2
Mg
2
+12
8
2
请标出能层上的能级符号,并将能级上所含有的电子数标在能级符号的右上角
Mg的核外电子排布式
1s2 2s2 2p6 3s2
问题探究:根据已有知识,试写出K原子的可能核外电子排布式与原子结构示意图
猜想一:1s22s22p63s23p63d1
猜想二:1s22s22p63s23p64s1
2
+19
8
9
2
+19
8
8
1
一、构造原理与电子排布式
1.构造原理
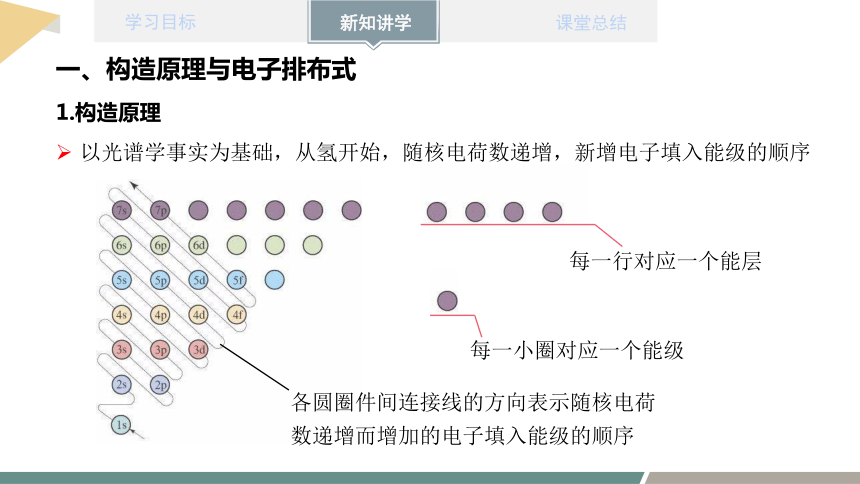
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序
每一行对应一个能层
每一小圈对应一个能级
各圆圈件间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序
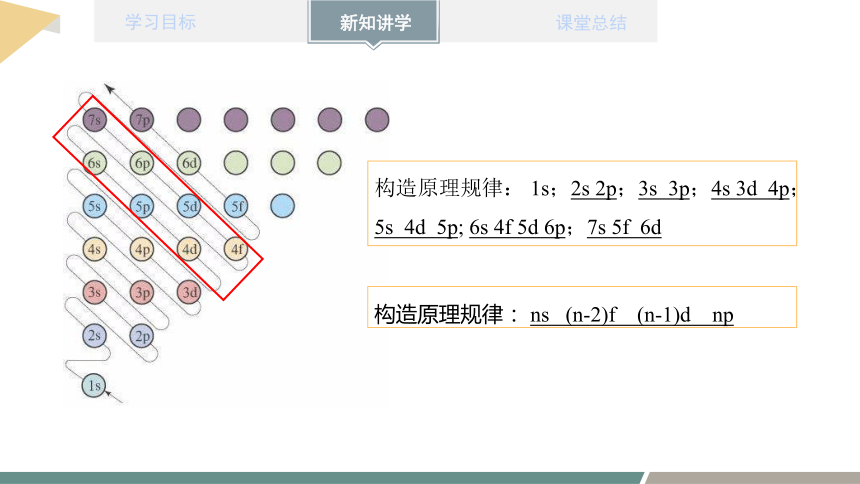
构造原理规律: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
构造原理规律: ns (n-2)f (n-1)d np
问题探究:根据已有知识,试写出K原子的可能核外电子排布式与原子结构示意图
猜想一:1s22s22p63s23p63d1
猜想二:1s22s22p63s23p64s1
2
+19
8
9
2
+19
8
8
1
√
2.电子排布式
理论依据:构造原理
元素核电荷数每递增一个,同时增加一个核电荷和核外电子,就得到一个基态原子的电子排布
电子填满一个能级,就开始填入下一个能级
从氢到碳的基态原子电子排布式如下:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢→ 氦 → 锂 → 铍 → 硼 → 碳
电子排布式是用数字在能级符号右上角标明该能级上排布的电子数的式子
Al原子电子排布式
【思考】
1.书写1~36号元素基态原子的电子排布式
2.阅读课本表1-1,总结电子排布式的书写原则
原子序数 元素名称 元素符号 电子排布
K L M
1 氢 H
2 氦 He
3 锂 Li
4 铍 Be
5 硼 B
6 碳 C
7 氮 N
8 氧 O
9 氟 F
1s1
1s2 2s1
1s2
1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
原子序数 元素名称 元素符号 电子排布
K L M N
10 氖 Ne
1s2 2s22p6
11 钠 Na
12 镁 Mg
13 铝 Al
14 硅 Si
15 磷 P
16 硫 S
17 氯 Cl
18 氩 Ar
1s2 2s22p6 3s1
1s2 2s22p6 3s2
1s2 2s22p6 3s23p1
1s2 2s22p6 3s23p2
1s2 2s22p6 3s23p3
1s2 2s22p6 3s23p4
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
1s2 2s22p5
原子序数 元素名称 元素符号 电子排布
K L M N
28 镍 Ni
29 铜 Cu
30 锌 Zn
31 镓 Ga
32 锗 Ge
33 砷 As
34 硒 Se
35 溴 Br
36 氪 Kr
1s2 2s22p6 3s23p63d10 4s24p1
1s2 2s22p6 3s23p63d10 4s24p2
1s2 2s22p6 3s23p63d10 4s24p3
1s2 2s22p6 3s23p63d10 4s24p4
1s2 2s22p6 3s23p63d10 4s24p5
1s2 2s22p6 3s23p63d10 4s24p6
1s2 2s22p6 3s23p63d10 4s1
1s2 2s22p6 3s23p63d10 4s2
原子序数 元素名称 元素符号 电子排布
K L M N
19 钾 K
20 钙 Ca
21 钪 Sc
22 钛 Ti
23 钒 V
24 铬 Cr
25 锰 Mn
26 铁 Fe
27 钴 Co
1s2 2s22p6 3s23p6 4s1
1s2 2s22p6 3s23p6 4s2
1s2 2s22p6 3s23p63d1 4s2
1s2 2s22p6 3s23p63d2 4s2
1s2 2s22p6 3s23p63d3 4s2
1s2 2s22p6 3s23p63d5 4s1
1s2 2s22p6 3s23p63d5 4s2
1s2 2s22p6 3s23p63d6 4s2
1s2 2s22p6 3s23p63d7 4s2
1s2 2s22p6 3s23p63d8 4s2
(1)能级交错
从第三能层开始出现能级交错现象,能级交错排列的顺序即电子能量由低到高的顺序,即Ens<E(n-2)f<E(n-1)d<Enp
随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的,这种现象被称为能级交错。
源于光谱学事实
(2)书写原则
按照构造原理将电子依次填充到能量逐渐升高的能级中
一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
基态铬、铜的核外电子排布不符合构造原理
Cr基态原子的电子排布式:
Cu基态原子的电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
半充满
全充满
【思考与讨论】
1.按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2
Ne 2s22p6
Ar 3s23p6
Kr 4s 24p6
Xe 5s 25p6
Rn 6s 26p6
通式:ns2np6
2.电子排布式可以简化,如Na的电子排布式可简化为[Ne]3s1,
(1) 上述方括号的意义是什么?
(2) 仿照Na的简化电子排布式,写出Be、Si、Cu的简化电子排布式
方括号:内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号的形式表示
Be [He] 2s2
Si [Ne]3s23p2
Cu [Ar] 3d10 4s1
【思考与讨论】
3.为突出化合价与电子排布式的关系,将在化学反应中可能发生电子变动的能级称 为价电子层。
Fe 简化电子排布式为[Ar]3d64s2 价电子排布式为3d64s2
通常元素周期表只给出价层电子排布式,请写出Na、Al、Cl、Mn、Br的价层电子排布
【思考与讨论】
原子 Na Al Cl Mn Br
价层电子排布 3s1 3s23p1 3s23p5 3d5 4s2 4s24p5
(1)最外层电子排布式为4s1的元素一定为K。( )
(2)K的电子排布式为1s22s22p63s23p63d1。( )
(3)Mg的简化电子排布式为[Ne]3s2 ( )
(4)原子核外每一能层最多可容纳n2个电子 ( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
×
√
练一练
练一练
2.下列各原子或离子的电子排布式错误的是( )
A.K+:1s22s22p63s23p6 B.As:1s22s22p63s23p63d104s24p3
C.N3-:1s22s22p6 D.Cr:1s22s22p63s23p63d44s2
D
3.已知某+2价离子的电子排布式为1s22s22p6,该元素在周期表中所属的族是( )
A.ⅡA B.ⅡB C.Ⅷ D.ⅠB
A
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
第一章 原子结构与性质
第一节 原子结构 课时2
1.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2.会书写1~36号元素基态原子核外电子的排布式。
原子结构
同一能层里的e-能量一样吗?
电子层(能层)
离核距离
能量
…654321
…PONMLK
原子结构
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
原子结构
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
s
s p
s p d
s p d f
s p d f g
…
每层最多容纳e-数:2n2
······
2+6+10=18
2+6=8
2
Mg
2
+12
8
2
请标出能层上的能级符号,并将能级上所含有的电子数标在能级符号的右上角
Mg的核外电子排布式
1s2 2s2 2p6 3s2
问题探究:根据已有知识,试写出K原子的可能核外电子排布式与原子结构示意图
猜想一:1s22s22p63s23p63d1
猜想二:1s22s22p63s23p64s1
2
+19
8
9
2
+19
8
8
1
一、构造原理与电子排布式
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序
每一行对应一个能层
每一小圈对应一个能级
各圆圈件间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序
构造原理规律: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
构造原理规律: ns (n-2)f (n-1)d np
问题探究:根据已有知识,试写出K原子的可能核外电子排布式与原子结构示意图
猜想一:1s22s22p63s23p63d1
猜想二:1s22s22p63s23p64s1
2
+19
8
9
2
+19
8
8
1
√
2.电子排布式
理论依据:构造原理
元素核电荷数每递增一个,同时增加一个核电荷和核外电子,就得到一个基态原子的电子排布
电子填满一个能级,就开始填入下一个能级
从氢到碳的基态原子电子排布式如下:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢→ 氦 → 锂 → 铍 → 硼 → 碳
电子排布式是用数字在能级符号右上角标明该能级上排布的电子数的式子
Al原子电子排布式
【思考】
1.书写1~36号元素基态原子的电子排布式
2.阅读课本表1-1,总结电子排布式的书写原则
原子序数 元素名称 元素符号 电子排布
K L M
1 氢 H
2 氦 He
3 锂 Li
4 铍 Be
5 硼 B
6 碳 C
7 氮 N
8 氧 O
9 氟 F
1s1
1s2 2s1
1s2
1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
原子序数 元素名称 元素符号 电子排布
K L M N
10 氖 Ne
1s2 2s22p6
11 钠 Na
12 镁 Mg
13 铝 Al
14 硅 Si
15 磷 P
16 硫 S
17 氯 Cl
18 氩 Ar
1s2 2s22p6 3s1
1s2 2s22p6 3s2
1s2 2s22p6 3s23p1
1s2 2s22p6 3s23p2
1s2 2s22p6 3s23p3
1s2 2s22p6 3s23p4
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
1s2 2s22p5
原子序数 元素名称 元素符号 电子排布
K L M N
28 镍 Ni
29 铜 Cu
30 锌 Zn
31 镓 Ga
32 锗 Ge
33 砷 As
34 硒 Se
35 溴 Br
36 氪 Kr
1s2 2s22p6 3s23p63d10 4s24p1
1s2 2s22p6 3s23p63d10 4s24p2
1s2 2s22p6 3s23p63d10 4s24p3
1s2 2s22p6 3s23p63d10 4s24p4
1s2 2s22p6 3s23p63d10 4s24p5
1s2 2s22p6 3s23p63d10 4s24p6
1s2 2s22p6 3s23p63d10 4s1
1s2 2s22p6 3s23p63d10 4s2
原子序数 元素名称 元素符号 电子排布
K L M N
19 钾 K
20 钙 Ca
21 钪 Sc
22 钛 Ti
23 钒 V
24 铬 Cr
25 锰 Mn
26 铁 Fe
27 钴 Co
1s2 2s22p6 3s23p6 4s1
1s2 2s22p6 3s23p6 4s2
1s2 2s22p6 3s23p63d1 4s2
1s2 2s22p6 3s23p63d2 4s2
1s2 2s22p6 3s23p63d3 4s2
1s2 2s22p6 3s23p63d5 4s1
1s2 2s22p6 3s23p63d5 4s2
1s2 2s22p6 3s23p63d6 4s2
1s2 2s22p6 3s23p63d7 4s2
1s2 2s22p6 3s23p63d8 4s2
(1)能级交错
从第三能层开始出现能级交错现象,能级交错排列的顺序即电子能量由低到高的顺序,即Ens<E(n-2)f<E(n-1)d<Enp
随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的,这种现象被称为能级交错。
源于光谱学事实
(2)书写原则
按照构造原理将电子依次填充到能量逐渐升高的能级中
一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
基态铬、铜的核外电子排布不符合构造原理
Cr基态原子的电子排布式:
Cu基态原子的电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
半充满
全充满
【思考与讨论】
1.按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2
Ne 2s22p6
Ar 3s23p6
Kr 4s 24p6
Xe 5s 25p6
Rn 6s 26p6
通式:ns2np6
2.电子排布式可以简化,如Na的电子排布式可简化为[Ne]3s1,
(1) 上述方括号的意义是什么?
(2) 仿照Na的简化电子排布式,写出Be、Si、Cu的简化电子排布式
方括号:内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号的形式表示
Be [He] 2s2
Si [Ne]3s23p2
Cu [Ar] 3d10 4s1
【思考与讨论】
3.为突出化合价与电子排布式的关系,将在化学反应中可能发生电子变动的能级称 为价电子层。
Fe 简化电子排布式为[Ar]3d64s2 价电子排布式为3d64s2
通常元素周期表只给出价层电子排布式,请写出Na、Al、Cl、Mn、Br的价层电子排布
【思考与讨论】
原子 Na Al Cl Mn Br
价层电子排布 3s1 3s23p1 3s23p5 3d5 4s2 4s24p5
(1)最外层电子排布式为4s1的元素一定为K。( )
(2)K的电子排布式为1s22s22p63s23p63d1。( )
(3)Mg的简化电子排布式为[Ne]3s2 ( )
(4)原子核外每一能层最多可容纳n2个电子 ( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
×
√
练一练
练一练
2.下列各原子或离子的电子排布式错误的是( )
A.K+:1s22s22p63s23p6 B.As:1s22s22p63s23p63d104s24p3
C.N3-:1s22s22p6 D.Cr:1s22s22p63s23p63d44s2
D
3.已知某+2价离子的电子排布式为1s22s22p6,该元素在周期表中所属的族是( )
A.ⅡA B.ⅡB C.Ⅷ D.ⅠB
A
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
