2.2 课时3 杂化轨道理论 课件(共21张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2 课时3 杂化轨道理论 课件(共21张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 12:13:53 | ||
图片预览





文档简介
(共21张PPT)
第二章 分子结构与性质
第二节 分子的空间结构 课时3
自然科学的研究在许多时候产生于人们对于一些既定科学事实的解释。虽然VSEPR理论很好的解释了分子具有一定的空间构型的原因,但是科学家却发现用传统的价键理论无法解释。
莱纳斯·卡尔·鲍林
↑
1s1
为什么能在CH4分子中与4个H原子的1s轨道会形成4个完全相同的σ键呢?
杂化轨道的理论
H
2s2
2p2
↑↓
↑
↑
C
1.了解杂化轨道理论的要点和类型;
2.能运用杂化轨道理论解释简单共价分子和离子的空间结构。
2s
2p
↑↓
↑
↑
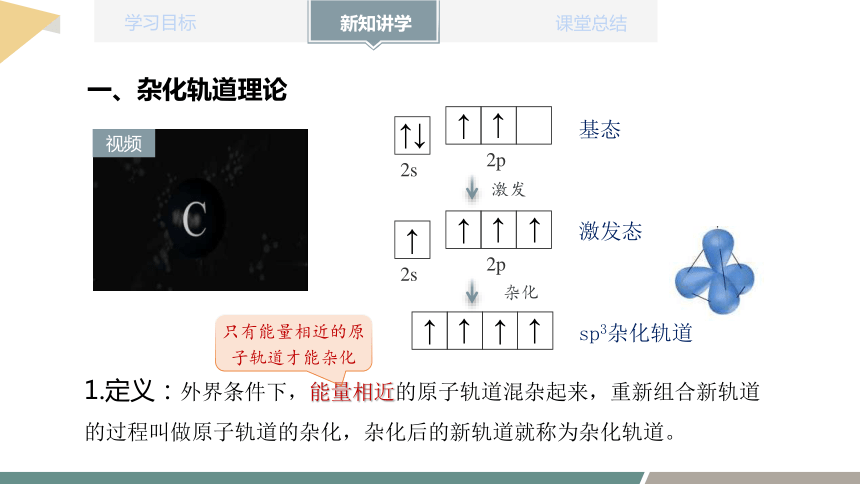
基态
激发
2s
2p
↑
↑
↑
↑
激发态
sp3杂化轨道
杂化
↑
↑
↑
↑
视频
1.定义:外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
一、杂化轨道理论
只有能量相近的原子轨道才能杂化
解释:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。当碳原子跟4个氢原子结合时,碳原子以4个sp杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键,因此呈正四面体形的空间结构。
杂化改变了原子轨道的形状、方向。杂化使原子的成键能力增加。
重叠程度增大
只有在形成分子时才能杂化,孤立的原子不可能发生杂化
2.杂化轨道的形成及其特点
价层电子
空轨道
杂化轨道
轨道总数不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度增大,生成的分子更稳定。
激发
轨道重新组合
成对电子中的一个
与激发电子邻近
能量相近、类型不同的原子轨道
3.杂化轨道的类型
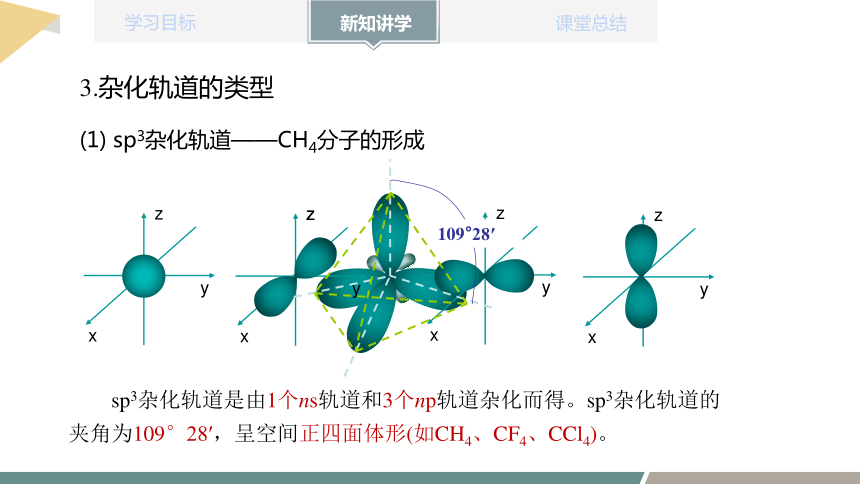
(1) sp3杂化轨道——CH4分子的形成
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化轨道是由1个ns轨道和3个np轨道杂化而得。sp3杂化轨道的夹角为109°28′,呈空间正四面体形(如CH4、CF4、CCl4)。
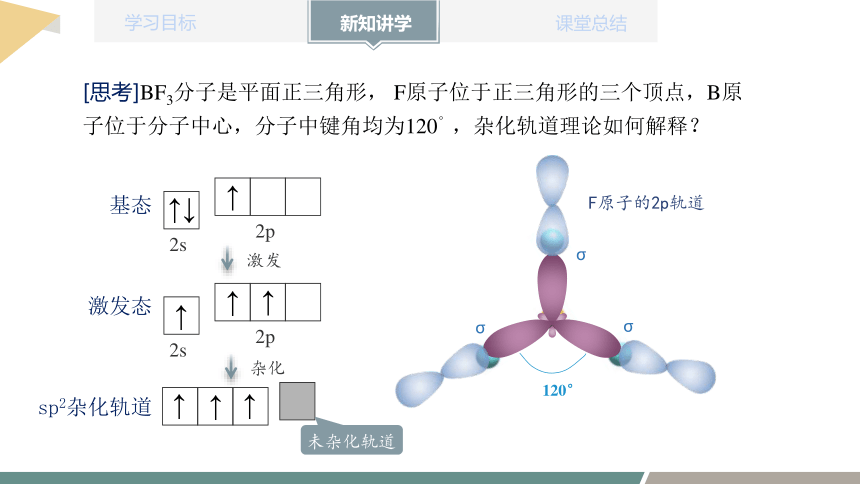
[思考]BF3分子是平面正三角形, F原子位于正三角形的三个顶点,B原子位于分子中心,分子中键角均为120°,杂化轨道理论如何解释?
2s
2p
↑↓
↑
基态
激发
2s
2p
↑
↑
激发态
↑
sp2杂化轨道
杂化
↑
↑
↑
未杂化轨道
σ
σ
σ
120°
F原子的2p轨道
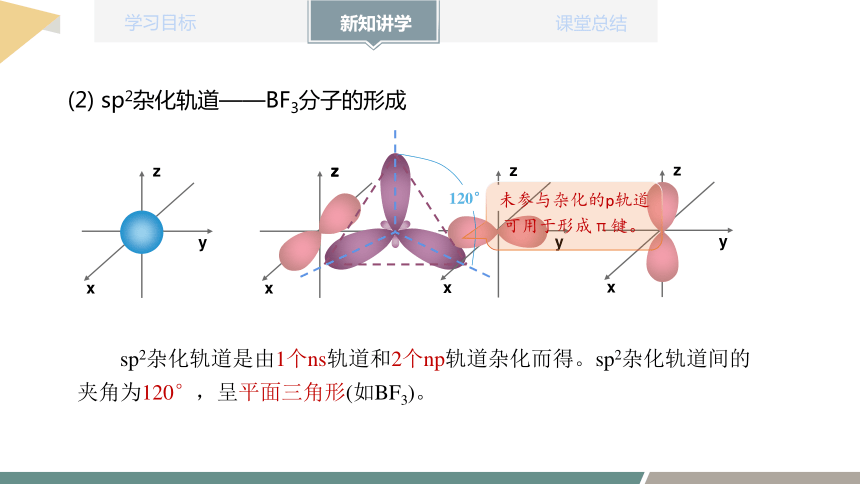
(2) sp2杂化轨道——BF3分子的形成
x
y
z
z
x
y
z
x
y
z
x
y
z
120°
sp2杂化轨道是由1个ns轨道和2个np轨道杂化而得。sp2杂化轨道间的夹角为120°,呈平面三角形(如BF3)。
未参与杂化的p轨道可用于形成π键。
[思考]气态BeCl2分子是直线形,Cl原子位于Be原子的两侧, BeCl2分子中键角为180o 。杂化轨道理论如何解释?
2s
2p
↑↓
基态
激发
2s
2p
↑
↑
激发态
杂化
sp杂化轨道
↑
↑
未杂化轨道
氯原子的3p轨道
σ
σ
(3) sp杂化轨道——BeCl2分子的形成
x
y
z
x
y
z
z
x
y
z
x
y
z
sp杂化轨道是由1个ns轨道和1个np轨道杂化而得。sp杂化轨道间的夹角为180°,呈直线形(如BeCl2)。分子的空间结构主要取决于原子轨道的杂化类型。
180°
Ⅰ.2s轨道与3p轨道能否形成sp2杂化轨道
思考与交流
Ⅱ.用杂化轨道理论解释NH3、H2O的空间结构。
①当杂化轨道中有未参与成键的孤电子对时,由于孤电子对参与互相排斥,使分子的空间结构与杂化轨道的形态发生变化。
②如水分子的氧原子的sp3杂化轨道中有2个被孤电子对占据,其分子不呈正四面体形,而呈V形;
③氨分子的氮原子的sp3杂化轨道中有1个被孤电子对占据,氨分子不呈正四面体形,而呈三角锥形。
不能。只有能量相近的原子轨道才能形成杂化轨道。2s轨道与3p轨道不在同一能层,能量相差较大。
(4)杂化类型的判断
①因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:中心原子的杂化轨道数=价层电子数=σ键电子对数(中心原子结合的电子数)+孤电子对数,再由杂化轨道数判断杂化类型。
中心原子的
价层电子对数
规律:
代表物 杂化轨道数 杂化轨道类型
CO2
CH2O
SO2
H2O
0+2=2
sp
0+3=3
sp2
1+2=3
2+2=4
sp2
sp3
2
3
4
sp
sp2
sp3
②通过看中心原子有没有形成双键或三键来判断
若有1个三键或2个双键,则其中有2个π键,用去2个p轨道,形成的是sp杂化;
若有1个双键则其中必有1个π键,用去1个p轨道,形成的是sp2杂化;
若全部是单键,则形成sp3杂化。
③根据杂化轨道之间的夹角判断
④根据杂化轨道的立体构型判断
杂化轨道
之间的夹角
180°
120°
109°28′
sp
sp2
sp3
杂化轨道
的立体构型
直线形
平面三角形
正四面体形或三角锥形
sp
sp2
sp3
5.杂化轨道与分子空间构型
价电子对数 VSEPR模型 VSEPR模型名称 杂化轨道数 中心原子的杂化轨道类型 分子的空间构型 实例
BeCl2
SO2
H2O
SO3
NH3
CH4
直线形
平面三角形
四面体形
平面三角形
四面体形
正四面体形
sp
sp2
sp3
sp2
sp3
sp3
直线形
V形
V形
平面三角形
三角锥形
正四面体形
2
3
4
3
4
4
2
3
4
3
4
4
1.判断正误
(1)价电子对之间的夹角越小,排斥力越小。 ( )
(2)NH3分子的VSEPR模型与分子空间结构不一致。( )
(3)五原子分子的空间结构都是正四面体形。( )
(4)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )
(5)凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )
(6)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
[练一练]
D
2.根据价层电子对互斥模型及原子杂化轨道理论判断NF3分子的空间结构和中心原子的杂化方式为( )
A.直线形 sp杂化
B.平面三角形 sp2杂化
C.三角锥形 sp2杂化
D.三角锥形 sp3杂化
3.在乙烯(CH2=CH2)分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
A
4.下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③ 苯 ④CH≡CH ⑤BeCl2 ⑥CH4
A.①②③
B.①⑤⑥
C.②③④
D.③⑤⑥
A
5.指出下列原子的杂化轨道类型、分子的结构式及空间结构。
(1)CS2分子中的C为 杂化, 空间结构为 ;
(2)CH2O中的C为 杂化, 空间结构为 ;
(3)CCl4分子中的C为 杂化, 空间结构为 ;
(4)H2S分子中的S为 杂化, 空间结构为 。
sp
直线形
sp2
平面三角形
sp3
正四面体
sp3
V形
分
子
的
空
间
结
构
多样的分子空间结构
价层电子对互斥模型
杂化轨道理论
分子结构的测定
红外光谱仪
质谱法
化学键或官能团
相对分子质量
直线形、V形
三角锥形、平面三角形
四面体形
内容概述
中心原子价层电子对数的计算
根据VSEPR模型判断分子的空间结构
杂化轨道类型
杂化轨道与分子空间结构
第二章 分子结构与性质
第二节 分子的空间结构 课时3
自然科学的研究在许多时候产生于人们对于一些既定科学事实的解释。虽然VSEPR理论很好的解释了分子具有一定的空间构型的原因,但是科学家却发现用传统的价键理论无法解释。
莱纳斯·卡尔·鲍林
↑
1s1
为什么能在CH4分子中与4个H原子的1s轨道会形成4个完全相同的σ键呢?
杂化轨道的理论
H
2s2
2p2
↑↓
↑
↑
C
1.了解杂化轨道理论的要点和类型;
2.能运用杂化轨道理论解释简单共价分子和离子的空间结构。
2s
2p
↑↓
↑
↑
基态
激发
2s
2p
↑
↑
↑
↑
激发态
sp3杂化轨道
杂化
↑
↑
↑
↑
视频
1.定义:外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
一、杂化轨道理论
只有能量相近的原子轨道才能杂化
解释:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。当碳原子跟4个氢原子结合时,碳原子以4个sp杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键,因此呈正四面体形的空间结构。
杂化改变了原子轨道的形状、方向。杂化使原子的成键能力增加。
重叠程度增大
只有在形成分子时才能杂化,孤立的原子不可能发生杂化
2.杂化轨道的形成及其特点
价层电子
空轨道
杂化轨道
轨道总数不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度增大,生成的分子更稳定。
激发
轨道重新组合
成对电子中的一个
与激发电子邻近
能量相近、类型不同的原子轨道
3.杂化轨道的类型
(1) sp3杂化轨道——CH4分子的形成
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化轨道是由1个ns轨道和3个np轨道杂化而得。sp3杂化轨道的夹角为109°28′,呈空间正四面体形(如CH4、CF4、CCl4)。
[思考]BF3分子是平面正三角形, F原子位于正三角形的三个顶点,B原子位于分子中心,分子中键角均为120°,杂化轨道理论如何解释?
2s
2p
↑↓
↑
基态
激发
2s
2p
↑
↑
激发态
↑
sp2杂化轨道
杂化
↑
↑
↑
未杂化轨道
σ
σ
σ
120°
F原子的2p轨道
(2) sp2杂化轨道——BF3分子的形成
x
y
z
z
x
y
z
x
y
z
x
y
z
120°
sp2杂化轨道是由1个ns轨道和2个np轨道杂化而得。sp2杂化轨道间的夹角为120°,呈平面三角形(如BF3)。
未参与杂化的p轨道可用于形成π键。
[思考]气态BeCl2分子是直线形,Cl原子位于Be原子的两侧, BeCl2分子中键角为180o 。杂化轨道理论如何解释?
2s
2p
↑↓
基态
激发
2s
2p
↑
↑
激发态
杂化
sp杂化轨道
↑
↑
未杂化轨道
氯原子的3p轨道
σ
σ
(3) sp杂化轨道——BeCl2分子的形成
x
y
z
x
y
z
z
x
y
z
x
y
z
sp杂化轨道是由1个ns轨道和1个np轨道杂化而得。sp杂化轨道间的夹角为180°,呈直线形(如BeCl2)。分子的空间结构主要取决于原子轨道的杂化类型。
180°
Ⅰ.2s轨道与3p轨道能否形成sp2杂化轨道
思考与交流
Ⅱ.用杂化轨道理论解释NH3、H2O的空间结构。
①当杂化轨道中有未参与成键的孤电子对时,由于孤电子对参与互相排斥,使分子的空间结构与杂化轨道的形态发生变化。
②如水分子的氧原子的sp3杂化轨道中有2个被孤电子对占据,其分子不呈正四面体形,而呈V形;
③氨分子的氮原子的sp3杂化轨道中有1个被孤电子对占据,氨分子不呈正四面体形,而呈三角锥形。
不能。只有能量相近的原子轨道才能形成杂化轨道。2s轨道与3p轨道不在同一能层,能量相差较大。
(4)杂化类型的判断
①因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:中心原子的杂化轨道数=价层电子数=σ键电子对数(中心原子结合的电子数)+孤电子对数,再由杂化轨道数判断杂化类型。
中心原子的
价层电子对数
规律:
代表物 杂化轨道数 杂化轨道类型
CO2
CH2O
SO2
H2O
0+2=2
sp
0+3=3
sp2
1+2=3
2+2=4
sp2
sp3
2
3
4
sp
sp2
sp3
②通过看中心原子有没有形成双键或三键来判断
若有1个三键或2个双键,则其中有2个π键,用去2个p轨道,形成的是sp杂化;
若有1个双键则其中必有1个π键,用去1个p轨道,形成的是sp2杂化;
若全部是单键,则形成sp3杂化。
③根据杂化轨道之间的夹角判断
④根据杂化轨道的立体构型判断
杂化轨道
之间的夹角
180°
120°
109°28′
sp
sp2
sp3
杂化轨道
的立体构型
直线形
平面三角形
正四面体形或三角锥形
sp
sp2
sp3
5.杂化轨道与分子空间构型
价电子对数 VSEPR模型 VSEPR模型名称 杂化轨道数 中心原子的杂化轨道类型 分子的空间构型 实例
BeCl2
SO2
H2O
SO3
NH3
CH4
直线形
平面三角形
四面体形
平面三角形
四面体形
正四面体形
sp
sp2
sp3
sp2
sp3
sp3
直线形
V形
V形
平面三角形
三角锥形
正四面体形
2
3
4
3
4
4
2
3
4
3
4
4
1.判断正误
(1)价电子对之间的夹角越小,排斥力越小。 ( )
(2)NH3分子的VSEPR模型与分子空间结构不一致。( )
(3)五原子分子的空间结构都是正四面体形。( )
(4)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )
(5)凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )
(6)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
[练一练]
D
2.根据价层电子对互斥模型及原子杂化轨道理论判断NF3分子的空间结构和中心原子的杂化方式为( )
A.直线形 sp杂化
B.平面三角形 sp2杂化
C.三角锥形 sp2杂化
D.三角锥形 sp3杂化
3.在乙烯(CH2=CH2)分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
A
4.下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③ 苯 ④CH≡CH ⑤BeCl2 ⑥CH4
A.①②③
B.①⑤⑥
C.②③④
D.③⑤⑥
A
5.指出下列原子的杂化轨道类型、分子的结构式及空间结构。
(1)CS2分子中的C为 杂化, 空间结构为 ;
(2)CH2O中的C为 杂化, 空间结构为 ;
(3)CCl4分子中的C为 杂化, 空间结构为 ;
(4)H2S分子中的S为 杂化, 空间结构为 。
sp
直线形
sp2
平面三角形
sp3
正四面体
sp3
V形
分
子
的
空
间
结
构
多样的分子空间结构
价层电子对互斥模型
杂化轨道理论
分子结构的测定
红外光谱仪
质谱法
化学键或官能团
相对分子质量
直线形、V形
三角锥形、平面三角形
四面体形
内容概述
中心原子价层电子对数的计算
根据VSEPR模型判断分子的空间结构
杂化轨道类型
杂化轨道与分子空间结构
