2.3 课时3 溶解性 分子的手性 课件(共24张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时3 溶解性 分子的手性 课件(共24张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 12:14:45 | ||
图片预览






文档简介
(共24张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质 课时3
1.理解影响物质溶解度的因素,会判断不同物质溶解度差异
的原因;
2.初步认识分子的手性,了解手性分子在药物研究中的应用。
水是一种常见的溶剂
物质在水中的溶解性与哪些因素有关?
温度,压强
思考与讨论
[实验现象]
实验结论:I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
[分析]分析下列哪些是极性分子,哪些是非极性分子?
H2O CCl4 I2
H2O为极性分子,CCl4、I2 为非极性分子。
为什么碘在四氯化碳中的溶解度大于其在水中的溶解度?
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。如蔗糖和氨易溶于水,难溶于CCl4。萘和碘易溶于CCl4,难溶于水。
已知:
I2 + I- I3-
实验结论:KI3 易溶于水,碘单质参与发生反应 。
一、溶解性
1.“相似相溶”规律
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
加入 KI
振荡
溶液
紫红色变浅
如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2.发生化学反应:
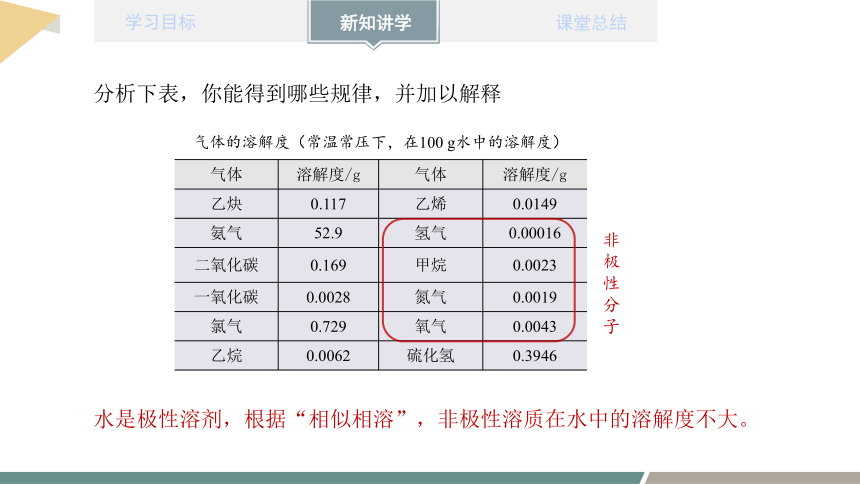
分析下表,你能得到哪些规律,并加以解释
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
非
极
性
分
子
水是极性溶剂,根据“相似相溶”,非极性溶质在水中的溶解度不大。
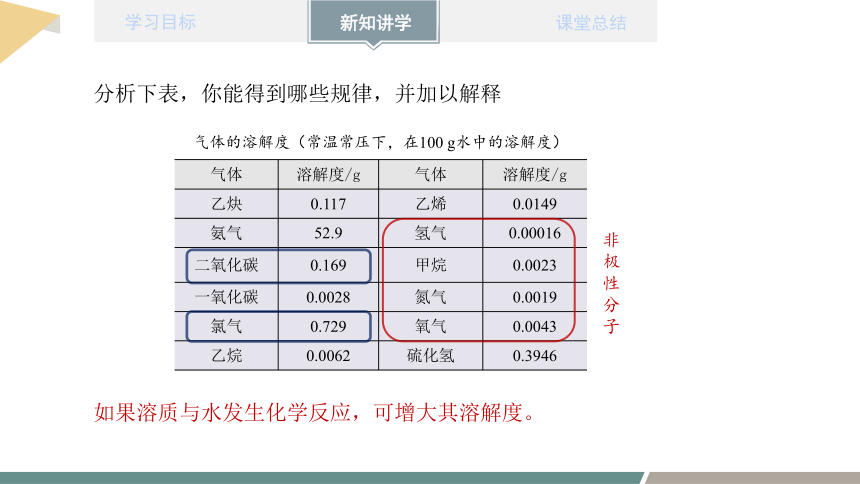
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
如果溶质与水发生化学反应,可增大其溶解度。
分析下表,你能得到哪些规律,并加以解释
非
极
性
分
子
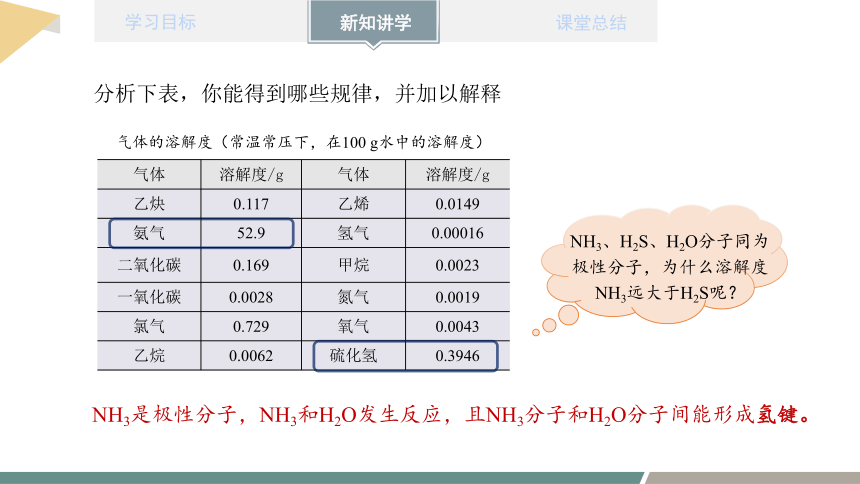
NH3是极性分子,NH3和H2O发生反应,且NH3分子和H2O分子间能形成氢键。
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
分析下表,你能得到哪些规律,并加以解释
NH3、H2S、H2O分子同为
极性分子,为什么溶解度NH3远大于H2S呢?
水和甲醇的相互溶解
(虚线表示氢键)
3.氢键:
若溶剂与溶质分子之间可以形成氢键,则溶解性好;若溶质分子不能与水分子形成氢键,在水中溶解度就相对较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为这些物质的分子与水分子之间能够形成氢键。
此外,“相似相溶”还适用于分子结构的相似性。
名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
某些物质在293 K,100 g水中的溶解度
例如:乙醇的化学式为CH3CH2OH,其中的—OH与水分子的—OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的—OH跟水分子的—OH的相似因素小得多了,因而它在水中的溶解度明显减小。
4.分子结构的相似性:
Ⅰ.比较NH3与CH4在水中的溶解度,怎样用相似相溶规律理解它们溶解度不同?
Ⅱ.为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?
油漆是非极性分子,有机溶剂如乙酸乙酯也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规则,应当用有机溶剂溶解油漆而不能用水溶解油漆。
思考与讨论
极性分子:NH3 、H2O
非极性分子:CH4
相似相溶
NH3 易溶于水
CH4 难溶于水
NH3 与水分子之间还可以形成氢键,使 NH3 更易溶于水。
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
科学·技术·社会
表面活性剂与细胞膜
有一大类称为表面活性剂的有机分子,分子的一端有极性,称为亲水基团,分子的另一端没有或者几乎没有极性,称为疏水基团,如烷基磺酸根离子。
烷基磺酸根离子
胶束
[思考]为什么肥皂和洗涤剂分子被称为表面活性剂呢?
空气
单分子层
表面活性剂在水的表面形成的单分子层
这些分子之所以称为表面活性剂,是由于它们会分散在水的液体表面形成一层疏水基团朝向空气的单分子层,又称单分子膜,从而大大降低水的表面张力。
细胞和细胞器的双分子膜
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性,另一端无极性)组装而成的。
[思考]为什么双分子膜以头向外而尾向内的方式排列?
细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
二、分子的手性
试一试:是否叠合?
两个分子互为镜像,不能相互叠合
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体。
1.手性异构体:
2.手性分子:
有手性异构体的分子。
[活动]搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,
并思考二者是否是同种分子?
CH2ClBr
绕轴旋转
能叠合
互为镜像关系的分子能叠合,是同种分子。
[活动]搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,
并思考二者是否是同种分子?
CHFClBr
互为镜像关系的分子不能叠合,不是同种分子
绕轴旋转
不能叠合
3.手性分子形成的条件:
同一个碳原子上连有四个不同的原子(基团)
互为镜像的分子在三维空间里不能叠合
互为手性异构体
4.手性分子的应用:
(1) 合成手性药物
手性分子在生命科学和药物生产方面有广泛的应用。现今使用的药物中手性药物超过50%。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。开发和服用有效的单一手性的药物不仅可以排除由于无效(或不良)手性异构体所引起的毒副作用,还能减少用药剂量和人体对无效手性异构体的代谢负担,提高药物的专一性,因而具有十分广阔的市场前景和巨大的经济价值。
(2) 合成手性催化剂
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到或者主要得到一种手性分子,这种独特的合成方法称为手性合成。手性催化剂只催化或者主要催化一种手性分子的合成,可以比喻成握手——手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握手。
催化剂
催化剂
不与催化剂手
性匹配的对映体
合成的对映体
巴斯德与手性
科学史话
2003年夏,全球化学家投票评选了化学史上十项最美的实验。1848年,法国科学家巴斯德(L·Pasteur,1822—1895)用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首。
一对手性酒石酸盐晶体
巴斯德发现,实验室合成的酒石酸盐与得自葡萄酒的酒石酸盐不同,无光学活性,是因为合成的酒石酸盐有两种光学上不对称的晶体。他通过实验把这两种不对称晶体分离,并证实他们都有光学活性。于是他假设,生物机体只能生产具有特定取向的分子,而这样的分子总是有光学活性的。为验证他的假设,巴斯德使合成酒石酸盐的溶液沾染霉菌,结果发现溶液渐渐提高光学活性,由此他得出结论:霉菌只利用两种品体之一。巴斯德的这个实验开启了化学成为生命科学基础的大门,意义重大。
1.已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关于 O3 和 O2 在水中的溶解度叙述正确的是( )
A. O3 在水中的溶解度和 O2 一样 B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大 D. 无法比较
C
注:由于臭氧的极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度。
[练一练]
2.下列各项比较中前者高于(或大于或强于)后者的是( )
A.CCl4和SiCl4的熔点
B.对羟基苯甲醛( )和邻羟基苯甲醛( )的沸点
C.I2在水中的溶解度和I2在CCl4溶液中的溶解度
D.NH3和HF的沸点
B
3.下列对分子性质的解释中,不正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.SO2易溶于水只是因为相似相溶原理
D
碳原子结合的四个原子或原子团各不相同
4.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。则下列可作为溶解Ni(CO)4的溶剂是( )
A.水 B.四氯化碳 C.盐酸 D.氯化钠溶液
B
5.下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH C.CH3CHOHCOOH
D.CH3COCH2CH3
D
溶解度
分子的手性
手性异构体
手性分子
手性碳原子
手性分子的应用
温度、压强
相似相溶
氢键
分子结构的相似性
发生化学反应反应
第二章 分子结构与性质
第三节 分子结构与物质的性质 课时3
1.理解影响物质溶解度的因素,会判断不同物质溶解度差异
的原因;
2.初步认识分子的手性,了解手性分子在药物研究中的应用。
水是一种常见的溶剂
物质在水中的溶解性与哪些因素有关?
温度,压强
思考与讨论
[实验现象]
实验结论:I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
[分析]分析下列哪些是极性分子,哪些是非极性分子?
H2O CCl4 I2
H2O为极性分子,CCl4、I2 为非极性分子。
为什么碘在四氯化碳中的溶解度大于其在水中的溶解度?
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。如蔗糖和氨易溶于水,难溶于CCl4。萘和碘易溶于CCl4,难溶于水。
已知:
I2 + I- I3-
实验结论:KI3 易溶于水,碘单质参与发生反应 。
一、溶解性
1.“相似相溶”规律
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
加入 KI
振荡
溶液
紫红色变浅
如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2.发生化学反应:
分析下表,你能得到哪些规律,并加以解释
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
非
极
性
分
子
水是极性溶剂,根据“相似相溶”,非极性溶质在水中的溶解度不大。
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
如果溶质与水发生化学反应,可增大其溶解度。
分析下表,你能得到哪些规律,并加以解释
非
极
性
分
子
NH3是极性分子,NH3和H2O发生反应,且NH3分子和H2O分子间能形成氢键。
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
分析下表,你能得到哪些规律,并加以解释
NH3、H2S、H2O分子同为
极性分子,为什么溶解度NH3远大于H2S呢?
水和甲醇的相互溶解
(虚线表示氢键)
3.氢键:
若溶剂与溶质分子之间可以形成氢键,则溶解性好;若溶质分子不能与水分子形成氢键,在水中溶解度就相对较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为这些物质的分子与水分子之间能够形成氢键。
此外,“相似相溶”还适用于分子结构的相似性。
名称 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
某些物质在293 K,100 g水中的溶解度
例如:乙醇的化学式为CH3CH2OH,其中的—OH与水分子的—OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的—OH跟水分子的—OH的相似因素小得多了,因而它在水中的溶解度明显减小。
4.分子结构的相似性:
Ⅰ.比较NH3与CH4在水中的溶解度,怎样用相似相溶规律理解它们溶解度不同?
Ⅱ.为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?
油漆是非极性分子,有机溶剂如乙酸乙酯也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规则,应当用有机溶剂溶解油漆而不能用水溶解油漆。
思考与讨论
极性分子:NH3 、H2O
非极性分子:CH4
相似相溶
NH3 易溶于水
CH4 难溶于水
NH3 与水分子之间还可以形成氢键,使 NH3 更易溶于水。
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
科学·技术·社会
表面活性剂与细胞膜
有一大类称为表面活性剂的有机分子,分子的一端有极性,称为亲水基团,分子的另一端没有或者几乎没有极性,称为疏水基团,如烷基磺酸根离子。
烷基磺酸根离子
胶束
[思考]为什么肥皂和洗涤剂分子被称为表面活性剂呢?
空气
单分子层
表面活性剂在水的表面形成的单分子层
这些分子之所以称为表面活性剂,是由于它们会分散在水的液体表面形成一层疏水基团朝向空气的单分子层,又称单分子膜,从而大大降低水的表面张力。
细胞和细胞器的双分子膜
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端有极性,另一端无极性)组装而成的。
[思考]为什么双分子膜以头向外而尾向内的方式排列?
细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
二、分子的手性
试一试:是否叠合?
两个分子互为镜像,不能相互叠合
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体。
1.手性异构体:
2.手性分子:
有手性异构体的分子。
[活动]搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,
并思考二者是否是同种分子?
CH2ClBr
绕轴旋转
能叠合
互为镜像关系的分子能叠合,是同种分子。
[活动]搭建CH2ClBr和CHFClBr的分子模型,并制作其镜像分子模型,
并思考二者是否是同种分子?
CHFClBr
互为镜像关系的分子不能叠合,不是同种分子
绕轴旋转
不能叠合
3.手性分子形成的条件:
同一个碳原子上连有四个不同的原子(基团)
互为镜像的分子在三维空间里不能叠合
互为手性异构体
4.手性分子的应用:
(1) 合成手性药物
手性分子在生命科学和药物生产方面有广泛的应用。现今使用的药物中手性药物超过50%。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。开发和服用有效的单一手性的药物不仅可以排除由于无效(或不良)手性异构体所引起的毒副作用,还能减少用药剂量和人体对无效手性异构体的代谢负担,提高药物的专一性,因而具有十分广阔的市场前景和巨大的经济价值。
(2) 合成手性催化剂
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到或者主要得到一种手性分子,这种独特的合成方法称为手性合成。手性催化剂只催化或者主要催化一种手性分子的合成,可以比喻成握手——手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握手。
催化剂
催化剂
不与催化剂手
性匹配的对映体
合成的对映体
巴斯德与手性
科学史话
2003年夏,全球化学家投票评选了化学史上十项最美的实验。1848年,法国科学家巴斯德(L·Pasteur,1822—1895)用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首。
一对手性酒石酸盐晶体
巴斯德发现,实验室合成的酒石酸盐与得自葡萄酒的酒石酸盐不同,无光学活性,是因为合成的酒石酸盐有两种光学上不对称的晶体。他通过实验把这两种不对称晶体分离,并证实他们都有光学活性。于是他假设,生物机体只能生产具有特定取向的分子,而这样的分子总是有光学活性的。为验证他的假设,巴斯德使合成酒石酸盐的溶液沾染霉菌,结果发现溶液渐渐提高光学活性,由此他得出结论:霉菌只利用两种品体之一。巴斯德的这个实验开启了化学成为生命科学基础的大门,意义重大。
1.已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关于 O3 和 O2 在水中的溶解度叙述正确的是( )
A. O3 在水中的溶解度和 O2 一样 B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大 D. 无法比较
C
注:由于臭氧的极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度。
[练一练]
2.下列各项比较中前者高于(或大于或强于)后者的是( )
A.CCl4和SiCl4的熔点
B.对羟基苯甲醛( )和邻羟基苯甲醛( )的沸点
C.I2在水中的溶解度和I2在CCl4溶液中的溶解度
D.NH3和HF的沸点
B
3.下列对分子性质的解释中,不正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.SO2易溶于水只是因为相似相溶原理
D
碳原子结合的四个原子或原子团各不相同
4.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。则下列可作为溶解Ni(CO)4的溶剂是( )
A.水 B.四氯化碳 C.盐酸 D.氯化钠溶液
B
5.下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH C.CH3CHOHCOOH
D.CH3COCH2CH3
D
溶解度
分子的手性
手性异构体
手性分子
手性碳原子
手性分子的应用
温度、压强
相似相溶
氢键
分子结构的相似性
发生化学反应反应
