3.2 课时2 共价晶体 课件 (共23张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2 课时2 共价晶体 课件 (共23张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 12:16:27 | ||
图片预览







文档简介
(共23张PPT)
第三章 晶体的结构与性质
第二节 分子晶体与共价晶体 课时2
1.知道共价晶体的结构特点,认识金刚石晶体中碳原子的三维骨架结构;
2.能借助共价晶体模型说明共价晶体中粒子间的相互作用。
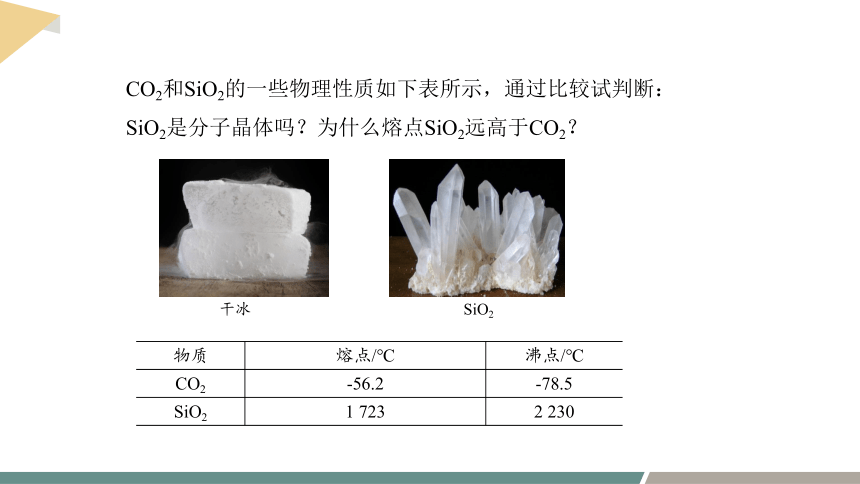
干冰
SiO2
物质 熔点/℃ 沸点/℃
CO2 -56.2 -78.5
SiO2 1 723 2 230
CO2和SiO2的一些物理性质如下表所示,通过比较试判断:
SiO2是分子晶体吗?为什么熔点SiO2远高于CO2?
一、共价晶体
1.概念:所有原子都以共价键相互结合形成三维的立体网状结构的晶体。
原子
共价键
共价晶体
构成微粒
微粒间作用力
2.常见的共价晶体
(1)硼(B)、金刚石(C)、硅(Si)、锗(Ge)和灰锡(Sn)等
(2)碳化硅(SiC)、氮化硅(Si3N4)、二氧化硅(SiO2)和刚玉(Al2O3)等
非密堆积
Ⅱ.“具有共价键的晶体叫做共价晶体”,这种说法对吗?为什么?
不一定。晶体He 、Ne 、Ar 、Kr等是分子晶体。
不正确。分子晶体如干冰CO2、冰等分子内可能含有共价键。
Ⅰ.只由原子形成的晶体一定是共价晶体吗?
思考与讨论
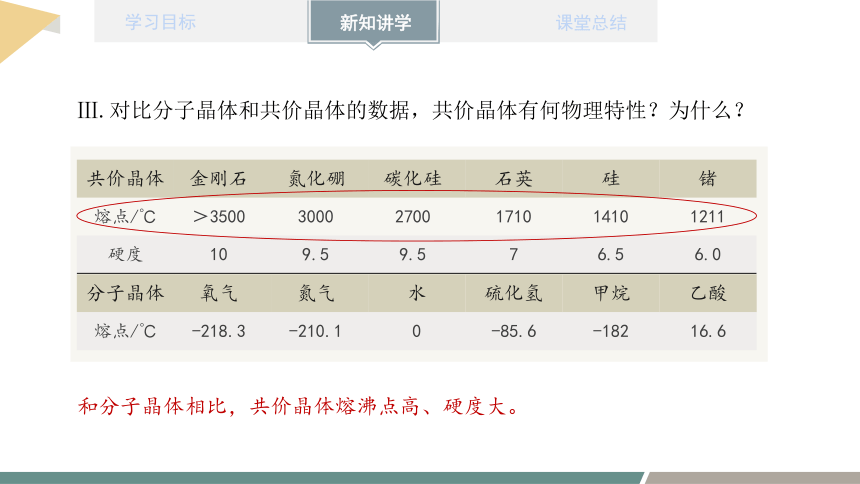
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3500 3000 2700 1710 1410 1211
硬度 10 9.5 9.5 7 6.5 6.0
Ⅲ.对比分子晶体和共价晶体的数据,共价晶体有何物理特性?为什么?
分子晶体 氧气 氮气 水 硫化氢 甲烷 乙酸
熔点/℃ -218.3 -210.1 0 -85.6 -182 16.6
和分子晶体相比,共价晶体熔沸点高、硬度大。
3.共价晶体的物理性质
(1)熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
提示:金刚石、硅和锗均为共价晶体。键长:碳碳键<硅硅键<锗锗键
思考与讨论
Si3N4航天耐高温材料
(2)硬度很大
单晶硅
金刚石
SiO2
刚玉
(4)难溶于一般溶剂
(3)一般不导电,但晶体硅是半导体
碳化硅(SiC)砂轮
二、典型共价晶体
1.金刚石
图3-21 金刚石的多面体外形、晶体结构示意图
109°28
[思考]金刚石中,每个碳原子与多少个碳原子成键?
碳原子采取什么杂化方式?
每个碳原子都采取sp3杂化,以共价键跟4个碳原子结合,形成正四面体。
二、典型共价晶体
1.金刚石
图3-21 金刚石的多面体外形、晶体结构示意图
109°28
[思考]最小的碳环由几个碳组成?
最小的碳环由6个碳组成,且不在同一平面内。
二、典型共价晶体
1.金刚石
金刚石的多面体外形、晶体结构示意图
109°28
[思考]1mol金刚石中含有多少mol碳碳键?
每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子
与C—C键数之比为:1:(4 × )= 1:2,故1mol金刚石中含有2mol碳碳键。
[思考]一个金刚石晶胞中,含有几个碳原子?
顶点:8× =1
面心:6× =3
8
1
2
1
1+3+4=8
体内:4
金刚石的晶胞示意图
顶点
体内
面心
[思考]二氧化硅晶体结构与金刚石晶体结构有什么相同点和不同点?
2.二氧化硅
把金刚石晶体中的碳原子换为硅原子,每两个硅原子之间增加一个氧原子,即形成SiO2的晶体结构。
(1)每个Si原子都采取 杂化,正四面体内O—Si—O键角为 。
(2)最小的碳环是由 个Si原子和 个O原子组成的 元环。
(3)1mol SiO2中含 Si—O键
2.二氧化硅
[思考]SiO2是二氧化硅的分子式吗?
二氧化硅为共价晶体,晶体中不存在单个分子,
其化学式为Si与O的最简个数比,而不是分子式。
sp3
109°28′
6
6
12
4mol
石英的左、右型晶体
二氧化硅晶体中硅氧四面体螺旋结构
石英表
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
制造:水泥、玻璃、人造宝石、单晶硅、硅光电池、芯片、光导纤维
晶体类型 共价晶体 分子晶体
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
三、共价晶体和分子晶体的比较
[思考]比较SiO2、CO2、H2O的熔点,并总结比较物质的熔点的方法。
熔点:SiO2 > H2O > CO2
[练一练]
1.下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
D
2.碳化硅(SiC)是一种晶体,具有类似于金刚石的结构,其中C原子和Si原子的位置是交替排列的。有下列三种晶体:①金刚石 ②晶体硅 ③碳化硅,它们的熔点从高到低的顺序是( )
A.①③② B.②③① C.③①② D.②①③
A
解析:C与Si同为第ⅣA族元素,三种晶体的相似性表现在金刚石是共价晶体,晶体硅、碳化硅也是共价晶体。根据硅的原子半径比碳大,可知Si—Si键的键能比C—C键小,而C—Si键键能应在二者之间,三种共价晶体空间结构相似,熔点取决于它们的键长与键能大小,故熔点从高到低分别是金刚石、碳化硅、晶体硅,正确答案为A。
3.有下列物质:①水晶 ②冰醋酸 ③氧化钙 ④白磷 ⑤晶体氩 ⑥氢氧化钠 ⑦铝 ⑧金刚石 ⑨过氧化钠 ⑩碳化钙 碳化硅 干冰 过氧化氢。根据要求填空:
(1)属于共价晶体的化合物是________(填序号,下同)。
(2)直接由原子构成的晶体是________。
(3)直接由原子构成的分子晶体是________。
(4)由极性分子构成的晶体是________,属于分子晶体的单质是________。
①
①⑤⑧
②
⑤
④⑤
4.硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。
根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为 。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si—Si键之间的夹角大小为 。
1s22s22p63s23p2
109°28'
(3)根据下表中三种物质(晶体)的熔点,简要解释熔点产生差异的原因:
①SiO2 SiCl4: 。
②SiCl4 SiF4: 。
物质 SiO2 SiCl4 SiF4
熔点/℃ 1 710 -70.4 -90.2
SiO2是共价晶体,微粒间作用力为共价键;SiCl4是分子晶体,分子间作用力为范德华力
SiCl4和SiF4均为分子晶体,分子间作用力均为范德华力,相对分子质量越大,范德华力越大
>
>
共价晶体
概念
常见的共价晶体
物理性质
典型的共价晶体
熔点高
硬度大
一般不导电
难溶于一般溶剂
构成微粒
微粒间作用力
原子
共价键
金刚石
二氧化硅
第三章 晶体的结构与性质
第二节 分子晶体与共价晶体 课时2
1.知道共价晶体的结构特点,认识金刚石晶体中碳原子的三维骨架结构;
2.能借助共价晶体模型说明共价晶体中粒子间的相互作用。
干冰
SiO2
物质 熔点/℃ 沸点/℃
CO2 -56.2 -78.5
SiO2 1 723 2 230
CO2和SiO2的一些物理性质如下表所示,通过比较试判断:
SiO2是分子晶体吗?为什么熔点SiO2远高于CO2?
一、共价晶体
1.概念:所有原子都以共价键相互结合形成三维的立体网状结构的晶体。
原子
共价键
共价晶体
构成微粒
微粒间作用力
2.常见的共价晶体
(1)硼(B)、金刚石(C)、硅(Si)、锗(Ge)和灰锡(Sn)等
(2)碳化硅(SiC)、氮化硅(Si3N4)、二氧化硅(SiO2)和刚玉(Al2O3)等
非密堆积
Ⅱ.“具有共价键的晶体叫做共价晶体”,这种说法对吗?为什么?
不一定。晶体He 、Ne 、Ar 、Kr等是分子晶体。
不正确。分子晶体如干冰CO2、冰等分子内可能含有共价键。
Ⅰ.只由原子形成的晶体一定是共价晶体吗?
思考与讨论
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3500 3000 2700 1710 1410 1211
硬度 10 9.5 9.5 7 6.5 6.0
Ⅲ.对比分子晶体和共价晶体的数据,共价晶体有何物理特性?为什么?
分子晶体 氧气 氮气 水 硫化氢 甲烷 乙酸
熔点/℃ -218.3 -210.1 0 -85.6 -182 16.6
和分子晶体相比,共价晶体熔沸点高、硬度大。
3.共价晶体的物理性质
(1)熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
提示:金刚石、硅和锗均为共价晶体。键长:碳碳键<硅硅键<锗锗键
思考与讨论
Si3N4航天耐高温材料
(2)硬度很大
单晶硅
金刚石
SiO2
刚玉
(4)难溶于一般溶剂
(3)一般不导电,但晶体硅是半导体
碳化硅(SiC)砂轮
二、典型共价晶体
1.金刚石
图3-21 金刚石的多面体外形、晶体结构示意图
109°28
[思考]金刚石中,每个碳原子与多少个碳原子成键?
碳原子采取什么杂化方式?
每个碳原子都采取sp3杂化,以共价键跟4个碳原子结合,形成正四面体。
二、典型共价晶体
1.金刚石
图3-21 金刚石的多面体外形、晶体结构示意图
109°28
[思考]最小的碳环由几个碳组成?
最小的碳环由6个碳组成,且不在同一平面内。
二、典型共价晶体
1.金刚石
金刚石的多面体外形、晶体结构示意图
109°28
[思考]1mol金刚石中含有多少mol碳碳键?
每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子
与C—C键数之比为:1:(4 × )= 1:2,故1mol金刚石中含有2mol碳碳键。
[思考]一个金刚石晶胞中,含有几个碳原子?
顶点:8× =1
面心:6× =3
8
1
2
1
1+3+4=8
体内:4
金刚石的晶胞示意图
顶点
体内
面心
[思考]二氧化硅晶体结构与金刚石晶体结构有什么相同点和不同点?
2.二氧化硅
把金刚石晶体中的碳原子换为硅原子,每两个硅原子之间增加一个氧原子,即形成SiO2的晶体结构。
(1)每个Si原子都采取 杂化,正四面体内O—Si—O键角为 。
(2)最小的碳环是由 个Si原子和 个O原子组成的 元环。
(3)1mol SiO2中含 Si—O键
2.二氧化硅
[思考]SiO2是二氧化硅的分子式吗?
二氧化硅为共价晶体,晶体中不存在单个分子,
其化学式为Si与O的最简个数比,而不是分子式。
sp3
109°28′
6
6
12
4mol
石英的左、右型晶体
二氧化硅晶体中硅氧四面体螺旋结构
石英表
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
制造:水泥、玻璃、人造宝石、单晶硅、硅光电池、芯片、光导纤维
晶体类型 共价晶体 分子晶体
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
三、共价晶体和分子晶体的比较
[思考]比较SiO2、CO2、H2O的熔点,并总结比较物质的熔点的方法。
熔点:SiO2 > H2O > CO2
[练一练]
1.下列有关共价晶体的叙述错误的是( )
A.共价晶体中,只存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
D
2.碳化硅(SiC)是一种晶体,具有类似于金刚石的结构,其中C原子和Si原子的位置是交替排列的。有下列三种晶体:①金刚石 ②晶体硅 ③碳化硅,它们的熔点从高到低的顺序是( )
A.①③② B.②③① C.③①② D.②①③
A
解析:C与Si同为第ⅣA族元素,三种晶体的相似性表现在金刚石是共价晶体,晶体硅、碳化硅也是共价晶体。根据硅的原子半径比碳大,可知Si—Si键的键能比C—C键小,而C—Si键键能应在二者之间,三种共价晶体空间结构相似,熔点取决于它们的键长与键能大小,故熔点从高到低分别是金刚石、碳化硅、晶体硅,正确答案为A。
3.有下列物质:①水晶 ②冰醋酸 ③氧化钙 ④白磷 ⑤晶体氩 ⑥氢氧化钠 ⑦铝 ⑧金刚石 ⑨过氧化钠 ⑩碳化钙 碳化硅 干冰 过氧化氢。根据要求填空:
(1)属于共价晶体的化合物是________(填序号,下同)。
(2)直接由原子构成的晶体是________。
(3)直接由原子构成的分子晶体是________。
(4)由极性分子构成的晶体是________,属于分子晶体的单质是________。
①
①⑤⑧
②
⑤
④⑤
4.硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。
根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为 。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si—Si键之间的夹角大小为 。
1s22s22p63s23p2
109°28'
(3)根据下表中三种物质(晶体)的熔点,简要解释熔点产生差异的原因:
①SiO2 SiCl4: 。
②SiCl4 SiF4: 。
物质 SiO2 SiCl4 SiF4
熔点/℃ 1 710 -70.4 -90.2
SiO2是共价晶体,微粒间作用力为共价键;SiCl4是分子晶体,分子间作用力为范德华力
SiCl4和SiF4均为分子晶体,分子间作用力均为范德华力,相对分子质量越大,范德华力越大
>
>
共价晶体
概念
常见的共价晶体
物理性质
典型的共价晶体
熔点高
硬度大
一般不导电
难溶于一般溶剂
构成微粒
微粒间作用力
原子
共价键
金刚石
二氧化硅
