第二章 章末复习 课件(共29张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 章末复习 课件(共29张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 712.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 12:19:26 | ||
图片预览







文档简介
(共29张PPT)
第三章 晶体的结构与性质
章末复习
1.能说出共价键的主要类型、特征与区别;能利用键参数解释物质的某些性质。
2.能根据给定的信息分析常见简单分子的空间结构,能利用价层电子对互斥模型和杂化轨道理论预测和解释简单的共价分子的空间结构。
3.能利用电负性判断共价键的极性,能根据共价分子的结构特点说明简单分子的某些性质;能说明分子间作用力(含氢键)对物质熔点、沸点等性质的影响,能列举含有氢键的物质及其性质特点,知道氢键对于生命的重大意义。
4.能根据键的极性和分子结构特点来判断分子的极性,并据此对分子的一些典型性质及其应用做出解释。
知识点一:共价键的形成与类型
1.σ键和π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式
特点
原子轨道重叠程度
成键规律判断
沿键轴方向
(“头碰头”)重叠
沿键轴方向平行
重叠(“肩并肩”)
轴对称
镜面对称
大
小
共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个是π键
知识点二:键参数
1.键能
(1)含义:
键能是气态分子中断裂1 mol化学键解离成气态原子所吸收的能量。
(2)应用:
①定量表示化学键的强弱
②判断结构相似的分子的相对稳定性
③估算化学反应的热效应
2.键长
(1)含义:
键长是构成化学键的两个原子的核间距。
(2)与键的稳定性的关系:
一般而言,化学键的键长越短,化学键就越强,键就越牢固。
(3)与分子空间结构的关系:
键长是影响分子空间结构的因素之一。如CH3Cl分子的空间结构是四面体形而不是正四面体,原因是C—H键和C—Cl键的键长不相等。
(4)定性判断键长的方法:
①其他条件相同时,成键原子半径越小,键长越短。
②成键原子相同的共价键的键长:单键键长 > 双键键长 > 三键键长。
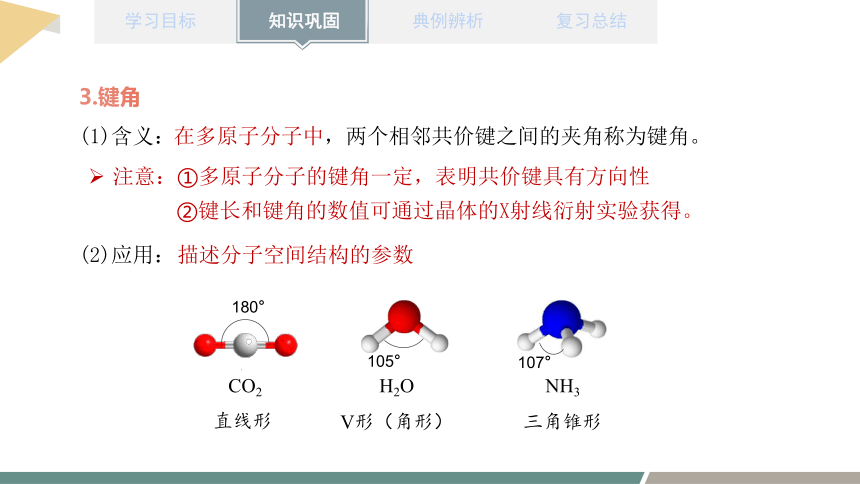
3.键角
(1)含义:
在多原子分子中,两个相邻共价键之间的夹角称为键角。
注意:①多原子分子的键角一定,表明共价键具有方向性
②键长和键角的数值可通过晶体的X射线衍射实验获得。
描述分子空间结构的参数
(2)应用:
NH3
H2O
CO2
三角锥形
V形(角形)
直线形
180°
107°
105°
知识点三:分子的空间结构
1.分子结构的测定
(1)红外光谱:
(2)质谱仪:
可以得知分子中含有何种化学键或官能团的信息。
可以测定分子的相对分子质量。
2.多样的分子空间结构
(1)三原子(AB2型)分子的空间结构:
(2)四原子(AB3型)分子的空间结构:
①直线形
②V形
①平面三角形
②三角锥形
③其他立体构型
(3)五原子(AB4型)分子的空间结构:
①正四面体形
②其他立体构型
分子空间结构与其稳定性有关。
知识点四:价层电子对互斥模型
能量最低
最稳定
价层电子对
互相排斥
尽可能远离
1.价层电子对
价层电子对数目= σ键电子对数+中心原子上的孤电子对数
(1)σ键电子对数:
可由化学式确定
(2)中心原子上的孤电子对数=
b为与中心原子结合的原子最多能接受的电子数。
x为与中心原子结合的原子数。
a——表示中心原子的价电子数
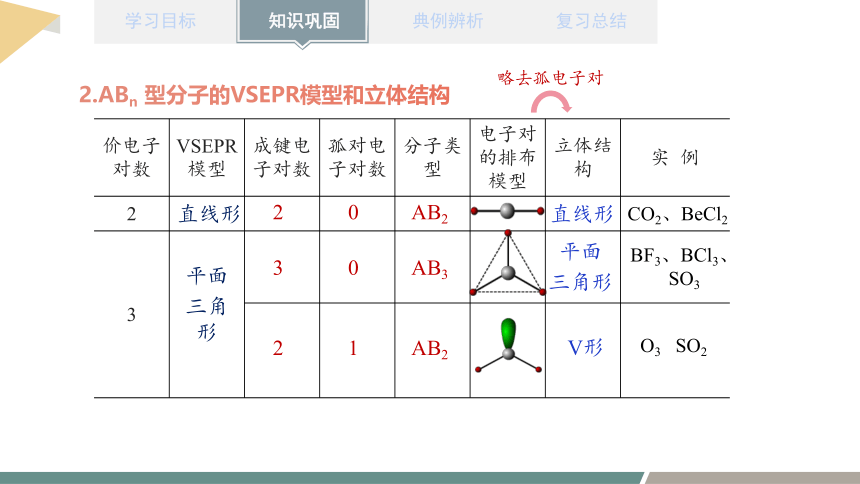
2.ABn 型分子的VSEPR模型和立体结构
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
2
3
直线形
2 0 AB2
直线形
3 0 AB3
平面
三角形
2 1 AB2
V形
O3 SO2
平面
三角形
BF3、BCl3、
SO3
CO2、BeCl2
略去孤电子对
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
4
正四面体
正四
面体
三角
锥形
V形
H2O
4 0 AB4
3 1 AB3
2 2 AB2
NH3、NF3
CH4、CCl4
2.ABn 型分子的VSEPR模型和立体结构
知识点五:杂化轨道理论
1.内容
外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
(1)定义:
(2)条件:
①只有能量相近的原子轨道才能杂化
②只有在形成分子时才能杂化,孤立的原子不可能发生杂化
(3)要点:
①杂化前后轨道总数不变,角度和形状发生变化
②杂化使原子的成键能力增加,轨道重叠程度增大,生成的分子更稳定
③杂化轨道间的夹角分布最大化
2.杂化轨道类型的判断
(1)中心原子的杂化轨道数=价层电子数=σ键电子对数+孤电子对数
中心原子的
价层电子对数
2
3
4
sp
sp2
sp3
(2)根据分子或离子中有无π键及π键数目判断
如没有π键为sp3杂化,含1个π键为sp2杂化,含2个π键为sp杂化。
③根据杂化轨道之间的夹角判断
④根据杂化轨道的立体构型判断
杂化轨道
之间的夹角
180°
120°
109°28′
sp
sp2
sp3
杂化轨道
的立体构型
直线形
平面三角形
正四面体形或三角锥形
sp
sp2
sp3
知识点六:键的极性和分子极性
共价键
分类 极性共价键 非极性共价键
成键原子
共用电子对
成键原子的电性
1.键的极性
不同元素的原子
同种元素的原子
发生偏移
不发生偏移
电负性较小的原子呈正电性(δ+),
电负性较大的原子呈负电性(δ-)
电中性
2.分子的极性
(1)非极性分子:
正电中心与负电中心重合。
(2)极性分子:
正电中心与负电中心不重合。
(3)分子极性的判断方法:
①双原子分子中分子的极性与键的极性一致。
②完全由非极性键组成的多原子分子一定是非极性分子。
③极性键构成的多原子分子是否有极性取决于化学键极性的向量和。
知识点七:分子间作用力
1.范德华力
(1)定义:是一种普遍存在于分子之间的相互作用力。一般没有饱和性和方向性。
类型 范德华力 氢键 化学键
键能或范德华力强度/kJ·mol-1 一般是2~20 一般不超过40 一般是100~600
(2)影响因素
①分子的极性会影响范德华力。
②组成结构相似的分子,相对分子质量越大,范德华力越大。
2.氢键
(1)定义:它是由已经与电负性很大的原子(如N、F、O)形成共价键的氢原子与另一分子中电负性很大的原子之间的作用力。
(2)本质:
静电作用
X—H----Y强弱与X和Y的电负性有关:电负性越大,则氢键越强。
(3)特征:
①方向性
②饱和性
(4)氢键的类型:
①分子内氢键
②分子间氢键
主要影响物理性质,如熔沸点
知识点八:溶解性
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
1.“相似相溶”规律
如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2.发生化学反应:
3.氢键:
若溶剂与溶质分子之间可以形成氢键,则溶解性好。
4.分子结构的相似性
知识点九:分子的手性
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体。
1.手性异构体:
2.手性分子:
有手性异构体的分子。
3.手性分子的应用:
(1) 合成手性药物
(2) 合成手性催化剂
【考点一】共价键类型的判断
1.下列分子中,既含有σ键,又含有π键的是( )
A.CH4 B.HCl C.H2O D.C2H4
D
2.下列说法错误的是( )
A.s﹣sσ键与p﹣pσ键的电子云图象都呈轴对称
B.s轨道与s轨道不能形成π键,p轨道与p轨道能形成π键
C.1,3﹣丁二烯(CH2=CH﹣CH=CH2)分子中含有7个σ键2个π
D.乙烯与乙烷化学性质不同,主要是因为乙烯中的π键不如σ键牢固
C
【考点二】键参数及其应用
1.下列各项比较中不正确的是( )
A.H﹣N﹣H键角:>NH3
B.H﹣O键极性:CF3COOH>CCl3COOH
C.25℃时的Ka:苯酚<乙醇
D.沸点: <
C
2.下列说法不正确的是( )
A.稀有气体一般难于发生化学反应,是因为分子中键能较大
B.已知石墨转化为金刚石要吸热,则等量的石墨与金刚石相比总键能大
C.HF、HCl、HBr、HI的热稳定性依次减弱,与共价键的键能大小有关
D.共价键的键能越大,键长越短
方法归纳
A
(1)一般的,共价键的键长越短,键能越大,共价键越稳定,含该共价键的分子越稳定,化学性质越不活泼。
(2)键长和键角常被用来描述分子的空间结构。
(3)键长和键能是衡量共价键强弱的物理量。
【考点三】判断简单分子或离子的构型
1.下列微粒的空间构型是平面三角形的是( )
A.NH3 B.CO2 C.SO3 D.CH4
2.下列说法不正确的是( )
A.H2O比H2S的沸点高,是由于H2O分子间存在氢键
B.的 VSEPR的模型与其离子空间构型是一致的
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.的 VSEPR的模型是正四面体形,因此H2SO4分子是非极性分子
D
C
【考点四】原子轨道杂化方式判断
1.磷酸亚铁锂(LiFePO4)可作锂离子电池的正极材料。工业上以FeCl3、NH4H2PO4、LiCl和苯胺( )等为原料制备磷酸亚铁锂。下列说法错误的是( )
A.苯胺中氮原子的杂化方式是sp3
B.和的空间结构相同
C.1mol苯胺分子中含有9molσ键
D.LiCl、苯胺和甲苯的熔点由高到低的顺序是LiCl>苯胺>甲苯
2.甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛、甲醇分子内C原子的杂化方式分别为( )
A.sp2、sp2 B.sp3、sp2 C.sp2、sp3 D.sp、sp3
C
C
【考点五】键的极性和分子的极性
1.下列氢化物分子内共价键的极性由强到弱的顺序正确的是( )
A.HF、H2O、CH4 B.H2O、CH4、HF
C.CH4、HF、H2O D.CH4、H2O、HF
2.下列各组物质中,属于由极性键构成的极性分子的是( )
A.CH4和Br2 B.NH3和H2S
C.BF3和CO2 D.BeCl2和HCl
A
B
【考点六】相似相溶原理及其应用
1.下列对分子性质的解释中,不正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.SO2易溶于水只是因为相似相溶原理
2.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。则下列可作为溶解Ni(CO)4的溶剂是( )
A.水 B.四氯化碳 C.盐酸 D.氯化钠溶液
D
B
【考点七】分子间作用力
1.以下关于分子间作用力的叙述不正确的是( )
A.分子间作用力是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对分子晶体的熔、沸点有影响
D.稀有气体分子间存在分子间作用力
2.下列五种烷烃:①2﹣甲基丁烷 ②2,2﹣二甲基丙烷 ③戊烷 ④丙烷 ⑤丁烷,它们的沸点由高到低的顺序排列正确的是( )
A.①②③④⑤ B.②③⑤④① C.④⑤②①③ D.③①②⑤④
D
A
【考点八】氢键的存在对物质性质的影响
1.下列说法正确的是( )
A.CH3CH3的熔、沸点低于CH3(CH2)2CH3,是由于CH3(CH2)2CH3中氢键数目更多
B.液态氟化氢中氟化氢分子之间形成氢键,可写为(HF)n,则NO2分子间也是因氢键而聚合形成N2O4
C.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
D.H2O的沸点比HF高,是由于单位物质的量的水分子形成的氢键数目多
2.下列描述与氢键无关的是( )
A.冰会浮在水面上 B.DNA呈双螺旋结构
C.氨气极易溶于水 D.沸点:SiH4>CH4
D
D
分子结构与性质
分子结构
分子性质
共价键
分子的空间结构
键和π键
键参数
键能
键长
键角
价层电子对互斥模型
杂化轨道理论
共价键的极性
分子间作用力
分子的手性
分子的极性
键的极性对化学性质的影响
范德华力及其对物质性质的影响
氢键及其对物质性质的影响
溶解性
第三章 晶体的结构与性质
章末复习
1.能说出共价键的主要类型、特征与区别;能利用键参数解释物质的某些性质。
2.能根据给定的信息分析常见简单分子的空间结构,能利用价层电子对互斥模型和杂化轨道理论预测和解释简单的共价分子的空间结构。
3.能利用电负性判断共价键的极性,能根据共价分子的结构特点说明简单分子的某些性质;能说明分子间作用力(含氢键)对物质熔点、沸点等性质的影响,能列举含有氢键的物质及其性质特点,知道氢键对于生命的重大意义。
4.能根据键的极性和分子结构特点来判断分子的极性,并据此对分子的一些典型性质及其应用做出解释。
知识点一:共价键的形成与类型
1.σ键和π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式
特点
原子轨道重叠程度
成键规律判断
沿键轴方向
(“头碰头”)重叠
沿键轴方向平行
重叠(“肩并肩”)
轴对称
镜面对称
大
小
共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个是π键
知识点二:键参数
1.键能
(1)含义:
键能是气态分子中断裂1 mol化学键解离成气态原子所吸收的能量。
(2)应用:
①定量表示化学键的强弱
②判断结构相似的分子的相对稳定性
③估算化学反应的热效应
2.键长
(1)含义:
键长是构成化学键的两个原子的核间距。
(2)与键的稳定性的关系:
一般而言,化学键的键长越短,化学键就越强,键就越牢固。
(3)与分子空间结构的关系:
键长是影响分子空间结构的因素之一。如CH3Cl分子的空间结构是四面体形而不是正四面体,原因是C—H键和C—Cl键的键长不相等。
(4)定性判断键长的方法:
①其他条件相同时,成键原子半径越小,键长越短。
②成键原子相同的共价键的键长:单键键长 > 双键键长 > 三键键长。
3.键角
(1)含义:
在多原子分子中,两个相邻共价键之间的夹角称为键角。
注意:①多原子分子的键角一定,表明共价键具有方向性
②键长和键角的数值可通过晶体的X射线衍射实验获得。
描述分子空间结构的参数
(2)应用:
NH3
H2O
CO2
三角锥形
V形(角形)
直线形
180°
107°
105°
知识点三:分子的空间结构
1.分子结构的测定
(1)红外光谱:
(2)质谱仪:
可以得知分子中含有何种化学键或官能团的信息。
可以测定分子的相对分子质量。
2.多样的分子空间结构
(1)三原子(AB2型)分子的空间结构:
(2)四原子(AB3型)分子的空间结构:
①直线形
②V形
①平面三角形
②三角锥形
③其他立体构型
(3)五原子(AB4型)分子的空间结构:
①正四面体形
②其他立体构型
分子空间结构与其稳定性有关。
知识点四:价层电子对互斥模型
能量最低
最稳定
价层电子对
互相排斥
尽可能远离
1.价层电子对
价层电子对数目= σ键电子对数+中心原子上的孤电子对数
(1)σ键电子对数:
可由化学式确定
(2)中心原子上的孤电子对数=
b为与中心原子结合的原子最多能接受的电子数。
x为与中心原子结合的原子数。
a——表示中心原子的价电子数
2.ABn 型分子的VSEPR模型和立体结构
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
2
3
直线形
2 0 AB2
直线形
3 0 AB3
平面
三角形
2 1 AB2
V形
O3 SO2
平面
三角形
BF3、BCl3、
SO3
CO2、BeCl2
略去孤电子对
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
4
正四面体
正四
面体
三角
锥形
V形
H2O
4 0 AB4
3 1 AB3
2 2 AB2
NH3、NF3
CH4、CCl4
2.ABn 型分子的VSEPR模型和立体结构
知识点五:杂化轨道理论
1.内容
外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
(1)定义:
(2)条件:
①只有能量相近的原子轨道才能杂化
②只有在形成分子时才能杂化,孤立的原子不可能发生杂化
(3)要点:
①杂化前后轨道总数不变,角度和形状发生变化
②杂化使原子的成键能力增加,轨道重叠程度增大,生成的分子更稳定
③杂化轨道间的夹角分布最大化
2.杂化轨道类型的判断
(1)中心原子的杂化轨道数=价层电子数=σ键电子对数+孤电子对数
中心原子的
价层电子对数
2
3
4
sp
sp2
sp3
(2)根据分子或离子中有无π键及π键数目判断
如没有π键为sp3杂化,含1个π键为sp2杂化,含2个π键为sp杂化。
③根据杂化轨道之间的夹角判断
④根据杂化轨道的立体构型判断
杂化轨道
之间的夹角
180°
120°
109°28′
sp
sp2
sp3
杂化轨道
的立体构型
直线形
平面三角形
正四面体形或三角锥形
sp
sp2
sp3
知识点六:键的极性和分子极性
共价键
分类 极性共价键 非极性共价键
成键原子
共用电子对
成键原子的电性
1.键的极性
不同元素的原子
同种元素的原子
发生偏移
不发生偏移
电负性较小的原子呈正电性(δ+),
电负性较大的原子呈负电性(δ-)
电中性
2.分子的极性
(1)非极性分子:
正电中心与负电中心重合。
(2)极性分子:
正电中心与负电中心不重合。
(3)分子极性的判断方法:
①双原子分子中分子的极性与键的极性一致。
②完全由非极性键组成的多原子分子一定是非极性分子。
③极性键构成的多原子分子是否有极性取决于化学键极性的向量和。
知识点七:分子间作用力
1.范德华力
(1)定义:是一种普遍存在于分子之间的相互作用力。一般没有饱和性和方向性。
类型 范德华力 氢键 化学键
键能或范德华力强度/kJ·mol-1 一般是2~20 一般不超过40 一般是100~600
(2)影响因素
①分子的极性会影响范德华力。
②组成结构相似的分子,相对分子质量越大,范德华力越大。
2.氢键
(1)定义:它是由已经与电负性很大的原子(如N、F、O)形成共价键的氢原子与另一分子中电负性很大的原子之间的作用力。
(2)本质:
静电作用
X—H----Y强弱与X和Y的电负性有关:电负性越大,则氢键越强。
(3)特征:
①方向性
②饱和性
(4)氢键的类型:
①分子内氢键
②分子间氢键
主要影响物理性质,如熔沸点
知识点八:溶解性
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
1.“相似相溶”规律
如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2.发生化学反应:
3.氢键:
若溶剂与溶质分子之间可以形成氢键,则溶解性好。
4.分子结构的相似性
知识点九:分子的手性
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体。
1.手性异构体:
2.手性分子:
有手性异构体的分子。
3.手性分子的应用:
(1) 合成手性药物
(2) 合成手性催化剂
【考点一】共价键类型的判断
1.下列分子中,既含有σ键,又含有π键的是( )
A.CH4 B.HCl C.H2O D.C2H4
D
2.下列说法错误的是( )
A.s﹣sσ键与p﹣pσ键的电子云图象都呈轴对称
B.s轨道与s轨道不能形成π键,p轨道与p轨道能形成π键
C.1,3﹣丁二烯(CH2=CH﹣CH=CH2)分子中含有7个σ键2个π
D.乙烯与乙烷化学性质不同,主要是因为乙烯中的π键不如σ键牢固
C
【考点二】键参数及其应用
1.下列各项比较中不正确的是( )
A.H﹣N﹣H键角:>NH3
B.H﹣O键极性:CF3COOH>CCl3COOH
C.25℃时的Ka:苯酚<乙醇
D.沸点: <
C
2.下列说法不正确的是( )
A.稀有气体一般难于发生化学反应,是因为分子中键能较大
B.已知石墨转化为金刚石要吸热,则等量的石墨与金刚石相比总键能大
C.HF、HCl、HBr、HI的热稳定性依次减弱,与共价键的键能大小有关
D.共价键的键能越大,键长越短
方法归纳
A
(1)一般的,共价键的键长越短,键能越大,共价键越稳定,含该共价键的分子越稳定,化学性质越不活泼。
(2)键长和键角常被用来描述分子的空间结构。
(3)键长和键能是衡量共价键强弱的物理量。
【考点三】判断简单分子或离子的构型
1.下列微粒的空间构型是平面三角形的是( )
A.NH3 B.CO2 C.SO3 D.CH4
2.下列说法不正确的是( )
A.H2O比H2S的沸点高,是由于H2O分子间存在氢键
B.的 VSEPR的模型与其离子空间构型是一致的
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.的 VSEPR的模型是正四面体形,因此H2SO4分子是非极性分子
D
C
【考点四】原子轨道杂化方式判断
1.磷酸亚铁锂(LiFePO4)可作锂离子电池的正极材料。工业上以FeCl3、NH4H2PO4、LiCl和苯胺( )等为原料制备磷酸亚铁锂。下列说法错误的是( )
A.苯胺中氮原子的杂化方式是sp3
B.和的空间结构相同
C.1mol苯胺分子中含有9molσ键
D.LiCl、苯胺和甲苯的熔点由高到低的顺序是LiCl>苯胺>甲苯
2.甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛、甲醇分子内C原子的杂化方式分别为( )
A.sp2、sp2 B.sp3、sp2 C.sp2、sp3 D.sp、sp3
C
C
【考点五】键的极性和分子的极性
1.下列氢化物分子内共价键的极性由强到弱的顺序正确的是( )
A.HF、H2O、CH4 B.H2O、CH4、HF
C.CH4、HF、H2O D.CH4、H2O、HF
2.下列各组物质中,属于由极性键构成的极性分子的是( )
A.CH4和Br2 B.NH3和H2S
C.BF3和CO2 D.BeCl2和HCl
A
B
【考点六】相似相溶原理及其应用
1.下列对分子性质的解释中,不正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.SO2易溶于水只是因为相似相溶原理
2.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。则下列可作为溶解Ni(CO)4的溶剂是( )
A.水 B.四氯化碳 C.盐酸 D.氯化钠溶液
D
B
【考点七】分子间作用力
1.以下关于分子间作用力的叙述不正确的是( )
A.分子间作用力是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对分子晶体的熔、沸点有影响
D.稀有气体分子间存在分子间作用力
2.下列五种烷烃:①2﹣甲基丁烷 ②2,2﹣二甲基丙烷 ③戊烷 ④丙烷 ⑤丁烷,它们的沸点由高到低的顺序排列正确的是( )
A.①②③④⑤ B.②③⑤④① C.④⑤②①③ D.③①②⑤④
D
A
【考点八】氢键的存在对物质性质的影响
1.下列说法正确的是( )
A.CH3CH3的熔、沸点低于CH3(CH2)2CH3,是由于CH3(CH2)2CH3中氢键数目更多
B.液态氟化氢中氟化氢分子之间形成氢键,可写为(HF)n,则NO2分子间也是因氢键而聚合形成N2O4
C.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
D.H2O的沸点比HF高,是由于单位物质的量的水分子形成的氢键数目多
2.下列描述与氢键无关的是( )
A.冰会浮在水面上 B.DNA呈双螺旋结构
C.氨气极易溶于水 D.沸点:SiH4>CH4
D
D
分子结构与性质
分子结构
分子性质
共价键
分子的空间结构
键和π键
键参数
键能
键长
键角
价层电子对互斥模型
杂化轨道理论
共价键的极性
分子间作用力
分子的手性
分子的极性
键的极性对化学性质的影响
范德华力及其对物质性质的影响
氢键及其对物质性质的影响
溶解性
