第三章 章末复习 课件(共26张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章 章末复习 课件(共26张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 719.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 12:19:46 | ||
图片预览







文档简介
(共26张PPT)
第三章 晶体的结构与性质
章末复习
1.回顾本单元的文本及教材,熟悉本单元的知识及逻辑结构。
2.能区别晶体与非晶体,计算晶胞中所含的粒子数;
2.能借助分子晶体、共价晶体、离子晶体、金属晶体等模型说明晶体中的粒
子及其粒子间的相互作用;
3.能说出配位键的特征;能运用配位键解释配合物的某些典型性质;能举例
说明配合物的广泛应用;
4.能举例说明物质在原子、分子、超分子、聚集态等不同尺度上的结构特点
对物质性质的影响。
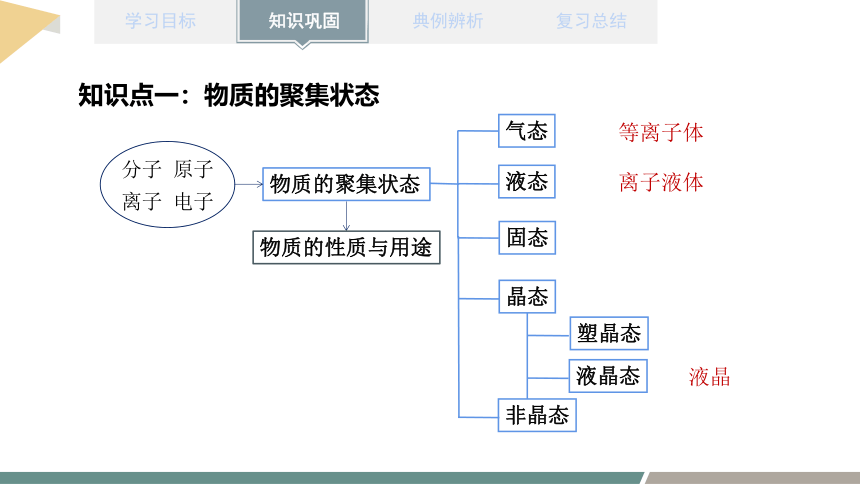
知识点一:物质的聚集状态
物质的聚集状态
气态
固态
液态
晶态
塑晶态
液晶态
非晶态
等离子体
液晶
离子液体
分子 原子
离子 电子
物质的性质与用途
1.等离子体
(1)定义:由 组成的整体上呈电中性的物质聚集体,称为等离子体,它是一种特殊 。
电子、阳离子和电中性粒子
气体
(2)特性:
含有带电粒子且能自由运动
良好的导电性和流动性
2.离子液体
离子液体是熔点不高的仅由离子组成的液体物质,如高温下的KCl。
3.液晶
液晶是介于 ,既具有液体的流动性、黏度、形变性等,又有晶体的某些物理性质,如导热性等。
液态和晶态之间的物质状态
知识点二:晶体与晶胞
1.晶体的特征
(1)晶体的自范性:
①定义:
②形成条件:
③本质原因:
(2)各向异性:
晶体在不同的方向上具有不同的物理性质。包括晶体的强度、导电性 、导热性、光学性质等。
(3)晶体有固定的熔点,非晶体没有固定的熔点。
晶体能自发地呈现多面体外形的性质。
晶体生长的速率适当。
晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象。
2.晶体的制备
(1)熔融态物质凝固
(2)气态物质冷却不经液态直接凝固
(3)溶质从溶液中析出
3.晶体与非晶体的比较
晶体 非晶体
微观结构特征 粒子周期性有序排列 粒子排列相对无序
性质特征 自范性 有 无
熔点 固定 不固定
各向异性 有 无
鉴别方法 间接方法
科学方法
举例
是否具有固定熔点或根据某些物理性质的各向异性
对固体进行X射线衍射实验
NaCl、I2、SiO2、Na晶体等
玻璃、橡胶等
(1)定义:
4.晶胞
描述晶体结构的基本单元叫做晶胞。
(2)形状:
常规的晶胞都是平行六面体。
(3)排列:
①晶体可以看作是数量巨大的晶胞“无隙并置”而成。
②所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
(4)晶胞中粒子数目的计算:
①均摊法——
如某个粒子为x个晶胞所共有,则该粒子有 属于一个晶胞。
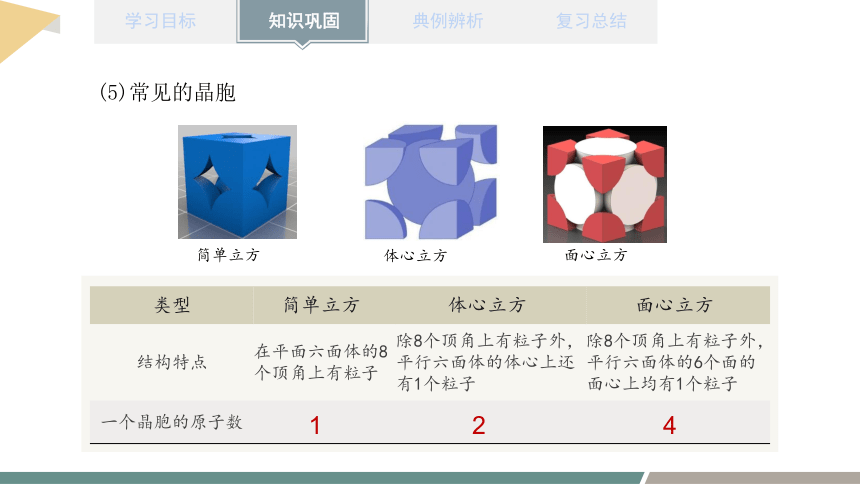
(5)常见的晶胞
简单立方
体心立方
面心立方
类型 简单立方 体心立方 面心立方
结构特点 在平面六面体的8个顶角上有粒子 除8个顶角上有粒子外,平行六面体的体心上还有1个粒子 除8个顶角上有粒子外,平行六面体的6个面的面心上均有1个粒子
一个晶胞的原子数
1
2
4
5.晶体结构的测定——X射线衍射实验
当单一波长的 X 射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上看到 或者 。
晶胞形状和大小、
分子或原子在微观空间有序排列呈现的对称类型、
原子在晶胞里的数目和位置等
测定晶胞中各个原子的位置(坐标),计算原子间的距离,判断哪些原子
之间存在化学键,确定键长和键角,得出分子的空间结构。
(1)原理:
(2)获得晶胞信息:
(3)获得分子信息:
分立的斑点
明锐的衍射峰
知识点三:分子晶体、共价晶体、金属晶体、离子晶体
1.类型比较
离子晶体 共价晶体 分子晶体 金属晶体
构成晶体 的粒子
粒子间 的作用
作用力大小 (一般而言)
判断作用 力大小的 参考数据
熔点
阴、阳离子
离子键
较强
原子
共价键
很强
分子
范德华力(氢键)
弱
金属阳离子
和自由电子
金属键
有的较强,有的较弱
离子电荷数、离子半径
键能、键长
(组成、结构相似)相对分子质量
离子半径、离子所带电荷数
较高
高
低
差别较大
离子晶体 共价晶体 分子晶体 金属晶体
硬度
导热和 导电性
溶解性
延展性
典型实例
略硬而脆
大
较小
差别较大
不良导体
(熔融后或溶于水导电)
不良导体
不良导体(部分溶于水,电离后导电)
良导体
多数易溶
一般不溶
相似相溶
一般不溶于水,
少数与水反应
差
差
差
优良
大部分非金属单
质和共价化合物
金刚石、硅、二氧化硅、碳化硅、刚玉等
NaCl、CsCl等
金属(除汞外)
2.过渡晶体与混合型晶体
(1)过渡晶体
原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
(2)混合型晶体
既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体,如石墨。
粒子
粒子间的作用力
晶体的类型
结构特点
性质特点
用途
3.研究晶体的思路
知识点四:配合物与超分子
1.配位键
(1)定义:成键原子或离子一方 ,另一方 而形成的,这类“电子对给予-接受”键被称为配位键。
(2)表示式:A→B或A—B(A为提供孤电子对的原子,B为接受孤电子对的原子)
注意:配位键是一种特殊的共价键,同样具有饱和性和方向性。
提供空轨道
提供孤电子对
2.配位化合物
(1)定义:
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
(2)组成:
[Cu(N H 3)4 ] S O 4
内界(配离子)
外界
配位体
配位数
配位原子
中心原子
配位键越强,配合物越稳定!
3.超分子
(1)定义:由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
(2)重要特征及其应用:
①“杯酚”分离C60和C70
②“冠醚识别碱金属离子
③自组装
【考点一】晶体类型的判断
1.下列各组物质的晶体类型相同的是( )
A.Cu和Ag B.I2和NaCl C.SiO2和SO3 D.SiC和MgO
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、H2、C2H4 B.PCl3、CO2、SiO2
C.H2SO4、SO3、NH3 D.CCl4、Na2S、H2O2
A
C
【考点二】晶体熔、沸点的比较
3.下列关于分子晶体熔、沸点的比较中,不正确的是( )
A.Cl2<Br2<I2
B.H2O<H2S<H2Se
C.CH4<SiH4<GeH4
D.CH3CH2CH2CH2CH3>C(CH3)4
4.下列各物质的熔点按由高到低的顺序排列的是( )
A.CsCl KCl NaCl B.Na K Ca
C.Si SiO2 SiC D.金刚石 硫磺 干冰
B
D
【考点三】晶胞的计算
5.已知NixMg1﹣xO晶体属立方晶系,晶胞边长a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A.Ni的配位数为6
B.Ni和Mg间的最短距离是a
C.该结构单元中O原子数为3
D.该物质化学式为Li0.5Mg1.125Ni2.375O4
D
6.已知SiC的熔点为2700℃,其晶胞结构如图所示。下列说法错误的是( )
A.SiC晶体中碳原子和硅原子均采用sp3杂化
B.硅单质的熔点高于2700℃
C.距离硅原子最近的硅原子数为12
D.若晶胞参数为a pm,则该晶体的密度为 g·cm-3
B
【解析】A.SiC晶体中碳原子和硅原子均形成4个σ键,则均采用sp3杂化;B.Si﹣Si键长大于Si﹣C键长,键长越长,熔点越低,SiC的熔点为2700℃,则硅单质的熔点低于2700℃,故B错误;
C.距离最短的Si为顶点和面心,每个顶点为12个面共有,则距离硅原子最近的硅原子数为12;
D.晶胞的体积为(1×10﹣10)3cm3,晶胞中Si原子个数为4,C原子个数为8×+6×=4,则晶胞的质量为,则晶胞的密度为ρ== g·cm-3
【总结】利用均摊法计算金属晶体的密度的方法:
(1)首先利用均摊法确定一个晶胞中平均含有的原子数目。
(2)其次确定金属原子的半径和晶胞边长之间的关系。
具体方法是:根据晶胞中金属原子的位置,灵活运用数学上立体几何的对角线(体对角线或面对角线)和边长的关系,将金属原子的半径和晶胞的边长放在同一个直角三角形中,通过解直角三角形即可。
(3)计算金属晶体的密度。
首先求一个晶胞的质量:m=NM/NA,N表示一个晶胞中平均含有的金属原子数,M表示金属的摩尔质量,NA表示阿伏加德罗常数。然后求金属晶体的密度:密度ρ=m/V,V表示一个晶胞的体积。
【考点四】晶体结构与性质的关系
7.下列关于原子晶体、分子晶体的叙述中,正确的是( )
A.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
B.晶体中分子间作用力越大,分子越稳定
C.HI的相对分子质量大于HF,所以HI 的沸点高于HF
D.金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子
D
【考点五】配合物的成键情况
8.关于[Co(NH3)4Cl2]Cl的说法中正确的是( )
A.1mol[Co(NH3)4Cl2]Cl含有σ键的数目为12NA
B.中心原子的化合价为+3价
C.钴离子提供孤电子对,NH3提供接受孤对电子的空轨道
D.含1mol[Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液,产生3mol白色沉淀
B
【考点六】不同晶体的结构微粒及微粒间作用力的区别
9.下列说法中正确的是( )
①原子晶体中共价键越强,熔点越高
②具有高熔、沸点的晶体一定是离子晶体或原子晶体
③冰融化时水分子中共价键发生断裂
④氯化钠熔化时离子键未被破坏
⑤在晶体中只要有阴离子就一定有阳离子
⑥分子间作用力越大,分子越稳定
A.①②③④ B.⑤⑥ C.②④ D.①⑤
D
晶体结构与性质
晶体
配合物
超分子
晶体的特性
晶胞
晶体结构的测定
四类典型晶体
分子晶体
共价晶体
金属晶体
离子晶体
配位键
配位化合物
超分子的特征及应用
第三章 晶体的结构与性质
章末复习
1.回顾本单元的文本及教材,熟悉本单元的知识及逻辑结构。
2.能区别晶体与非晶体,计算晶胞中所含的粒子数;
2.能借助分子晶体、共价晶体、离子晶体、金属晶体等模型说明晶体中的粒
子及其粒子间的相互作用;
3.能说出配位键的特征;能运用配位键解释配合物的某些典型性质;能举例
说明配合物的广泛应用;
4.能举例说明物质在原子、分子、超分子、聚集态等不同尺度上的结构特点
对物质性质的影响。
知识点一:物质的聚集状态
物质的聚集状态
气态
固态
液态
晶态
塑晶态
液晶态
非晶态
等离子体
液晶
离子液体
分子 原子
离子 电子
物质的性质与用途
1.等离子体
(1)定义:由 组成的整体上呈电中性的物质聚集体,称为等离子体,它是一种特殊 。
电子、阳离子和电中性粒子
气体
(2)特性:
含有带电粒子且能自由运动
良好的导电性和流动性
2.离子液体
离子液体是熔点不高的仅由离子组成的液体物质,如高温下的KCl。
3.液晶
液晶是介于 ,既具有液体的流动性、黏度、形变性等,又有晶体的某些物理性质,如导热性等。
液态和晶态之间的物质状态
知识点二:晶体与晶胞
1.晶体的特征
(1)晶体的自范性:
①定义:
②形成条件:
③本质原因:
(2)各向异性:
晶体在不同的方向上具有不同的物理性质。包括晶体的强度、导电性 、导热性、光学性质等。
(3)晶体有固定的熔点,非晶体没有固定的熔点。
晶体能自发地呈现多面体外形的性质。
晶体生长的速率适当。
晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象。
2.晶体的制备
(1)熔融态物质凝固
(2)气态物质冷却不经液态直接凝固
(3)溶质从溶液中析出
3.晶体与非晶体的比较
晶体 非晶体
微观结构特征 粒子周期性有序排列 粒子排列相对无序
性质特征 自范性 有 无
熔点 固定 不固定
各向异性 有 无
鉴别方法 间接方法
科学方法
举例
是否具有固定熔点或根据某些物理性质的各向异性
对固体进行X射线衍射实验
NaCl、I2、SiO2、Na晶体等
玻璃、橡胶等
(1)定义:
4.晶胞
描述晶体结构的基本单元叫做晶胞。
(2)形状:
常规的晶胞都是平行六面体。
(3)排列:
①晶体可以看作是数量巨大的晶胞“无隙并置”而成。
②所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
(4)晶胞中粒子数目的计算:
①均摊法——
如某个粒子为x个晶胞所共有,则该粒子有 属于一个晶胞。
(5)常见的晶胞
简单立方
体心立方
面心立方
类型 简单立方 体心立方 面心立方
结构特点 在平面六面体的8个顶角上有粒子 除8个顶角上有粒子外,平行六面体的体心上还有1个粒子 除8个顶角上有粒子外,平行六面体的6个面的面心上均有1个粒子
一个晶胞的原子数
1
2
4
5.晶体结构的测定——X射线衍射实验
当单一波长的 X 射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上看到 或者 。
晶胞形状和大小、
分子或原子在微观空间有序排列呈现的对称类型、
原子在晶胞里的数目和位置等
测定晶胞中各个原子的位置(坐标),计算原子间的距离,判断哪些原子
之间存在化学键,确定键长和键角,得出分子的空间结构。
(1)原理:
(2)获得晶胞信息:
(3)获得分子信息:
分立的斑点
明锐的衍射峰
知识点三:分子晶体、共价晶体、金属晶体、离子晶体
1.类型比较
离子晶体 共价晶体 分子晶体 金属晶体
构成晶体 的粒子
粒子间 的作用
作用力大小 (一般而言)
判断作用 力大小的 参考数据
熔点
阴、阳离子
离子键
较强
原子
共价键
很强
分子
范德华力(氢键)
弱
金属阳离子
和自由电子
金属键
有的较强,有的较弱
离子电荷数、离子半径
键能、键长
(组成、结构相似)相对分子质量
离子半径、离子所带电荷数
较高
高
低
差别较大
离子晶体 共价晶体 分子晶体 金属晶体
硬度
导热和 导电性
溶解性
延展性
典型实例
略硬而脆
大
较小
差别较大
不良导体
(熔融后或溶于水导电)
不良导体
不良导体(部分溶于水,电离后导电)
良导体
多数易溶
一般不溶
相似相溶
一般不溶于水,
少数与水反应
差
差
差
优良
大部分非金属单
质和共价化合物
金刚石、硅、二氧化硅、碳化硅、刚玉等
NaCl、CsCl等
金属(除汞外)
2.过渡晶体与混合型晶体
(1)过渡晶体
原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
(2)混合型晶体
既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体,如石墨。
粒子
粒子间的作用力
晶体的类型
结构特点
性质特点
用途
3.研究晶体的思路
知识点四:配合物与超分子
1.配位键
(1)定义:成键原子或离子一方 ,另一方 而形成的,这类“电子对给予-接受”键被称为配位键。
(2)表示式:A→B或A—B(A为提供孤电子对的原子,B为接受孤电子对的原子)
注意:配位键是一种特殊的共价键,同样具有饱和性和方向性。
提供空轨道
提供孤电子对
2.配位化合物
(1)定义:
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
(2)组成:
[Cu(N H 3)4 ] S O 4
内界(配离子)
外界
配位体
配位数
配位原子
中心原子
配位键越强,配合物越稳定!
3.超分子
(1)定义:由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
(2)重要特征及其应用:
①“杯酚”分离C60和C70
②“冠醚识别碱金属离子
③自组装
【考点一】晶体类型的判断
1.下列各组物质的晶体类型相同的是( )
A.Cu和Ag B.I2和NaCl C.SiO2和SO3 D.SiC和MgO
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、H2、C2H4 B.PCl3、CO2、SiO2
C.H2SO4、SO3、NH3 D.CCl4、Na2S、H2O2
A
C
【考点二】晶体熔、沸点的比较
3.下列关于分子晶体熔、沸点的比较中,不正确的是( )
A.Cl2<Br2<I2
B.H2O<H2S<H2Se
C.CH4<SiH4<GeH4
D.CH3CH2CH2CH2CH3>C(CH3)4
4.下列各物质的熔点按由高到低的顺序排列的是( )
A.CsCl KCl NaCl B.Na K Ca
C.Si SiO2 SiC D.金刚石 硫磺 干冰
B
D
【考点三】晶胞的计算
5.已知NixMg1﹣xO晶体属立方晶系,晶胞边长a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A.Ni的配位数为6
B.Ni和Mg间的最短距离是a
C.该结构单元中O原子数为3
D.该物质化学式为Li0.5Mg1.125Ni2.375O4
D
6.已知SiC的熔点为2700℃,其晶胞结构如图所示。下列说法错误的是( )
A.SiC晶体中碳原子和硅原子均采用sp3杂化
B.硅单质的熔点高于2700℃
C.距离硅原子最近的硅原子数为12
D.若晶胞参数为a pm,则该晶体的密度为 g·cm-3
B
【解析】A.SiC晶体中碳原子和硅原子均形成4个σ键,则均采用sp3杂化;B.Si﹣Si键长大于Si﹣C键长,键长越长,熔点越低,SiC的熔点为2700℃,则硅单质的熔点低于2700℃,故B错误;
C.距离最短的Si为顶点和面心,每个顶点为12个面共有,则距离硅原子最近的硅原子数为12;
D.晶胞的体积为(1×10﹣10)3cm3,晶胞中Si原子个数为4,C原子个数为8×+6×=4,则晶胞的质量为,则晶胞的密度为ρ== g·cm-3
【总结】利用均摊法计算金属晶体的密度的方法:
(1)首先利用均摊法确定一个晶胞中平均含有的原子数目。
(2)其次确定金属原子的半径和晶胞边长之间的关系。
具体方法是:根据晶胞中金属原子的位置,灵活运用数学上立体几何的对角线(体对角线或面对角线)和边长的关系,将金属原子的半径和晶胞的边长放在同一个直角三角形中,通过解直角三角形即可。
(3)计算金属晶体的密度。
首先求一个晶胞的质量:m=NM/NA,N表示一个晶胞中平均含有的金属原子数,M表示金属的摩尔质量,NA表示阿伏加德罗常数。然后求金属晶体的密度:密度ρ=m/V,V表示一个晶胞的体积。
【考点四】晶体结构与性质的关系
7.下列关于原子晶体、分子晶体的叙述中,正确的是( )
A.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
B.晶体中分子间作用力越大,分子越稳定
C.HI的相对分子质量大于HF,所以HI 的沸点高于HF
D.金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子
D
【考点五】配合物的成键情况
8.关于[Co(NH3)4Cl2]Cl的说法中正确的是( )
A.1mol[Co(NH3)4Cl2]Cl含有σ键的数目为12NA
B.中心原子的化合价为+3价
C.钴离子提供孤电子对,NH3提供接受孤对电子的空轨道
D.含1mol[Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液,产生3mol白色沉淀
B
【考点六】不同晶体的结构微粒及微粒间作用力的区别
9.下列说法中正确的是( )
①原子晶体中共价键越强,熔点越高
②具有高熔、沸点的晶体一定是离子晶体或原子晶体
③冰融化时水分子中共价键发生断裂
④氯化钠熔化时离子键未被破坏
⑤在晶体中只要有阴离子就一定有阳离子
⑥分子间作用力越大,分子越稳定
A.①②③④ B.⑤⑥ C.②④ D.①⑤
D
晶体结构与性质
晶体
配合物
超分子
晶体的特性
晶胞
晶体结构的测定
四类典型晶体
分子晶体
共价晶体
金属晶体
离子晶体
配位键
配位化合物
超分子的特征及应用
