高中化学必修第一册 1.1物质的分类及转化 教学设计
文档属性
| 名称 | 高中化学必修第一册 1.1物质的分类及转化 教学设计 |

|
|
| 格式 | docx | ||
| 文件大小 | 900.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 15:32:14 | ||
图片预览



文档简介
专题01 物质的分类及转化
【知识导图】
【目标导航】
物质的分类的考查方式主要是判断各选项的正误,考查角度是对概念的辨析;单质、氧化物、酸、碱、盐之间的转化会结合与社会热点相关的物质、材料、工业流程等进行考查;分散系的相关知识主要侧重胶体性质与应用的考查。题型为选择题
1、物质的分类、物质的性质与变化常与其他知识综合考查,一般以选择题形式出现。
2、分散系的知识考查频率不高,难度不大,一般出现在选择题的个别选项中。
【重难点精讲】
一、物质的分类
(一)根据物质的组成和性质分类
(1)同一种可以组成不同的单质,由同一种元素组成的不同单质之间互称为同素异形体;不同元素可以组成化合物,100多种元素可以能成种类繁多的物质。我们可以采用树状分类法和交叉分类法来认识和研究物质的组成、性质、用途、制备等。
(2)树状分类法和交叉分类法
A.树状分类法
对同类事物按某种标准再进行分类的方法叫树状分类法,根据物质的组成可以采用树状分类法对物质进行分类如下:
B.交叉分类法
对同一种物质按不同的标准分类的方法叫交叉分类法,从不同的标准对同一物质进行分类,可以采用交叉分类法对物质进行分类。
(3)根据物质的性质也可以对物质进行分类
根据氧化物质的性质可对氧化物进行分类,能与酸反应生成盐和水的氧化物叫碱性氧化物,如CaO;能与碱反应生成盐和水的氧化物叫酸性氧化物,如CO2;既能与酸反应生成盐和水又能与碱反应生成盐和水的氧化物叫两性氧化物,如Al2O3;既不能与酸反应生成盐和水又不能与碱反应生成盐和水的氧化物叫不成盐氧化物,如NO、CO;
大多数非金属氧化物是酸性氧化物,大多数金属氧化物是碱性氧化物。
特别提醒:(1)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸或碱,如SiO2、Fe2O3。
(2)能与酸反应生成盐和水的氧化物不一定是碱性氧化物,如Al2O3。
(3)能与碱反应生成盐和水的氧化物不一定是酸性氧化物,如NO2、Al2O3。
(4)碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。
(5)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
(6)酸性氧化物一定是酸酐,但酸酐不一定是酸性氧化物,如醋酸酐(CH3CO)2O()不属于氧化物。
(7)既能与酸反应也能与碱反应的氧化物不一定是两性氧化物,如SiO2,既能与HF反应,也能与NaOH反应,但SiO2属酸性氧化物。因为SiO2与HF反应生成的不是盐和水,且SiO2不与其他酸反应。
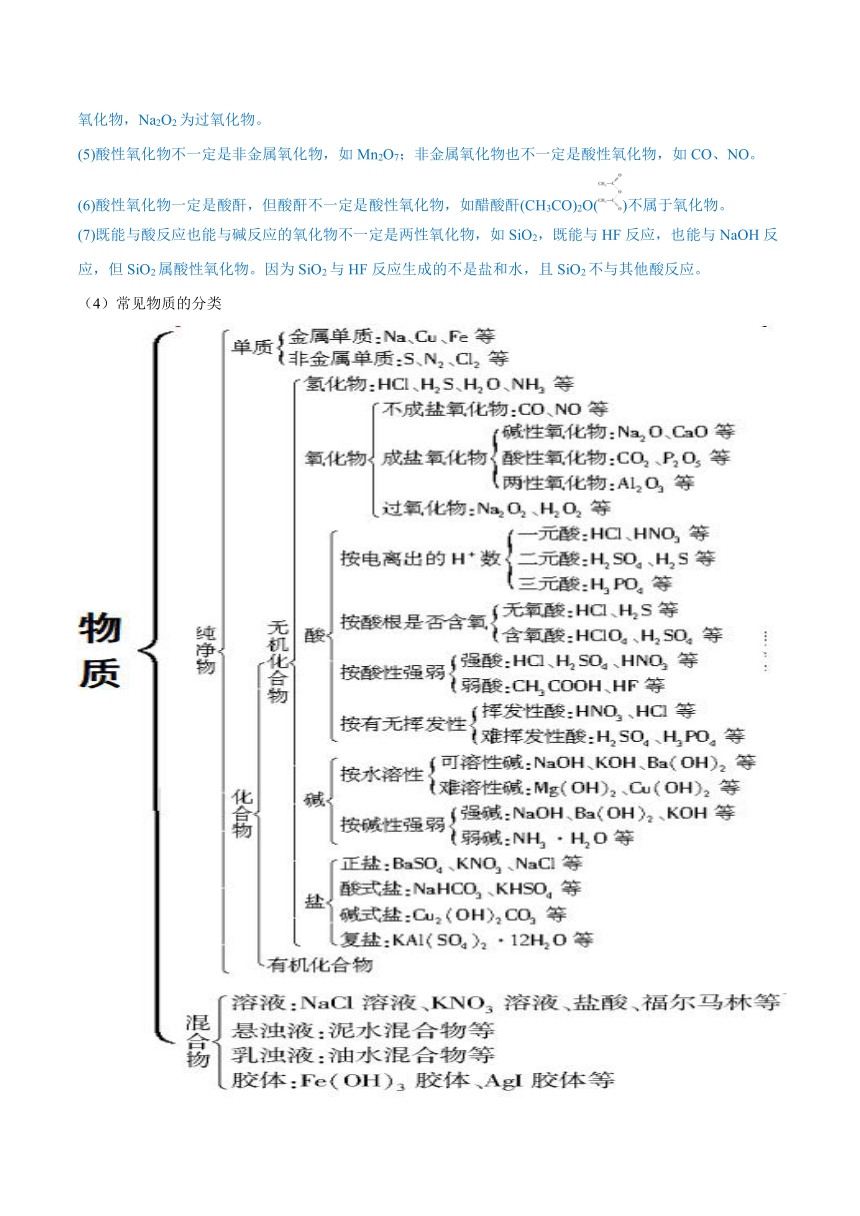
(4)常见物质的分类
特别提醒:
1.物质分类方法很多,根据研究需要,可以从多种角度对物质进行分类,并得到不同的分类结果,因此,明确分类标准是对物质正确分类的关键。
2.同一种物质用不同的分类方法分类,可属于不同的类别。如Na2SO4既是钠盐,又是硫酸盐。
3.化学物质有“名不符实”的现象:冰水混合物实际上是纯净物;纯净的盐酸是混合物;高分子化合物是混合物;纯碱属于盐类,石炭酸属于酚类。
4.纯净物和混合物的判断中的特殊情况
(1)只含一种元素的物质不一定是纯净物,也可能是混合物,如O2和O3,金刚石和石墨,正交硫和单斜硫。
(2)结晶水合物属于纯净物,如CuSO4·5H2O、KAl(SO4)2·12H2O等物质。
(3)同位素形成的单质或化合物是纯净物,如H2与D2、H2O和D2O。
5.常见的混合物
(1)气体混合物:空气;水煤气(CO和H2);爆鸣气(H2和O2);天然气(主要成分是CH4);焦炉气(主要成分是H2和CH4);高炉煤气;石油气;裂解气。
(2)液体混合物:氨水;氯水;王水;天然水;硬水;软水;水玻璃;福尔马林;浓H2SO4;盐酸;汽油;植物油;分散系(如溶液、胶体、浊液等)。
(3)固体混合物:碱石灰;漂白粉;高分子化合物(如蛋白质、纤维素、淀粉等);玻璃;水泥;合金;铝热剂。
(二)分散系及其分类
1.分散系
(1)概念:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
(2)分类:根据分散质粒子的大小将分散系分为溶液、浊液和胶体,可用如下直观地表示。
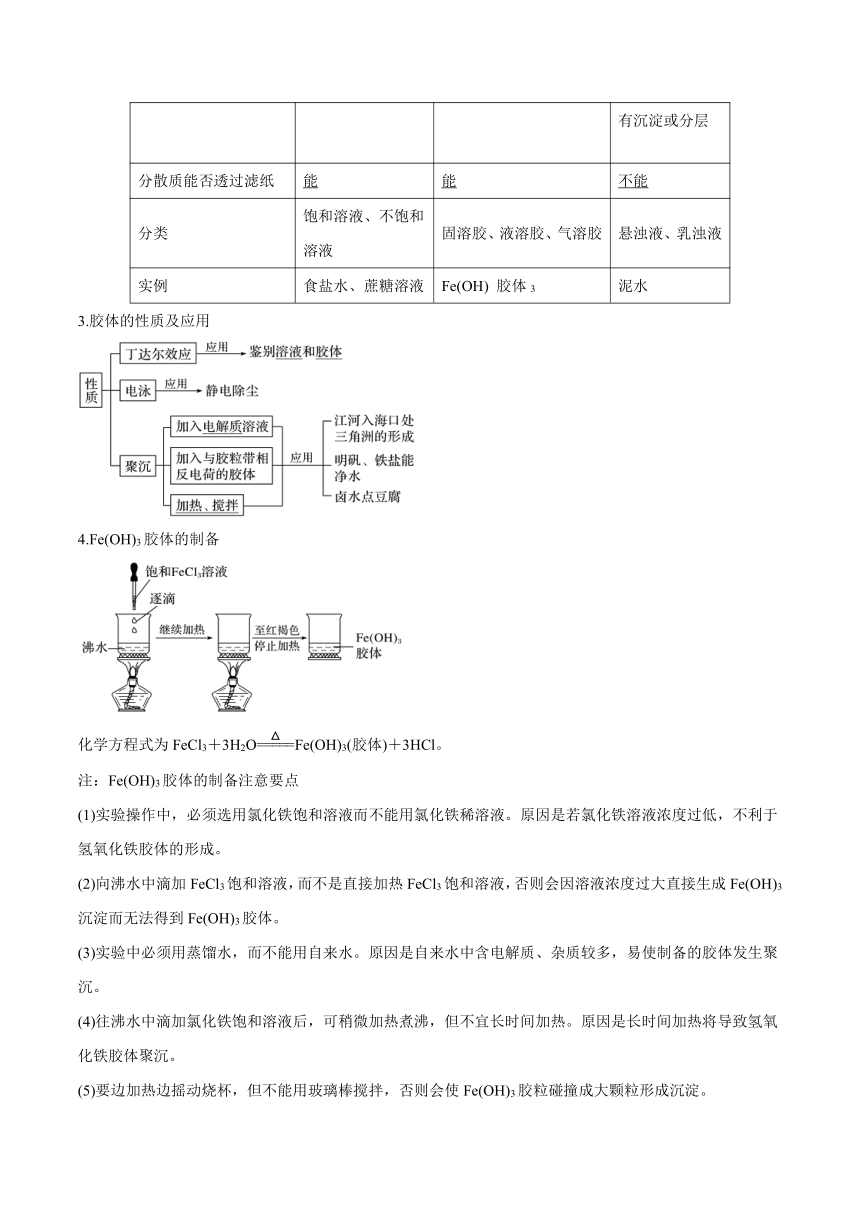
2.三种分散系比较
分散系 溶液 胶体 浊液
分散质粒子直径大小 <1 nm 1~100 nm >100 nm
分散质微粒成分 离子或小分子 大分子或离子 集合体 巨大分子或 离子集合体
外观特征 均匀、透明 均匀、透明或半透明 不均匀、不透明
稳定性 稳定,静置无沉淀 较稳定 不稳定,静置 有沉淀或分层
分散质能否透过滤纸 能 能 不能
分类 饱和溶液、不饱和溶液 固溶胶、液溶胶、气溶胶 悬浊液、乳浊液
实例 食盐水、蔗糖溶液 Fe(OH) 胶体3 泥水
3.胶体的性质及应用
4.Fe(OH)3胶体的制备
化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
注:Fe(OH)3胶体的制备注意要点
(1)实验操作中,必须选用氯化铁饱和溶液而不能用氯化铁稀溶液。原因是若氯化铁溶液浓度过低,不利于氢氧化铁胶体的形成。
(2)向沸水中滴加FeCl3饱和溶液,而不是直接加热FeCl3饱和溶液,否则会因溶液浓度过大直接生成Fe(OH)3沉淀而无法得到Fe(OH)3胶体。
(3)实验中必须用蒸馏水,而不能用自来水。原因是自来水中含电解质、杂质较多,易使制备的胶体发生聚沉。
(4)往沸水中滴加氯化铁饱和溶液后,可稍微加热煮沸,但不宜长时间加热。原因是长时间加热将导致氢氧化铁胶体聚沉。
(5)要边加热边摇动烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶粒碰撞成大颗粒形成沉淀。
名师助学:
(1)胶体不带电,胶体中的胶粒能够吸附体系中的带电离子而使胶粒带电荷,但整个分散系仍呈电中性。
(2)书写Fe(OH)3胶体制备化学方程式的四个易错点。
①用“===”而不用“??”;
②Fe(OH)3分子式后注明胶体而不使用“↓”符号;
③反应条件是“△”;
④HCl后不能标“↑”符号。
(3)固溶胶不发生电泳现象。凡是胶粒带电荷的液溶胶,通常都可发生电泳现象。气溶胶在高压电的条件也能发生电泳现象
(4)同种胶体的胶粒带相同的电荷
二、物质的转化
1.酸、碱、盐的性质
同类物质的性质具有相似的性质,酸、碱、盐都各自有自己的化学通性。
(1)酸:酸溶液中都含有H+
①酸与活泼金属单质反应,生成盐和氢气: Fe+2HCl=FeCl2+H2↑
②酸与金属化合物反应,生成盐和水: Fe2O3+6HCl=2FeCl3+3H2O
③酸与碱反应:HCl+NaOH=NaCl+H2O
④酸与盐反应:HCl+AgNO3=AgCl↓+HNO3
特别提醒:(1)酸为“几元”是依据一个酸分子最多能电离出几个H+划分的,而不是酸所含的氢原子数目,如次磷酸H3PO2为一元酸,有机酸CH3COOH也是一元酸。
(2)溶液呈酸性的物质不一定是酸,溶液呈碱性的物质不一定是碱。
①NaHSO4、CuSO4、NH4Cl溶液呈酸性,这些物质均属盐。
②Na2CO3、NaHCO3、Cu2(OH)2CO3溶液呈碱性,这些物质均属盐。
(3)电离生成H+的化合物不一定是酸,如NaHSO4。
(2)碱:碱溶液中都含有OH-
①碱与非金属氧化物反应:2NaOH+CO2=Na2CO3+H2O
②碱与酸反应:2NaOH+H2SO4=Na2SO4+2H2O
③碱与盐反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(3)盐:同类盐含有相同的酸根离子
①盐与某些金属单质反应:Fe+CuSO4=FeSO4+Cu
②盐与酸反应:BaCl2+H2SO4=BaSO4↓+2HCl
③盐与碱反应:CuCl2+2NaOH=Cu(OH)2↓+2NaCl
2、化学反应的分类
化学反应
3、物质间的转化
(1)物质间的转化:金属单质、非金属单质、氧化物、酸、碱、盐之间有如下转化关系:
从物质的分类上,纵向、横向构建知识分类意识。横向以化合价为基础,结合氧化还原反应规律,学会分析物质的化学转化关系;纵向则对比同类物质的性质差异,把握物质性质差异性。我们可以总结出如下两条转化路线:
金属单质碱性氧化物碱盐
非金属单质酸性氧化物酸盐
(2)物质间转化的应用
1)物质的制备:从上述转化关系我们可以找到制备某种物质的可能方法。
①酸的制备:酸性氧化物与水反应、盐与另一种酸反应
②碱的制备:碱性氧化物与水反应、盐与另一种碱反应
③盐的制备:金属单质与非金属单质反应、酸性氧化物与碱性氧化物反应、盐与盐反应、酸与盐反应、碱与盐反应
2)工业上物质的制备方法选择因素:要从反应的可能性、原料来源、成本高低、设备要求等方面来选择物质制备的适宜方法。
【典题精练】
考点1、考查物质的分类
例1.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
B.HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
解析:HCOOH是酸,Cu2(OH)2CO3是碱式盐,A项错误;CH3CH2OH是非电解质,C项错误;HCOOH分子中只有羧基氢可以电离,属于一元酸,D项错误。
答案:B
误区警示:①误认为由相同元素组成的物质一定是纯净物。②误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。③误认为金属氧化物、非金属氧化物与碱性氧化物、酸性氧化物相对应。④误认为酸分子中有多个氢原子就认为是几元酸,如次磷酸H3PO2为一元酸,有机酸CH3COOH也是一元酸。
考点2、考查分散系类别的判断及性质特点
例2.下列有关分散系的说法中,正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.“血液透析”利用了胶体的性质
D.葡萄糖注射液可产生丁达尔效应现象,属于胶体
解析:判断A选项的正误时,需要明确Fe(OH)3沉淀和Fe(OH)3胶体制备上的不同,浓氨水中滴加FeCl3饱和溶液,会迅速生成大量Fe(OH)3,聚集程度较大,进而得到的是Fe(OH)3沉淀,而向沸腾的水中滴加FeCl3饱和溶液,发生水解反应,方可制得Fe(OH)3胶体,所以A项错误;判断B选项的正误时,首先需要明确胶体是由分散质(胶粒)扩散到分散剂中形成的分散系,为混合物,而硅酸为纯净物,不是分散系,故不是胶体,硅酸扩散到水中形成的分散系可为胶体,也可以是浊液或溶液,视其扩散程度而定。氯化铁溶液顾名思义是溶液不是胶体,所以B项错误;判断C选项是否正确,不仅需要明确血液是胶体,还要清楚血液透析的原理,实际上血液透析就是利用胶体的渗析原理净化血液,所以C项正确;判断D选项是否正确,需要清楚葡萄糖和淀粉的差别,淀粉是高分子化合物,溶于水形成的分散系具有胶体的性质,有丁达尔现象,而葡萄糖是易溶于水的小分子,所以葡萄糖注射液属于溶液,不是胶体,不能产生丁达尔现象,D选项错误。
答案:C
名师总结:判断一种物质是不是胶体首先看其是不是分散系,如果是一种纯净物,那它可能是胶体粒子,但肯定不是胶体(比如PM2.5肯定不是胶体,雾霾是胶体),如果是分散系,然后可根据如下三种方法判断其是否为胶体:(1)从本质看,分散质粒子直径在1~100 nm的分散系才是胶体。(2)从性质看,具有丁达尔现象的分散系一定是胶体。(3)记住一些常见的胶体:云、烟、雾、泡沫、牛奶、稀豆浆、含水原油、血液、油墨、墨水、河水、珍珠、有色玻璃,淀粉溶液和蛋白质溶液也有胶体的性质,可看作是胶体。
考点3、考查胶体知识在工农业生产中的应用
例3.关于胶体的性质与应用,相关说法错误的是()
A.静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性而加以除去
B.“雨后彩虹”既是一种自然现象又是光学现象,同时也与胶体有关
C.医学上的血液透析原理同胶体的渗析类似,透析膜同滤纸类似
D.“江河入海口三角洲的形成”和“伤口上撒盐”通常与胶体的聚沉有关
解析:A项、静电除尘器除去空气或工厂废气中的飘尘是利用胶粒的带电性而加以除去,此过程为胶体的电泳,故A正确;B.“雨后彩虹”既是一种自然现象又是光学现象,与胶体的知识有关,雨后空气中含有纳米级的小水珠,与空气形成胶体,故B正确;C.血液是一种胶体,利用渗析的原理可以除去血液中的毒性小分子物质,而血液中的必要成分不能通过透析膜,但可以透过滤纸,故C错误;D.“江河入海口三角洲的形成”属于胶体的聚沉。血液属于胶体,所以血液应具备胶体的性质,在遇到电解质溶液、加热、电性相反的电解质的时候都会聚沉;在伤口上撒盐可以使伤口表面的血液凝结,从而阻止进一步出血,以及防治细菌感染,属于胶体的聚沉,D正确;
答案:C
思路点拨:积累胶体所具有的性质,理解胶体为什么具有这样的性质,及它们之间的逻辑关系,并熟练掌握胶体的哪一项性质能解释什么问题。
考点4、考查化学反应的分类
例4.按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应。这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图。
图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
(1)化学反应可以分为哪四种基本反应类型:___、___、___、___。
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应 ___________;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应 ______________;
请分别举出符合以上两种情况的一个例子:________; ___________。
(3)下列说法正确的是___。
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化
解析:(1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有元素化合价变化的分解反应属于氧化还原反应,有元素化合价变化的化合反应属于氧化还原反应,所以化合反应和分解反应与氧化还原反应属于交叉关系,置换反应被氧化还原反应包含,复分解反应和氧化还原反应既不交叉也不被包含,若B表示化合反应,则C表示分解反应,A表示置换反应,D表示复分解反应;
(2)B圈与氧化还原反应重叠的阴影部分表示既是氧化还原反应又是化合反应,则为有元素化合价变化的化合反应,如:Cl2+2FeCl2=2FeCl3;C圈与氧化还原反应重叠的阴影部分表示既是分解反应又是氧化还原反应,则为有元素化合价变化的分解反应,如:2KClO32KCl+3O2↑;
(3)A.置换反应一定有化合价变化,属于氧化还原反应,A正确;B.同素异形体之间的转化有单质生成或有单质参加,但无元素化合价变化,不属于氧化还原反应,B错误;C.氧化还原反应可发生在同一物质之间,如在Cl2+H2OHCl+HClO反应中,Cl2既是氧化剂,又是还原剂,C错误;D.氧化还原反应发生的本质是电子转移,D错误;故合理选项是A。
【答案】(1)化合反应 分解反应 置换反应 复分解反应 (2)有元素化合价变化的化合反应 有元素化合价变化的分解反应 Cl2+2FeCl2=2FeCl3 2KClO32KCl+3O2↑ (3)A
名师点睛:本题考查了化学反应不同分类标准之间的关系,明确四种基本反应类型中是否有元素的化合价变化是判断是否属于氧化还原反应的标准,明确包含、交叉、并列的意义即可解答。氧化还原反应中电子转移实质,特征是元素化合价的升降,化合价的变化、反应实质及反应类型的关系可概括为“升、失、氧,降、得、还”。
考点5、考查物质间的转化
例5.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
A.A B.B C.C D.D
【解析】A.氢氧化铝不能一步反应生成铝,不符合转化关系,A不符合题意;B.稀硝酸与铜反应生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,符合转化关系, B符合题意;C.二氧化硅不溶于水,不能与水反应生成硅酸,不符合转化关系,C不符合题意;D.Cu与氧气反应生成氧化铜,氧化铜不能与水反应产生氢氧化铜,氢氧化铜不能直接变为铜单质,不符合转化关系,D不符合题意;故合理选项是B。
【答案】B
误区警示:
(1)S燃烧不能直接生成SO3而是生成SO2。
(2)Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3
(3)NH3催化氧化不能直接生成NO2。
(4)Fe与Cl2反应不能生成FeCl2。
(5)Fe与H+、Cu2+、S、I2反应不能生成Fe3+。
【知识导图】
【目标导航】
物质的分类的考查方式主要是判断各选项的正误,考查角度是对概念的辨析;单质、氧化物、酸、碱、盐之间的转化会结合与社会热点相关的物质、材料、工业流程等进行考查;分散系的相关知识主要侧重胶体性质与应用的考查。题型为选择题
1、物质的分类、物质的性质与变化常与其他知识综合考查,一般以选择题形式出现。
2、分散系的知识考查频率不高,难度不大,一般出现在选择题的个别选项中。
【重难点精讲】
一、物质的分类
(一)根据物质的组成和性质分类
(1)同一种可以组成不同的单质,由同一种元素组成的不同单质之间互称为同素异形体;不同元素可以组成化合物,100多种元素可以能成种类繁多的物质。我们可以采用树状分类法和交叉分类法来认识和研究物质的组成、性质、用途、制备等。
(2)树状分类法和交叉分类法
A.树状分类法
对同类事物按某种标准再进行分类的方法叫树状分类法,根据物质的组成可以采用树状分类法对物质进行分类如下:
B.交叉分类法
对同一种物质按不同的标准分类的方法叫交叉分类法,从不同的标准对同一物质进行分类,可以采用交叉分类法对物质进行分类。
(3)根据物质的性质也可以对物质进行分类
根据氧化物质的性质可对氧化物进行分类,能与酸反应生成盐和水的氧化物叫碱性氧化物,如CaO;能与碱反应生成盐和水的氧化物叫酸性氧化物,如CO2;既能与酸反应生成盐和水又能与碱反应生成盐和水的氧化物叫两性氧化物,如Al2O3;既不能与酸反应生成盐和水又不能与碱反应生成盐和水的氧化物叫不成盐氧化物,如NO、CO;
大多数非金属氧化物是酸性氧化物,大多数金属氧化物是碱性氧化物。
特别提醒:(1)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸或碱,如SiO2、Fe2O3。
(2)能与酸反应生成盐和水的氧化物不一定是碱性氧化物,如Al2O3。
(3)能与碱反应生成盐和水的氧化物不一定是酸性氧化物,如NO2、Al2O3。
(4)碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。
(5)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
(6)酸性氧化物一定是酸酐,但酸酐不一定是酸性氧化物,如醋酸酐(CH3CO)2O()不属于氧化物。
(7)既能与酸反应也能与碱反应的氧化物不一定是两性氧化物,如SiO2,既能与HF反应,也能与NaOH反应,但SiO2属酸性氧化物。因为SiO2与HF反应生成的不是盐和水,且SiO2不与其他酸反应。
(4)常见物质的分类
特别提醒:
1.物质分类方法很多,根据研究需要,可以从多种角度对物质进行分类,并得到不同的分类结果,因此,明确分类标准是对物质正确分类的关键。
2.同一种物质用不同的分类方法分类,可属于不同的类别。如Na2SO4既是钠盐,又是硫酸盐。
3.化学物质有“名不符实”的现象:冰水混合物实际上是纯净物;纯净的盐酸是混合物;高分子化合物是混合物;纯碱属于盐类,石炭酸属于酚类。
4.纯净物和混合物的判断中的特殊情况
(1)只含一种元素的物质不一定是纯净物,也可能是混合物,如O2和O3,金刚石和石墨,正交硫和单斜硫。
(2)结晶水合物属于纯净物,如CuSO4·5H2O、KAl(SO4)2·12H2O等物质。
(3)同位素形成的单质或化合物是纯净物,如H2与D2、H2O和D2O。
5.常见的混合物
(1)气体混合物:空气;水煤气(CO和H2);爆鸣气(H2和O2);天然气(主要成分是CH4);焦炉气(主要成分是H2和CH4);高炉煤气;石油气;裂解气。
(2)液体混合物:氨水;氯水;王水;天然水;硬水;软水;水玻璃;福尔马林;浓H2SO4;盐酸;汽油;植物油;分散系(如溶液、胶体、浊液等)。
(3)固体混合物:碱石灰;漂白粉;高分子化合物(如蛋白质、纤维素、淀粉等);玻璃;水泥;合金;铝热剂。
(二)分散系及其分类
1.分散系
(1)概念:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
(2)分类:根据分散质粒子的大小将分散系分为溶液、浊液和胶体,可用如下直观地表示。
2.三种分散系比较
分散系 溶液 胶体 浊液
分散质粒子直径大小 <1 nm 1~100 nm >100 nm
分散质微粒成分 离子或小分子 大分子或离子 集合体 巨大分子或 离子集合体
外观特征 均匀、透明 均匀、透明或半透明 不均匀、不透明
稳定性 稳定,静置无沉淀 较稳定 不稳定,静置 有沉淀或分层
分散质能否透过滤纸 能 能 不能
分类 饱和溶液、不饱和溶液 固溶胶、液溶胶、气溶胶 悬浊液、乳浊液
实例 食盐水、蔗糖溶液 Fe(OH) 胶体3 泥水
3.胶体的性质及应用
4.Fe(OH)3胶体的制备
化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
注:Fe(OH)3胶体的制备注意要点
(1)实验操作中,必须选用氯化铁饱和溶液而不能用氯化铁稀溶液。原因是若氯化铁溶液浓度过低,不利于氢氧化铁胶体的形成。
(2)向沸水中滴加FeCl3饱和溶液,而不是直接加热FeCl3饱和溶液,否则会因溶液浓度过大直接生成Fe(OH)3沉淀而无法得到Fe(OH)3胶体。
(3)实验中必须用蒸馏水,而不能用自来水。原因是自来水中含电解质、杂质较多,易使制备的胶体发生聚沉。
(4)往沸水中滴加氯化铁饱和溶液后,可稍微加热煮沸,但不宜长时间加热。原因是长时间加热将导致氢氧化铁胶体聚沉。
(5)要边加热边摇动烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶粒碰撞成大颗粒形成沉淀。
名师助学:
(1)胶体不带电,胶体中的胶粒能够吸附体系中的带电离子而使胶粒带电荷,但整个分散系仍呈电中性。
(2)书写Fe(OH)3胶体制备化学方程式的四个易错点。
①用“===”而不用“??”;
②Fe(OH)3分子式后注明胶体而不使用“↓”符号;
③反应条件是“△”;
④HCl后不能标“↑”符号。
(3)固溶胶不发生电泳现象。凡是胶粒带电荷的液溶胶,通常都可发生电泳现象。气溶胶在高压电的条件也能发生电泳现象
(4)同种胶体的胶粒带相同的电荷
二、物质的转化
1.酸、碱、盐的性质
同类物质的性质具有相似的性质,酸、碱、盐都各自有自己的化学通性。
(1)酸:酸溶液中都含有H+
①酸与活泼金属单质反应,生成盐和氢气: Fe+2HCl=FeCl2+H2↑
②酸与金属化合物反应,生成盐和水: Fe2O3+6HCl=2FeCl3+3H2O
③酸与碱反应:HCl+NaOH=NaCl+H2O
④酸与盐反应:HCl+AgNO3=AgCl↓+HNO3
特别提醒:(1)酸为“几元”是依据一个酸分子最多能电离出几个H+划分的,而不是酸所含的氢原子数目,如次磷酸H3PO2为一元酸,有机酸CH3COOH也是一元酸。
(2)溶液呈酸性的物质不一定是酸,溶液呈碱性的物质不一定是碱。
①NaHSO4、CuSO4、NH4Cl溶液呈酸性,这些物质均属盐。
②Na2CO3、NaHCO3、Cu2(OH)2CO3溶液呈碱性,这些物质均属盐。
(3)电离生成H+的化合物不一定是酸,如NaHSO4。
(2)碱:碱溶液中都含有OH-
①碱与非金属氧化物反应:2NaOH+CO2=Na2CO3+H2O
②碱与酸反应:2NaOH+H2SO4=Na2SO4+2H2O
③碱与盐反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(3)盐:同类盐含有相同的酸根离子
①盐与某些金属单质反应:Fe+CuSO4=FeSO4+Cu
②盐与酸反应:BaCl2+H2SO4=BaSO4↓+2HCl
③盐与碱反应:CuCl2+2NaOH=Cu(OH)2↓+2NaCl
2、化学反应的分类
化学反应
3、物质间的转化
(1)物质间的转化:金属单质、非金属单质、氧化物、酸、碱、盐之间有如下转化关系:
从物质的分类上,纵向、横向构建知识分类意识。横向以化合价为基础,结合氧化还原反应规律,学会分析物质的化学转化关系;纵向则对比同类物质的性质差异,把握物质性质差异性。我们可以总结出如下两条转化路线:
金属单质碱性氧化物碱盐
非金属单质酸性氧化物酸盐
(2)物质间转化的应用
1)物质的制备:从上述转化关系我们可以找到制备某种物质的可能方法。
①酸的制备:酸性氧化物与水反应、盐与另一种酸反应
②碱的制备:碱性氧化物与水反应、盐与另一种碱反应
③盐的制备:金属单质与非金属单质反应、酸性氧化物与碱性氧化物反应、盐与盐反应、酸与盐反应、碱与盐反应
2)工业上物质的制备方法选择因素:要从反应的可能性、原料来源、成本高低、设备要求等方面来选择物质制备的适宜方法。
【典题精练】
考点1、考查物质的分类
例1.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
B.HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
解析:HCOOH是酸,Cu2(OH)2CO3是碱式盐,A项错误;CH3CH2OH是非电解质,C项错误;HCOOH分子中只有羧基氢可以电离,属于一元酸,D项错误。
答案:B
误区警示:①误认为由相同元素组成的物质一定是纯净物。②误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。③误认为金属氧化物、非金属氧化物与碱性氧化物、酸性氧化物相对应。④误认为酸分子中有多个氢原子就认为是几元酸,如次磷酸H3PO2为一元酸,有机酸CH3COOH也是一元酸。
考点2、考查分散系类别的判断及性质特点
例2.下列有关分散系的说法中,正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.“血液透析”利用了胶体的性质
D.葡萄糖注射液可产生丁达尔效应现象,属于胶体
解析:判断A选项的正误时,需要明确Fe(OH)3沉淀和Fe(OH)3胶体制备上的不同,浓氨水中滴加FeCl3饱和溶液,会迅速生成大量Fe(OH)3,聚集程度较大,进而得到的是Fe(OH)3沉淀,而向沸腾的水中滴加FeCl3饱和溶液,发生水解反应,方可制得Fe(OH)3胶体,所以A项错误;判断B选项的正误时,首先需要明确胶体是由分散质(胶粒)扩散到分散剂中形成的分散系,为混合物,而硅酸为纯净物,不是分散系,故不是胶体,硅酸扩散到水中形成的分散系可为胶体,也可以是浊液或溶液,视其扩散程度而定。氯化铁溶液顾名思义是溶液不是胶体,所以B项错误;判断C选项是否正确,不仅需要明确血液是胶体,还要清楚血液透析的原理,实际上血液透析就是利用胶体的渗析原理净化血液,所以C项正确;判断D选项是否正确,需要清楚葡萄糖和淀粉的差别,淀粉是高分子化合物,溶于水形成的分散系具有胶体的性质,有丁达尔现象,而葡萄糖是易溶于水的小分子,所以葡萄糖注射液属于溶液,不是胶体,不能产生丁达尔现象,D选项错误。
答案:C
名师总结:判断一种物质是不是胶体首先看其是不是分散系,如果是一种纯净物,那它可能是胶体粒子,但肯定不是胶体(比如PM2.5肯定不是胶体,雾霾是胶体),如果是分散系,然后可根据如下三种方法判断其是否为胶体:(1)从本质看,分散质粒子直径在1~100 nm的分散系才是胶体。(2)从性质看,具有丁达尔现象的分散系一定是胶体。(3)记住一些常见的胶体:云、烟、雾、泡沫、牛奶、稀豆浆、含水原油、血液、油墨、墨水、河水、珍珠、有色玻璃,淀粉溶液和蛋白质溶液也有胶体的性质,可看作是胶体。
考点3、考查胶体知识在工农业生产中的应用
例3.关于胶体的性质与应用,相关说法错误的是()
A.静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性而加以除去
B.“雨后彩虹”既是一种自然现象又是光学现象,同时也与胶体有关
C.医学上的血液透析原理同胶体的渗析类似,透析膜同滤纸类似
D.“江河入海口三角洲的形成”和“伤口上撒盐”通常与胶体的聚沉有关
解析:A项、静电除尘器除去空气或工厂废气中的飘尘是利用胶粒的带电性而加以除去,此过程为胶体的电泳,故A正确;B.“雨后彩虹”既是一种自然现象又是光学现象,与胶体的知识有关,雨后空气中含有纳米级的小水珠,与空气形成胶体,故B正确;C.血液是一种胶体,利用渗析的原理可以除去血液中的毒性小分子物质,而血液中的必要成分不能通过透析膜,但可以透过滤纸,故C错误;D.“江河入海口三角洲的形成”属于胶体的聚沉。血液属于胶体,所以血液应具备胶体的性质,在遇到电解质溶液、加热、电性相反的电解质的时候都会聚沉;在伤口上撒盐可以使伤口表面的血液凝结,从而阻止进一步出血,以及防治细菌感染,属于胶体的聚沉,D正确;
答案:C
思路点拨:积累胶体所具有的性质,理解胶体为什么具有这样的性质,及它们之间的逻辑关系,并熟练掌握胶体的哪一项性质能解释什么问题。
考点4、考查化学反应的分类
例4.按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应。这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图。
图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
(1)化学反应可以分为哪四种基本反应类型:___、___、___、___。
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应 ___________;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应 ______________;
请分别举出符合以上两种情况的一个例子:________; ___________。
(3)下列说法正确的是___。
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化
解析:(1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有元素化合价变化的分解反应属于氧化还原反应,有元素化合价变化的化合反应属于氧化还原反应,所以化合反应和分解反应与氧化还原反应属于交叉关系,置换反应被氧化还原反应包含,复分解反应和氧化还原反应既不交叉也不被包含,若B表示化合反应,则C表示分解反应,A表示置换反应,D表示复分解反应;
(2)B圈与氧化还原反应重叠的阴影部分表示既是氧化还原反应又是化合反应,则为有元素化合价变化的化合反应,如:Cl2+2FeCl2=2FeCl3;C圈与氧化还原反应重叠的阴影部分表示既是分解反应又是氧化还原反应,则为有元素化合价变化的分解反应,如:2KClO32KCl+3O2↑;
(3)A.置换反应一定有化合价变化,属于氧化还原反应,A正确;B.同素异形体之间的转化有单质生成或有单质参加,但无元素化合价变化,不属于氧化还原反应,B错误;C.氧化还原反应可发生在同一物质之间,如在Cl2+H2OHCl+HClO反应中,Cl2既是氧化剂,又是还原剂,C错误;D.氧化还原反应发生的本质是电子转移,D错误;故合理选项是A。
【答案】(1)化合反应 分解反应 置换反应 复分解反应 (2)有元素化合价变化的化合反应 有元素化合价变化的分解反应 Cl2+2FeCl2=2FeCl3 2KClO32KCl+3O2↑ (3)A
名师点睛:本题考查了化学反应不同分类标准之间的关系,明确四种基本反应类型中是否有元素的化合价变化是判断是否属于氧化还原反应的标准,明确包含、交叉、并列的意义即可解答。氧化还原反应中电子转移实质,特征是元素化合价的升降,化合价的变化、反应实质及反应类型的关系可概括为“升、失、氧,降、得、还”。
考点5、考查物质间的转化
例5.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
A.A B.B C.C D.D
【解析】A.氢氧化铝不能一步反应生成铝,不符合转化关系,A不符合题意;B.稀硝酸与铜反应生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,符合转化关系, B符合题意;C.二氧化硅不溶于水,不能与水反应生成硅酸,不符合转化关系,C不符合题意;D.Cu与氧气反应生成氧化铜,氧化铜不能与水反应产生氢氧化铜,氢氧化铜不能直接变为铜单质,不符合转化关系,D不符合题意;故合理选项是B。
【答案】B
误区警示:
(1)S燃烧不能直接生成SO3而是生成SO2。
(2)Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3
(3)NH3催化氧化不能直接生成NO2。
(4)Fe与Cl2反应不能生成FeCl2。
(5)Fe与H+、Cu2+、S、I2反应不能生成Fe3+。
