高中必修第一册化学 4.2 元素周期律 教学设计
文档属性
| 名称 | 高中必修第一册化学 4.2 元素周期律 教学设计 |

|
|
| 格式 | docx | ||
| 文件大小 | 398.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-13 00:00:00 | ||
图片预览


文档简介
第四章 元素周期律
第2节 元素周期性表和元素周期律的应用(二课时)
“元素周期表”是必修一模块第四章。新课程标准对本节内容要求是:认识原子结构、元素性质与元素在元素周期表中位置的关系。知道元素和核素的含义,了解原子核外电子的排布。结合有关数据和实验事实认识原子结构、元素性质呈现周期性变化的规律,构建元素周期律。知道元素周期表的结构,以第三周期的钠、镁、铝、硅、硫、氯,以及碱金属和卤族元素为例,了解同周期和主族元素性质的递变规律。给出的活动与探究建议是:查阅元素周期律的发现史料,讨论元素周期律的发现对化学科学发展的重要意义。元素周期律这部分内容始终是高中化学概念理论部分的重点内容之一。在新课程中,更加关注概念理论知识的建构过程和各部分知识间的联系。课程标准规定或建议的核心教学活动凸现了概念理论的建构过程,更注重科学学习方法的教育。
元素周期律是对元素性质呈现周期性变化实质的揭示,通过本节的学习,可以使学生对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识,同时也会以此理论来指导后续学习,所以学好元素周期律是十分重要的。这一课时的内容是:首先归纳周期和主族的性质递变规律,对元素周期表和元素周期律进行整体分析,然后引导元素周期表和元素周期律的应用,体现结构、位置、性质之间的相互联系与有机统一关系。通过本节的学习,可以使学生对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识,之后再以理性认识指导后续学习实践的跨越。
【宏观辨识与微观探析】
1、知道元素周期表的简单分区。
【证据推理与模型认知】
1、进一步认识元素周期表是元素周期律的具体表现形式。
2、学会运用元素周期表、元素周期律的有关知识,指导科学研究和工农业生产。
3、通过元素周期律、元素周期表的应用的探究,培养学生科学态度与社会责任、证据推理与模型认知能力。
1、对元素周期表结构和规律的认知。
2、金属性和非金属性的判断和归纳。
3、对“位”“构”“性”的认识。
4、元素周期律在工农业和研究中的应用。
投影
【引入】门捷列夫作出这些伟大预言的科学依据是什么?
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
一、元素的金属性、非金属性与元素在周期表中位置的关系
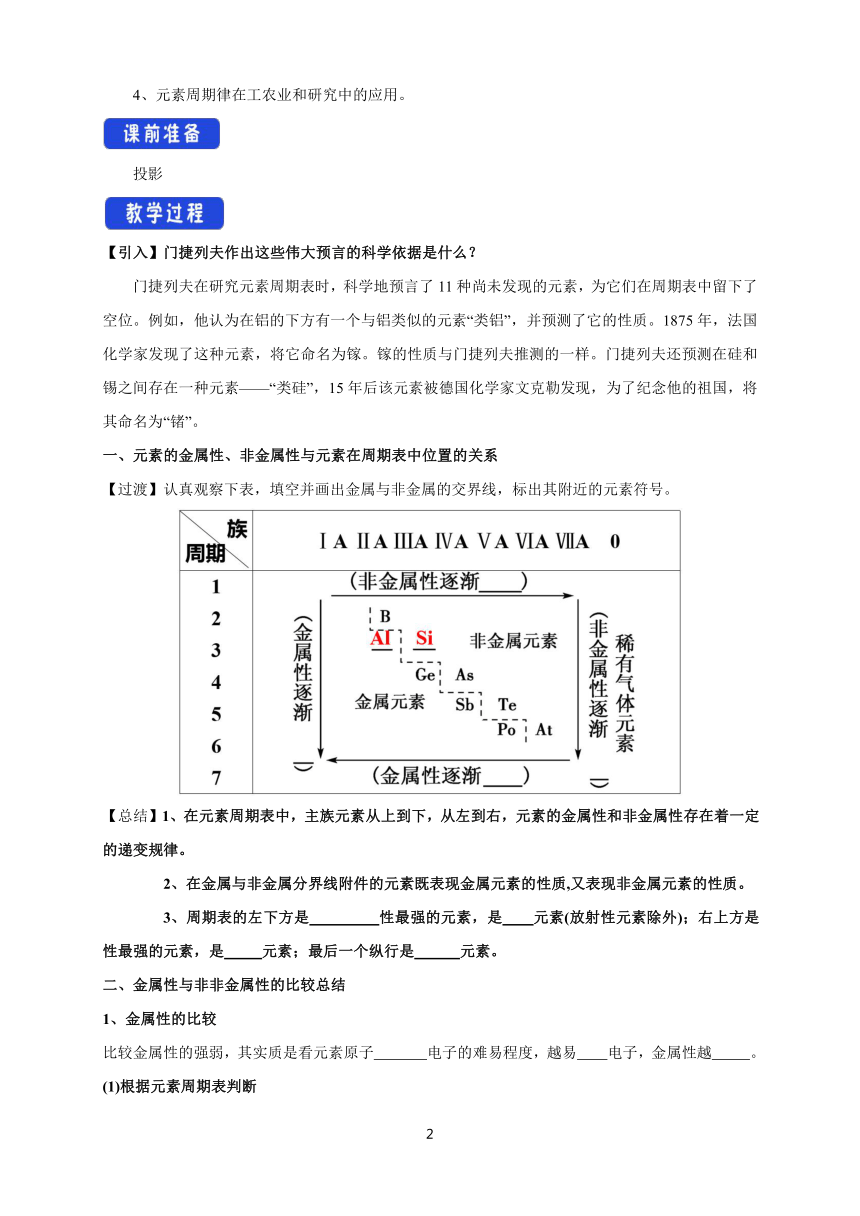
【过渡】认真观察下表,填空并画出金属与非金属的交界线,标出其附近的元素符号。
【总结】1、在元素周期表中,主族元素从上到下,从左到右,元素的金属性和非金属性存在着一定的递变规律。
2、在金属与非金属分界线附件的元素既表现金属元素的性质,又表现非金属元素的性质。
3、周期表的左下方是 性最强的元素,是 元素(放射性元素除外);右上方是 性最强的元素,是 元素;最后一个纵行是 元素。
二、金属性与非非金属性的比较总结
1、金属性的比较
比较金属性的强弱,其实质是看元素原子 电子的难易程度,越易 电子,金属性越 。
(1)根据元素周期表判断
①同一周期,从左到右,随着原子序数的递增,元素的金属性逐渐 ;
②同一主族,从上到下,随着原子序数的递增,元素的金属性逐渐 。
(2)根据元素单质及其化合物的相关性质判断
①金属单质与水(或酸)反应越剧烈,元素的金属性 。如Zn与盐酸反应比Fe与盐酸反应更容易,则金属性:Zn>Fe;
②最高价氧化物对应水化物的碱性越强,元素的金属性 。如碱性:NaOH>Mg(OH)2,则金属性:Na>Mg;
③金属单质间的置换反应。如Zn+Cu2+=Zn2++Cu,则金属性:Zn>Cu;
④元素的原子对应阳离子的氧化性越强,则元素的金属性 。如氧化性:Mg2+>Na+,则金属性:Mg<Na。
(3)根据金属活动性顺序判断
一般来说,排在前面的金属元素其金属性比排在后面的强。如Fe排在Cu的前面,则金属性:Fe>Cu。
【注意】金属性强弱的比较,关键是比较原子失去电子的难易,而不是失去电子数的多少。如Na失去一个电子,而Mg失去两个电子,但Na的金属性比Mg强。
2、非金属性的比较
比较元素非金属性的强弱,其实质是看元素原子 电子的难易程度,越易 电子,非金属性越 。
(1)根据元素周期表判断
①同一周期,从左到右,随着原子序数的递增,元素的非金属性逐渐 ;
②同一主族,从上到下,随着原子序数的递增,元素的非金属性逐渐 。
(2)根据元素单质及其化合物的相关性质判断
①非金属单质越易跟H2化合,其非金属性 。如F2与H2在暗处即可反应,Br2与H2在加热条件下才能反应,则非金属性:F>Br;
②气态氢化物越稳定,其非金属性 。如稳定性:HF>HCl,则非金属性:F>Cl;
③最高价氧化物对应水化物的酸性越强,其非金属性 。如酸性:H2SO4>H3PO4,则非金属性:S>P;
④非金属单质间的置换反应。如Cl2+2KI=2KCl+I2,则非金属性:Cl>I;
⑤元素的原子对应阴离子的还原性越强,其非金属性就 。如还原性:S2->Cl-,则非金属性:Cl>S。
三、元素的化合价与元素在周期表中的位置关系
主族元素的最高正化合价等于原子所能 的最外层电子数(价电子),而非金属的最低负化合价则等于使原子达到8电子稳定结构所需 的电子数。所以,非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于 。
(1)最高正化合价= 序数=原子 电子数(O、F除外)。 (2)最高正化合价+|最低负化合价|= 。
【归纳总结】元素金属性、非金属性递变与其在周期表中的位置关系
碱性最强的是CsOH,酸性最强的含氧酸是HClO4。
四、元素周期表和元素周期律的应用
(1)指导其他与化学相关的科学技术
①在周期表中__________________,可以找到半导体材料。
②在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
③寻找制取农药的元素 。
(2)元素周期表和元素周期律的理论应用
① 预测元素的性质
例1、镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是( )
A.镭比钙金属性更强 B.氢氧化物呈两性
C.在化合物中呈+2价 D.碳酸盐难溶于水
② 比较元素的性质
例2、下列说法正确的是( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强。
D.甲、乙两种非金属元素与金属钠反应时,甲得电子的数目多,所以甲活泼。
例3、已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4A、原子半径XB、得电子能力X、Y、Z逐渐减弱
C、单质与氢气反应按照X、Y、Z顺序越来越容易
D、气态氢化物的稳定性按照X、Y、Z顺序减弱
【归纳总结】“位”“构”“性”总结
【归纳总结】元素周期律的应用
【课堂练习】
1、下列说法错误的是( )
A.作半导体材料的元素大多数位于周期表中金属元素和非金属元素的
交界处
B.农药中常含有的元素通常在元素周期表的右上方区域内
C.构成催化剂的元素通常在元素周期表的左下方区域内
D.在周期表过渡元素中寻找作耐高温和耐腐蚀的合金材料的元素
2、X、Y是元素周期表第ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
本节课属于内容较抽象,理论性强,教学必须具有严密的逻辑性,从课堂教学的结构上,应当体现出教材本身逻辑系统的要求;要重视理论推理。为了提高学生学习的积极性,希望通过课堂讨论的形式和实验现象进行适当的引导,多让学生自主思考和交流,启发学生动脑、动口、动手,主动积极地进行学习,以提高他们的逻辑思维能力和语言表达能力,从而提高教学质量。因此,在今后的教学中,我们只有不断地反思自己,去伪存真,扬长避短,方能提升自己、完善自己。从素养为本的课堂中提高学生宏观辨识与微观探析、证据推理与模型认知的核心素养。
第2节 元素周期性表和元素周期律的应用(二课时)
“元素周期表”是必修一模块第四章。新课程标准对本节内容要求是:认识原子结构、元素性质与元素在元素周期表中位置的关系。知道元素和核素的含义,了解原子核外电子的排布。结合有关数据和实验事实认识原子结构、元素性质呈现周期性变化的规律,构建元素周期律。知道元素周期表的结构,以第三周期的钠、镁、铝、硅、硫、氯,以及碱金属和卤族元素为例,了解同周期和主族元素性质的递变规律。给出的活动与探究建议是:查阅元素周期律的发现史料,讨论元素周期律的发现对化学科学发展的重要意义。元素周期律这部分内容始终是高中化学概念理论部分的重点内容之一。在新课程中,更加关注概念理论知识的建构过程和各部分知识间的联系。课程标准规定或建议的核心教学活动凸现了概念理论的建构过程,更注重科学学习方法的教育。
元素周期律是对元素性质呈现周期性变化实质的揭示,通过本节的学习,可以使学生对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识,同时也会以此理论来指导后续学习,所以学好元素周期律是十分重要的。这一课时的内容是:首先归纳周期和主族的性质递变规律,对元素周期表和元素周期律进行整体分析,然后引导元素周期表和元素周期律的应用,体现结构、位置、性质之间的相互联系与有机统一关系。通过本节的学习,可以使学生对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识,之后再以理性认识指导后续学习实践的跨越。
【宏观辨识与微观探析】
1、知道元素周期表的简单分区。
【证据推理与模型认知】
1、进一步认识元素周期表是元素周期律的具体表现形式。
2、学会运用元素周期表、元素周期律的有关知识,指导科学研究和工农业生产。
3、通过元素周期律、元素周期表的应用的探究,培养学生科学态度与社会责任、证据推理与模型认知能力。
1、对元素周期表结构和规律的认知。
2、金属性和非金属性的判断和归纳。
3、对“位”“构”“性”的认识。
4、元素周期律在工农业和研究中的应用。
投影
【引入】门捷列夫作出这些伟大预言的科学依据是什么?
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
一、元素的金属性、非金属性与元素在周期表中位置的关系
【过渡】认真观察下表,填空并画出金属与非金属的交界线,标出其附近的元素符号。
【总结】1、在元素周期表中,主族元素从上到下,从左到右,元素的金属性和非金属性存在着一定的递变规律。
2、在金属与非金属分界线附件的元素既表现金属元素的性质,又表现非金属元素的性质。
3、周期表的左下方是 性最强的元素,是 元素(放射性元素除外);右上方是 性最强的元素,是 元素;最后一个纵行是 元素。
二、金属性与非非金属性的比较总结
1、金属性的比较
比较金属性的强弱,其实质是看元素原子 电子的难易程度,越易 电子,金属性越 。
(1)根据元素周期表判断
①同一周期,从左到右,随着原子序数的递增,元素的金属性逐渐 ;
②同一主族,从上到下,随着原子序数的递增,元素的金属性逐渐 。
(2)根据元素单质及其化合物的相关性质判断
①金属单质与水(或酸)反应越剧烈,元素的金属性 。如Zn与盐酸反应比Fe与盐酸反应更容易,则金属性:Zn>Fe;
②最高价氧化物对应水化物的碱性越强,元素的金属性 。如碱性:NaOH>Mg(OH)2,则金属性:Na>Mg;
③金属单质间的置换反应。如Zn+Cu2+=Zn2++Cu,则金属性:Zn>Cu;
④元素的原子对应阳离子的氧化性越强,则元素的金属性 。如氧化性:Mg2+>Na+,则金属性:Mg<Na。
(3)根据金属活动性顺序判断
一般来说,排在前面的金属元素其金属性比排在后面的强。如Fe排在Cu的前面,则金属性:Fe>Cu。
【注意】金属性强弱的比较,关键是比较原子失去电子的难易,而不是失去电子数的多少。如Na失去一个电子,而Mg失去两个电子,但Na的金属性比Mg强。
2、非金属性的比较
比较元素非金属性的强弱,其实质是看元素原子 电子的难易程度,越易 电子,非金属性越 。
(1)根据元素周期表判断
①同一周期,从左到右,随着原子序数的递增,元素的非金属性逐渐 ;
②同一主族,从上到下,随着原子序数的递增,元素的非金属性逐渐 。
(2)根据元素单质及其化合物的相关性质判断
①非金属单质越易跟H2化合,其非金属性 。如F2与H2在暗处即可反应,Br2与H2在加热条件下才能反应,则非金属性:F>Br;
②气态氢化物越稳定,其非金属性 。如稳定性:HF>HCl,则非金属性:F>Cl;
③最高价氧化物对应水化物的酸性越强,其非金属性 。如酸性:H2SO4>H3PO4,则非金属性:S>P;
④非金属单质间的置换反应。如Cl2+2KI=2KCl+I2,则非金属性:Cl>I;
⑤元素的原子对应阴离子的还原性越强,其非金属性就 。如还原性:S2->Cl-,则非金属性:Cl>S。
三、元素的化合价与元素在周期表中的位置关系
主族元素的最高正化合价等于原子所能 的最外层电子数(价电子),而非金属的最低负化合价则等于使原子达到8电子稳定结构所需 的电子数。所以,非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于 。
(1)最高正化合价= 序数=原子 电子数(O、F除外)。 (2)最高正化合价+|最低负化合价|= 。
【归纳总结】元素金属性、非金属性递变与其在周期表中的位置关系
碱性最强的是CsOH,酸性最强的含氧酸是HClO4。
四、元素周期表和元素周期律的应用
(1)指导其他与化学相关的科学技术
①在周期表中__________________,可以找到半导体材料。
②在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
③寻找制取农药的元素 。
(2)元素周期表和元素周期律的理论应用
① 预测元素的性质
例1、镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是( )
A.镭比钙金属性更强 B.氢氧化物呈两性
C.在化合物中呈+2价 D.碳酸盐难溶于水
② 比较元素的性质
例2、下列说法正确的是( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强。
D.甲、乙两种非金属元素与金属钠反应时,甲得电子的数目多,所以甲活泼。
例3、已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4
C、单质与氢气反应按照X、Y、Z顺序越来越容易
D、气态氢化物的稳定性按照X、Y、Z顺序减弱
【归纳总结】“位”“构”“性”总结
【归纳总结】元素周期律的应用
【课堂练习】
1、下列说法错误的是( )
A.作半导体材料的元素大多数位于周期表中金属元素和非金属元素的
交界处
B.农药中常含有的元素通常在元素周期表的右上方区域内
C.构成催化剂的元素通常在元素周期表的左下方区域内
D.在周期表过渡元素中寻找作耐高温和耐腐蚀的合金材料的元素
2、X、Y是元素周期表第ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
本节课属于内容较抽象,理论性强,教学必须具有严密的逻辑性,从课堂教学的结构上,应当体现出教材本身逻辑系统的要求;要重视理论推理。为了提高学生学习的积极性,希望通过课堂讨论的形式和实验现象进行适当的引导,多让学生自主思考和交流,启发学生动脑、动口、动手,主动积极地进行学习,以提高他们的逻辑思维能力和语言表达能力,从而提高教学质量。因此,在今后的教学中,我们只有不断地反思自己,去伪存真,扬长避短,方能提升自己、完善自己。从素养为本的课堂中提高学生宏观辨识与微观探析、证据推理与模型认知的核心素养。
