4.1原子结构与元素周期表第3课时课件(共27张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1原子结构与元素周期表第3课时课件(共27张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 62.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 08:42:31 | ||
图片预览








文档简介
(共27张PPT)
第一节 原子结构与元素周期表
第四章 物质结构 元素周期律
第3课时:原子结构与元素的性质
目 录
CONTENTS
01
碱金属元素
02
卤族元素
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有2个视频,根据需要选择即时播放。
视频清单
①碱金属元素的性质
②卤族元素的性质
致老师和同学们
学习目标
1.了解碱金属、卤素在周期表中的位置及其原子结构特点,了解原子结构与元素性质的关系。
2.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释同主族元素性质的递变规律。
新课导入
我们知道,金属元素的原子最外层电子一般少于4个,在化学反应中容易失去电子,具有金属性;非金属元素的原子最外层电子一般多于4个,在化学反应中容易得到电子,具有非金属性。所以说原子结构决定元素的性质。人们经常把元素周期表中的同族元素放在一起研究,是因为它们之间存在着某种内在的联系。那么,这种内在的联系是什么呢?我们将从它们的结构和性质的关系来进行探讨。
1
碱金属元素
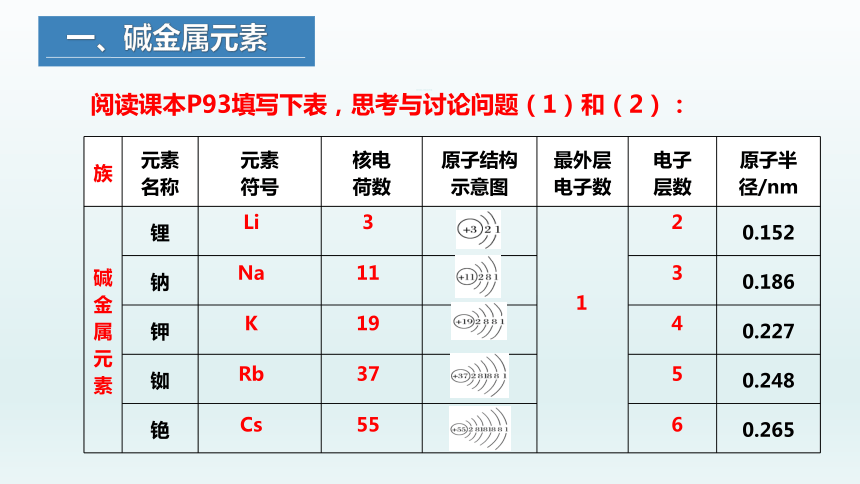
阅读课本P93填写下表,思考与讨论问题(1)和(2):
族 元素 名称 元素 符号 核电 荷数 原子结构 示意图 最外层 电子数 电子 层数 原子半
径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
填写下表中信息,并思考与讨论下列问题。
Li
Na
K
Rb
Cs
3
11
19
37
55
1
2
3
4
5
6
一、碱金属元素
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?从哪一点能够推断出碱金属元素的化学性质具有相似性?
阅读课本P93填写下表,思考与讨论问题:
一、碱金属元素
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?从哪一点能够推断出碱金属元素的化学性质具有相似性?
一、碱金属元素
1.碱金属元素的原子结构特点
(1)相似性
碱金属元素原子的最外层都有1个电子,很容易失去,最高正价为+1价,最高价氧化物对应的水化物均为强碱,是典型的活泼金属元素。
(2)递变性
随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大。
一、碱金属元素
2.碱金属元素的化学性质
(1)相似性(用R表示碱金属元素)
一、碱金属元素
2.碱金属元素的化学性质
(2)递变性
一、碱金属元素
元素名称 元素符号 核电荷数 颜色和状态 密度g/cm3 熔点℃ 沸点℃
锂 Li 3 银白色, 柔软 0.534 180.5 1347
钠 Na 11 银白色, 柔软 0.97 97.81 882.9
钾 K 19 银白色, 柔软 0.86 63.65 774
铷 Rb 37 银白色, 柔软 1.532 38.89 688
铯 Cs 55 略带金色光泽,柔软 1.879 28.40 678.4
阅读课本P95表4-2,分析归纳碱金属物理性质有哪些相似性和递变性?
一、碱金属元素
1. 相似性
碱金属单质都有银白色的金属光泽(但铯略带金色光泽)、硬度小、有延展性,密度小、熔沸点较低,导电、导热性良好。液态钠钾合金可做原子反应堆的导热剂。
2. 递变性
随着核电荷数的增加,单质的熔点和沸点逐渐降低,密度逐渐增大,(但ρK﹤ρNa),且Li、Na、K 的密度﹤1,Rb、Cs的密度 >1。
2.碱金属单质的物理性质
一、碱金属元素
最外层电子数
电子层数
核电荷数
原子半径
原子
结构
相似性
递变性
元素
性质
I A
同主族——ⅠA族
周期表
位置
碱金属元素
决 定
反 映
原子失电子能力
“位置—结构—性质”模型
一、碱金属元素
【小 结】
[典例1]下列有关金属钠和金属钾的比较,正确的是( )
A.金属性:Na>K
B.氢氧化物的碱性:NaC.还原性:Na>K
D.与水反应的剧烈程度:Na>K
B
一、碱金属元素
[典例2]同主族元素性质类似,下列关于碱金属元素的说法中正确的是( )
A.从上到下,原子半径和单质的熔、沸点逐渐减小
B.Cs的活动性强于K,则Cs可从K的盐溶液中置换出K
C.Li、Na、K均可保存在煤油中
D.Li+、Na+、K+、Rb+、Cs+的离子半径逐渐增大,氧化性逐渐减弱
D
一、碱金属元素
2
卤族元素
1.卤族元素的主要物理性质
阅读课本P96 表4-3,归纳卤族元素物理性质的递变规律。
F2 Cl2 Br2 I2
浅黄绿色
气体
黄绿色
气体
深红棕色
液体
紫黑色
固体
密度逐渐增大,熔沸点逐渐升高
二、卤族元素
2.卤族元素的原子结构特点
阅读课本P96 图4-10,归纳卤族元素原子结构的递变规律。
二、卤族元素
根据卤素原子结构,推测氟、氯、溴、碘在化学性质上所表现的相似性和递变性?
(1)相似性:最外层电子数均为7
(2)递变性: 随核电荷数逐渐增大,电子层数逐渐增多, 原子半径逐渐增大。
3.卤素单质的化学性质
(1)卤素与氢气反应
H2+X2=2HX
( X=F、Cl、Br、I )
卤素 条件及现象 方程式 氢化物稳定性
F2 冷暗处爆炸
Cl2 光照或点燃
Br2 高温 500℃
I2 高温、持续加热缓慢进行
① 与氢气反应的难易程度: ;
② 生成氢化物的稳定性: ;
③ 卤素非金属性的强弱: ;
由易到难
由强到弱
由强到弱
H2+F2=2HF
H2+Cl2=2HCl
H2+Br2=2HBr
H2+I2 2HI
HF很稳定
HCl稳定
HBr较不稳定
HI很不稳定
二、卤族元素
【实验】4-1,观察实验现象,你能得出什么结论?
二、卤族元素
实验 现象 化学方程式
KBr+氯水 振荡
KI+氯水 振荡
KI+溴水 振荡
2KBr + Cl2 = 2KCl +Br2
2KI + Cl2 = 2KCl +I2
2KI + Br2 = 2KBr +I2
2Br-+Cl2=2Cl-+Br2
2I-+Cl2 = 2Cl-+I2
2I-+Br2 = 2Br-+I2
(2)卤素单质间的置换反应
溶液颜色变为橙色
溶液颜色变为紫红色
溶液颜色变为紫红色
二、卤族元素
结论:从Cl2→I2单质氧化性逐渐减弱。
[典例3]含KBr和KI的混合溶液中通入过量的Cl2,然后把溶液蒸干并灼烧,最后留下的固体是( )
A.KCl
B.KCl和KBr的混合物
C.Br2
D.I2和KCl
A
二、卤族元素
[典例4]下列关于卤族元素由上到下性质递变的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.④⑤
C
二、卤族元素
课堂小结
谢谢观赏
第一节 原子结构与元素周期表
第四章 物质结构 元素周期律
第3课时:原子结构与元素的性质
目 录
CONTENTS
01
碱金属元素
02
卤族元素
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有2个视频,根据需要选择即时播放。
视频清单
①碱金属元素的性质
②卤族元素的性质
致老师和同学们
学习目标
1.了解碱金属、卤素在周期表中的位置及其原子结构特点,了解原子结构与元素性质的关系。
2.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释同主族元素性质的递变规律。
新课导入
我们知道,金属元素的原子最外层电子一般少于4个,在化学反应中容易失去电子,具有金属性;非金属元素的原子最外层电子一般多于4个,在化学反应中容易得到电子,具有非金属性。所以说原子结构决定元素的性质。人们经常把元素周期表中的同族元素放在一起研究,是因为它们之间存在着某种内在的联系。那么,这种内在的联系是什么呢?我们将从它们的结构和性质的关系来进行探讨。
1
碱金属元素
阅读课本P93填写下表,思考与讨论问题(1)和(2):
族 元素 名称 元素 符号 核电 荷数 原子结构 示意图 最外层 电子数 电子 层数 原子半
径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
填写下表中信息,并思考与讨论下列问题。
Li
Na
K
Rb
Cs
3
11
19
37
55
1
2
3
4
5
6
一、碱金属元素
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?从哪一点能够推断出碱金属元素的化学性质具有相似性?
阅读课本P93填写下表,思考与讨论问题:
一、碱金属元素
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?从哪一点能够推断出碱金属元素的化学性质具有相似性?
一、碱金属元素
1.碱金属元素的原子结构特点
(1)相似性
碱金属元素原子的最外层都有1个电子,很容易失去,最高正价为+1价,最高价氧化物对应的水化物均为强碱,是典型的活泼金属元素。
(2)递变性
随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大。
一、碱金属元素
2.碱金属元素的化学性质
(1)相似性(用R表示碱金属元素)
一、碱金属元素
2.碱金属元素的化学性质
(2)递变性
一、碱金属元素
元素名称 元素符号 核电荷数 颜色和状态 密度g/cm3 熔点℃ 沸点℃
锂 Li 3 银白色, 柔软 0.534 180.5 1347
钠 Na 11 银白色, 柔软 0.97 97.81 882.9
钾 K 19 银白色, 柔软 0.86 63.65 774
铷 Rb 37 银白色, 柔软 1.532 38.89 688
铯 Cs 55 略带金色光泽,柔软 1.879 28.40 678.4
阅读课本P95表4-2,分析归纳碱金属物理性质有哪些相似性和递变性?
一、碱金属元素
1. 相似性
碱金属单质都有银白色的金属光泽(但铯略带金色光泽)、硬度小、有延展性,密度小、熔沸点较低,导电、导热性良好。液态钠钾合金可做原子反应堆的导热剂。
2. 递变性
随着核电荷数的增加,单质的熔点和沸点逐渐降低,密度逐渐增大,(但ρK﹤ρNa),且Li、Na、K 的密度﹤1,Rb、Cs的密度 >1。
2.碱金属单质的物理性质
一、碱金属元素
最外层电子数
电子层数
核电荷数
原子半径
原子
结构
相似性
递变性
元素
性质
I A
同主族——ⅠA族
周期表
位置
碱金属元素
决 定
反 映
原子失电子能力
“位置—结构—性质”模型
一、碱金属元素
【小 结】
[典例1]下列有关金属钠和金属钾的比较,正确的是( )
A.金属性:Na>K
B.氢氧化物的碱性:Na
D.与水反应的剧烈程度:Na>K
B
一、碱金属元素
[典例2]同主族元素性质类似,下列关于碱金属元素的说法中正确的是( )
A.从上到下,原子半径和单质的熔、沸点逐渐减小
B.Cs的活动性强于K,则Cs可从K的盐溶液中置换出K
C.Li、Na、K均可保存在煤油中
D.Li+、Na+、K+、Rb+、Cs+的离子半径逐渐增大,氧化性逐渐减弱
D
一、碱金属元素
2
卤族元素
1.卤族元素的主要物理性质
阅读课本P96 表4-3,归纳卤族元素物理性质的递变规律。
F2 Cl2 Br2 I2
浅黄绿色
气体
黄绿色
气体
深红棕色
液体
紫黑色
固体
密度逐渐增大,熔沸点逐渐升高
二、卤族元素
2.卤族元素的原子结构特点
阅读课本P96 图4-10,归纳卤族元素原子结构的递变规律。
二、卤族元素
根据卤素原子结构,推测氟、氯、溴、碘在化学性质上所表现的相似性和递变性?
(1)相似性:最外层电子数均为7
(2)递变性: 随核电荷数逐渐增大,电子层数逐渐增多, 原子半径逐渐增大。
3.卤素单质的化学性质
(1)卤素与氢气反应
H2+X2=2HX
( X=F、Cl、Br、I )
卤素 条件及现象 方程式 氢化物稳定性
F2 冷暗处爆炸
Cl2 光照或点燃
Br2 高温 500℃
I2 高温、持续加热缓慢进行
① 与氢气反应的难易程度: ;
② 生成氢化物的稳定性: ;
③ 卤素非金属性的强弱: ;
由易到难
由强到弱
由强到弱
H2+F2=2HF
H2+Cl2=2HCl
H2+Br2=2HBr
H2+I2 2HI
HF很稳定
HCl稳定
HBr较不稳定
HI很不稳定
二、卤族元素
【实验】4-1,观察实验现象,你能得出什么结论?
二、卤族元素
实验 现象 化学方程式
KBr+氯水 振荡
KI+氯水 振荡
KI+溴水 振荡
2KBr + Cl2 = 2KCl +Br2
2KI + Cl2 = 2KCl +I2
2KI + Br2 = 2KBr +I2
2Br-+Cl2=2Cl-+Br2
2I-+Cl2 = 2Cl-+I2
2I-+Br2 = 2Br-+I2
(2)卤素单质间的置换反应
溶液颜色变为橙色
溶液颜色变为紫红色
溶液颜色变为紫红色
二、卤族元素
结论:从Cl2→I2单质氧化性逐渐减弱。
[典例3]含KBr和KI的混合溶液中通入过量的Cl2,然后把溶液蒸干并灼烧,最后留下的固体是( )
A.KCl
B.KCl和KBr的混合物
C.Br2
D.I2和KCl
A
二、卤族元素
[典例4]下列关于卤族元素由上到下性质递变的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.④⑤
C
二、卤族元素
课堂小结
谢谢观赏
