2.3物质的量的单位——摩尔 教案(表格式)
文档属性
| 名称 | 2.3物质的量的单位——摩尔 教案(表格式) | 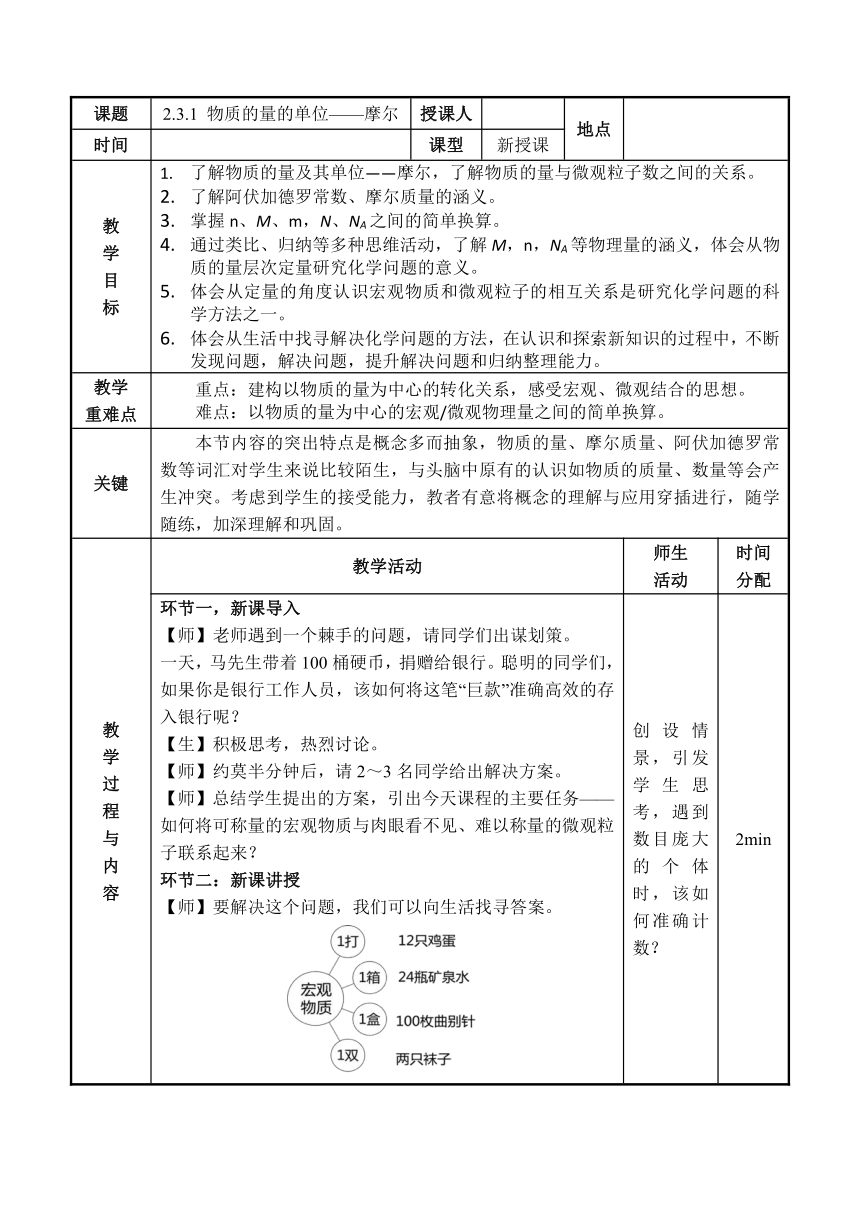 | |
| 格式 | docx | ||
| 文件大小 | 210.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 09:53:31 | ||
图片预览



文档简介
课题 2.3.1 物质的量的单位——摩尔 授课人 地点
时间 课型 新授课
教 学 目 标 了解物质的量及其单位——摩尔,了解物质的量与微观粒子数之间的关系。 了解阿伏加德罗常数、摩尔质量的涵义。 掌握n、M、m,N、NA之间的简单换算。 通过类比、归纳等多种思维活动,了解M,n,NA等物理量的涵义,体会从物质的量层次定量研究化学问题的意义。 体会从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学方法之一。 体会从生活中找寻解决化学问题的方法,在认识和探索新知识的过程中,不断发现问题,解决问题,提升解决问题和归纳整理能力。
教学 重难点 重点:建构以物质的量为中心的转化关系,感受宏观、微观结合的思想。 难点:以物质的量为中心的宏观/微观物理量之间的简单换算。
关键 本节内容的突出特点是概念多而抽象,物质的量、摩尔质量、阿伏加德罗常数等词汇对学生来说比较陌生,与头脑中原有的认识如物质的质量、数量等会产生冲突。考虑到学生的接受能力,教者有意将概念的理解与应用穿插进行,随学随练,加深理解和巩固。
教 学 过 程 与 内 容 教学活动 师生 活动 时间 分配
环节一,新课导入 【师】老师遇到一个棘手的问题,请同学们出谋划策。 一天,马先生带着100桶硬币,捐赠给银行。聪明的同学们,如果你是银行工作人员,该如何将这笔“巨款”准确高效的存入银行呢? 【生】积极思考,热烈讨论。 【师】约莫半分钟后,请2~3名同学给出解决方案。 【师】总结学生提出的方案,引出今天课程的主要任务——如何将可称量的宏观物质与肉眼看不见、难以称量的微观粒子联系起来? 环节二:新课讲授 【师】要解决这个问题,我们可以向生活找寻答案。 创设情景,引发学生思考,遇到数目庞大的个体时,该如何准确计数? 2min
教 学 过 程 与 内 容 教学活动 师生 活动 时间 分配
想一想,如果,你去超市购买60只鸡蛋,是一只一只的数方便,还是把鸡蛋“打包”起来,一堆一堆的数方便呢? 【生】将小个体打包起来,数集合方便。 【师】我们常常见到“1打,1箱,1盒……”这类的计量方式。把微小物质扩大倍数,形成一定数目的集合体,方便生活、交流、科学研究。在化学里,是否也可以定义“1集合体分子、原子、离子……”呢?是1箱,还是1盒呢? 【生】1摩尔。 【师】没错,对于微观粒子,我们也可以将其打包起来,称作“1摩尔”或“几摩尔”,这便是我们今天要认识的第一个物理量——物质的量。 【板书】一、物质的量 1. 定义:表示含有一定数目粒子的集合体的物理量,符号n 【师】物质的量,是一个物理量,表示含有一定数目粒子的集合体,符号为n。那它既然是一个物理量,自然有相应的单位了。 【板书】2. 单位:摩尔,简称摩,符号mol。 【师】那么问题又来了,1摩尔包含多少个体呢?是12,24,亦或是100,1000 呢? 【生】6.02×1023 【师】国际上规定,1mol粒子集合体所含的粒子数约为6.02×1023。 【师】一粒大米的质量约为0.02g,请大家试着算一算,6.02×1023粒大米的质量是多少?如果把6.02×1023粒米给全球70亿人吃,每人每天吃一斤,又能吃多久呢? 【生】0.02×6.02×1023=1.204×1022g =1.204×1016 吨 【生】≈10万年 【师】这是人类遥不可及的天文数字。 回归生活,运用类比、对比的学习方法,体会将个体组成一个集合进行计数的便利。 学生动手计算6.02×1023粒米的质量是多少? 用具体的实例让学生感受6.02×1023是一个多么遥不可及的数字。 8min
教 学 过 程 与 内 容 教学活动 师生 活动 时间 分配
【随堂巩固】 1. 下列叙述是否正确? 摩尔是七个物理量之一。 物质的量就是物质的质量,简写为物质量。 1摩尔大米含有 6.02×1023粒米。 1 mol氯。 2. 说出下列符号的意义 ①2H, ②2mol H, ③2mol H+, ④2molH2 3. 用化学符号表示 ①2摩尔水分子、②5摩尔硫酸根离子、③2.3 摩尔碳酸氢根离子④b摩尔亚铁离子 【师】通过这几道例题,同学们能否感受到在使用“物质的量”时,都有哪些要注意的地方呢? 【生1】物质的量才是基本物理量,摩尔只是它的单位; 【生2】“物质的量”四个字不能拆开,也不能省略; 【生3】物质的量只能用来描述微观粒子,原子、分子…… 【生4】要指明具体粒子的种类,常用化学符号表示 【师】学生回答的已经很全面了,简单过渡即可。 【板书】二、阿伏加德罗常数 定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。 【师】阿伏加德罗常数是一个精确测定的数值,只不过在计算时,近似等于6.02×1023。然而,这个常数并不是阿伏加德罗先生发现的,后人为了纪念他,以他的名字命名。 【板书】 2. 符号:NA,通常用6.02×1023 mol-1表示。 3. 阿伏加德罗常数是一个物理量,单位是mol-1。 【师】有意思的是,每年的10月23日是世界摩尔日,因为美式的日期表示,与阿伏加德罗常数相似,因而,人们在这一天的上午6:02~下午6:02之间,举办各种有趣活动,庆祝这个日子。更有趣的是,因为“mole”这个词,与英文中的“鼹鼠”相同,因而,这个呆萌的小动物便顺理成章的成为了世界摩尔日的吉祥物了。 附上几道简单习题,鼓励学生犯错,加深对物质的量这个物理量的认识和理解,并在纠错过程中,体会 物理量的使用注意事项。 趣味化学,将枯燥的阿伏加德罗常数与生动有趣的节日,小动物联系起来,缓解沉闷的气氛,再度激发学生学习兴趣。 10min
教 学 过 程 与 内 容 教学活动 师生活动 时间 分配
【过渡】 【思考】如何理解阿伏加德罗常数(NA)与6.02×1023 mol-1、6.02×1023的关系? 【生】积极思考,踊跃发言 【师】 (1) 联系:三者均可表示1 mol粒子的个数。 (2) 区别:阿伏加德罗常数(NA)是一个精确数值; NA ≈ 6.02×1023 mol-1,有单位; 而6.02×1023,是一个数值,无单位。 建构物质的量与粒子数之间的关系 【板书】 4. 物质的量、阿伏加德罗常数与粒子数(N)之间的关系: 【随堂巩固】 1. 1mol 氯原子含有__________个氯原子; 2. 0.3 mol硫酸根离子含有个___________硫酸根离子; 3. 10mol 水分子含有___________个氢原子, 含有________个质子,含有___________个水分子; 4. 下列关于阿伏加德罗常数的说法正确的是: 阿伏加德罗常数是一个纯数,没有单位; 阿伏加德罗常数就是6.02×1023; 阿伏加德罗常数是指1mol任何粒子的粒子数; 阿伏加德罗常数的近似值为: 6.02×1023 mol-1。 5. 知识拓展 (1) 1摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子 H2O 2H O 微粒个数 1 2 1 微粒集体 NA 2NA NA 物质的量 1mol 2mol 1mol 【生】总结并得出结论:微粒之间的物质的量之比等于微粒间个数比 附上几道例题,加深物质的量、阿伏加德罗常数与粒子数(N)之间的关系的理解。 5 min
教 学 过 程 与 内 容 教学活动 师生活动 时间 分配
(2) 2H2 + O2 === 2H2O 微粒个数 2个 1个 2个 物质的量 2mol 1mol 2mol 【生】总结并得出结论:化学方程式中,反应过程中各物质的物质的量之比等于其化学计量系数之比。 【过渡】1摩尔微粒的数量我们已经知道是多少了,那么1摩尔微粒的质量又是多少呢?这其中是否存在什么规律? 【师】大家有什么发现么? 【生】1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。 【师】那么,1mol不同物质的质量和什么有关呢,下面我们继续看一组实验数据。 【讨论】请大家动动小手,计算1摩尔物质的质量是多少?根据你的计算结果,可得出什么规律? 【生】1mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。 【过渡】这便是我们今天要认识的第三个物理量——摩尔质量。 【师】一边板书,一边讲解。 【板书】三、摩尔质量 1. 定义:单位物质的量 (1mol) 的物质所具有的质量叫做摩尔质量。 2. 符号是M,单位:g/mol (或g·mol-1) 3. 定义式 列举事实,让学生归纳并得出结论。 列举事实,让学生通过观察、归纳,得出结论。 实践体验,观察、计算、归纳,得出结论。 10min
教 学 过 程 与 内 容 教学活动 师生活动 时间 分配
【随堂巩固】 1mol H2SO4的摩尔质量为_________ 5mol H2SO4的摩尔质量为_________ H2SO4的相对分子质量为_____ 1 mol H2O的质量为_________ n molH2O的质量为_________ 24.5 g H2SO4的物质的量是___________ 【生】归纳(1)摩尔质量有单位,“g·mol-1 ”,数值上等于该物质的式量;(2)对于指定物质,摩尔质量为一个定值,不随其物质的量多少而改变; 【师】补充:平均摩尔质量 【板书】5. 质量、物质的量和摩尔质量的关系 【板书】6. 质量m、物质的量n、摩尔质量M、NA、粒子数N之间的关系 环节三:本课小结 【生】结合板书,总结本课所学内容 随堂练习,体会“摩尔质量”这一物理量的使用注意事项。 。 学生总结 5 min
板书 设计 2.3.1 物质的量单位——摩尔 一、物质的量 1. 定义:是一个物理量,表示含有一定数目粒子的集合体。符号为n。 2. 单位:摩尔,简称摩,符号mol。 二、阿伏加德罗常数 1. 定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。 2. 符号:NA,通常用6.02×1023 mol-1表示。 3. 阿伏加德罗常数是一个物理量,单位是mol-1。 4. 物质的量、阿伏加德罗常数与粒子数(N)之间的关系: 三、摩尔质量 1. 定义:单位物质的量 (1mol) 的物质所具有的质量叫做摩尔质量。 2. 符号是M,单位:g/mol (或g·mol-1) 3. 定义式 4. 质量、物质的量和摩尔质量的关系 5. 质量m、物质的量n、摩尔质量M、NA、粒子数N之间的关系
时间 课型 新授课
教 学 目 标 了解物质的量及其单位——摩尔,了解物质的量与微观粒子数之间的关系。 了解阿伏加德罗常数、摩尔质量的涵义。 掌握n、M、m,N、NA之间的简单换算。 通过类比、归纳等多种思维活动,了解M,n,NA等物理量的涵义,体会从物质的量层次定量研究化学问题的意义。 体会从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学方法之一。 体会从生活中找寻解决化学问题的方法,在认识和探索新知识的过程中,不断发现问题,解决问题,提升解决问题和归纳整理能力。
教学 重难点 重点:建构以物质的量为中心的转化关系,感受宏观、微观结合的思想。 难点:以物质的量为中心的宏观/微观物理量之间的简单换算。
关键 本节内容的突出特点是概念多而抽象,物质的量、摩尔质量、阿伏加德罗常数等词汇对学生来说比较陌生,与头脑中原有的认识如物质的质量、数量等会产生冲突。考虑到学生的接受能力,教者有意将概念的理解与应用穿插进行,随学随练,加深理解和巩固。
教 学 过 程 与 内 容 教学活动 师生 活动 时间 分配
环节一,新课导入 【师】老师遇到一个棘手的问题,请同学们出谋划策。 一天,马先生带着100桶硬币,捐赠给银行。聪明的同学们,如果你是银行工作人员,该如何将这笔“巨款”准确高效的存入银行呢? 【生】积极思考,热烈讨论。 【师】约莫半分钟后,请2~3名同学给出解决方案。 【师】总结学生提出的方案,引出今天课程的主要任务——如何将可称量的宏观物质与肉眼看不见、难以称量的微观粒子联系起来? 环节二:新课讲授 【师】要解决这个问题,我们可以向生活找寻答案。 创设情景,引发学生思考,遇到数目庞大的个体时,该如何准确计数? 2min
教 学 过 程 与 内 容 教学活动 师生 活动 时间 分配
想一想,如果,你去超市购买60只鸡蛋,是一只一只的数方便,还是把鸡蛋“打包”起来,一堆一堆的数方便呢? 【生】将小个体打包起来,数集合方便。 【师】我们常常见到“1打,1箱,1盒……”这类的计量方式。把微小物质扩大倍数,形成一定数目的集合体,方便生活、交流、科学研究。在化学里,是否也可以定义“1集合体分子、原子、离子……”呢?是1箱,还是1盒呢? 【生】1摩尔。 【师】没错,对于微观粒子,我们也可以将其打包起来,称作“1摩尔”或“几摩尔”,这便是我们今天要认识的第一个物理量——物质的量。 【板书】一、物质的量 1. 定义:表示含有一定数目粒子的集合体的物理量,符号n 【师】物质的量,是一个物理量,表示含有一定数目粒子的集合体,符号为n。那它既然是一个物理量,自然有相应的单位了。 【板书】2. 单位:摩尔,简称摩,符号mol。 【师】那么问题又来了,1摩尔包含多少个体呢?是12,24,亦或是100,1000 呢? 【生】6.02×1023 【师】国际上规定,1mol粒子集合体所含的粒子数约为6.02×1023。 【师】一粒大米的质量约为0.02g,请大家试着算一算,6.02×1023粒大米的质量是多少?如果把6.02×1023粒米给全球70亿人吃,每人每天吃一斤,又能吃多久呢? 【生】0.02×6.02×1023=1.204×1022g =1.204×1016 吨 【生】≈10万年 【师】这是人类遥不可及的天文数字。 回归生活,运用类比、对比的学习方法,体会将个体组成一个集合进行计数的便利。 学生动手计算6.02×1023粒米的质量是多少? 用具体的实例让学生感受6.02×1023是一个多么遥不可及的数字。 8min
教 学 过 程 与 内 容 教学活动 师生 活动 时间 分配
【随堂巩固】 1. 下列叙述是否正确? 摩尔是七个物理量之一。 物质的量就是物质的质量,简写为物质量。 1摩尔大米含有 6.02×1023粒米。 1 mol氯。 2. 说出下列符号的意义 ①2H, ②2mol H, ③2mol H+, ④2molH2 3. 用化学符号表示 ①2摩尔水分子、②5摩尔硫酸根离子、③2.3 摩尔碳酸氢根离子④b摩尔亚铁离子 【师】通过这几道例题,同学们能否感受到在使用“物质的量”时,都有哪些要注意的地方呢? 【生1】物质的量才是基本物理量,摩尔只是它的单位; 【生2】“物质的量”四个字不能拆开,也不能省略; 【生3】物质的量只能用来描述微观粒子,原子、分子…… 【生4】要指明具体粒子的种类,常用化学符号表示 【师】学生回答的已经很全面了,简单过渡即可。 【板书】二、阿伏加德罗常数 定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。 【师】阿伏加德罗常数是一个精确测定的数值,只不过在计算时,近似等于6.02×1023。然而,这个常数并不是阿伏加德罗先生发现的,后人为了纪念他,以他的名字命名。 【板书】 2. 符号:NA,通常用6.02×1023 mol-1表示。 3. 阿伏加德罗常数是一个物理量,单位是mol-1。 【师】有意思的是,每年的10月23日是世界摩尔日,因为美式的日期表示,与阿伏加德罗常数相似,因而,人们在这一天的上午6:02~下午6:02之间,举办各种有趣活动,庆祝这个日子。更有趣的是,因为“mole”这个词,与英文中的“鼹鼠”相同,因而,这个呆萌的小动物便顺理成章的成为了世界摩尔日的吉祥物了。 附上几道简单习题,鼓励学生犯错,加深对物质的量这个物理量的认识和理解,并在纠错过程中,体会 物理量的使用注意事项。 趣味化学,将枯燥的阿伏加德罗常数与生动有趣的节日,小动物联系起来,缓解沉闷的气氛,再度激发学生学习兴趣。 10min
教 学 过 程 与 内 容 教学活动 师生活动 时间 分配
【过渡】 【思考】如何理解阿伏加德罗常数(NA)与6.02×1023 mol-1、6.02×1023的关系? 【生】积极思考,踊跃发言 【师】 (1) 联系:三者均可表示1 mol粒子的个数。 (2) 区别:阿伏加德罗常数(NA)是一个精确数值; NA ≈ 6.02×1023 mol-1,有单位; 而6.02×1023,是一个数值,无单位。 建构物质的量与粒子数之间的关系 【板书】 4. 物质的量、阿伏加德罗常数与粒子数(N)之间的关系: 【随堂巩固】 1. 1mol 氯原子含有__________个氯原子; 2. 0.3 mol硫酸根离子含有个___________硫酸根离子; 3. 10mol 水分子含有___________个氢原子, 含有________个质子,含有___________个水分子; 4. 下列关于阿伏加德罗常数的说法正确的是: 阿伏加德罗常数是一个纯数,没有单位; 阿伏加德罗常数就是6.02×1023; 阿伏加德罗常数是指1mol任何粒子的粒子数; 阿伏加德罗常数的近似值为: 6.02×1023 mol-1。 5. 知识拓展 (1) 1摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子 H2O 2H O 微粒个数 1 2 1 微粒集体 NA 2NA NA 物质的量 1mol 2mol 1mol 【生】总结并得出结论:微粒之间的物质的量之比等于微粒间个数比 附上几道例题,加深物质的量、阿伏加德罗常数与粒子数(N)之间的关系的理解。 5 min
教 学 过 程 与 内 容 教学活动 师生活动 时间 分配
(2) 2H2 + O2 === 2H2O 微粒个数 2个 1个 2个 物质的量 2mol 1mol 2mol 【生】总结并得出结论:化学方程式中,反应过程中各物质的物质的量之比等于其化学计量系数之比。 【过渡】1摩尔微粒的数量我们已经知道是多少了,那么1摩尔微粒的质量又是多少呢?这其中是否存在什么规律? 【师】大家有什么发现么? 【生】1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。 【师】那么,1mol不同物质的质量和什么有关呢,下面我们继续看一组实验数据。 【讨论】请大家动动小手,计算1摩尔物质的质量是多少?根据你的计算结果,可得出什么规律? 【生】1mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。 【过渡】这便是我们今天要认识的第三个物理量——摩尔质量。 【师】一边板书,一边讲解。 【板书】三、摩尔质量 1. 定义:单位物质的量 (1mol) 的物质所具有的质量叫做摩尔质量。 2. 符号是M,单位:g/mol (或g·mol-1) 3. 定义式 列举事实,让学生归纳并得出结论。 列举事实,让学生通过观察、归纳,得出结论。 实践体验,观察、计算、归纳,得出结论。 10min
教 学 过 程 与 内 容 教学活动 师生活动 时间 分配
【随堂巩固】 1mol H2SO4的摩尔质量为_________ 5mol H2SO4的摩尔质量为_________ H2SO4的相对分子质量为_____ 1 mol H2O的质量为_________ n molH2O的质量为_________ 24.5 g H2SO4的物质的量是___________ 【生】归纳(1)摩尔质量有单位,“g·mol-1 ”,数值上等于该物质的式量;(2)对于指定物质,摩尔质量为一个定值,不随其物质的量多少而改变; 【师】补充:平均摩尔质量 【板书】5. 质量、物质的量和摩尔质量的关系 【板书】6. 质量m、物质的量n、摩尔质量M、NA、粒子数N之间的关系 环节三:本课小结 【生】结合板书,总结本课所学内容 随堂练习,体会“摩尔质量”这一物理量的使用注意事项。 。 学生总结 5 min
板书 设计 2.3.1 物质的量单位——摩尔 一、物质的量 1. 定义:是一个物理量,表示含有一定数目粒子的集合体。符号为n。 2. 单位:摩尔,简称摩,符号mol。 二、阿伏加德罗常数 1. 定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。 2. 符号:NA,通常用6.02×1023 mol-1表示。 3. 阿伏加德罗常数是一个物理量,单位是mol-1。 4. 物质的量、阿伏加德罗常数与粒子数(N)之间的关系: 三、摩尔质量 1. 定义:单位物质的量 (1mol) 的物质所具有的质量叫做摩尔质量。 2. 符号是M,单位:g/mol (或g·mol-1) 3. 定义式 4. 质量、物质的量和摩尔质量的关系 5. 质量m、物质的量n、摩尔质量M、NA、粒子数N之间的关系
