2.2.1 化学反应中能量变化的本质及转化形式同步练 (含解析)2023-2024学年高一下学期化学鲁科版(2019)必修2
文档属性
| 名称 | 2.2.1 化学反应中能量变化的本质及转化形式同步练 (含解析)2023-2024学年高一下学期化学鲁科版(2019)必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 148.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 11:19:27 | ||
图片预览



文档简介
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第1课时 化学反应中能量变化的本质及转化形式
基础过关
1.下列反应中,属于放热反应的是( )
①煅娆石灰石;②燃烧木炭取暖;③炸药爆炸;④酸与碱的中和反应;⑤碳与水蒸气制水煤气;⑥食物因氧化而腐败。
A. ①②④⑤ B. ②④⑤⑥ C. ②③④⑥ D. 全部
2.在下列反应中,反应物的总能量低于生成物的总能量的是( )
A. 2H2+O22H2O B. CaCO3CaO+CO2↑
C. CaO+CO2=CaCO3 D. C2H5OH+3O22CO2+3H2O
3.已知反应物的总能量高于产物的总能量,则反应是( )
A. 放热反应 B. 吸热反应 C. 有催化剂作用 D. 无法判断
4.下列过程放出热量的是( )
A. 断裂化学键 B. 水的分解
C. 总能量生成物高于反应物的反应 D. 浓硫酸稀释
5.已知断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol H—N键吸收的能量为391 kJ,根据化学方程式:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是( )
A. 431 kJ B. 945.6 kJ C. 649 kJ D. 869 kJ
6.下列图中能正确表示X + 3Y === 2Z(放热反应)过程的能量变化的是( )
A. B.
C. D.
7.下列说法错误的是 ( )
A. 放热反应在常温下不一定能直接发生
B. 需要加热方能发生的反应一定是吸热反应
C. 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小
D 吸热反应在一定条件下也能发生
8.化学反应过程中,除有新物质生成外,一定还有( )
A. 体积发生变化 B. 能量发生变化
C. 质量发生变化 D. 物质状态发生变化
9.关于吸热反应的说法正确的是( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
10.下列有关能量的叙述错误的是( )
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值
D.物质的化学能可以在一定条件下转化为热能、电能为人类所用
11.下列过程中能量的转化与图示吻合的是( )
A. 铵盐溶于水 B. C与CO 2 (g)反应
C. 水结成冰 D. 断开氢气中的H—H键
12.(双选)已知化学反应2C(s)+O2(g)2CO(g)、2CO(g)+O2(g)2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同) ( )
A. 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
B. 12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
C. 12 g C所具有的能量一定高于28 g CO所具有的能量
D.将一定质量的C燃烧,生成CO比生成CO2时放出的热量多
13.从宏观来看化学变化的本质是有新物质生成。从微观角度来看,下列变化不能说明发生了化学变化的是( )
A.变化时有电子的得失或共用电子对的形成
B.变化过程中有化学键的断裂和形成
C.变化时释放出能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
能力提升
14.某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2===2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
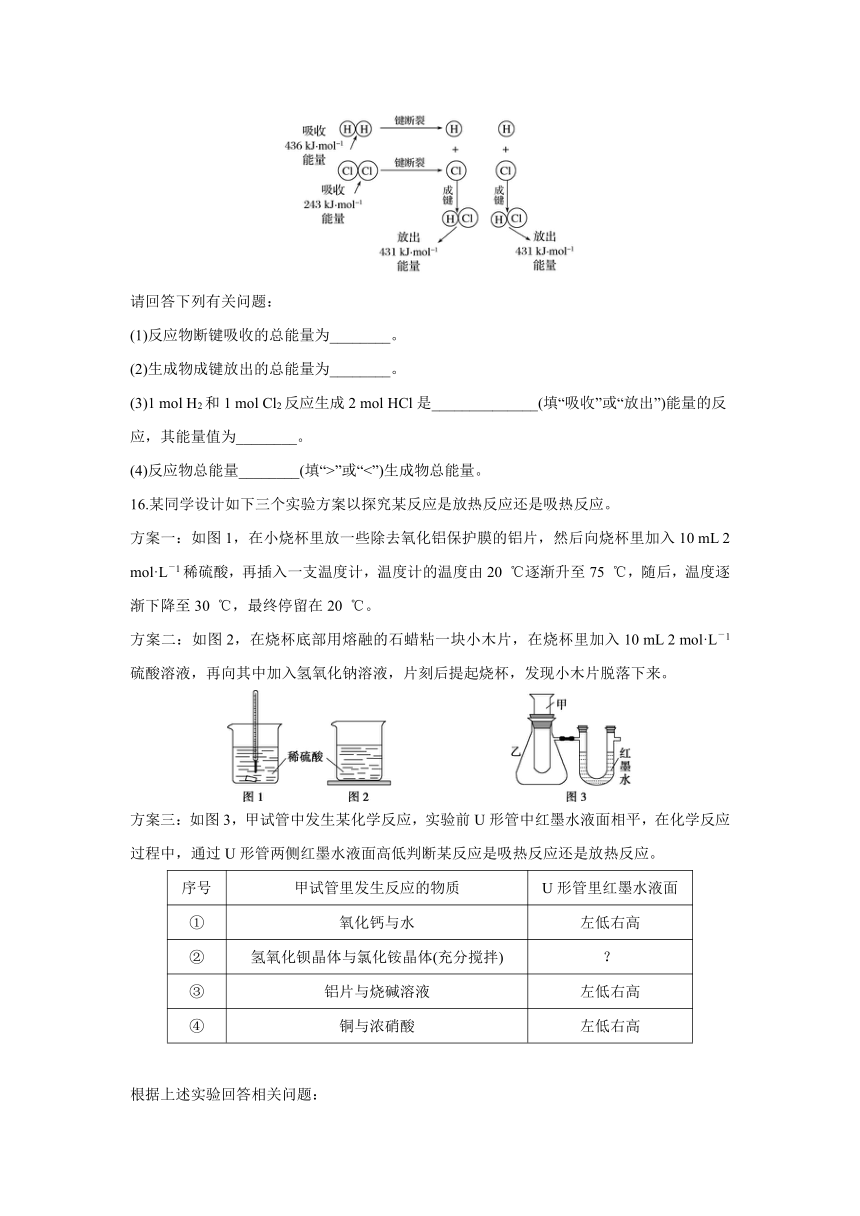
15. 在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl2===2HCl的化学反应可用下图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)1 mol H2和1 mol Cl2反应生成2 mol HCl是______________(填“吸收”或“放出”)能量的反应,其能量值为________。
(4)反应物总能量________(填“>”或“<”)生成物总能量。
16.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应。
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的石蜡粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
方案三:如图3,甲试管中发生某化学反应,实验前U形管中红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应。
序号 甲试管里发生反应的物质 U形管里红墨水液面
① 氧化钙与水 左低右高
② 氢氧化钡晶体与氯化铵晶体(充分搅拌) ?
③ 铝片与烧碱溶液 左低右高
④ 铜与浓硝酸 左低右高
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写出该反应的离子方程式:______________________________________________________________________________。
(2)方案一中,温度升至最大值后又下降的原因是________________________________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”、“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是___________________________。
(6)方案三实验②的U形管中的现象为______________________,说明反应物的总能量________(填“大于”、“小于”或“等于”)生成物的总能量。
参考答案
基础过关
1.【答案】C
【解析】①煅娆石灰石为吸热反应;
②燃烧木炭取暖,为放热反应;
③炸药爆炸释放出大量的能量,为放热反应;
④酸与碱的中和反应为放热反应;
⑤碳与水蒸气制水煤气为吸热反应;
⑥食物因氧化而腐败属于放热反应。
综上所述可知:属于放热反应的是②③④⑥,故合理选项是C。
2.【答案】B
【解析】A.2H2+O22H2O反应放热,反应物的总能量大于生成物的总能量,故A错误;
B.CaCO3CaO+CO2↑反应吸热,反应物的总能量低于生成物的总能量,故B正确;
C.CaO+CO2===CaCO3反应放热,反应物的总能量大于生成物的总能量,故C错误;
D.C2H5OH+3O22CO2+3H2O反应放热,反应物的总能量大于生成物的总能量,故D错误。
3.【答案】A
【解析】反应物的总能量高于产物的总能量的反应是放热反应,故A正确;反应物的总能量低于产物的总能量的反应是吸热反应,故B错误;催化剂对反应热无影响,故C错误; D错误。
4.【答案】D
【解析】A、断裂化学键需要吸收能量,A不选;
B.水的分解为吸热反应,B不选;
C. 总能量生成物高于反应物的反应为吸热反应,C不选;
D.浓硫酸稀释,放出大量的热,D选。
答案选D。
5.【答案】B
【解析】H-H键能为436kJ/mol,H-N键能为391kJ/mol,设N≡N的键能为x,对于反应N2(g)+3H2(g)2NH3(g) H =-92.4kJ/mol, H=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,解得:x=945.6 kJ/mol,断裂1molN≡N吸收945.6kJ的能量,故选B。
6.【答案】B
【解析】A.由于生成物的能量比反应物高,所以该反应为吸热反应。错误。B.由于反应物的能量比生成物高,所以该反应为放热反应。正确。C。由于反应物、生成物的能量相同,所以反应过程中无能量变化。错误。D.化学反应的过程就是旧键断裂、新键形成的过程。断裂化学键要吸收能量。这与图像画的不符合。错误。
7.【答案】B
【解析】A项,反应是放热还是吸热,与反应条件无关,故放热反应在常温下不一定能直接发生,如燃烧反应都要点燃才能发生,A项正确;
B项,需要加热方能发生的反应不一定是吸热反应,如铝热反应为放热反应,需要加热才能发生,B项错误;
C项,反应是放热反应还是吸热反应看反应物和生成物具有的总能量的相对大小,C项正确;
D项,吸热反应在一定条件下也能发生,如氢氧化钡晶体和氯化铵常温下就能反应,D项正确;
答案选B。
8.【答案】B
【解析】化学反应的实质:旧键的断裂和新键的生成;
其中旧键断裂吸收的能量和新键生成释放的能量不同,化学反应必然伴随能量的变化。
9.【答案】D
【解析】反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程,一定是吸热反应,D对。
10.【答案】C
【解析】常见的吸热反应,如水的电解、制水煤气等均有一定的利用价值。
11.【答案】C
【解析】A项、铵盐溶于水,铵根离子在溶液中的水解反应是吸热反应,故A错误;
B项、灼热的C与CO 2反应生成CO,该反应为吸热反应,故B错误;
C项、水结成冰是放热的过程,故C正确;
D项、断开氢气中的H—H键需要吸收能量,故D错误。
12.【答案】CD
【解析】放出热量的化学反应,反应物的总能量一定高于生成物的总能量。C和CO的燃烧反应都是放热反应,所以C+O2CO2必然是放热反应,因此,A、B两项的说法正确;12 g C并不代表反应物的全部,O2也是反应物,所以C项不正确;由于CCO放热、COCO2放热,所以CCO2比CCO放出的热量要多,故D项说法不正确。
13.【答案】C
【解析】某些物理变化也能释放能量,如浓H2SO4、NaOH溶于水放出热量,白炽灯工作时发光发热等。
能力提升
14.【答案】(1). b (2). a (3). b (4). Li2O
【解析】(1)氢氧化钡晶体与氯化铵晶体混合,是典型的吸热反应,所以装置②中反应后溶液的温度降低,选b;
(2)铝与盐酸是放热反应,所以反应物的总能量比生成物的总能量高,故选a;
(3)反应H2+I2===2HI断裂化学键吸收的能量为436kJ+151 kJ=587 kJ,形成化学键放出能量299kJ×2=598 kJ,放出的能量大于吸收的能量,所以反应放热,选b;
(4)钠在空气中燃烧生成Na2O2,锂的活泼性小于钠,所以锂单质在空气中燃烧的产物应为Li2O。
15.【答案】(1)679 kJ (2)862 kJ (3)放出 183 kJ (4)>
【解析】(1)反应物断键吸收的总能量应该是1 mol H—H与1 mol Cl—Cl键之和,即436 kJ+243 kJ=679 kJ。(2)生成物成键放出总能量为2×431 kJ=862 kJ。(3)由于吸收的总能量小于放出的总能量,故该反应为放热反应。放出的热量值为862 kJ-679 kJ=183 kJ。(4)因该反应为放热反应,故反应物的总能量大于生成物的总能量。
16.【答案】(1)放热 2Al+6H+===2Al3++3H2↑
(2)反应完全后,热量向空气中传递,烧杯里物质的温度降低
(3)石蜡熔化 氢氧化钠与硫酸的反应是放热反应
(4)低于 (5)放热 红墨水液面左右相平 (6)红墨水液面左高右低 小于
【解析】(1)根据温度计示数判断铝与稀硫酸的反应是放热反应,金属与非氧化性酸的反应实质是金属与H+反应。(2)当化学反应完成后,随着热量的散失,烧杯里溶液的温度会降低。(3)石蜡受热熔化,小木片会脱落,由此推知氢氧化钠与硫酸发生的反应是放热反应。(4)U形管里左右红墨水液面高低由左右管里气体压强的相对大小(外界大气压恒定)决定,当左管内气压大于右管内气压时,红墨水液面会左低右高,当左管内气压小于右管内气压时,红墨水液面会左高右低。(5)根据①③④现象推知,氧化钙与水的反应、铝与氢氧化钠溶液的反应、铜与浓硝酸的反应都是放热反应。(6)氢氧化钡晶体与氯化铵晶体混合发生吸热反应,使锥形瓶里气体温度降低,气体压强小于外界大气压,使红墨水液面左高右低。对于吸热反应,反应物的总能量小于生成物的总能量
第2节 化学反应与能量转化
第1课时 化学反应中能量变化的本质及转化形式
基础过关
1.下列反应中,属于放热反应的是( )
①煅娆石灰石;②燃烧木炭取暖;③炸药爆炸;④酸与碱的中和反应;⑤碳与水蒸气制水煤气;⑥食物因氧化而腐败。
A. ①②④⑤ B. ②④⑤⑥ C. ②③④⑥ D. 全部
2.在下列反应中,反应物的总能量低于生成物的总能量的是( )
A. 2H2+O22H2O B. CaCO3CaO+CO2↑
C. CaO+CO2=CaCO3 D. C2H5OH+3O22CO2+3H2O
3.已知反应物的总能量高于产物的总能量,则反应是( )
A. 放热反应 B. 吸热反应 C. 有催化剂作用 D. 无法判断
4.下列过程放出热量的是( )
A. 断裂化学键 B. 水的分解
C. 总能量生成物高于反应物的反应 D. 浓硫酸稀释
5.已知断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol H—N键吸收的能量为391 kJ,根据化学方程式:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是( )
A. 431 kJ B. 945.6 kJ C. 649 kJ D. 869 kJ
6.下列图中能正确表示X + 3Y === 2Z(放热反应)过程的能量变化的是( )
A. B.
C. D.
7.下列说法错误的是 ( )
A. 放热反应在常温下不一定能直接发生
B. 需要加热方能发生的反应一定是吸热反应
C. 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小
D 吸热反应在一定条件下也能发生
8.化学反应过程中,除有新物质生成外,一定还有( )
A. 体积发生变化 B. 能量发生变化
C. 质量发生变化 D. 物质状态发生变化
9.关于吸热反应的说法正确的是( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
10.下列有关能量的叙述错误的是( )
A.化石能源物质内部蕴涵着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值
D.物质的化学能可以在一定条件下转化为热能、电能为人类所用
11.下列过程中能量的转化与图示吻合的是( )
A. 铵盐溶于水 B. C与CO 2 (g)反应
C. 水结成冰 D. 断开氢气中的H—H键
12.(双选)已知化学反应2C(s)+O2(g)2CO(g)、2CO(g)+O2(g)2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同) ( )
A. 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
B. 12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
C. 12 g C所具有的能量一定高于28 g CO所具有的能量
D.将一定质量的C燃烧,生成CO比生成CO2时放出的热量多
13.从宏观来看化学变化的本质是有新物质生成。从微观角度来看,下列变化不能说明发生了化学变化的是( )
A.变化时有电子的得失或共用电子对的形成
B.变化过程中有化学键的断裂和形成
C.变化时释放出能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
能力提升
14.某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2===2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
15. 在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl2===2HCl的化学反应可用下图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)1 mol H2和1 mol Cl2反应生成2 mol HCl是______________(填“吸收”或“放出”)能量的反应,其能量值为________。
(4)反应物总能量________(填“>”或“<”)生成物总能量。
16.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应。
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的石蜡粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
方案三:如图3,甲试管中发生某化学反应,实验前U形管中红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应。
序号 甲试管里发生反应的物质 U形管里红墨水液面
① 氧化钙与水 左低右高
② 氢氧化钡晶体与氯化铵晶体(充分搅拌) ?
③ 铝片与烧碱溶液 左低右高
④ 铜与浓硝酸 左低右高
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写出该反应的离子方程式:______________________________________________________________________________。
(2)方案一中,温度升至最大值后又下降的原因是________________________________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”、“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是___________________________。
(6)方案三实验②的U形管中的现象为______________________,说明反应物的总能量________(填“大于”、“小于”或“等于”)生成物的总能量。
参考答案
基础过关
1.【答案】C
【解析】①煅娆石灰石为吸热反应;
②燃烧木炭取暖,为放热反应;
③炸药爆炸释放出大量的能量,为放热反应;
④酸与碱的中和反应为放热反应;
⑤碳与水蒸气制水煤气为吸热反应;
⑥食物因氧化而腐败属于放热反应。
综上所述可知:属于放热反应的是②③④⑥,故合理选项是C。
2.【答案】B
【解析】A.2H2+O22H2O反应放热,反应物的总能量大于生成物的总能量,故A错误;
B.CaCO3CaO+CO2↑反应吸热,反应物的总能量低于生成物的总能量,故B正确;
C.CaO+CO2===CaCO3反应放热,反应物的总能量大于生成物的总能量,故C错误;
D.C2H5OH+3O22CO2+3H2O反应放热,反应物的总能量大于生成物的总能量,故D错误。
3.【答案】A
【解析】反应物的总能量高于产物的总能量的反应是放热反应,故A正确;反应物的总能量低于产物的总能量的反应是吸热反应,故B错误;催化剂对反应热无影响,故C错误; D错误。
4.【答案】D
【解析】A、断裂化学键需要吸收能量,A不选;
B.水的分解为吸热反应,B不选;
C. 总能量生成物高于反应物的反应为吸热反应,C不选;
D.浓硫酸稀释,放出大量的热,D选。
答案选D。
5.【答案】B
【解析】H-H键能为436kJ/mol,H-N键能为391kJ/mol,设N≡N的键能为x,对于反应N2(g)+3H2(g)2NH3(g) H =-92.4kJ/mol, H=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,解得:x=945.6 kJ/mol,断裂1molN≡N吸收945.6kJ的能量,故选B。
6.【答案】B
【解析】A.由于生成物的能量比反应物高,所以该反应为吸热反应。错误。B.由于反应物的能量比生成物高,所以该反应为放热反应。正确。C。由于反应物、生成物的能量相同,所以反应过程中无能量变化。错误。D.化学反应的过程就是旧键断裂、新键形成的过程。断裂化学键要吸收能量。这与图像画的不符合。错误。
7.【答案】B
【解析】A项,反应是放热还是吸热,与反应条件无关,故放热反应在常温下不一定能直接发生,如燃烧反应都要点燃才能发生,A项正确;
B项,需要加热方能发生的反应不一定是吸热反应,如铝热反应为放热反应,需要加热才能发生,B项错误;
C项,反应是放热反应还是吸热反应看反应物和生成物具有的总能量的相对大小,C项正确;
D项,吸热反应在一定条件下也能发生,如氢氧化钡晶体和氯化铵常温下就能反应,D项正确;
答案选B。
8.【答案】B
【解析】化学反应的实质:旧键的断裂和新键的生成;
其中旧键断裂吸收的能量和新键生成释放的能量不同,化学反应必然伴随能量的变化。
9.【答案】D
【解析】反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程,一定是吸热反应,D对。
10.【答案】C
【解析】常见的吸热反应,如水的电解、制水煤气等均有一定的利用价值。
11.【答案】C
【解析】A项、铵盐溶于水,铵根离子在溶液中的水解反应是吸热反应,故A错误;
B项、灼热的C与CO 2反应生成CO,该反应为吸热反应,故B错误;
C项、水结成冰是放热的过程,故C正确;
D项、断开氢气中的H—H键需要吸收能量,故D错误。
12.【答案】CD
【解析】放出热量的化学反应,反应物的总能量一定高于生成物的总能量。C和CO的燃烧反应都是放热反应,所以C+O2CO2必然是放热反应,因此,A、B两项的说法正确;12 g C并不代表反应物的全部,O2也是反应物,所以C项不正确;由于CCO放热、COCO2放热,所以CCO2比CCO放出的热量要多,故D项说法不正确。
13.【答案】C
【解析】某些物理变化也能释放能量,如浓H2SO4、NaOH溶于水放出热量,白炽灯工作时发光发热等。
能力提升
14.【答案】(1). b (2). a (3). b (4). Li2O
【解析】(1)氢氧化钡晶体与氯化铵晶体混合,是典型的吸热反应,所以装置②中反应后溶液的温度降低,选b;
(2)铝与盐酸是放热反应,所以反应物的总能量比生成物的总能量高,故选a;
(3)反应H2+I2===2HI断裂化学键吸收的能量为436kJ+151 kJ=587 kJ,形成化学键放出能量299kJ×2=598 kJ,放出的能量大于吸收的能量,所以反应放热,选b;
(4)钠在空气中燃烧生成Na2O2,锂的活泼性小于钠,所以锂单质在空气中燃烧的产物应为Li2O。
15.【答案】(1)679 kJ (2)862 kJ (3)放出 183 kJ (4)>
【解析】(1)反应物断键吸收的总能量应该是1 mol H—H与1 mol Cl—Cl键之和,即436 kJ+243 kJ=679 kJ。(2)生成物成键放出总能量为2×431 kJ=862 kJ。(3)由于吸收的总能量小于放出的总能量,故该反应为放热反应。放出的热量值为862 kJ-679 kJ=183 kJ。(4)因该反应为放热反应,故反应物的总能量大于生成物的总能量。
16.【答案】(1)放热 2Al+6H+===2Al3++3H2↑
(2)反应完全后,热量向空气中传递,烧杯里物质的温度降低
(3)石蜡熔化 氢氧化钠与硫酸的反应是放热反应
(4)低于 (5)放热 红墨水液面左右相平 (6)红墨水液面左高右低 小于
【解析】(1)根据温度计示数判断铝与稀硫酸的反应是放热反应,金属与非氧化性酸的反应实质是金属与H+反应。(2)当化学反应完成后,随着热量的散失,烧杯里溶液的温度会降低。(3)石蜡受热熔化,小木片会脱落,由此推知氢氧化钠与硫酸发生的反应是放热反应。(4)U形管里左右红墨水液面高低由左右管里气体压强的相对大小(外界大气压恒定)决定,当左管内气压大于右管内气压时,红墨水液面会左低右高,当左管内气压小于右管内气压时,红墨水液面会左高右低。(5)根据①③④现象推知,氧化钙与水的反应、铝与氢氧化钠溶液的反应、铜与浓硝酸的反应都是放热反应。(6)氢氧化钡晶体与氯化铵晶体混合发生吸热反应,使锥形瓶里气体温度降低,气体压强小于外界大气压,使红墨水液面左高右低。对于吸热反应,反应物的总能量小于生成物的总能量
