第三章第二节第一课时 醇类 课件 (共48张PPT)2023-2024学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 第三章第二节第一课时 醇类 课件 (共48张PPT)2023-2024学年高二下学期化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 11:20:29 | ||
图片预览








文档简介
(共48张PPT)
第三章 烃的衍生物
第二节 醇 酚
第一课时
学习目标
掌握乙醇的主要化学性质。(重点)
1
了解乙醇的工业制法及用途。
2
了解醇类的一般通性和几种多元醇的用途。
3
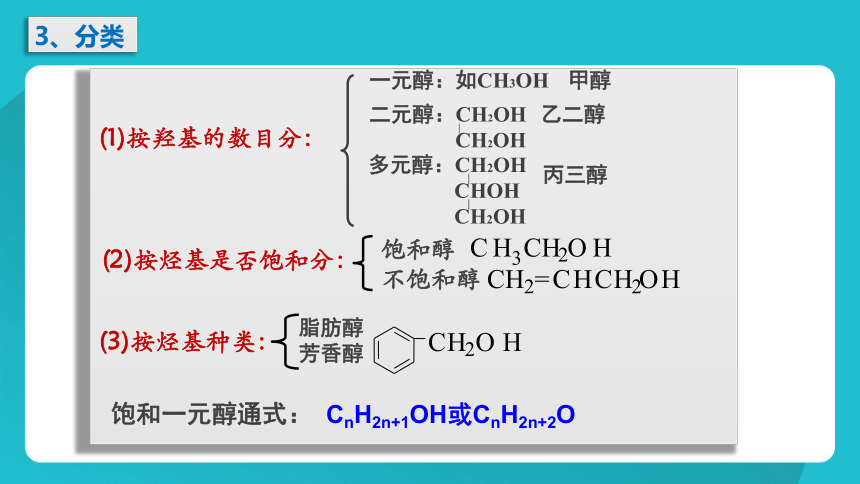
一.醇类
1、概念
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
2、官能团
名称:羟基 符号: -OH
3、分类
(1)按羟基的数目分:
(2)按烃基是否饱和分:
(3)按烃基种类:
一元醇:如CH3OH
甲醇
二元醇:CH2OH
CH2OH
乙二醇
多元醇:CH2OH
CHOH
CH2OH
丙三醇
饱和醇
不饱和醇
C
H
2
=
C
H
C
H
2
O
H
C
H
3
C
H
2
O
H
脂肪醇
芳香醇
C
H
2
O
H
饱和一元醇通式:
CnH2n+1OH或CnH2n+2O
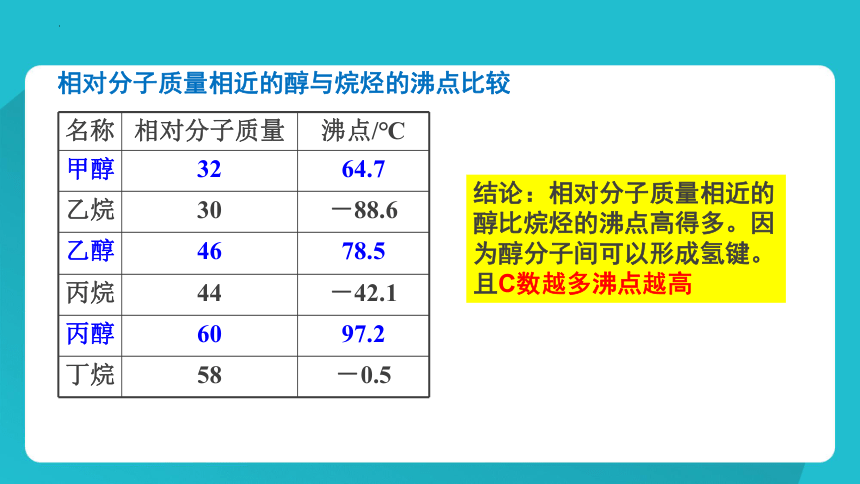
名称 相对分子质量 沸点/℃
甲醇 32 64.7
乙烷 30 -88.6
乙醇 46 78.5
丙烷 44 -42.1
丙醇 60 97.2
丁烷 58 -0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
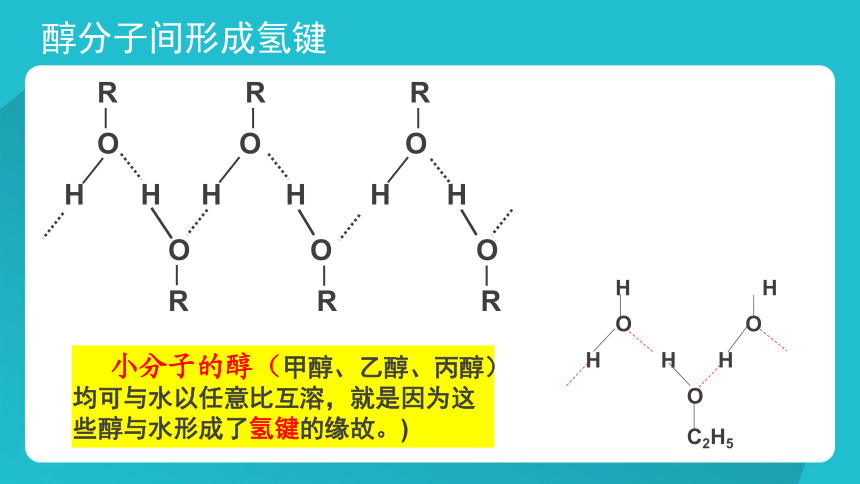
R R R
O O O
H H H H H H
O O O
R R R
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。)
H H
O O
H H H
O
C2H5
醇分子间形成氢键
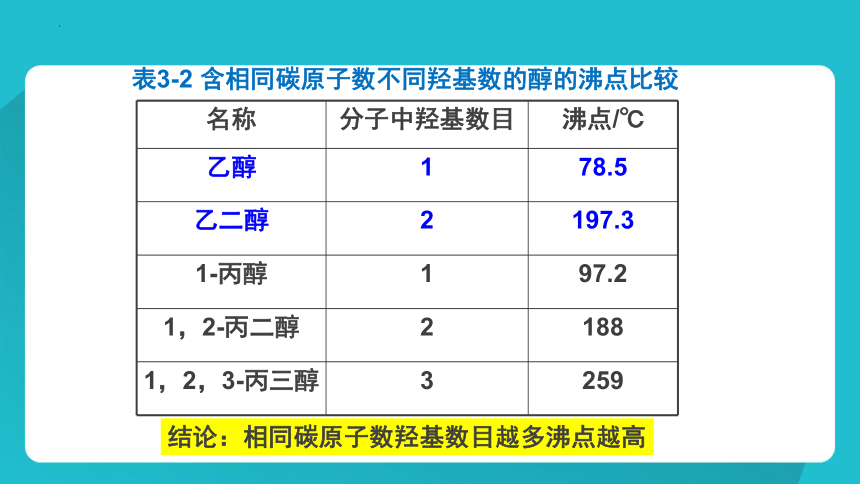
表3-2 含相同碳原子数不同羟基数的醇的沸点比较
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
结论:相同碳原子数羟基数目越多沸点越高
4、物理性质
(1)溶解性:
(2)沸点:
(3)密度:
三个碳以下的醇能与水以任意比互溶,4-11个碳原子的醇为油状液体,部分能溶于水,12个碳以上的醇为无色无味蜡状固体,不溶于水。
饱和一元醇随碳原子数增多,沸点增大。由于醇间能形成氢键,醇的沸点远高于相对分子质量相近的烷。
醇的密度小于水。
趁热打铁
提示:(1)将含有与羟基(—OH)相连的碳原子的最长碳链作为主链,根据碳原子数目称为某醇。
(2)从距离羟基最近的一端给主链上的碳原子依次编号定位。
(3)羟基的位置用阿拉伯数字表示;羟基的个数用“二”“三”等表示。
1.醇如何命名?
趁热打铁
2.醇的通式是什么?
提示:醇可看作链烃或苯的同系物等烃分子里的氢原子被羟基取代的产物,故醇的通式可由烃的通式衍变而得。如:
烷烃的通式为CnH2n+2,则饱和一元醇的通式为CnH2n+2O或CnH2n+1OH,简写为R—OH,饱和x元醇的通式为CnH2n+2Ox。
烯烃的通式为CnH2n,则相应的一元醇的通式为CnH2nO。
苯的同系物的通式为CnH2n-6,则相应的一元醇的通式为CnH2n-6O。
其他醇简介
(1)甲醇:
甲醇有毒:人饮用约10mL就能使眼睛失明,再多则能致死。
(2)乙二醇和丙三醇
乙二醇和丙三醇都是无色、黏稠、有甜味的液体。乙二醇易溶于水和乙醇;丙三醇吸湿性强,能跟水、酒精以任意比混溶。它们都是重要的化工原料。此外,丙三醇还有护肤作用,俗称甘油。
典题例证——思维深化
【例1】 2006年广州发生假酒案,假酒中严重超标的有毒成分主要是( )
【解析】 甲醇是无色透明的液体,有剧毒,是假酒的主要成分。故选B。
【答案】 B
典题例证——思维深化
【例2】 (多选)只用水就能鉴别的一组物质是( )
A.苯 乙醇 四氯化碳 B.乙醇 乙酸 乙烷
C.乙二醇 甘油 溴乙烷 D.碳化钙 碳酸钙 氯化钙
【解析】 利用水鉴别物质主要是根据物质在水中的溶解情况,以及其密度与水的密度的相对大小来进行。A项中苯不溶于水,密度比水小;乙醇可溶于水;四氯化碳不溶于水,密度比水大,可用水鉴别。B项中乙醇、乙酸都可溶于水,不能用水鉴别。C项中乙二醇、甘油都可溶于水,不能用水鉴别。D项中碳化钙与水反应产生气体,碳酸钙不溶于水,氯化钙可溶于水,可用水鉴别。故选AD。
【答案】 AD
精选习题——落实强化
今有四种有机物:①丙三醇;②丙烷;③乙二醇;④乙醇。它们的沸点由高到低排列正确的是( )
A.①②③④ B.④③②①
C.①③④② D.①③②④
【解析】 本题主要考查醇的沸点变化规律,醇的羟基之间易形成较强的相互作用,故醇的沸点比同碳数的烃要高,醇中碳原子数越多,其沸点越高,碳原子数相同的醇,所含羟基数目越多,其沸点越高,故选C项。
【答案】 C
二.乙醇
1、物理性质
乙醇是一种无色、有特殊香味的液体,密度比水小,易挥发,易溶于水(跟水以任意比互溶),是一种良好的有机溶剂,俗称酒精。 200C时的密度是0.7893g/cm3
检验C2H5OH(H2O) 。
除杂C2H5OH(H2O) 。
CuSO4
先加CaO后蒸馏
思考交流1:
2、乙醇的结构
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
分子式
结构式
结构简式
官能团
O—H C—O 键的极性较大,易断键。
结构分析
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移,因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
【思考交流2:】试比较乙醇和水的酸性强弱?
能否通过此反应测定有机物的羟基数目?
断①号键
置换反应
比较Na与水及乙醇的反应
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
仍是块状
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2 NaOH +H2↑
[结论]乙醇羟基上的氢原子比水中氢原子不活泼。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
每2mol 羟基与足量的Na反应生成1mol H2
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
断①号键
RO—H + Na →
醇钠
2 2 2 RONa + H2↑
置换反应
1.甲醇 乙二醇 丙三醇中分别加入足量的金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
2.22g某醇与足量的金属钠反应收集到标况下的气体336ml,则该醇是( )
A.甲醇 B.异丙醇 C.2-甲基-2-丙醇
C
结论:2-OH——H2可用于快速确定醇中羟基数目
典题例证——思维深化
【例3】下列物质中加入金属钠,不能产生氢气的是( )
A.蒸馏水 B.苯
C.无水酒精 D.乙二醇
【解析】 乙醇和水都可以与钠反应,而乙二醇也属于醇类,分子内有两个羟基,也可以与钠发生反应。故选B。
【答案】 B
精选习题——落实强化
相同质量的下列醇,分别和过量的金属钠作用,放出氢气最多的是( )
A.甲醇 B.乙醇
C.乙二醇 D.丙三醇
【答案】 D
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
思考:
反应条件
结构条件?
3.(1)放入几片碎瓷片作用是什么?
(2)浓硫酸的作用是什么?
(3)酒精与浓硫酸体积比为何要为1∶3?
(4)温度计的位置?
(5)为何使液体温度迅速升到170℃并保持在170℃ ?
(6)有何杂质气体,如何除去?
(7)为何可用排水集气法收集?
防止暴沸
催化剂和脱水剂
保证浓硫酸的浓度才能脱水。
水银球置于反应液中测反应物的温度。
(5)在140℃时乙醇将生成乙醚,而温度过高浓硫酸会将乙醇碳化。
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3+H2O
浓H2SO4
140 ℃
C + 2H2SO4 == CO2 + 2SO2 + 2H2O
(6)乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
乙烯难溶于水,密度比空气密度略小。
C2H5OH+2H2SO4(浓)→ 2C+2SO2↑+5H2O
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
③净化装置:
氢氧化钠除去CO2、SO2
NaOH
H2SO4
④干燥装置:
浓硫酸
⑤收集方法:
排水法
2.判断下列物质中那些能发生消去反应
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
OH
CH3
H-OH
CH3—C—CH2—Br
CH3
Cl
CH3-C-CH2-CH3
CH3
Cl
课堂练习
3.写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
课堂练习
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ H2O
【例4】(双选) 下列条件下能发生消去反应的是( )
A.1-溴丙烷与NaOH醇溶液共热
B.乙醇与浓H2SO4共热至140℃
C.溴乙烷与NaOH水溶液共热
D.乙醇与浓H2SO4共热至170℃
【解析】 1-溴丙烷与NaOH醇溶液共热可以发生消去反应得到丙烯;而溴乙烷与NaOH水溶液共热发生的是水解反应;乙醇与浓H2SO4共热至140℃发生的是取代反应得到乙醚;乙醇与浓H2SO4共热至170℃发生消去反应得到乙烯。故选AD。
【答案】 AD
典题例证——思维深化
精选习题——落实强化
(双选)醇与浓H2SO4在不同温度下反应时可生成烯或醚,下列醇与浓H2SO4作用只能生成醚的是( )
A.CH3OH B.(CH3)2CHOH
C.(CH3)3COH D.(CH3)3C—CH2OH
【答案】 AD
3、化学性质
(3)取代反应
断②号键
①和浓HX反应:
C2H5 OH + H Br C2H5Br + H2O
△
断①②号键
②分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3+H2O
浓H2SO4
140 ℃
和卤代烃的水解是两个互逆过程
断①号键
③酯化反应:
CH3CH2OH+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
酸脱羟基醇脱氢
典题例证——思维深化
【例5】 下列物质不能经一步反应生成氯乙烷的是( )
A.乙醇 B.乙烯
C.氯乙烯 D.乙炔
【解析】 A与HCl取代,B与HCl加成,C与H2加成,只有D不可能。故选D。
【答案】 D
精选习题——落实强化
(双选)乙醇可以发生下列反应,在反应中乙醇分子断裂C—O键而失去羟基的是( )
A.乙醇在浓H2SO4存在下发生消去反应
B.乙醇与醋酸反应
C.乙醇与氢卤酸的取代反应
D.乙醇和金属钠的反应
【答案】 AC
精选习题——落实强化
用浓硫酸跟分子式分别为C2H6O和C3H8O的醇所组成的混合液反应,可能得到的醚的种类有( )
A.四种 B.五种
C.六种 D.七种
【答案】 C
3、化学性质
(4)氧化反应
①燃烧:
②与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应。
2CO2 +3H2O
C2H5OH +3 O2
点燃
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为灰绿色检验酒驾
酸性高锰酸钾紫红色褪去
焊接银器、铜器时,表面会生成发黑的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初!这是何原理?
3、化学性质
(4)氧化反应
③催化氧化:
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:直C有H
下列醇在Cu或Ag的作用下将如何发生催化氧化反应
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛。
与-OH相连的C原子上有1个H原子的,氧化成酮。
与-OH相连的C原子上没有H原子的,不能催化氧化。
4.写出下列方程式
无
2
2CH3—C —CH3
+ 2 H2O
O
CH3
CH3
2CH3—C —CHO
+ 2 H2O
2
有机反应中加氧去氢的叫氧化反应;加氢去氧的成为还原反应
5.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
A.CH3OH B.CH2OHCH2CH3
C.(CH3)3COH D.(CH3)2COHCH2CH3
B
乙醇的化学性质与其结构的关系
课堂小结
CH3CH2OH CH3CHO CH3COOH
①
②
③
④
⑤
CH3COOCH2CH3
有机框图推断中醇的地位
典题例证——思维深化
【例6】 某物质的分子式为C4H10O,它能被氧化生成具有相同碳原子数的醛,则该物质的结构可能有( )
A.2种 B.3种
C.4种 D.5种
【解析】 根据醇氧化为醛的规律,只有含有两个α—H的醇(即含有—CH2OH结构)才可以氧化得到醛。可以将C4H10O改写成C3H7—CH2OH,则只需要判断出C3H7—有几种同分异构体即可。C3H7—有CH3CH2CH2—和(CH3)2CH—两种同分异构体,则该物质应有两种可能的结构。故选A。
【答案】 A
精选习题——落实强化
【答案】 B
有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如右图所示。
实验操作:预先使棉花团浸透乙醇并按照右图安装好;在铜丝的中间部位加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题:
精选习题——落实强化
(1)被加热的铜丝处发生反应的化学方程式为________。
(2)A管中可观察到________的实验现象。从中可认识到,在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的________。
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?原受热的铜丝处有什么现象?为什么有这种现象?
有机反应中的氧化反应和还原反应的比较。
①氧化反应:有机物燃烧属于氧化反应,许多有机物还能发生被其他氧化剂氧化的反应,生成其他类型的有机物。与无机物氧化反应的概念相比,有机化学中一般把有机物分子中加氧或去氢的反应叫氧化反应。
a.燃烧氧化:在足量的氧气中,有机物燃烧后往往生成对应元素的最高价氧化物。
②还原反应:与氧化反应相反,有机物发生还原反应主要是指在反应过程中加氢或去氧的反应。其中加氢反应又属于加成反应。
a.加氢还原:通常为不饱和有机物与H2的加成反应。如烯烃、炔烃、芳香族化合物、醛、酮等都可以发生加氢还原反应。
b.去氧还原:高中有机化学中无典型反应。
c.既加氢又去氧:如硝基苯还原为苯胺:
THANK YOU
第三章 烃的衍生物
第二节 醇 酚
第一课时
学习目标
掌握乙醇的主要化学性质。(重点)
1
了解乙醇的工业制法及用途。
2
了解醇类的一般通性和几种多元醇的用途。
3
一.醇类
1、概念
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
2、官能团
名称:羟基 符号: -OH
3、分类
(1)按羟基的数目分:
(2)按烃基是否饱和分:
(3)按烃基种类:
一元醇:如CH3OH
甲醇
二元醇:CH2OH
CH2OH
乙二醇
多元醇:CH2OH
CHOH
CH2OH
丙三醇
饱和醇
不饱和醇
C
H
2
=
C
H
C
H
2
O
H
C
H
3
C
H
2
O
H
脂肪醇
芳香醇
C
H
2
O
H
饱和一元醇通式:
CnH2n+1OH或CnH2n+2O
名称 相对分子质量 沸点/℃
甲醇 32 64.7
乙烷 30 -88.6
乙醇 46 78.5
丙烷 44 -42.1
丙醇 60 97.2
丁烷 58 -0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
R R R
O O O
H H H H H H
O O O
R R R
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。)
H H
O O
H H H
O
C2H5
醇分子间形成氢键
表3-2 含相同碳原子数不同羟基数的醇的沸点比较
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
结论:相同碳原子数羟基数目越多沸点越高
4、物理性质
(1)溶解性:
(2)沸点:
(3)密度:
三个碳以下的醇能与水以任意比互溶,4-11个碳原子的醇为油状液体,部分能溶于水,12个碳以上的醇为无色无味蜡状固体,不溶于水。
饱和一元醇随碳原子数增多,沸点增大。由于醇间能形成氢键,醇的沸点远高于相对分子质量相近的烷。
醇的密度小于水。
趁热打铁
提示:(1)将含有与羟基(—OH)相连的碳原子的最长碳链作为主链,根据碳原子数目称为某醇。
(2)从距离羟基最近的一端给主链上的碳原子依次编号定位。
(3)羟基的位置用阿拉伯数字表示;羟基的个数用“二”“三”等表示。
1.醇如何命名?
趁热打铁
2.醇的通式是什么?
提示:醇可看作链烃或苯的同系物等烃分子里的氢原子被羟基取代的产物,故醇的通式可由烃的通式衍变而得。如:
烷烃的通式为CnH2n+2,则饱和一元醇的通式为CnH2n+2O或CnH2n+1OH,简写为R—OH,饱和x元醇的通式为CnH2n+2Ox。
烯烃的通式为CnH2n,则相应的一元醇的通式为CnH2nO。
苯的同系物的通式为CnH2n-6,则相应的一元醇的通式为CnH2n-6O。
其他醇简介
(1)甲醇:
甲醇有毒:人饮用约10mL就能使眼睛失明,再多则能致死。
(2)乙二醇和丙三醇
乙二醇和丙三醇都是无色、黏稠、有甜味的液体。乙二醇易溶于水和乙醇;丙三醇吸湿性强,能跟水、酒精以任意比混溶。它们都是重要的化工原料。此外,丙三醇还有护肤作用,俗称甘油。
典题例证——思维深化
【例1】 2006年广州发生假酒案,假酒中严重超标的有毒成分主要是( )
【解析】 甲醇是无色透明的液体,有剧毒,是假酒的主要成分。故选B。
【答案】 B
典题例证——思维深化
【例2】 (多选)只用水就能鉴别的一组物质是( )
A.苯 乙醇 四氯化碳 B.乙醇 乙酸 乙烷
C.乙二醇 甘油 溴乙烷 D.碳化钙 碳酸钙 氯化钙
【解析】 利用水鉴别物质主要是根据物质在水中的溶解情况,以及其密度与水的密度的相对大小来进行。A项中苯不溶于水,密度比水小;乙醇可溶于水;四氯化碳不溶于水,密度比水大,可用水鉴别。B项中乙醇、乙酸都可溶于水,不能用水鉴别。C项中乙二醇、甘油都可溶于水,不能用水鉴别。D项中碳化钙与水反应产生气体,碳酸钙不溶于水,氯化钙可溶于水,可用水鉴别。故选AD。
【答案】 AD
精选习题——落实强化
今有四种有机物:①丙三醇;②丙烷;③乙二醇;④乙醇。它们的沸点由高到低排列正确的是( )
A.①②③④ B.④③②①
C.①③④② D.①③②④
【解析】 本题主要考查醇的沸点变化规律,醇的羟基之间易形成较强的相互作用,故醇的沸点比同碳数的烃要高,醇中碳原子数越多,其沸点越高,碳原子数相同的醇,所含羟基数目越多,其沸点越高,故选C项。
【答案】 C
二.乙醇
1、物理性质
乙醇是一种无色、有特殊香味的液体,密度比水小,易挥发,易溶于水(跟水以任意比互溶),是一种良好的有机溶剂,俗称酒精。 200C时的密度是0.7893g/cm3
检验C2H5OH(H2O) 。
除杂C2H5OH(H2O) 。
CuSO4
先加CaO后蒸馏
思考交流1:
2、乙醇的结构
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
分子式
结构式
结构简式
官能团
O—H C—O 键的极性较大,易断键。
结构分析
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移,因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
【思考交流2:】试比较乙醇和水的酸性强弱?
能否通过此反应测定有机物的羟基数目?
断①号键
置换反应
比较Na与水及乙醇的反应
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
仍是块状
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2 NaOH +H2↑
[结论]乙醇羟基上的氢原子比水中氢原子不活泼。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
每2mol 羟基与足量的Na反应生成1mol H2
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
断①号键
RO—H + Na →
醇钠
2 2 2 RONa + H2↑
置换反应
1.甲醇 乙二醇 丙三醇中分别加入足量的金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
2.22g某醇与足量的金属钠反应收集到标况下的气体336ml,则该醇是( )
A.甲醇 B.异丙醇 C.2-甲基-2-丙醇
C
结论:2-OH——H2可用于快速确定醇中羟基数目
典题例证——思维深化
【例3】下列物质中加入金属钠,不能产生氢气的是( )
A.蒸馏水 B.苯
C.无水酒精 D.乙二醇
【解析】 乙醇和水都可以与钠反应,而乙二醇也属于醇类,分子内有两个羟基,也可以与钠发生反应。故选B。
【答案】 B
精选习题——落实强化
相同质量的下列醇,分别和过量的金属钠作用,放出氢气最多的是( )
A.甲醇 B.乙醇
C.乙二醇 D.丙三醇
【答案】 D
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
思考:
反应条件
结构条件?
3.(1)放入几片碎瓷片作用是什么?
(2)浓硫酸的作用是什么?
(3)酒精与浓硫酸体积比为何要为1∶3?
(4)温度计的位置?
(5)为何使液体温度迅速升到170℃并保持在170℃ ?
(6)有何杂质气体,如何除去?
(7)为何可用排水集气法收集?
防止暴沸
催化剂和脱水剂
保证浓硫酸的浓度才能脱水。
水银球置于反应液中测反应物的温度。
(5)在140℃时乙醇将生成乙醚,而温度过高浓硫酸会将乙醇碳化。
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3+H2O
浓H2SO4
140 ℃
C + 2H2SO4 == CO2 + 2SO2 + 2H2O
(6)乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
乙烯难溶于水,密度比空气密度略小。
C2H5OH+2H2SO4(浓)→ 2C+2SO2↑+5H2O
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
③净化装置:
氢氧化钠除去CO2、SO2
NaOH
H2SO4
④干燥装置:
浓硫酸
⑤收集方法:
排水法
2.判断下列物质中那些能发生消去反应
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
OH
CH3
H-OH
CH3—C—CH2—Br
CH3
Cl
CH3-C-CH2-CH3
CH3
Cl
课堂练习
3.写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
课堂练习
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ H2O
【例4】(双选) 下列条件下能发生消去反应的是( )
A.1-溴丙烷与NaOH醇溶液共热
B.乙醇与浓H2SO4共热至140℃
C.溴乙烷与NaOH水溶液共热
D.乙醇与浓H2SO4共热至170℃
【解析】 1-溴丙烷与NaOH醇溶液共热可以发生消去反应得到丙烯;而溴乙烷与NaOH水溶液共热发生的是水解反应;乙醇与浓H2SO4共热至140℃发生的是取代反应得到乙醚;乙醇与浓H2SO4共热至170℃发生消去反应得到乙烯。故选AD。
【答案】 AD
典题例证——思维深化
精选习题——落实强化
(双选)醇与浓H2SO4在不同温度下反应时可生成烯或醚,下列醇与浓H2SO4作用只能生成醚的是( )
A.CH3OH B.(CH3)2CHOH
C.(CH3)3COH D.(CH3)3C—CH2OH
【答案】 AD
3、化学性质
(3)取代反应
断②号键
①和浓HX反应:
C2H5 OH + H Br C2H5Br + H2O
△
断①②号键
②分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3+H2O
浓H2SO4
140 ℃
和卤代烃的水解是两个互逆过程
断①号键
③酯化反应:
CH3CH2OH+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
酸脱羟基醇脱氢
典题例证——思维深化
【例5】 下列物质不能经一步反应生成氯乙烷的是( )
A.乙醇 B.乙烯
C.氯乙烯 D.乙炔
【解析】 A与HCl取代,B与HCl加成,C与H2加成,只有D不可能。故选D。
【答案】 D
精选习题——落实强化
(双选)乙醇可以发生下列反应,在反应中乙醇分子断裂C—O键而失去羟基的是( )
A.乙醇在浓H2SO4存在下发生消去反应
B.乙醇与醋酸反应
C.乙醇与氢卤酸的取代反应
D.乙醇和金属钠的反应
【答案】 AC
精选习题——落实强化
用浓硫酸跟分子式分别为C2H6O和C3H8O的醇所组成的混合液反应,可能得到的醚的种类有( )
A.四种 B.五种
C.六种 D.七种
【答案】 C
3、化学性质
(4)氧化反应
①燃烧:
②与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应。
2CO2 +3H2O
C2H5OH +3 O2
点燃
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为灰绿色检验酒驾
酸性高锰酸钾紫红色褪去
焊接银器、铜器时,表面会生成发黑的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初!这是何原理?
3、化学性质
(4)氧化反应
③催化氧化:
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:直C有H
下列醇在Cu或Ag的作用下将如何发生催化氧化反应
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛。
与-OH相连的C原子上有1个H原子的,氧化成酮。
与-OH相连的C原子上没有H原子的,不能催化氧化。
4.写出下列方程式
无
2
2CH3—C —CH3
+ 2 H2O
O
CH3
CH3
2CH3—C —CHO
+ 2 H2O
2
有机反应中加氧去氢的叫氧化反应;加氢去氧的成为还原反应
5.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
A.CH3OH B.CH2OHCH2CH3
C.(CH3)3COH D.(CH3)2COHCH2CH3
B
乙醇的化学性质与其结构的关系
课堂小结
CH3CH2OH CH3CHO CH3COOH
①
②
③
④
⑤
CH3COOCH2CH3
有机框图推断中醇的地位
典题例证——思维深化
【例6】 某物质的分子式为C4H10O,它能被氧化生成具有相同碳原子数的醛,则该物质的结构可能有( )
A.2种 B.3种
C.4种 D.5种
【解析】 根据醇氧化为醛的规律,只有含有两个α—H的醇(即含有—CH2OH结构)才可以氧化得到醛。可以将C4H10O改写成C3H7—CH2OH,则只需要判断出C3H7—有几种同分异构体即可。C3H7—有CH3CH2CH2—和(CH3)2CH—两种同分异构体,则该物质应有两种可能的结构。故选A。
【答案】 A
精选习题——落实强化
【答案】 B
有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如右图所示。
实验操作:预先使棉花团浸透乙醇并按照右图安装好;在铜丝的中间部位加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题:
精选习题——落实强化
(1)被加热的铜丝处发生反应的化学方程式为________。
(2)A管中可观察到________的实验现象。从中可认识到,在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的________。
(3)实验一段时间后,如果撤掉酒精灯,反应还能否继续进行?原受热的铜丝处有什么现象?为什么有这种现象?
有机反应中的氧化反应和还原反应的比较。
①氧化反应:有机物燃烧属于氧化反应,许多有机物还能发生被其他氧化剂氧化的反应,生成其他类型的有机物。与无机物氧化反应的概念相比,有机化学中一般把有机物分子中加氧或去氢的反应叫氧化反应。
a.燃烧氧化:在足量的氧气中,有机物燃烧后往往生成对应元素的最高价氧化物。
②还原反应:与氧化反应相反,有机物发生还原反应主要是指在反应过程中加氢或去氧的反应。其中加氢反应又属于加成反应。
a.加氢还原:通常为不饱和有机物与H2的加成反应。如烯烃、炔烃、芳香族化合物、醛、酮等都可以发生加氢还原反应。
b.去氧还原:高中有机化学中无典型反应。
c.既加氢又去氧:如硝基苯还原为苯胺:
THANK YOU
