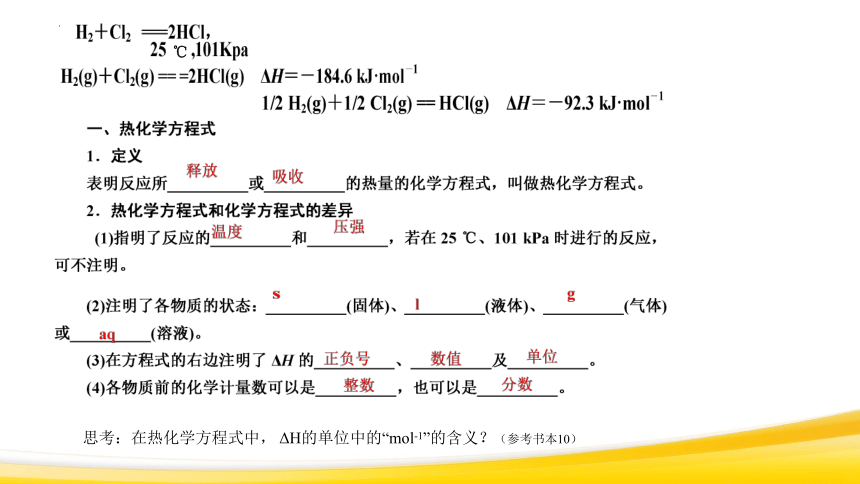
1.2.1热化学方程式 课件(共36张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2.1热化学方程式 课件(共36张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 11:22:22 | ||
图片预览









文档简介
(共36张PPT)
化学反应的热效应
第一章 第一节
§1.1.2 热化学方程式
思考:在热化学方程式中, ΔH的单位中的“mol-1”的含义?(参考书本10)
℃
ΔH的绝对值与化学方程式计量数的关系
H2(g) + 1/2O2(g) H2O(l) ΔH= -285.8 kJ/mol
2H2(g) + O2(g) H2O(g) ΔH= kJ/mol
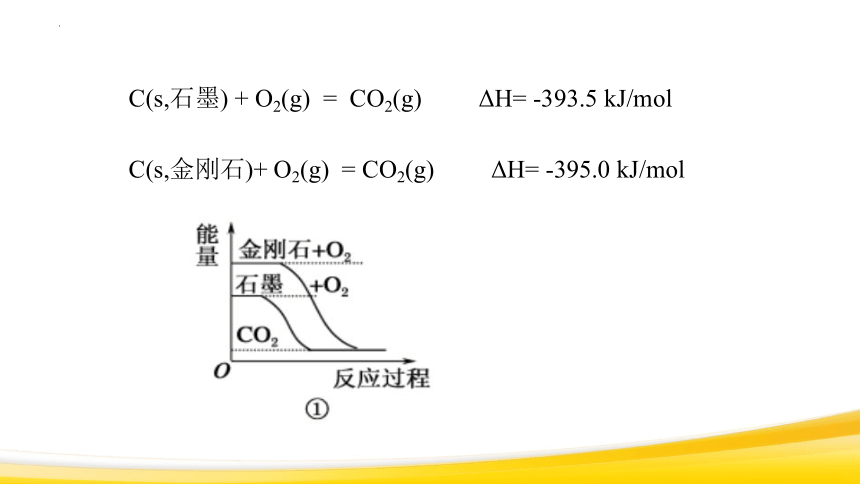
C(s,石墨) + O2(g) = CO2(g) ΔH= -393.5 kJ/mol
C(s,金刚石)+ O2(g) = CO2(g) ΔH= -395.0 kJ/mol
注意:△H的表示:
① 单位: kJ/mol或 kJ mol-1
1mol反应:表示按照各物质的化学计量数反应。
②数值:与反应式中的系数成正比例。
③ 对于正、逆反应,△H的数值相同,符号相反
④ 对于可逆反应,△H的数值表示1mol反应的热效应
二、书写热化学方程式的四部曲:
一写化学方程式:各物质前的化学计量数可以是整数,可以是分数。(因为其表示物质的量,不表示分子数。)
二标状态:反应物和生成物要注明聚集状态,若存在同素异形体,需注明具体物质。(物质的聚集状态不同, 所含的能量也不同。)
三注温度和压强:101kPa和25℃时可不注明。
四写焓变:
例2:已知在1×105Pa,293K条件下,2mol氢气燃烧生成液态水放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(l)=H2(g) +1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)= 2H2O(l) ΔH=-484kJ·mol-1
C. H2(g) +1/2O2(g)=H2O(g) ΔH=-242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
A B
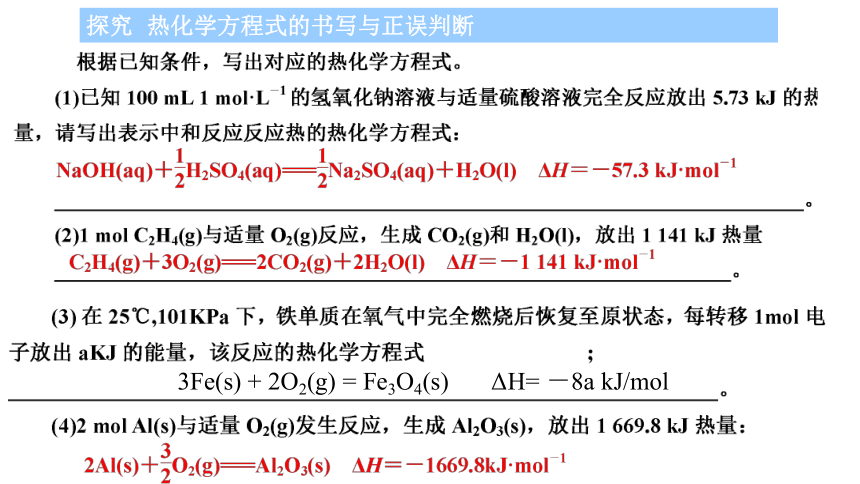
探究 热化学方程式的书写与正误判断
3Fe(s) + 2O2(g) = Fe3O4(s) ΔH= -8a kJ/mol
(2023·上海·高三统考专题练习)常温常压下,1mol CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是 ( )
A.加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小 B.加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多 C.1mol CH3OH完全燃烧生成液态水和二氧化碳(g)放出393kJ的热量 D.生成HCHO的热化学方程式为2CH3OH+O2=2HCHO+2H2O+316kJ
B
各式各样的能源
§1.1.3 燃烧热
一、燃烧热
1、概念:在 101K Pa, 1 mol纯物质完全燃烧生成指定的物质时所放出的热量。
H2(g)+1/2O2(g) = H2O(l) ΔH = -285.8 kJ/mol
注意:① 测定的条件: 101kPa;
② 产物是稳定的物质:
C-CO2;H2-H2O(l); S-SO2;N-N2
③以1mol可燃物的为标准来配平其余物质的化学计量数(常出现分数)
概念辨析:1mol碳的燃烧热是2mol碳的燃烧热的2倍。
2、表示方法
方法一:CH4的燃烧热为 890.3KJ/mol或 △H=-890.31KJ/mol,
3. 公式:Q放 =n(可燃物)×△H
4. 测量方法:量热计
方法二:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -890.31KJ/mol
注意:
(1)文字表示没有不带负号,△H表示带负号。
(2)△H单位中的“mol-1”表示 1mol可燃物
E. H2(g) + Cl2(g) = 2HCl(g) ΔH = -230.8 kJ/mol
考查:燃烧热的表示方法
小结:燃烧热和中和热的区别与联系
1mol反应物完全燃烧时放出的热量;
不同反应物,标准燃烧热不同。
生成1mol水时放出的热量;
25℃,101kpa强酸与强碱的中和热约为57.3kJ/mol 。
燃烧热
中和热
相同点
不同点
能量变化
H
标准
含义
放热反应
H<0;单位:kJ/mol
1mol可燃物
生成1mol水
B
在一定条件下,CO和 CH4燃烧的热化学方程式分别为:
由1molCO和3mol CH4组成的混合气在上述条件下充分燃烧时,释放的热量为 ( )
A. 2912kJ B. 2953kJ C. 3236kJ D. 3867kJ
B
△H =-566kJ/mol
△H =-890kJ/mol
题型一:燃烧热的计算
Q (放)=n(可燃物) × △Hc
3 16
课后作业2/8
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
CO(g)+1/2O2(g)===CO2(g) ΔH=-282.9 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )A.2∶1
B.1∶2C.1∶1
D.2∶3
C
课时作业2/12
苯与氢气发生加成反应(在25 ℃,产物均为液态)的能量变化与反应进程的关系如图所示,其中环己三烯为假设分子(分子中含有三个碳碳双键)。下列说法错误的是 ( )
B
课时作业2/14
(2022·广东广州高二检测)东京奥运会火炬传递的火炬样式采用樱花形状。奥运会火炬常用的燃料为丙烷(C3H8)、丁烷(C4H10)等。已知:
化合物 甲烷(CH4) 乙烷(C2H6) 丙烷(C3H8) 正丁烷(CH3CH2CH2CH3) 异丁烷[CH3CH(CH3)2]
燃烧热/(kJ·mol-1) 890 1 560 2 220 2 878 2 870
(2)下列有关说法不正确的是 (填字母)。A.火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能B.异丁烷分子中的碳氢键数目比正丁烷多C.正丁烷比异丁烷稳定(3)现有3 mol由甲烷和乙烷组成的混合气体,完全燃烧放出的热量为 3340 kJ,则该混合气体中甲烷和乙烷的物质的量之比是 。
BC
2:1
课堂小结
知识点:
知识点一: 热化学方程式:书写、辨析
知识点二: 燃烧热: 概念、计算
题型:
1、判断热化学方程式正误、书写热化学方程式
2、燃烧热的表示方法、利用燃烧热进行计算
已知两个热化学方程式:
2H2(g)+O2(g)= 2H2O(l) △H1 =-571.5 kJ·mol 1
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) △H2 =-2220 kJ·mol 1
实验测得氢气和丙烷的混合气体共5 mol完全
燃烧时共放热3847.5kJ,则混合气体中氢气和
丙烷的体积比为多少?
练练手
方法一: 列方程
方法二:平均值法 + 十字相差法: 6154.5/5=1230.9
3:2
在同温同压下,下列各组热化学方程式中Q2A. HCl(g) = 1/2H2(g)+1/2Cl2(g) △H= Q1
2HCl(g) = H2(g)+Cl2(g) △H= Q2
B. C(s)+1/2O2(g)=CO (g) △H= Q1
C(s)+O2(g)= CO2 (g) △H= Q2
C. 2H2(g)+O2(g)=2H2O(l) △H= Q1
2H2(g)+O2(g)=2H2O(g) △H= Q2
D. S(s) +O2(g) =SO2 (g) △H= Q1
S(g)+O2(g)=SO2 (g) △H= Q2
B
题型二: △H比大小(带不带符号?)
方法:越负越小
B
下列说法正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.稀HCl溶液和稀NaOH溶液生成1mol水时的中和热为△H=- 57.3kJ/mol,稀HCl溶液和稀NaOH溶液反应时生成2mol水时的中和热为△H=- 2×57.3kJ/mol
C.焓变是指1mol物质参加反应时的能量变化
D.稀HCl溶液和稀NaOH溶液反应时的中和热为
△H=- 57.3kJ/mol,
则稀H2SO4和稀Ba(OH)2反应时生成1mol水也释放出57.3kJ的能量。
A
强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l) △H=-57.3k kJ·mol 1 则:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)
△H= - Q1kJ·mol 1
H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)
△H= - Q2 kJ·mol 1
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l)
△H= - Q3 kJ·mol 1
H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)
△H= -Q4 kJ·mol1
则Q1、Q2、Q3、Q4的关系正确的是 ( )
A.Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 > Q4
C. Q4 > Q2 > Q3 > Q1 D. Q2 = Q3 > Q1
C
3 39
反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式 ( )
A.N2(g)+3H2(g) 2NH3(g)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
C.1/2N2(g)+3/2H2(g) NH3(l)
ΔH=(b+c-a)kJ·mol-1
D.NH3(l) 1/2N2(g)+3/2H2(g)
ΔH=(b + c - a) kJ·mol-1
BD
例:3:在25℃,101KPa下,13.5克铝单质在氧气中完全燃烧后恢复至原状态,放出419KJ的能量,该反应的热化学方程式 ;
4Al(s) + 3O2(g) = 2Al2O3(s) ΔH= -3352.0 kJ/mol
例4: 在25℃,101KPa下,铁单质在氧气中完全燃烧后恢复至原状态,每转移1mol电子放出aKJ的能量,该反应的热化学方程式 ;
3Fe(s) + 2O2(g) = Fe3O4(s) ΔH= -8a kJ/mol
化合物 燃烧热(kJ·mol-1) 化合物 燃烧热(kJ·mol-1)
甲烷 891.0 正丁烷 2 878.0
乙烷 1 560.8 异丁烷 2 869.6
丙烷 2 221.5 2 甲基丁烷 3 531.3
一些烷烃的燃烧热如下表:
下列说法正确的是 ( )
A.正戊烷的燃烧热大约是3540 kJ·mol-1
B.热稳定性:正丁烷 > 异丁烷
C.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)ΔH=-1560.8 ×2kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
A
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知25℃,101KPa 1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是 ( )
A.该反应中肼作还原剂
B.液态肼的燃烧热为20.05 kJ·mol-1
C.该动力源的突出优点之一是生成物对环境无污染
D.肼和过氧化氢反应的热化学方程式为
N2H4 (l)+2H2O2(l)=N2(g)+4H2O(g)
ΔH=-641.6 kJ·mol-1
B
例4:已知在30℃、101kPa下,1g C8H18(辛烷)燃烧
生成二氧化碳和液态水时放出48.40kJ 热量。写出能
表示上述反应的热化学方程式正确的是 。
2C8H18(l)+25O2(g) 16CO2(g)+ 18H2O(l)
△H= - 11036kJ·mol -1
30℃
101kPa
C8H18(l)+25/2O2(g) 8CO2(g) +9H2O(l)
△H= - 5518kJ·mol -1
30℃
101kPa
化学反应的热效应
第一章 第一节
§1.1.2 热化学方程式
思考:在热化学方程式中, ΔH的单位中的“mol-1”的含义?(参考书本10)
℃
ΔH的绝对值与化学方程式计量数的关系
H2(g) + 1/2O2(g) H2O(l) ΔH= -285.8 kJ/mol
2H2(g) + O2(g) H2O(g) ΔH= kJ/mol
C(s,石墨) + O2(g) = CO2(g) ΔH= -393.5 kJ/mol
C(s,金刚石)+ O2(g) = CO2(g) ΔH= -395.0 kJ/mol
注意:△H的表示:
① 单位: kJ/mol或 kJ mol-1
1mol反应:表示按照各物质的化学计量数反应。
②数值:与反应式中的系数成正比例。
③ 对于正、逆反应,△H的数值相同,符号相反
④ 对于可逆反应,△H的数值表示1mol反应的热效应
二、书写热化学方程式的四部曲:
一写化学方程式:各物质前的化学计量数可以是整数,可以是分数。(因为其表示物质的量,不表示分子数。)
二标状态:反应物和生成物要注明聚集状态,若存在同素异形体,需注明具体物质。(物质的聚集状态不同, 所含的能量也不同。)
三注温度和压强:101kPa和25℃时可不注明。
四写焓变:
例2:已知在1×105Pa,293K条件下,2mol氢气燃烧生成液态水放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(l)=H2(g) +1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)= 2H2O(l) ΔH=-484kJ·mol-1
C. H2(g) +1/2O2(g)=H2O(g) ΔH=-242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
A B
探究 热化学方程式的书写与正误判断
3Fe(s) + 2O2(g) = Fe3O4(s) ΔH= -8a kJ/mol
(2023·上海·高三统考专题练习)常温常压下,1mol CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是 ( )
A.加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小 B.加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多 C.1mol CH3OH完全燃烧生成液态水和二氧化碳(g)放出393kJ的热量 D.生成HCHO的热化学方程式为2CH3OH+O2=2HCHO+2H2O+316kJ
B
各式各样的能源
§1.1.3 燃烧热
一、燃烧热
1、概念:在 101K Pa, 1 mol纯物质完全燃烧生成指定的物质时所放出的热量。
H2(g)+1/2O2(g) = H2O(l) ΔH = -285.8 kJ/mol
注意:① 测定的条件: 101kPa;
② 产物是稳定的物质:
C-CO2;H2-H2O(l); S-SO2;N-N2
③以1mol可燃物的为标准来配平其余物质的化学计量数(常出现分数)
概念辨析:1mol碳的燃烧热是2mol碳的燃烧热的2倍。
2、表示方法
方法一:CH4的燃烧热为 890.3KJ/mol或 △H=-890.31KJ/mol,
3. 公式:Q放 =n(可燃物)×△H
4. 测量方法:量热计
方法二:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -890.31KJ/mol
注意:
(1)文字表示没有不带负号,△H表示带负号。
(2)△H单位中的“mol-1”表示 1mol可燃物
E. H2(g) + Cl2(g) = 2HCl(g) ΔH = -230.8 kJ/mol
考查:燃烧热的表示方法
小结:燃烧热和中和热的区别与联系
1mol反应物完全燃烧时放出的热量;
不同反应物,标准燃烧热不同。
生成1mol水时放出的热量;
25℃,101kpa强酸与强碱的中和热约为57.3kJ/mol 。
燃烧热
中和热
相同点
不同点
能量变化
H
标准
含义
放热反应
H<0;单位:kJ/mol
1mol可燃物
生成1mol水
B
在一定条件下,CO和 CH4燃烧的热化学方程式分别为:
由1molCO和3mol CH4组成的混合气在上述条件下充分燃烧时,释放的热量为 ( )
A. 2912kJ B. 2953kJ C. 3236kJ D. 3867kJ
B
△H =-566kJ/mol
△H =-890kJ/mol
题型一:燃烧热的计算
Q (放)=n(可燃物) × △Hc
3 16
课后作业2/8
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
CO(g)+1/2O2(g)===CO2(g) ΔH=-282.9 kJ·mol-1,某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )A.2∶1
B.1∶2C.1∶1
D.2∶3
C
课时作业2/12
苯与氢气发生加成反应(在25 ℃,产物均为液态)的能量变化与反应进程的关系如图所示,其中环己三烯为假设分子(分子中含有三个碳碳双键)。下列说法错误的是 ( )
B
课时作业2/14
(2022·广东广州高二检测)东京奥运会火炬传递的火炬样式采用樱花形状。奥运会火炬常用的燃料为丙烷(C3H8)、丁烷(C4H10)等。已知:
化合物 甲烷(CH4) 乙烷(C2H6) 丙烷(C3H8) 正丁烷(CH3CH2CH2CH3) 异丁烷[CH3CH(CH3)2]
燃烧热/(kJ·mol-1) 890 1 560 2 220 2 878 2 870
(2)下列有关说法不正确的是 (填字母)。A.火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能B.异丁烷分子中的碳氢键数目比正丁烷多C.正丁烷比异丁烷稳定(3)现有3 mol由甲烷和乙烷组成的混合气体,完全燃烧放出的热量为 3340 kJ,则该混合气体中甲烷和乙烷的物质的量之比是 。
BC
2:1
课堂小结
知识点:
知识点一: 热化学方程式:书写、辨析
知识点二: 燃烧热: 概念、计算
题型:
1、判断热化学方程式正误、书写热化学方程式
2、燃烧热的表示方法、利用燃烧热进行计算
已知两个热化学方程式:
2H2(g)+O2(g)= 2H2O(l) △H1 =-571.5 kJ·mol 1
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) △H2 =-2220 kJ·mol 1
实验测得氢气和丙烷的混合气体共5 mol完全
燃烧时共放热3847.5kJ,则混合气体中氢气和
丙烷的体积比为多少?
练练手
方法一: 列方程
方法二:平均值法 + 十字相差法: 6154.5/5=1230.9
3:2
在同温同压下,下列各组热化学方程式中Q2
2HCl(g) = H2(g)+Cl2(g) △H= Q2
B. C(s)+1/2O2(g)=CO (g) △H= Q1
C(s)+O2(g)= CO2 (g) △H= Q2
C. 2H2(g)+O2(g)=2H2O(l) △H= Q1
2H2(g)+O2(g)=2H2O(g) △H= Q2
D. S(s) +O2(g) =SO2 (g) △H= Q1
S(g)+O2(g)=SO2 (g) △H= Q2
B
题型二: △H比大小(带不带符号?)
方法:越负越小
B
下列说法正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.稀HCl溶液和稀NaOH溶液生成1mol水时的中和热为△H=- 57.3kJ/mol,稀HCl溶液和稀NaOH溶液反应时生成2mol水时的中和热为△H=- 2×57.3kJ/mol
C.焓变是指1mol物质参加反应时的能量变化
D.稀HCl溶液和稀NaOH溶液反应时的中和热为
△H=- 57.3kJ/mol,
则稀H2SO4和稀Ba(OH)2反应时生成1mol水也释放出57.3kJ的能量。
A
强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l) △H=-57.3k kJ·mol 1 则:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)
△H= - Q1kJ·mol 1
H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)
△H= - Q2 kJ·mol 1
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l)
△H= - Q3 kJ·mol 1
H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)
△H= -Q4 kJ·mol1
则Q1、Q2、Q3、Q4的关系正确的是 ( )
A.Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 > Q4
C. Q4 > Q2 > Q3 > Q1 D. Q2 = Q3 > Q1
C
3 39
反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式 ( )
A.N2(g)+3H2(g) 2NH3(g)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
C.1/2N2(g)+3/2H2(g) NH3(l)
ΔH=(b+c-a)kJ·mol-1
D.NH3(l) 1/2N2(g)+3/2H2(g)
ΔH=(b + c - a) kJ·mol-1
BD
例:3:在25℃,101KPa下,13.5克铝单质在氧气中完全燃烧后恢复至原状态,放出419KJ的能量,该反应的热化学方程式 ;
4Al(s) + 3O2(g) = 2Al2O3(s) ΔH= -3352.0 kJ/mol
例4: 在25℃,101KPa下,铁单质在氧气中完全燃烧后恢复至原状态,每转移1mol电子放出aKJ的能量,该反应的热化学方程式 ;
3Fe(s) + 2O2(g) = Fe3O4(s) ΔH= -8a kJ/mol
化合物 燃烧热(kJ·mol-1) 化合物 燃烧热(kJ·mol-1)
甲烷 891.0 正丁烷 2 878.0
乙烷 1 560.8 异丁烷 2 869.6
丙烷 2 221.5 2 甲基丁烷 3 531.3
一些烷烃的燃烧热如下表:
下列说法正确的是 ( )
A.正戊烷的燃烧热大约是3540 kJ·mol-1
B.热稳定性:正丁烷 > 异丁烷
C.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)ΔH=-1560.8 ×2kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
A
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知25℃,101KPa 1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是 ( )
A.该反应中肼作还原剂
B.液态肼的燃烧热为20.05 kJ·mol-1
C.该动力源的突出优点之一是生成物对环境无污染
D.肼和过氧化氢反应的热化学方程式为
N2H4 (l)+2H2O2(l)=N2(g)+4H2O(g)
ΔH=-641.6 kJ·mol-1
B
例4:已知在30℃、101kPa下,1g C8H18(辛烷)燃烧
生成二氧化碳和液态水时放出48.40kJ 热量。写出能
表示上述反应的热化学方程式正确的是 。
2C8H18(l)+25O2(g) 16CO2(g)+ 18H2O(l)
△H= - 11036kJ·mol -1
30℃
101kPa
C8H18(l)+25/2O2(g) 8CO2(g) +9H2O(l)
△H= - 5518kJ·mol -1
30℃
101kPa
