化学人教版(2019)选择性必修1 1.2反应热的计算(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.2反应热的计算(共35张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 59.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 13:27:45 | ||
图片预览




文档简介
(共35张PPT)
反应热的计算
第二节
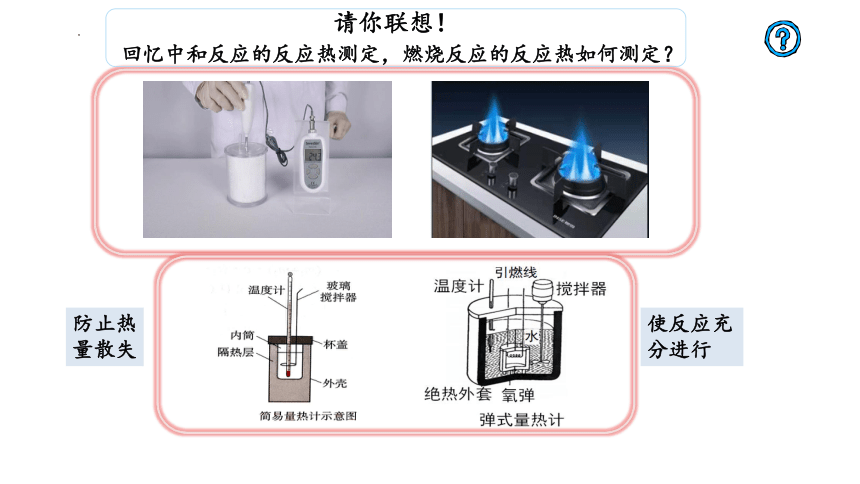
请你联想!
回忆中和反应的反应热测定,燃烧反应的反应热如何测定?
防止热量散失
使反应充分进行
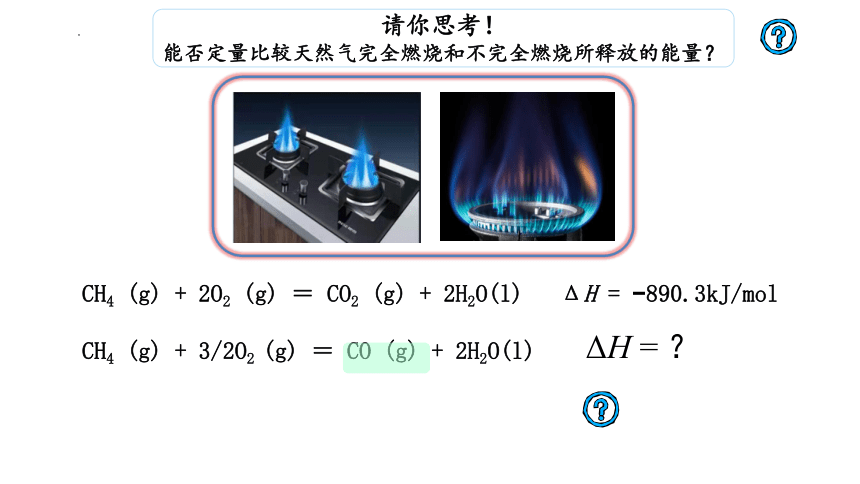
请你思考!
能否定量比较天然气完全燃烧和不完全燃烧所释放的能量?
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) ΔH = 890.3kJ/mol
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
ΔH = ?
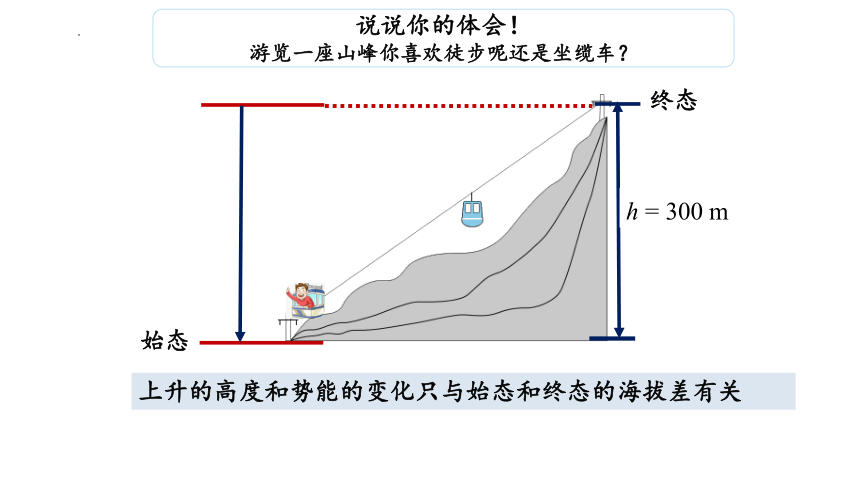
说说你的体会!
游览一座山峰你喜欢徒步呢还是坐缆车?
h = 300 m
终态
始态
上升的高度和势能的变化只与始态和终态的海拔差有关
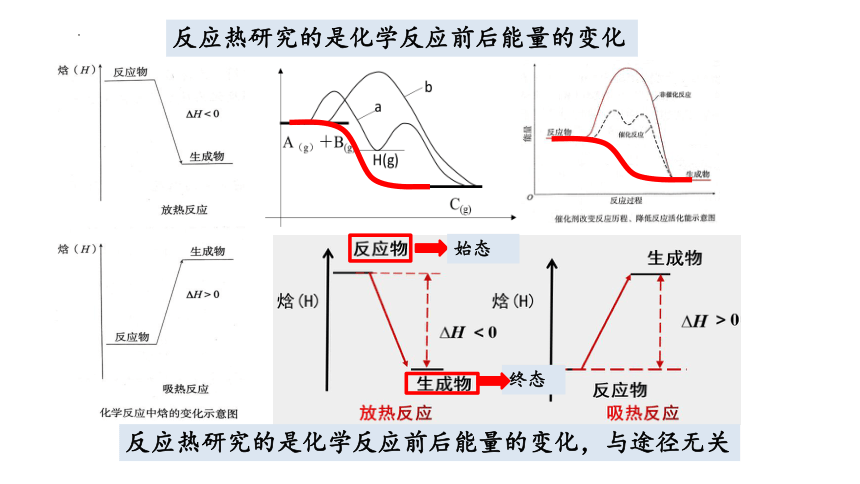
反应热研究的是化学反应前后能量的变化
始态
终态
反应热研究的是化学反应前后能量的变化,与途径无关
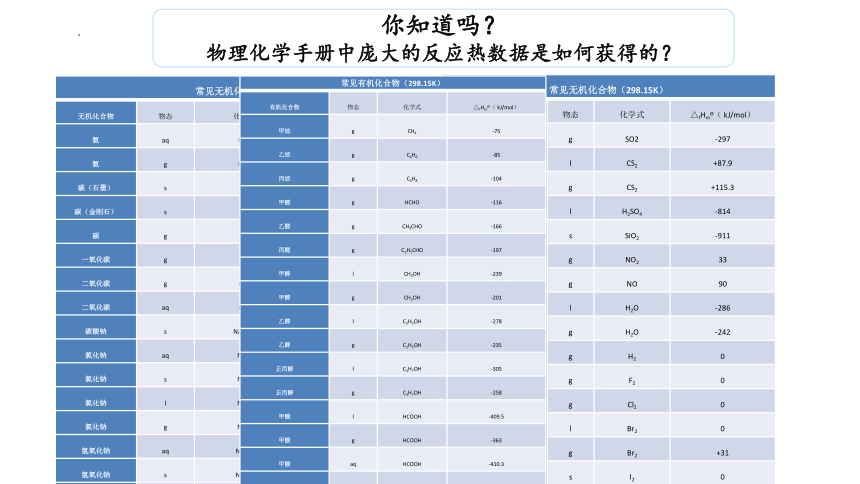
常见无机化合物(298.15K) 无机化合物 物态 化学式 △fHm ( kJ/mol)
氨 aq NH3 -80
氨 g NH3 -46.1
碳(石墨) s C 0
碳(金刚石) s C +1.987
碳 g C +718.9
一氧化碳 g CO -110.53
二氧化碳 g CO2 -393.51
二氧化碳 aq CO2 -413.8
碳酸钠 s Na2CO3 -1131
氯化钠 aq NaCl -407
氯化钠 s NaCl -411.12
氯化钠 l NaCl -385.92
氯化钠 g NaCl -181.42
氢氧化钠 aq NaOH -469.6
氢氧化钠 s NaOH -426.7
硝酸钠 aq NaNO3 -446.2
硝酸钠 s NaNO3 -424.8
常见无机化合物(298.15K) 无机化合物 物态 化学式 △fHm ( kJ/mol)
二氧化硫 g SO2 -297
二硫化碳 l CS2 +87.9
二硫化碳 g CS2 +115.3
硫酸 l H2SO4 -814
二氧化硅 s SiO2 -911
二氧化氮 g NO2 33
一氧化氮 g NO 90
水 l H2O -286
水 g H2O -242
氢 g H2 0
氟 g F2 0
氯 g Cl2 0
溴 l Br2 0
溴 g Br2 +31
碘 s I2 0
碘 g I2 +62
常见有机化合物(298.15K) 有机化合物 物态 化学式 △fHm ( kJ/mol)
甲烷 g CH4 -75
乙烷 g C2H6 -85
丙烷 g C3H8 -104
甲醛 g HCHO -116
乙醛 g CH3CHO -166
丙醛 g C2H5CHO -197
甲醇 l CH3OH -239
甲醇 g CH3OH -201
乙醇 l C2H5OH -278
乙醇 g C2H5OH -235
正丙醇 l C3H7OH -305
正丙醇 g C3H7OH -258
甲酸 l HCOOH -409.5
甲酸 g HCOOH -363
甲酸 aq HCOOH -410.3
乙酸 l CH3COOH -487
乙酸 g CH3COOH -435
丙酸 l C2H5COOH -511
你知道吗?
物理化学手册中庞大的反应热数据是如何获得的?
科学史话
热化学研究的先驱——盖斯
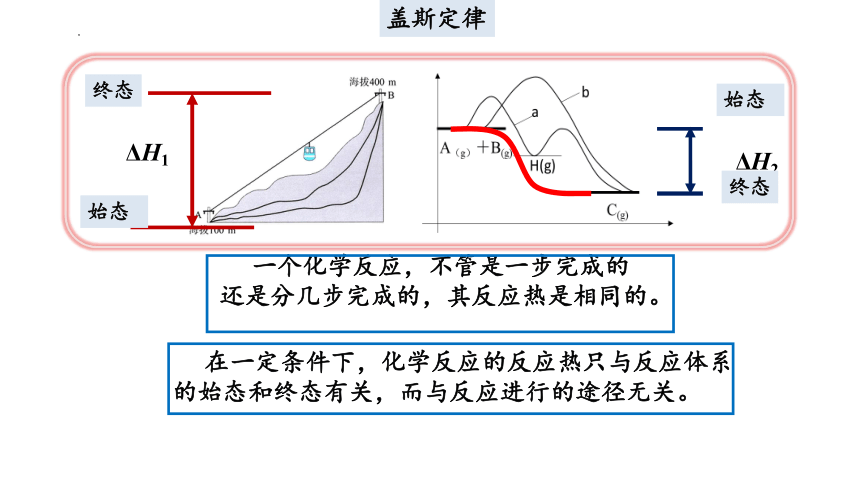
一个化学反应,不管是一步完成的还是分几步完成的,其反应热都是相同的。
不管化学反应是一步完成或分几步完成,其反应热是相同的。
瑞士化学家盖斯
在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1840年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。所以我们常称盖斯是热化学的奠基人。
换句话说:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
一、盖斯定律
盖斯定律
ΔH1
ΔH2
终态
始态
始态
终态
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
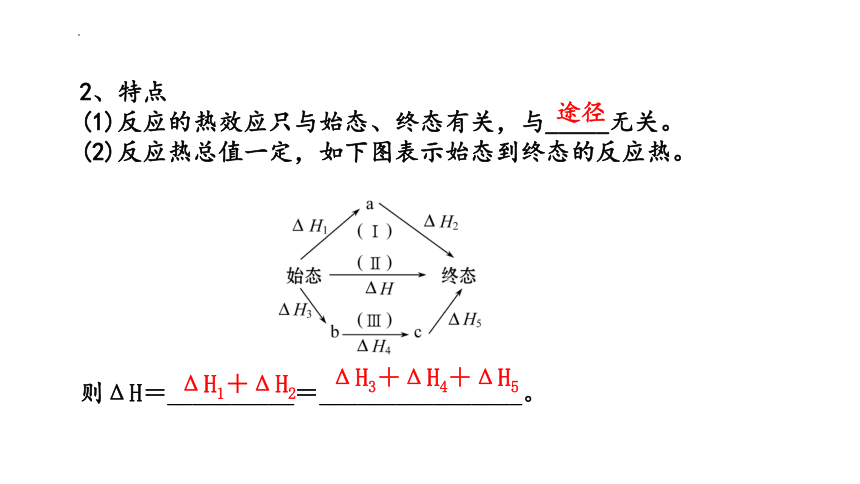
2、特点
(1)反应的热效应只与始态、终态有关,与_____无关。
(2)反应热总值一定,如下图表示始态到终态的反应热。
则ΔH=__________=________________。
途径
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
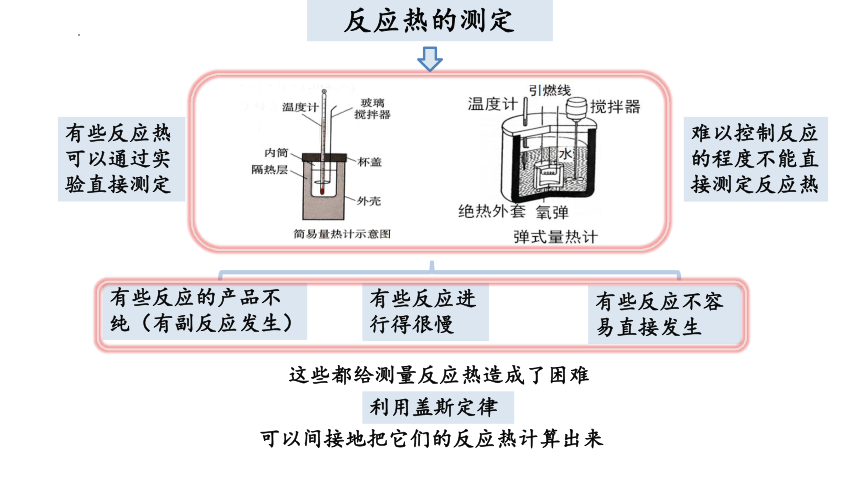
反应热的测定
有些反应热可以通过实验直接测定
难以控制反应的程度不能直接测定反应热
有些反应的产品不纯(有副反应发生)
有些反应进行得很慢
有些反应不容易直接发生
这些都给测量反应热造成了困难
利用盖斯定律
可以间接地把它们的反应热计算出来
3.意义
应用盖斯定律,可以间接计算以下情况(不能直接测定)的反应热:
(1)有些反应进行得很慢。
(2)有些反应不容易直接发生。
(3)有些反应往往有副反应发生。
CO2 (g)
C(s)+O2(g)
CO(g)+1/2O2(g)
ΔH2
ΔH3
ΔH1
始态
终态
分步进行
一步完成
例 已知在298K时:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
能否通过实验直接测定C(s) + 1/2O2(g) = CO(g) ΔH3=?若可以,请说明理由;若不可以,能否设计路径使之可测定?
H3 + H2 = H1
方案一、路径法
△H3 =△H1 - △H2
= 393.5 kJ/mol ( 283.0 kJ/mol)
= 110.5 kJ/mol
C(s) + O2(g) = CO(g) △H3=?
CO(g)+ O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/mol
+)
△H3 =△H1 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol= -110.5 kJ/mol
1
2
1
2
C(s) + O2(g) = CO(g) △H3= -110.5 kJ/mol
1
2
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
关键:目标方程式的“四则运算式”的导出(消元法)
方法:写出目标方程式确定“过渡物质” (要消去的物质)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
方案二、加合法
二、用盖斯定律计算反应热
1、目标方程中找唯一
3、同加异减
目标方程式中的物质:在给出的各个已知方程式中只出现一次的物质
目标方程式中的物质:
与已知方程式中物质在方程式的同侧,则相加;
与已知方程式中物质在方程式的异侧,则相减;
2、化系数
把已知方程式中的系数化成与目标方程式中物质的系数一致。
【技巧指导】
1、已知
① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③ C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试计算:
④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
【解】:①×2 + ②×4 - ③ = ④
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
2、已知下列反应的反应热
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -870.3 kJ/mol
C(s) + O2 (g) = CO2(g) △H2= -393.5 kJ/mol
H2(g) + O2(g) =H2O(l) △H3= -285.8 kJ/mol
试计算下述反应的反应热:
2C(s) + 2H2 (g) + O2 (g) = CH3COOH (l)
解: ④= ②×2 +③×2- ①
2C(s) + 2O2 (g) = 2CO2(g) 2△H2= -787.0 kJ/mol
2H2(g) + O2(g) =2H2O(l) 2△H3= -571.6 kJ/mol
+) 2CO2(g)+2H2O(l) =CH3COOH(l)+2O2(g) -△H1= 870.3 kJ/mol
----------------------------------------------------------------------------
2C(s) +2H2(l)+O2(g)=CH3COOH(l) △H= -488.3 kJ/mol
3、已知25 ℃、101 kPa时:
4Fe(s)+3O2(g)==2Fe2O3(s) ΔH1=-1648kJ·mol-1 ①
C(s)+O2(g)==CO2(g) ΔH2=-393kJ·mol-1 ②
2Fe(s)+2C(s)+3O2(g)==2FeCO3(s) ΔH3=-1480kJ·mol-1 ③
写出FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
2FeCO3(s)+1/2O2(g)= Fe2O3(s) + 2CO2(g) ΔH=-130 kJ·mol-1
解析:①×1/2+②×2-③
= -1648 ×1/2+(-393 )×2-(-1480 )
=-130 kJ·mol-1
4、已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为( )
A.+7.28 kJ·mol-1 B.-7.28 kJ·mol-1
C.+43.68 kJ·mol-1 D.-43.68 kJ·mol-1
【答案】A
通过以上几例,总结归纳这类问题的解题步骤:
①确定待求的反应方程式;
④实施叠加并检验。
③根据待求方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;
②找出待求方程式中各物质出现在已知方程式的什么位置;
数学本质——加和法
目的:始态和终态完全一致,消除中间产物。
1、计算公式:
ΔH=反应物的键能总和-生成物的键能总和。
2、计算关键:
正确找出反应物和生成物所含化学键的数目。
三、根据键能计算
1 mol P4含有6 mol P—P键
1 mol晶体硅含有2 mol Si—Si键
1 mol石墨晶体中含有1.5 mol C—C键
1 mol金刚石含有2 mol C—C键
1 mol SiO2含有4 mol Si—O键
成键电子数
2
化学键数=
例1、白磷与氧气可发生如下反应:P4(g)+5O2(g)=P4O10(g)。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A、(6a+5d-4c-12b) kJ·mol-1
B、(4c+12b-6a-5d) kJ·mol-1
C、(4c+12b-4a-5d) kJ·mol-1
D、(4a+5d-4c-12b) kJ·mol-1
A
例2、乙苯催化脱氢制苯乙烯反应:
已知:
化学键 C-H C-C C=C H-H
键能/kJ·mol-1 412 348 612 436
计算上述反应的△H=________ kJ·mol-1。
+124
不变的地方不要管
则2O(g)=O2(g)的ΔH 为( )
A、428 kJ·mol-1 B、-428 kJ·mol-1
C、498 kJ·mol-1 D、-498 kJ·mol-1
共价键 H- H H-O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1 D
例3、已知共价键的键能与热化学方程式信息如下表:
四、根据内能计算
例1、理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是 ( )
A、HCN比HNC稳定
B、该异构化反应的ΔH=+59.3 kJ·mol-1
C、1mol HCN的化学键断裂吸收186kJ的能量
D、使用催化剂,可以改变反应的反应热
D
计算公式:ΔH=生成物的内能总和-反应物的内能总和。
例2、一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
① D是________(填离子符号)。
② B→A+C反应的热化学方程式为_________________________(用离子符号表示)。
3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117 kJ/mol
ClO4-
方法一:利用盖斯定律进行比较
由①-②可得2H2O(l)=2H2O(g)
ΔH=ΔH1-ΔH2>0,
则ΔH1>ΔH2
例:比较ΔH1、ΔH2大小
①2H2(g)+O2(g)=2H2O(g) ΔH1
②2H2(g)+O2(g)=2H2O(l) ΔH2
五、反应热的大小比较
方法二:利用能量变化图进行比较
由图像可以看出放出或吸收热量的多少,
若是放热反应,放出的热量越多,ΔH越小;
若是吸热反应,吸收的热量越多,ΔH越大,故ΔH1>ΔH2。
1.下列各组热化学方程式中,化学反应的△H 前者大于后者的是 ( )
①C(s)+O2(g)=CO2(g) △H1
C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3
S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(l) △H5
2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)= CaO(s)+CO2(g) △H7
CaO(s)+H2O(l) =Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
c
看“符号”
看“系数”
【练习】
1. 能源问题是人类社会面临的重大课题,H2 、CO 、CH3OH 都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、
282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)=CH3OH(l)。则 CO 与 H2 反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)=CH3OH(l) ΔH=+127.4 kJ·mol-1
B.CO(g)+2H2(g)=CH3OH(g)
C.CO(g)+2H2(g)=CH3OH(g)
ΔH=-127.4 kJ·mol-1
ΔH=+127.4 kJ·mol-1
D.CO(g)+2H2(g)=CH3OH(l) ΔH=-127.4 kJ·mol-1
达标检测
D
2、下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________________、________________________
[审题指导] (1)找出待求热化学方程式
系统(Ⅰ):H2O(l)===H2(g)+1/2O2(g)
系统(Ⅱ):H2S(g)===H2(g)+S(s)
(2)调整涉及的已知热化学方程式
系统(Ⅰ)
系统(Ⅱ)
(3)加和调整好的热化学方程式
(4)求焓变ΔH
(5)检查
系统(Ⅰ):①+②+③可得出H2O(l)===H2(g)+1/2O2(g) ΔH=ΔH1+ΔH2+ΔH3
【答案】
H2O(l)===H2(g)+1/2O2(g) ΔH=+286 kJ·mol-1 H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1
3、发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1;
2H2(g)+O2(g)===2H2O(g) ΔH2=-484 kJ·mol-1;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH3=-534 kJ·mol-1;
H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1。
写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式:__________________________________
解析: 将已知的热化学方程式依次编号为①、②、③、④,将方程式③×2-①-④×4得
2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l),所以反应的ΔH=2×(-534 kJ·mol-1)-67.7 kJ·mol-1-4×(+44.0 kJ·mol-1)=-1 311.7 kJ·mol-1。
2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l) ΔH=-1 311.7 kJ·mol-1
反应热的计算
第二节
请你联想!
回忆中和反应的反应热测定,燃烧反应的反应热如何测定?
防止热量散失
使反应充分进行
请你思考!
能否定量比较天然气完全燃烧和不完全燃烧所释放的能量?
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O(l) ΔH = 890.3kJ/mol
CH4 (g) + 3/2O2 (g) = CO (g) + 2H2O(l)
ΔH = ?
说说你的体会!
游览一座山峰你喜欢徒步呢还是坐缆车?
h = 300 m
终态
始态
上升的高度和势能的变化只与始态和终态的海拔差有关
反应热研究的是化学反应前后能量的变化
始态
终态
反应热研究的是化学反应前后能量的变化,与途径无关
常见无机化合物(298.15K) 无机化合物 物态 化学式 △fHm ( kJ/mol)
氨 aq NH3 -80
氨 g NH3 -46.1
碳(石墨) s C 0
碳(金刚石) s C +1.987
碳 g C +718.9
一氧化碳 g CO -110.53
二氧化碳 g CO2 -393.51
二氧化碳 aq CO2 -413.8
碳酸钠 s Na2CO3 -1131
氯化钠 aq NaCl -407
氯化钠 s NaCl -411.12
氯化钠 l NaCl -385.92
氯化钠 g NaCl -181.42
氢氧化钠 aq NaOH -469.6
氢氧化钠 s NaOH -426.7
硝酸钠 aq NaNO3 -446.2
硝酸钠 s NaNO3 -424.8
常见无机化合物(298.15K) 无机化合物 物态 化学式 △fHm ( kJ/mol)
二氧化硫 g SO2 -297
二硫化碳 l CS2 +87.9
二硫化碳 g CS2 +115.3
硫酸 l H2SO4 -814
二氧化硅 s SiO2 -911
二氧化氮 g NO2 33
一氧化氮 g NO 90
水 l H2O -286
水 g H2O -242
氢 g H2 0
氟 g F2 0
氯 g Cl2 0
溴 l Br2 0
溴 g Br2 +31
碘 s I2 0
碘 g I2 +62
常见有机化合物(298.15K) 有机化合物 物态 化学式 △fHm ( kJ/mol)
甲烷 g CH4 -75
乙烷 g C2H6 -85
丙烷 g C3H8 -104
甲醛 g HCHO -116
乙醛 g CH3CHO -166
丙醛 g C2H5CHO -197
甲醇 l CH3OH -239
甲醇 g CH3OH -201
乙醇 l C2H5OH -278
乙醇 g C2H5OH -235
正丙醇 l C3H7OH -305
正丙醇 g C3H7OH -258
甲酸 l HCOOH -409.5
甲酸 g HCOOH -363
甲酸 aq HCOOH -410.3
乙酸 l CH3COOH -487
乙酸 g CH3COOH -435
丙酸 l C2H5COOH -511
你知道吗?
物理化学手册中庞大的反应热数据是如何获得的?
科学史话
热化学研究的先驱——盖斯
一个化学反应,不管是一步完成的还是分几步完成的,其反应热都是相同的。
不管化学反应是一步完成或分几步完成,其反应热是相同的。
瑞士化学家盖斯
在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1840年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。所以我们常称盖斯是热化学的奠基人。
换句话说:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
一、盖斯定律
盖斯定律
ΔH1
ΔH2
终态
始态
始态
终态
一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
2、特点
(1)反应的热效应只与始态、终态有关,与_____无关。
(2)反应热总值一定,如下图表示始态到终态的反应热。
则ΔH=__________=________________。
途径
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
反应热的测定
有些反应热可以通过实验直接测定
难以控制反应的程度不能直接测定反应热
有些反应的产品不纯(有副反应发生)
有些反应进行得很慢
有些反应不容易直接发生
这些都给测量反应热造成了困难
利用盖斯定律
可以间接地把它们的反应热计算出来
3.意义
应用盖斯定律,可以间接计算以下情况(不能直接测定)的反应热:
(1)有些反应进行得很慢。
(2)有些反应不容易直接发生。
(3)有些反应往往有副反应发生。
CO2 (g)
C(s)+O2(g)
CO(g)+1/2O2(g)
ΔH2
ΔH3
ΔH1
始态
终态
分步进行
一步完成
例 已知在298K时:
① C(s) + O2(g) = CO2(g) ΔH1= 393.5kJ/mol
② CO(g) + 1/2O2(g) = CO2(g) ΔH2= 283.0kJ/mol
能否通过实验直接测定C(s) + 1/2O2(g) = CO(g) ΔH3=?若可以,请说明理由;若不可以,能否设计路径使之可测定?
H3 + H2 = H1
方案一、路径法
△H3 =△H1 - △H2
= 393.5 kJ/mol ( 283.0 kJ/mol)
= 110.5 kJ/mol
C(s) + O2(g) = CO(g) △H3=?
CO(g)+ O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/mol
+)
△H3 =△H1 - △H2
= -393.5 kJ/mol -(-283.0 kJ/mol= -110.5 kJ/mol
1
2
1
2
C(s) + O2(g) = CO(g) △H3= -110.5 kJ/mol
1
2
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
关键:目标方程式的“四则运算式”的导出(消元法)
方法:写出目标方程式确定“过渡物质” (要消去的物质)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
方案二、加合法
二、用盖斯定律计算反应热
1、目标方程中找唯一
3、同加异减
目标方程式中的物质:在给出的各个已知方程式中只出现一次的物质
目标方程式中的物质:
与已知方程式中物质在方程式的同侧,则相加;
与已知方程式中物质在方程式的异侧,则相减;
2、化系数
把已知方程式中的系数化成与目标方程式中物质的系数一致。
【技巧指导】
1、已知
① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③ C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试计算:
④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
【解】:①×2 + ②×4 - ③ = ④
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
2、已知下列反应的反应热
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -870.3 kJ/mol
C(s) + O2 (g) = CO2(g) △H2= -393.5 kJ/mol
H2(g) + O2(g) =H2O(l) △H3= -285.8 kJ/mol
试计算下述反应的反应热:
2C(s) + 2H2 (g) + O2 (g) = CH3COOH (l)
解: ④= ②×2 +③×2- ①
2C(s) + 2O2 (g) = 2CO2(g) 2△H2= -787.0 kJ/mol
2H2(g) + O2(g) =2H2O(l) 2△H3= -571.6 kJ/mol
+) 2CO2(g)+2H2O(l) =CH3COOH(l)+2O2(g) -△H1= 870.3 kJ/mol
----------------------------------------------------------------------------
2C(s) +2H2(l)+O2(g)=CH3COOH(l) △H= -488.3 kJ/mol
3、已知25 ℃、101 kPa时:
4Fe(s)+3O2(g)==2Fe2O3(s) ΔH1=-1648kJ·mol-1 ①
C(s)+O2(g)==CO2(g) ΔH2=-393kJ·mol-1 ②
2Fe(s)+2C(s)+3O2(g)==2FeCO3(s) ΔH3=-1480kJ·mol-1 ③
写出FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
2FeCO3(s)+1/2O2(g)= Fe2O3(s) + 2CO2(g) ΔH=-130 kJ·mol-1
解析:①×1/2+②×2-③
= -1648 ×1/2+(-393 )×2-(-1480 )
=-130 kJ·mol-1
4、已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为( )
A.+7.28 kJ·mol-1 B.-7.28 kJ·mol-1
C.+43.68 kJ·mol-1 D.-43.68 kJ·mol-1
【答案】A
通过以上几例,总结归纳这类问题的解题步骤:
①确定待求的反应方程式;
④实施叠加并检验。
③根据待求方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;
②找出待求方程式中各物质出现在已知方程式的什么位置;
数学本质——加和法
目的:始态和终态完全一致,消除中间产物。
1、计算公式:
ΔH=反应物的键能总和-生成物的键能总和。
2、计算关键:
正确找出反应物和生成物所含化学键的数目。
三、根据键能计算
1 mol P4含有6 mol P—P键
1 mol晶体硅含有2 mol Si—Si键
1 mol石墨晶体中含有1.5 mol C—C键
1 mol金刚石含有2 mol C—C键
1 mol SiO2含有4 mol Si—O键
成键电子数
2
化学键数=
例1、白磷与氧气可发生如下反应:P4(g)+5O2(g)=P4O10(g)。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A、(6a+5d-4c-12b) kJ·mol-1
B、(4c+12b-6a-5d) kJ·mol-1
C、(4c+12b-4a-5d) kJ·mol-1
D、(4a+5d-4c-12b) kJ·mol-1
A
例2、乙苯催化脱氢制苯乙烯反应:
已知:
化学键 C-H C-C C=C H-H
键能/kJ·mol-1 412 348 612 436
计算上述反应的△H=________ kJ·mol-1。
+124
不变的地方不要管
则2O(g)=O2(g)的ΔH 为( )
A、428 kJ·mol-1 B、-428 kJ·mol-1
C、498 kJ·mol-1 D、-498 kJ·mol-1
共价键 H- H H-O
键能/(kJ·mol-1) 436 463
热化学方程式 2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1 D
例3、已知共价键的键能与热化学方程式信息如下表:
四、根据内能计算
例1、理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是 ( )
A、HCN比HNC稳定
B、该异构化反应的ΔH=+59.3 kJ·mol-1
C、1mol HCN的化学键断裂吸收186kJ的能量
D、使用催化剂,可以改变反应的反应热
D
计算公式:ΔH=生成物的内能总和-反应物的内能总和。
例2、一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
① D是________(填离子符号)。
② B→A+C反应的热化学方程式为_________________________(用离子符号表示)。
3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117 kJ/mol
ClO4-
方法一:利用盖斯定律进行比较
由①-②可得2H2O(l)=2H2O(g)
ΔH=ΔH1-ΔH2>0,
则ΔH1>ΔH2
例:比较ΔH1、ΔH2大小
①2H2(g)+O2(g)=2H2O(g) ΔH1
②2H2(g)+O2(g)=2H2O(l) ΔH2
五、反应热的大小比较
方法二:利用能量变化图进行比较
由图像可以看出放出或吸收热量的多少,
若是放热反应,放出的热量越多,ΔH越小;
若是吸热反应,吸收的热量越多,ΔH越大,故ΔH1>ΔH2。
1.下列各组热化学方程式中,化学反应的△H 前者大于后者的是 ( )
①C(s)+O2(g)=CO2(g) △H1
C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3
S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(l) △H5
2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)= CaO(s)+CO2(g) △H7
CaO(s)+H2O(l) =Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
c
看“符号”
看“系数”
【练习】
1. 能源问题是人类社会面临的重大课题,H2 、CO 、CH3OH 都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、
282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)=CH3OH(l)。则 CO 与 H2 反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)=CH3OH(l) ΔH=+127.4 kJ·mol-1
B.CO(g)+2H2(g)=CH3OH(g)
C.CO(g)+2H2(g)=CH3OH(g)
ΔH=-127.4 kJ·mol-1
ΔH=+127.4 kJ·mol-1
D.CO(g)+2H2(g)=CH3OH(l) ΔH=-127.4 kJ·mol-1
达标检测
D
2、下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________________、________________________
[审题指导] (1)找出待求热化学方程式
系统(Ⅰ):H2O(l)===H2(g)+1/2O2(g)
系统(Ⅱ):H2S(g)===H2(g)+S(s)
(2)调整涉及的已知热化学方程式
系统(Ⅰ)
系统(Ⅱ)
(3)加和调整好的热化学方程式
(4)求焓变ΔH
(5)检查
系统(Ⅰ):①+②+③可得出H2O(l)===H2(g)+1/2O2(g) ΔH=ΔH1+ΔH2+ΔH3
【答案】
H2O(l)===H2(g)+1/2O2(g) ΔH=+286 kJ·mol-1 H2S(g)===H2(g)+S(s) ΔH=+20 kJ·mol-1
3、发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1;
2H2(g)+O2(g)===2H2O(g) ΔH2=-484 kJ·mol-1;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH3=-534 kJ·mol-1;
H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1。
写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式:__________________________________
解析: 将已知的热化学方程式依次编号为①、②、③、④,将方程式③×2-①-④×4得
2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l),所以反应的ΔH=2×(-534 kJ·mol-1)-67.7 kJ·mol-1-4×(+44.0 kJ·mol-1)=-1 311.7 kJ·mol-1。
2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l) ΔH=-1 311.7 kJ·mol-1
