化学人教版(2019)选择性必修3 1.2研究有机化合物的方法(共68张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.2研究有机化合物的方法(共68张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 13:31:54 | ||
图片预览






文档简介
(共68张PPT)
第一章 有机化合物的结构特点和研究方法
第二节 研究有机化合物的方法
了解研究有机物应采取的步骤和方法
1
初步学会分离、提纯有机物的方法(重点)
2
学习目标
掌握蒸馏、重结晶和萃取实验的基本技能(重点)
3
知道通过化学实验和某些物理方法可以确定有机化合物的结构
4
槟榔
口腔癌的发生率因近年来嚼食槟榔人口的增加而逐年上升。
长期嚼食槟榔的人罹患口腔癌的机率比一般人高20倍。
李时珍在《本草纲目》中记载,槟榔有“下水肿、通关节、健脾调中、治心痛积聚”等诸多病症。
槟榔是我国的四大南药之一
如果你是化学家,你该如何来研究槟榔中的有机化合物?一般的步骤和方法是什么?
有机物(粗品)
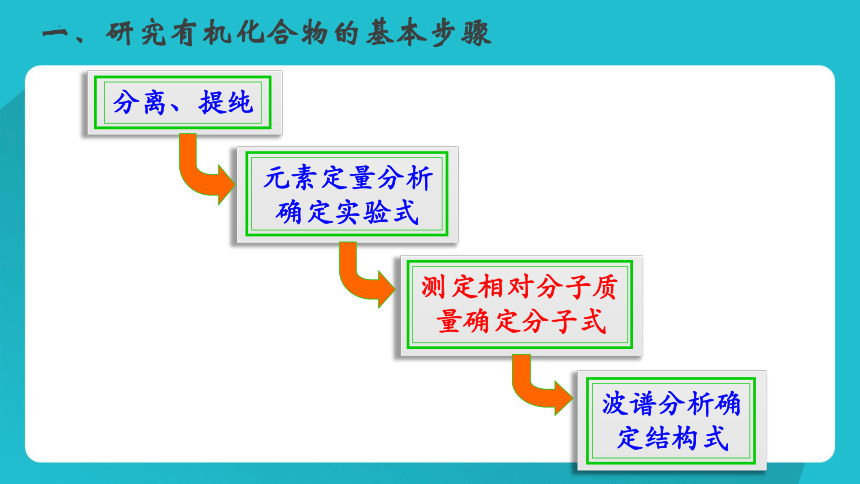
一、研究有机化合物的基本步骤
分离、提纯
元素定量分析
确定实验式
波谱分析确定结构式
测定相对分子质量确定分子式
一、研究有机化合物的基本步骤
1.什么是物质的分离、提纯?分离、提纯物质的方法有哪些?分离提纯的总原则是什么?
(1)物质的分离是把混合物的各种成分物质分开的过程,分开以后的各物质应该尽量减少损失。
(2)物质的提纯是将某物质中的杂质,采用物理或化学方法除掉的过程。
两者主要区别在于提纯除掉后的杂质可以不进行恢复。
(3)分离、提纯的方法:
物理方法:溶解、过滤、重结晶、升华、蒸发、蒸馏、萃取、分液、液化、汽化、渗析、盐析、洗气等。
化学方法:加热分解、氧化还原转化、生成沉淀、酸碱中和、络合、水解、化学方法洗气等。
杂转纯杂变沉化为气溶剂分
(4)分离提纯的原则:不增不减易分离易复原
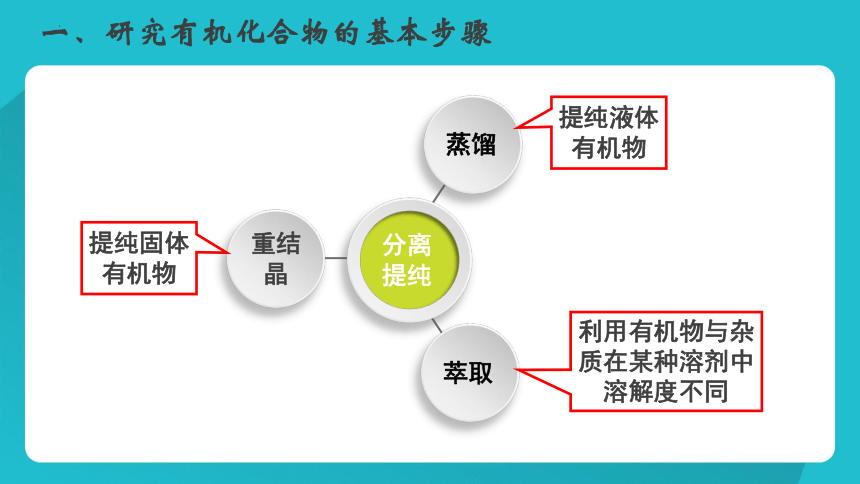
一、研究有机化合物的基本步骤
蒸馏
萃取
重结
晶
分离
提纯
提纯固体有机物
提纯液体有机物
利用有机物与杂质在某种溶剂中溶解度不同
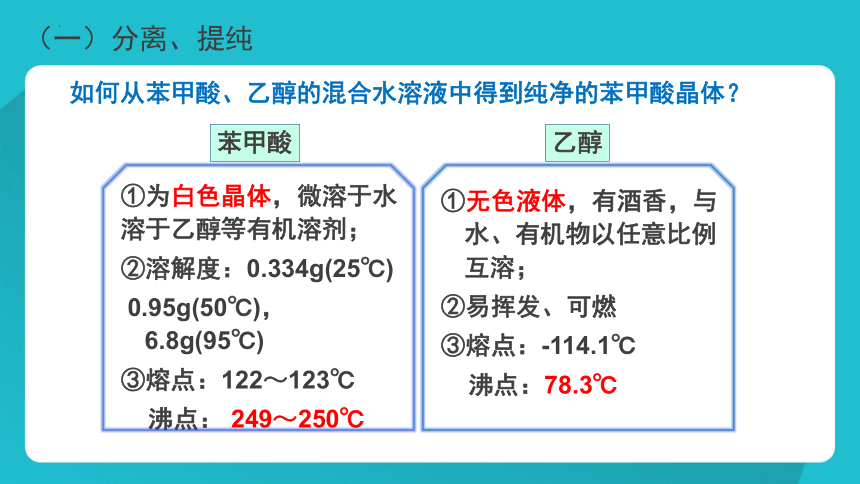
①无色液体,有酒香,与水、有机物以任意比例互溶;
②易挥发、可燃
③熔点:-114.1℃
沸点:78.3℃
乙醇
苯甲酸
①为白色晶体,微溶于水
溶于乙醇等有机溶剂;
②溶解度:0.334g(25℃)
0.95g(50℃), 6.8g(95℃)
③熔点:122~123℃
沸点: 249~250℃
如何从苯甲酸、乙醇的混合水溶液中得到纯净的苯甲酸晶体?
(一)分离、提纯
(一)分离、提纯
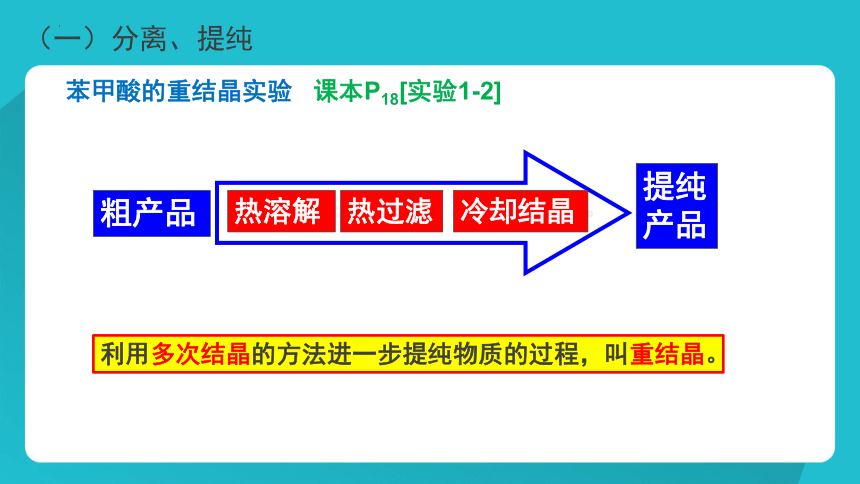
苯甲酸的重结晶实验 课本P18[实验1-2]
粗产品
热溶解
热过滤
冷却结晶
提纯产品
利用多次结晶的方法进一步提纯物质的过程,叫重结晶。
(一)分离、提纯
2.通过实验思考一下问题:
(1)在实验中我们是如何尽量减少苯甲酸损失的?
(2)冷却结晶时温度是不是越低越好?
(3)在重结晶过程中要多次进行洗涤,在进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其目的是什么?为什么要用冷溶剂?
(2)温度过低,杂质溶解度也会降低,部分杂质会析出,达不到提纯苯甲酸的目的
趁热过滤
(3)用热溶剂是洗涤不溶性固体表面的可溶性有机物。
用冷溶剂洗涤目的是除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
(1)加热溶解
(一)分离、提纯
固
很大或很小
温度
较大
较小
关键:
选择适当的溶剂
(一)分离、提纯
互不相溶
溶解性
有机溶剂
分液漏斗
铁架台
烧杯
振荡
上口倒出
(一)分离、提纯
(4)萃取包括:
①液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程。(专用仪器设备)
(一)分离、提纯
趁热打铁
4、色谱法
俄国植物学家茨卫特
1906年,茨卫特在一根玻璃管的细端塞上一小团绵花,在管中充填碳酸钙粉末,让溶有绿色植物叶子色素的石油醚溶液自上而下地通过。结果植物色素便被碳酸钙吸附,分成三段不同颜色:绿色、黄色、黄绿色。再将碳酸钙吸附柱取出,并用乙醇洗脱,即得色素的溶液:叶绿素、叶黄素、胡萝卜素。
(一)分离、提纯
德国化学家库恩
茨卫特的色谱实验当时并未引起人们的注意。直到25年后的1931年,德国化学家库恩在分离、提纯、确定胡萝卜素异构体和维生素的结构中,应用了色谱法,并获得1938年诺贝尔化学奖。
(一)分离、提纯
4、色谱法
(1)色谱法原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法叫色谱法。
色谱法是化学家分离、提纯有机物不可缺少的方法。
(2)常用的吸附剂:碳酸钙、硅胶、氧化铝、活性炭等。
(3)分类:根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等。
(一)分离、提纯
质量分数
实验式
CO2
H2O
(二)元素分析与相对分子质量的测定
元
素
分
析
仪
德国化学家李比希
(1803~1873)
李比希法:定量测定有机物中碳和氢元素含量的一种分析方法。
将准确称量的样品置于一燃烧管中,再将其彻底燃烧成二氧化碳和水,用纯的氧气流把它们分别赶入烧碱石棉剂(附在石棉上粉碎的氢氧化钠)及高氯酸镁的吸收管内,前者将排出的二氧化碳变为碳酸钠,后者吸收水变为含有结晶水的高氯酸镁,这两个吸收管增加的重量分别表示生成的二氧化碳和水的重量,由此即可计算样品中的碳和氢的含量。如果碳与氢的百分含量相加达不到100%,而又检测不出其他元素,则差数就是氧的百分含量。本法的特点是碳氢分析在同一样品中进行,且对仪器装置稍加改装后,即能连续检测其他元素。
取定量含C、H(O)的有机物
加氧化铜
氧化
H2O
CO2
用无水
CaCl2吸收
用KOH浓
溶液吸收
得前后质量差
得前后质量差
“李比希元素分析法”原理
H2O CO2
实验装置:
取定量含C、H(O)的有机物
加氧化铜
氧化
H2O
CO2
用无水
CaCl2吸收
用KOH浓
溶液吸收
得前后质量差
得前后质量差
计算C、H含量
计算O含量
如何计算
CO2
H2O
一定量
有机物
燃烧
C
m有机物-mC – mH
H
氧元素含量的计算
= mO
5.8 g某有机物完全燃烧,生成CO2 13.2 g , H2O 5.4 g 。含有哪些元素 该有机物的实验式为?能否根据实验式确定分子式?
即:C3H6O
实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。
分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。
m(C) =
13.2
= 3.6 g
m(H) =
5
= 0.6 g
m(O) =
5.8 – 3.6 – 0.6
= 1.6 g
该有机物的实验式:
N(C):N(H):N(O) = : :
= 3:6:1
不能根据实验式确定分子式
实验测得某碳氢化合物A中,含碳80%、含氢 20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
实验式是CH3
分子式是C2H6
(CH3)n=30
15n = 30
n = 2
知道最简式,要确定分子式,还需要知道相对分子质量。
N(C):N(H) = :
= 1:3
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求该未知物A的实验式。
思路:
(1) 先确定该有机物中各组成元素原子的质量分数
(2) 再求各元素原子的个数比
该物质A的实验式为:C2H6O
思考:该物质能根据最简式直接确定分子式吗?
分子式为:C2H6O
有哪些方法可以求相对分子质量?
(1)M = m / n
(2)根据有机蒸气的相对密度D: D =M1/M2
(3)标况下有机蒸气的密度为ρg/L,
M = 22.4L/mol ×ρg/L
(4)质谱法——测定相对分子质量。
测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
有机物分子
高能电子束轰击
带电的
“碎片”
确定结构
碎片的质荷比
质荷比:碎片的相对质量(m)和所带电荷(e-)的比值
质谱法作用:测定相对分子质量
CH3CH2OH
+
质荷比
31
100
80
60
40
20
0
20
30
40
50
27
29
45
46
CH3CH2
+
CH2=OH
+
CH3CH=OH
+
相对丰度/%
乙醇的质谱图
最大分子、离子的质荷比越大,达到检测器需要的时间越长,因此质谱图中的质荷比最大的就是未知物的相对分子质量。
趁热打铁
二甲醚
乙醇
写出C2H6O可能的结构:
有机物A的分子式为C2H6O,你怎样确定有机物A是乙醇,还是二甲醚?
化学键
吸收频率
(三)分子结构的鉴定
氢原子的类型
数目
位置不同
氢原子数
红
外
光
谱
仪
趁热打铁
即学即练
问题引入——自主探究
典题例证——思维深化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
问题引入——自主探究
要点归纳——深化知识
典题例证——思维深化
实验步骤 解释实验结论
测得A的蒸气密度是同状况下甲烷的4.375倍 (1)A的相对分子质量为____________
将5.6 g A在足量氧气中充分燃烧,并将产物依次通过浓硫酸和碱石灰,分别增重7.2 g和17.6 g (2)A的实验式为________;A的分子式为________
将A通入溴水,溴水褪色 (3)说明A属于__________(若不褪色,则A属于______)
A的核磁共振氢谱如下: (4)综上所述,A的结构简式为____________________
典题例证——思维深化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
THANK YOU
第一章 有机化合物的结构特点和研究方法
第二节 研究有机化合物的方法
了解研究有机物应采取的步骤和方法
1
初步学会分离、提纯有机物的方法(重点)
2
学习目标
掌握蒸馏、重结晶和萃取实验的基本技能(重点)
3
知道通过化学实验和某些物理方法可以确定有机化合物的结构
4
槟榔
口腔癌的发生率因近年来嚼食槟榔人口的增加而逐年上升。
长期嚼食槟榔的人罹患口腔癌的机率比一般人高20倍。
李时珍在《本草纲目》中记载,槟榔有“下水肿、通关节、健脾调中、治心痛积聚”等诸多病症。
槟榔是我国的四大南药之一
如果你是化学家,你该如何来研究槟榔中的有机化合物?一般的步骤和方法是什么?
有机物(粗品)
一、研究有机化合物的基本步骤
分离、提纯
元素定量分析
确定实验式
波谱分析确定结构式
测定相对分子质量确定分子式
一、研究有机化合物的基本步骤
1.什么是物质的分离、提纯?分离、提纯物质的方法有哪些?分离提纯的总原则是什么?
(1)物质的分离是把混合物的各种成分物质分开的过程,分开以后的各物质应该尽量减少损失。
(2)物质的提纯是将某物质中的杂质,采用物理或化学方法除掉的过程。
两者主要区别在于提纯除掉后的杂质可以不进行恢复。
(3)分离、提纯的方法:
物理方法:溶解、过滤、重结晶、升华、蒸发、蒸馏、萃取、分液、液化、汽化、渗析、盐析、洗气等。
化学方法:加热分解、氧化还原转化、生成沉淀、酸碱中和、络合、水解、化学方法洗气等。
杂转纯杂变沉化为气溶剂分
(4)分离提纯的原则:不增不减易分离易复原
一、研究有机化合物的基本步骤
蒸馏
萃取
重结
晶
分离
提纯
提纯固体有机物
提纯液体有机物
利用有机物与杂质在某种溶剂中溶解度不同
①无色液体,有酒香,与水、有机物以任意比例互溶;
②易挥发、可燃
③熔点:-114.1℃
沸点:78.3℃
乙醇
苯甲酸
①为白色晶体,微溶于水
溶于乙醇等有机溶剂;
②溶解度:0.334g(25℃)
0.95g(50℃), 6.8g(95℃)
③熔点:122~123℃
沸点: 249~250℃
如何从苯甲酸、乙醇的混合水溶液中得到纯净的苯甲酸晶体?
(一)分离、提纯
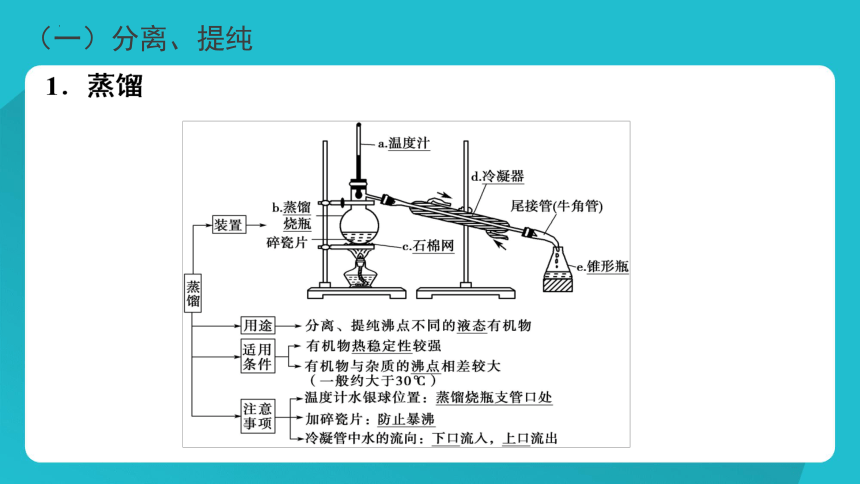
(一)分离、提纯
苯甲酸的重结晶实验 课本P18[实验1-2]
粗产品
热溶解
热过滤
冷却结晶
提纯产品
利用多次结晶的方法进一步提纯物质的过程,叫重结晶。
(一)分离、提纯
2.通过实验思考一下问题:
(1)在实验中我们是如何尽量减少苯甲酸损失的?
(2)冷却结晶时温度是不是越低越好?
(3)在重结晶过程中要多次进行洗涤,在进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其目的是什么?为什么要用冷溶剂?
(2)温度过低,杂质溶解度也会降低,部分杂质会析出,达不到提纯苯甲酸的目的
趁热过滤
(3)用热溶剂是洗涤不溶性固体表面的可溶性有机物。
用冷溶剂洗涤目的是除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
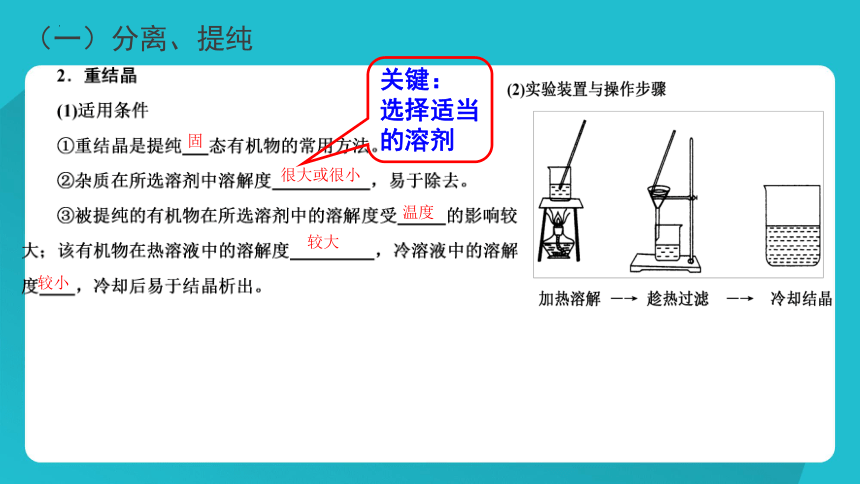
(1)加热溶解
(一)分离、提纯
固
很大或很小
温度
较大
较小
关键:
选择适当的溶剂
(一)分离、提纯
互不相溶
溶解性
有机溶剂
分液漏斗
铁架台
烧杯
振荡
上口倒出
(一)分离、提纯
(4)萃取包括:
①液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程。(专用仪器设备)
(一)分离、提纯
趁热打铁
4、色谱法
俄国植物学家茨卫特
1906年,茨卫特在一根玻璃管的细端塞上一小团绵花,在管中充填碳酸钙粉末,让溶有绿色植物叶子色素的石油醚溶液自上而下地通过。结果植物色素便被碳酸钙吸附,分成三段不同颜色:绿色、黄色、黄绿色。再将碳酸钙吸附柱取出,并用乙醇洗脱,即得色素的溶液:叶绿素、叶黄素、胡萝卜素。
(一)分离、提纯
德国化学家库恩
茨卫特的色谱实验当时并未引起人们的注意。直到25年后的1931年,德国化学家库恩在分离、提纯、确定胡萝卜素异构体和维生素的结构中,应用了色谱法,并获得1938年诺贝尔化学奖。
(一)分离、提纯
4、色谱法
(1)色谱法原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法叫色谱法。
色谱法是化学家分离、提纯有机物不可缺少的方法。
(2)常用的吸附剂:碳酸钙、硅胶、氧化铝、活性炭等。
(3)分类:根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等。
(一)分离、提纯
质量分数
实验式
CO2
H2O
(二)元素分析与相对分子质量的测定
元
素
分
析
仪
德国化学家李比希
(1803~1873)
李比希法:定量测定有机物中碳和氢元素含量的一种分析方法。
将准确称量的样品置于一燃烧管中,再将其彻底燃烧成二氧化碳和水,用纯的氧气流把它们分别赶入烧碱石棉剂(附在石棉上粉碎的氢氧化钠)及高氯酸镁的吸收管内,前者将排出的二氧化碳变为碳酸钠,后者吸收水变为含有结晶水的高氯酸镁,这两个吸收管增加的重量分别表示生成的二氧化碳和水的重量,由此即可计算样品中的碳和氢的含量。如果碳与氢的百分含量相加达不到100%,而又检测不出其他元素,则差数就是氧的百分含量。本法的特点是碳氢分析在同一样品中进行,且对仪器装置稍加改装后,即能连续检测其他元素。
取定量含C、H(O)的有机物
加氧化铜
氧化
H2O
CO2
用无水
CaCl2吸收
用KOH浓
溶液吸收
得前后质量差
得前后质量差
“李比希元素分析法”原理
H2O CO2
实验装置:
取定量含C、H(O)的有机物
加氧化铜
氧化
H2O
CO2
用无水
CaCl2吸收
用KOH浓
溶液吸收
得前后质量差
得前后质量差
计算C、H含量
计算O含量
如何计算
CO2
H2O
一定量
有机物
燃烧
C
m有机物-mC – mH
H
氧元素含量的计算
= mO
5.8 g某有机物完全燃烧,生成CO2 13.2 g , H2O 5.4 g 。含有哪些元素 该有机物的实验式为?能否根据实验式确定分子式?
即:C3H6O
实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。
分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。
m(C) =
13.2
= 3.6 g
m(H) =
5
= 0.6 g
m(O) =
5.8 – 3.6 – 0.6
= 1.6 g
该有机物的实验式:
N(C):N(H):N(O) = : :
= 3:6:1
不能根据实验式确定分子式
实验测得某碳氢化合物A中,含碳80%、含氢 20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
实验式是CH3
分子式是C2H6
(CH3)n=30
15n = 30
n = 2
知道最简式,要确定分子式,还需要知道相对分子质量。
N(C):N(H) = :
= 1:3
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求该未知物A的实验式。
思路:
(1) 先确定该有机物中各组成元素原子的质量分数
(2) 再求各元素原子的个数比
该物质A的实验式为:C2H6O
思考:该物质能根据最简式直接确定分子式吗?
分子式为:C2H6O
有哪些方法可以求相对分子质量?
(1)M = m / n
(2)根据有机蒸气的相对密度D: D =M1/M2
(3)标况下有机蒸气的密度为ρg/L,
M = 22.4L/mol ×ρg/L
(4)质谱法——测定相对分子质量。
测定相对分子质量的方法很多,质谱法是最精确、最快捷的方法。它是用高能电子流等轰击样品分子,使该分子失去电子变成带正电荷的分子离子和碎片离子。这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
有机物分子
高能电子束轰击
带电的
“碎片”
确定结构
碎片的质荷比
质荷比:碎片的相对质量(m)和所带电荷(e-)的比值
质谱法作用:测定相对分子质量
CH3CH2OH
+
质荷比
31
100
80
60
40
20
0
20
30
40
50
27
29
45
46
CH3CH2
+
CH2=OH
+
CH3CH=OH
+
相对丰度/%
乙醇的质谱图
最大分子、离子的质荷比越大,达到检测器需要的时间越长,因此质谱图中的质荷比最大的就是未知物的相对分子质量。
趁热打铁
二甲醚
乙醇
写出C2H6O可能的结构:
有机物A的分子式为C2H6O,你怎样确定有机物A是乙醇,还是二甲醚?
化学键
吸收频率
(三)分子结构的鉴定
氢原子的类型
数目
位置不同
氢原子数
红
外
光
谱
仪
趁热打铁
即学即练
问题引入——自主探究
典题例证——思维深化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
问题引入——自主探究
要点归纳——深化知识
典题例证——思维深化
实验步骤 解释实验结论
测得A的蒸气密度是同状况下甲烷的4.375倍 (1)A的相对分子质量为____________
将5.6 g A在足量氧气中充分燃烧,并将产物依次通过浓硫酸和碱石灰,分别增重7.2 g和17.6 g (2)A的实验式为________;A的分子式为________
将A通入溴水,溴水褪色 (3)说明A属于__________(若不褪色,则A属于______)
A的核磁共振氢谱如下: (4)综上所述,A的结构简式为____________________
典题例证——思维深化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
精选习题——落实强化
THANK YOU
