备战2024年中考化学题型突破:题型三 工艺流程题课件(共43张PPT)
文档属性
| 名称 | 备战2024年中考化学题型突破:题型三 工艺流程题课件(共43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 20:17:13 | ||
图片预览









文档简介
(共43张PPT)
题型三 工艺流程题
题型帮
工艺流程题主要考查物质的生产和除杂,试题常由题头、题干和题尾三部分组成,题头一般介绍工艺流程的原材料和生产目的,题干主要用框图的形式将原料到产品的生产过程表示出来,题尾主要根据工艺流程中涉及的化学知识来设置问题,试题常综合考查化学式和化学方程式的书写、过滤操作、物质的转化等相关内容,难度相对较大。
方法帮
类型1 物质的制备类流程题 (近5年2考)
类型2 物质的回收、提纯类流程题 (近5年1考)
解题通法
命题点 解题方法
原料处 理 ①研磨(粉碎) 目的是增大反应物之间的接触面积,加快反应
速率;
②打磨:目的是除去物质表面的污物或氧化膜
命题点 解题方法
物料反 应 ①生成物和反应物的判断:对比流程图中反应前后的物质进行判
断,如不满足质量守恒定律,在溶液中进行的反应要考虑是否有水
参与反应,在空气中进行的反应要考虑是否有氧气参与反应;
②化学方程式的书写:从流程图中找出反应物和生成物以及反应条
件,注意沉淀符号或气体符号的书写;
③反应条件的控制:控制温度通常是为了防止反应物或生成物在高
温下分解;控制 通常是为了防止目标阳离子生成沉淀;在氮气
(或稀有气体)氛围中进行主要是为了防止反应物或生成物被氧气
氧化
续表
命题点 解题方法
实验操 作 ①搅拌(或加热) 加快反应速率;
②过滤:使沉淀与溶液分离;
③趁热过滤:防止温度降低时某些物质析出;
④蒸发结晶(或降温结晶) 从溶液中得到固体
实验评 价 ①常见优点:物质可循环使用,反应不生成污染物,耗能少等;
②常见缺点:生成空气污染物,没有尾气处理装置,耗能多等
续表
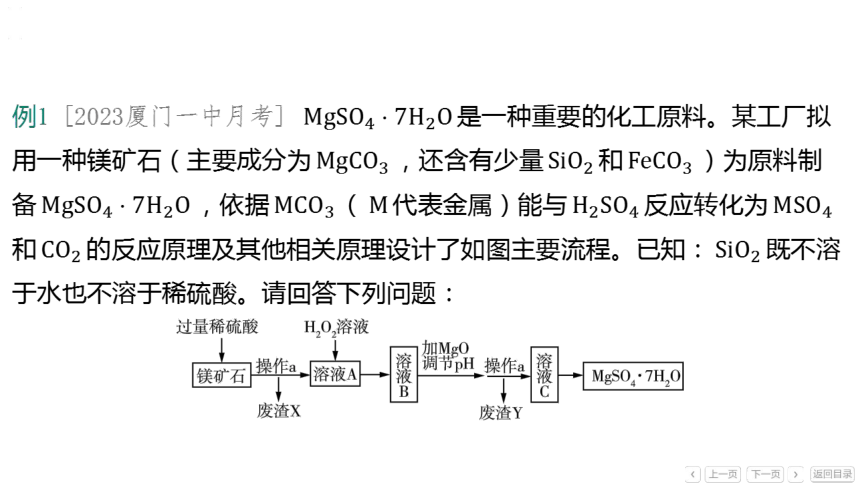
例1 [2023厦门一中月考] 是一种重要的化工原料。某工厂拟
用一种镁矿石(主要成分为 ,还含有少量 和 )为原料制
备 ,依据 ( 代表金属)能与 反应转化为
和 的反应原理及其他相关原理设计了如图主要流程。已知: 既不溶
于水也不溶于稀硫酸。请回答下列问题:
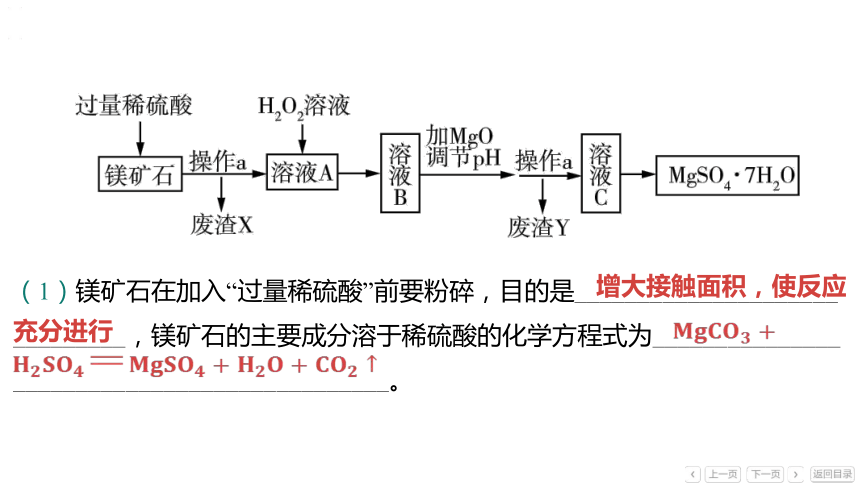
(1)镁矿石在加入“过量稀硫酸”前要粉碎,目的是_____________________
_________,镁矿石的主要成分溶于稀硫酸的化学方程式为_______________
______________________________。
增大接触面积,使反应充分进行
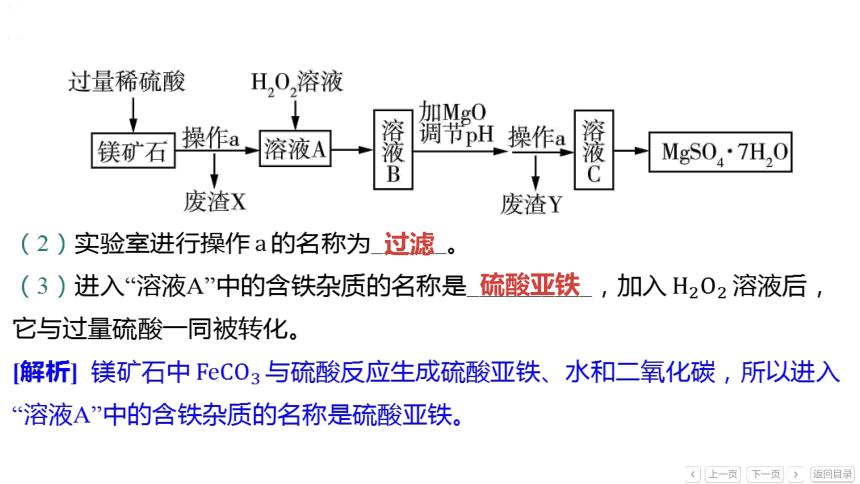
(2)实验室进行操作 的名称为______。
过滤
(3)进入“溶液A”中的含铁杂质的名称是__________,加入 溶液后,
它与过量硫酸一同被转化。
硫酸亚铁
[解析] 镁矿石中 与硫酸反应生成硫酸亚铁、水和二氧化碳,所以进入
“溶液A”中的含铁杂质的名称是硫酸亚铁。
(4)“废渣 ”中含有少量的 ,其中铁元素的化合价是_ ___。
[解析] 在化合物中,氢元素显 价,氧元素显 价,设 中铁元
素化合价为 ,根据化合物中各元素正、负化合价的代数和等于0,则
,得 。
(5)流程采用“加 调节 ”,目的是使 转化为沉淀,________
(填“可以”或“不可以”)用 代替 ,理由是____________________
_____________________。
不可以
氢氧化钠和硫酸反应会生成新的杂质硫酸钠
[解析] 该流程的目标产品是 ,不可以用 代替 调节
,因为氢氧化钠和硫酸反应会生成新的杂质硫酸钠。
例2 [2023成都中考] 成都有丰富的钙芒硝矿(主要成分有硫酸钠和硫酸钙),是生产元明粉(硫酸钠)的重要原料,工艺流程和硫酸钠的溶解度曲线如图。回答问题。
(1)①处用到的分离方法是______。
过滤
[解析] 经①处操作后得到浸出渣和浸出液,实现固液分离,可知该操作为过滤。
(2)矿石粉共经过____次浸出,可有效增大“一段浸出液”的浓度,其目的
是提高产率和________________________。
三
避免蒸发时消耗更多能源
[解析] 分析流程图信息,第一次浸出后得到一段浸出液,第二次浸出后得到二段浸出液,第三次浸出后得到洗液,故矿石粉共经过三次浸出。
(3)终渣中主要含有硫酸钙,原因是__________________________。
硫酸钙在水中溶解能力较弱
(4)②处浓溶液的温度约为_ _____时,开始降温结晶,较为合适。
[解析] 根据硫酸钠的溶解度曲线图, 时,硫酸钠的溶解度最大,对应溶液
中溶质的质量分数最大,则②处浓溶液从 开始降温结晶,较为合适。
(5)硫酸钠可用于钡盐(如氯化钡)中毒的解毒剂,解毒原理的化学方程
式为_ _________________________________。
变式训练1 [2023福州十九中模拟]
氯化亚铜 常用作催化剂、杀菌
剂、脱色剂等。工业上用印刷电路的
蚀刻液的废液(含 、 、
【查阅资料】 是一种白色晶体,不溶于乙醇而溶于氨水,在空气中迅
速氧化,变成绿色,见光分解,变成褐色。
。
回答下列问题:
)生产 并制得 蚀刻液的流程如图所示。
(1)写出向废液中加入过量铁粉后发生置换反应的化学方程式:_________
___________________。
(2)滤渣2的成分是_ ___(写化学式)。
[解析] 滤液1中溶质为氯化亚铁,滤渣1为铜和铁,加入过量盐酸,铁和盐酸反应生成氯化亚铁和氢气,铜不与盐酸反应,故滤渣2为铜。
(3)滤液1、2合并后与 溶液反应生成 蚀刻液的化学方程式为
,则 的化学式为_____。
[解析] 根据质量守恒定律,反应前后原子的种类和数目都不变,反应前共有4个
氢原子、2个氧原子、2个铁原子、6个氯原子,反应后除 外有2个铁原子、6
个氯原子,故 中有4个氢原子、2个氧原子,则 的化学式为 。
(4)分离、提纯 晶体过程中的“系列操作”包括“调 、过滤、洗涤、
低温烘干”。实验探究 对 产率的影响如下表所示。分析表格可知析
出 晶体的最佳 为___。为了得到纯净的 晶体,可用______(填
“氨水”或“乙醇”)进行洗涤。
1 2 3 4 5 6 7
产率/% 70 90 82 78 75 72 70
2
乙醇
[解析] 根据表格数据分析可知,当 等于2时, 产率最高,故析出
晶体的最佳 为2;由于氯化亚铜不溶于乙醇而溶于氨水,为了得到纯净的氯
化亚铜晶体,可用乙醇进行洗涤。
(5)在 的生产过程中,除环境、安全问题外,你认为还应注意的关键
问题是____________________________。
防止氯化亚铜氧化和见光分解
[解析] 由查阅的资料可知,氯化亚铜易氧化变质且见光分解,所以生产中应防止氯化亚铜氧化和见光分解,减少产品氯化亚铜的损失。
变式训练2 [2023娄底中考] 二氧化氯 用于家庭、公共场所的杀菌消
毒,是一种高效和安全的杀菌消毒剂,在工业上以含可溶性杂质 和
的粗盐为原料来制取,生产过程如图所示。
(1)操作①的名称:______。
过滤
(2)步骤Ⅰ除杂中,可用饱和 溶液浸洗粗盐除去可溶性杂质,其原因
是_ ______________。
防止 溶解
[解析] 用饱和 溶液浸洗粗盐除去可溶性杂质,饱和 溶液不会继续
溶解 ,可防止 溶解。
(3)从元素守恒角度分析,Ⅲ中有水参与反应,请写出该反应的化学方程
式:_ ______________________________。
(4)上述流程中可循环利用的物质是_ _____。
[解析] 既为步骤Ⅳ的生成物,也为步骤Ⅲ的反应物,故可循环利用。
变式训练3 [2023青岛中考] 自然界中的铝元素以化合物的形式存在于各种
矿石中,某铝土矿的主要成分是 ,含少量 、 等杂质。从该铝
土矿中提取铝可采用如下工艺流程(不考虑其他杂质参与反应)
已知: 不溶于水且不与盐酸反应; 能与 溶液反应,生成
可溶性盐。
请回答下列问题。
(1)步骤①加盐酸前先将铝土矿粉碎的目的是_________________________
_______________;所得滤液A中的溶质有___种。
增大反应物接触面积,使反应更快、更充分
3
[解析] 某铝土矿的主要成分是 ,含少量 、 等杂质,
不溶于水且不与盐酸反应,过量的盐酸与 反应生成 和 ,与
反应生成 和 ,故所得滤液A中的溶质有3种,即 、
和 。
(2)步骤②中所加 溶液须过量的目的是____________________。
使氢氧化铝完全溶解
(3)步骤 加热分解生成两种氧化物,请写出该反应的化学方程
式:_ __________________________。
[解析] 加热分解生成两种氧化物,其中一种是 ,则另一种氧
化物一定含氢元素,故为 ,可写出相应的化学方程式。
(4)步骤④是通过电解熔融状态的 制备铝。 的熔点是 ,
很难达到熔融状态,工业上通过加入冰晶石使其在 左右熔化,请写
出这一做法的意义:____________________________。
降低氧化铝的熔点,节约能源
变式训练4 法国医生吕布兰开创了规模化工业制取碳酸钠的先河,具体流程如图。
回答下列问题:
(1)①中发生的反应属于基本反应类型中的____________。
复分解反应
[解析] ①中发生的反应是氯化钠与浓硫酸在加热的条件下反应生成硫酸钠和氯化氢气体,是两种化合物交换成分生成另外两种化合物的反应,符合复分解反应的特点,属于复分解反应。
(2)②中 和木炭反应生成 和 ,写出该反应的化学方程式:
_ ____________________________。
(3)③中主要操作需用到玻璃棒,其作用是____________。
搅拌和引流
[解析] ③中主要操作有水浸,以及将固体和液体分离,涉及溶解和过滤,所以玻璃棒的作用是搅拌和引流。
(4)上述流程有明显不足,请写出其中一处:____________________________
_______________________________。
步骤②生成的一氧化碳会污染空气(或没有尾气处理,合理即可)
(5)工业上用制碱废液(主要成分为 )
吸收 ,随着 的通入,溶液组成变化如下图
所示。通入过量 后,最终产物是_ ________。
例3 [2022福建中考] 我国古代提纯焰硝(含 和少量 、 等)
工艺的主要过程示意图如下:
(1)步骤Ⅰ中,“搅拌”的作用是________________________(写一种)。
加快溶解(或均匀受热)
(2)步骤Ⅲ加小灰水(含 )时,发生反应的化学方程式为_________
_______________________。
(3)如图为硝酸钾、氯化钠的溶解度曲线。步骤 Ⅳ
在较高温度下过滤的目的是________________。
防止硝酸钾析出
[解析] 较高温度时硝酸钾的溶解度较大,且硝酸钾的溶
解度受温度影响较大,温度降低时会使其析出,高温时
过滤可除去 等杂质,不会析出硝酸钾。
(4)步骤Ⅴ析出硝酸钾晶体的过程称之为______。
结晶
(5)“溶液2”一定含有的溶质有 、_______和___________________(填
化学式)。
(或 )
[解析] 加小灰水除去了溶液中的氯化钙,但生成了氯化钾,故溶液中的离子有
钾离子、钠离子、硝酸根离子、氯离子,硝酸钾析出后“溶液2”为硝酸钾的饱
和溶液,故“溶液2”一定含有的溶质有 、 、 (或 )。
变式训练5 [2023厦门质检] 垃圾是放错地方的资源,城市的废旧电器是一座“矿山”。从废旧电器回收的电路板中含有塑料、锡、锌、金、铜等。小明同学设计从回收的混合物中提取铜、金的流程如下:
(1)以上流程中分拣出来的塑料属于___(填标号)。
A
A.可回收垃圾 B.有害垃圾 C.其他垃圾
(2)写出分拣后金属混合物与稀硫酸发生反应的化学方程式:
_ ____________________________________________________________(写一
个)。
(或 )
(3)灼烧铜、金混合物时,发生反应的基本类型是__________。
化合反应
[解析] 在加热条件下金与氧气不反应,铜与氧气反应生成氧化铜,该反应由两种物质生成一种物质,属于化合反应。
(4)溶液 的溶质是_ _____________________。
硫酸亚铁(或 )
[解析] 向金与氧化铜的混合物中加过量稀硫酸,金不与稀硫酸反应,氧化铜
与稀硫酸反应生成硫酸铜和水,所以溶液 为硫酸铜溶液和稀硫酸的混合溶
液,加入过量铁粉,铁与硫酸铜反应生成硫酸亚铁和铜,铁与稀硫酸反应生
成硫酸亚铁和氢气,所以溶液 中的溶质是硫酸亚铁。
(5)操作 可以采用的物理方法是__________________________。
用磁铁吸引铁粉,分离出铜
[解析] 操作 是将混合物中的铁除去,可采用的物理方法是用磁铁吸引铁粉,
留下铜。
变式训练6 [2023黄冈中考] 兴趣小组的同学利用某废镍材料(含有金属
及少量 、 )回收镍,设计流程如下图所示(部分产物略去)。
请根据上述流程回答下列问题:
(1)过滤时,玻璃棒的作用是______。
引流
(2)写出“酸浸”时发生反应的化学方程式:_____________________________
_________________________________(任写一个)。
(或 )
[解析] 由滤液Ⅰ中含有 可知, 能与硫酸发生反应。
(4) 、 、 的金属活动性由强到弱的顺序为_ ____________。
、 、
[解析] 由 能与硫酸反应,可知金属活动性 ,由适量铁粉加入滤液
Ⅱ中生成镍单质,可知金属活动性 ,故金属活动性: 。
(3)过氧化氢具有氧化性,“氧化”时发生反应的化学方程式为
,则 的化学式是_____。
[解析] 根据质量守恒定律,化学反应前后原子的种类和个数均不变,结合化
学方程式可推出 为 。
(5)已知 和 开始沉淀和完全沉淀时的 如下表。“除铁”过程中
加入 溶液的目的是通过调节溶液的 使 完全沉淀而 不沉淀,
则 的范围是___(填字母序号)。
离子 开始沉淀时的 完全沉淀时的
2.7 3.2
7.2 8.7
B
A. B. C.
[解析] 由题表知 在 为2.7时开始沉淀,在 为3.2时完全沉淀,
在 为7.2时开始沉淀,要使 完全沉淀而 不沉淀, 的范围应为
。
题型三 工艺流程题
题型帮
工艺流程题主要考查物质的生产和除杂,试题常由题头、题干和题尾三部分组成,题头一般介绍工艺流程的原材料和生产目的,题干主要用框图的形式将原料到产品的生产过程表示出来,题尾主要根据工艺流程中涉及的化学知识来设置问题,试题常综合考查化学式和化学方程式的书写、过滤操作、物质的转化等相关内容,难度相对较大。
方法帮
类型1 物质的制备类流程题 (近5年2考)
类型2 物质的回收、提纯类流程题 (近5年1考)
解题通法
命题点 解题方法
原料处 理 ①研磨(粉碎) 目的是增大反应物之间的接触面积,加快反应
速率;
②打磨:目的是除去物质表面的污物或氧化膜
命题点 解题方法
物料反 应 ①生成物和反应物的判断:对比流程图中反应前后的物质进行判
断,如不满足质量守恒定律,在溶液中进行的反应要考虑是否有水
参与反应,在空气中进行的反应要考虑是否有氧气参与反应;
②化学方程式的书写:从流程图中找出反应物和生成物以及反应条
件,注意沉淀符号或气体符号的书写;
③反应条件的控制:控制温度通常是为了防止反应物或生成物在高
温下分解;控制 通常是为了防止目标阳离子生成沉淀;在氮气
(或稀有气体)氛围中进行主要是为了防止反应物或生成物被氧气
氧化
续表
命题点 解题方法
实验操 作 ①搅拌(或加热) 加快反应速率;
②过滤:使沉淀与溶液分离;
③趁热过滤:防止温度降低时某些物质析出;
④蒸发结晶(或降温结晶) 从溶液中得到固体
实验评 价 ①常见优点:物质可循环使用,反应不生成污染物,耗能少等;
②常见缺点:生成空气污染物,没有尾气处理装置,耗能多等
续表
例1 [2023厦门一中月考] 是一种重要的化工原料。某工厂拟
用一种镁矿石(主要成分为 ,还含有少量 和 )为原料制
备 ,依据 ( 代表金属)能与 反应转化为
和 的反应原理及其他相关原理设计了如图主要流程。已知: 既不溶
于水也不溶于稀硫酸。请回答下列问题:
(1)镁矿石在加入“过量稀硫酸”前要粉碎,目的是_____________________
_________,镁矿石的主要成分溶于稀硫酸的化学方程式为_______________
______________________________。
增大接触面积,使反应充分进行
(2)实验室进行操作 的名称为______。
过滤
(3)进入“溶液A”中的含铁杂质的名称是__________,加入 溶液后,
它与过量硫酸一同被转化。
硫酸亚铁
[解析] 镁矿石中 与硫酸反应生成硫酸亚铁、水和二氧化碳,所以进入
“溶液A”中的含铁杂质的名称是硫酸亚铁。
(4)“废渣 ”中含有少量的 ,其中铁元素的化合价是_ ___。
[解析] 在化合物中,氢元素显 价,氧元素显 价,设 中铁元
素化合价为 ,根据化合物中各元素正、负化合价的代数和等于0,则
,得 。
(5)流程采用“加 调节 ”,目的是使 转化为沉淀,________
(填“可以”或“不可以”)用 代替 ,理由是____________________
_____________________。
不可以
氢氧化钠和硫酸反应会生成新的杂质硫酸钠
[解析] 该流程的目标产品是 ,不可以用 代替 调节
,因为氢氧化钠和硫酸反应会生成新的杂质硫酸钠。
例2 [2023成都中考] 成都有丰富的钙芒硝矿(主要成分有硫酸钠和硫酸钙),是生产元明粉(硫酸钠)的重要原料,工艺流程和硫酸钠的溶解度曲线如图。回答问题。
(1)①处用到的分离方法是______。
过滤
[解析] 经①处操作后得到浸出渣和浸出液,实现固液分离,可知该操作为过滤。
(2)矿石粉共经过____次浸出,可有效增大“一段浸出液”的浓度,其目的
是提高产率和________________________。
三
避免蒸发时消耗更多能源
[解析] 分析流程图信息,第一次浸出后得到一段浸出液,第二次浸出后得到二段浸出液,第三次浸出后得到洗液,故矿石粉共经过三次浸出。
(3)终渣中主要含有硫酸钙,原因是__________________________。
硫酸钙在水中溶解能力较弱
(4)②处浓溶液的温度约为_ _____时,开始降温结晶,较为合适。
[解析] 根据硫酸钠的溶解度曲线图, 时,硫酸钠的溶解度最大,对应溶液
中溶质的质量分数最大,则②处浓溶液从 开始降温结晶,较为合适。
(5)硫酸钠可用于钡盐(如氯化钡)中毒的解毒剂,解毒原理的化学方程
式为_ _________________________________。
变式训练1 [2023福州十九中模拟]
氯化亚铜 常用作催化剂、杀菌
剂、脱色剂等。工业上用印刷电路的
蚀刻液的废液(含 、 、
【查阅资料】 是一种白色晶体,不溶于乙醇而溶于氨水,在空气中迅
速氧化,变成绿色,见光分解,变成褐色。
。
回答下列问题:
)生产 并制得 蚀刻液的流程如图所示。
(1)写出向废液中加入过量铁粉后发生置换反应的化学方程式:_________
___________________。
(2)滤渣2的成分是_ ___(写化学式)。
[解析] 滤液1中溶质为氯化亚铁,滤渣1为铜和铁,加入过量盐酸,铁和盐酸反应生成氯化亚铁和氢气,铜不与盐酸反应,故滤渣2为铜。
(3)滤液1、2合并后与 溶液反应生成 蚀刻液的化学方程式为
,则 的化学式为_____。
[解析] 根据质量守恒定律,反应前后原子的种类和数目都不变,反应前共有4个
氢原子、2个氧原子、2个铁原子、6个氯原子,反应后除 外有2个铁原子、6
个氯原子,故 中有4个氢原子、2个氧原子,则 的化学式为 。
(4)分离、提纯 晶体过程中的“系列操作”包括“调 、过滤、洗涤、
低温烘干”。实验探究 对 产率的影响如下表所示。分析表格可知析
出 晶体的最佳 为___。为了得到纯净的 晶体,可用______(填
“氨水”或“乙醇”)进行洗涤。
1 2 3 4 5 6 7
产率/% 70 90 82 78 75 72 70
2
乙醇
[解析] 根据表格数据分析可知,当 等于2时, 产率最高,故析出
晶体的最佳 为2;由于氯化亚铜不溶于乙醇而溶于氨水,为了得到纯净的氯
化亚铜晶体,可用乙醇进行洗涤。
(5)在 的生产过程中,除环境、安全问题外,你认为还应注意的关键
问题是____________________________。
防止氯化亚铜氧化和见光分解
[解析] 由查阅的资料可知,氯化亚铜易氧化变质且见光分解,所以生产中应防止氯化亚铜氧化和见光分解,减少产品氯化亚铜的损失。
变式训练2 [2023娄底中考] 二氧化氯 用于家庭、公共场所的杀菌消
毒,是一种高效和安全的杀菌消毒剂,在工业上以含可溶性杂质 和
的粗盐为原料来制取,生产过程如图所示。
(1)操作①的名称:______。
过滤
(2)步骤Ⅰ除杂中,可用饱和 溶液浸洗粗盐除去可溶性杂质,其原因
是_ ______________。
防止 溶解
[解析] 用饱和 溶液浸洗粗盐除去可溶性杂质,饱和 溶液不会继续
溶解 ,可防止 溶解。
(3)从元素守恒角度分析,Ⅲ中有水参与反应,请写出该反应的化学方程
式:_ ______________________________。
(4)上述流程中可循环利用的物质是_ _____。
[解析] 既为步骤Ⅳ的生成物,也为步骤Ⅲ的反应物,故可循环利用。
变式训练3 [2023青岛中考] 自然界中的铝元素以化合物的形式存在于各种
矿石中,某铝土矿的主要成分是 ,含少量 、 等杂质。从该铝
土矿中提取铝可采用如下工艺流程(不考虑其他杂质参与反应)
已知: 不溶于水且不与盐酸反应; 能与 溶液反应,生成
可溶性盐。
请回答下列问题。
(1)步骤①加盐酸前先将铝土矿粉碎的目的是_________________________
_______________;所得滤液A中的溶质有___种。
增大反应物接触面积,使反应更快、更充分
3
[解析] 某铝土矿的主要成分是 ,含少量 、 等杂质,
不溶于水且不与盐酸反应,过量的盐酸与 反应生成 和 ,与
反应生成 和 ,故所得滤液A中的溶质有3种,即 、
和 。
(2)步骤②中所加 溶液须过量的目的是____________________。
使氢氧化铝完全溶解
(3)步骤 加热分解生成两种氧化物,请写出该反应的化学方程
式:_ __________________________。
[解析] 加热分解生成两种氧化物,其中一种是 ,则另一种氧
化物一定含氢元素,故为 ,可写出相应的化学方程式。
(4)步骤④是通过电解熔融状态的 制备铝。 的熔点是 ,
很难达到熔融状态,工业上通过加入冰晶石使其在 左右熔化,请写
出这一做法的意义:____________________________。
降低氧化铝的熔点,节约能源
变式训练4 法国医生吕布兰开创了规模化工业制取碳酸钠的先河,具体流程如图。
回答下列问题:
(1)①中发生的反应属于基本反应类型中的____________。
复分解反应
[解析] ①中发生的反应是氯化钠与浓硫酸在加热的条件下反应生成硫酸钠和氯化氢气体,是两种化合物交换成分生成另外两种化合物的反应,符合复分解反应的特点,属于复分解反应。
(2)②中 和木炭反应生成 和 ,写出该反应的化学方程式:
_ ____________________________。
(3)③中主要操作需用到玻璃棒,其作用是____________。
搅拌和引流
[解析] ③中主要操作有水浸,以及将固体和液体分离,涉及溶解和过滤,所以玻璃棒的作用是搅拌和引流。
(4)上述流程有明显不足,请写出其中一处:____________________________
_______________________________。
步骤②生成的一氧化碳会污染空气(或没有尾气处理,合理即可)
(5)工业上用制碱废液(主要成分为 )
吸收 ,随着 的通入,溶液组成变化如下图
所示。通入过量 后,最终产物是_ ________。
例3 [2022福建中考] 我国古代提纯焰硝(含 和少量 、 等)
工艺的主要过程示意图如下:
(1)步骤Ⅰ中,“搅拌”的作用是________________________(写一种)。
加快溶解(或均匀受热)
(2)步骤Ⅲ加小灰水(含 )时,发生反应的化学方程式为_________
_______________________。
(3)如图为硝酸钾、氯化钠的溶解度曲线。步骤 Ⅳ
在较高温度下过滤的目的是________________。
防止硝酸钾析出
[解析] 较高温度时硝酸钾的溶解度较大,且硝酸钾的溶
解度受温度影响较大,温度降低时会使其析出,高温时
过滤可除去 等杂质,不会析出硝酸钾。
(4)步骤Ⅴ析出硝酸钾晶体的过程称之为______。
结晶
(5)“溶液2”一定含有的溶质有 、_______和___________________(填
化学式)。
(或 )
[解析] 加小灰水除去了溶液中的氯化钙,但生成了氯化钾,故溶液中的离子有
钾离子、钠离子、硝酸根离子、氯离子,硝酸钾析出后“溶液2”为硝酸钾的饱
和溶液,故“溶液2”一定含有的溶质有 、 、 (或 )。
变式训练5 [2023厦门质检] 垃圾是放错地方的资源,城市的废旧电器是一座“矿山”。从废旧电器回收的电路板中含有塑料、锡、锌、金、铜等。小明同学设计从回收的混合物中提取铜、金的流程如下:
(1)以上流程中分拣出来的塑料属于___(填标号)。
A
A.可回收垃圾 B.有害垃圾 C.其他垃圾
(2)写出分拣后金属混合物与稀硫酸发生反应的化学方程式:
_ ____________________________________________________________(写一
个)。
(或 )
(3)灼烧铜、金混合物时,发生反应的基本类型是__________。
化合反应
[解析] 在加热条件下金与氧气不反应,铜与氧气反应生成氧化铜,该反应由两种物质生成一种物质,属于化合反应。
(4)溶液 的溶质是_ _____________________。
硫酸亚铁(或 )
[解析] 向金与氧化铜的混合物中加过量稀硫酸,金不与稀硫酸反应,氧化铜
与稀硫酸反应生成硫酸铜和水,所以溶液 为硫酸铜溶液和稀硫酸的混合溶
液,加入过量铁粉,铁与硫酸铜反应生成硫酸亚铁和铜,铁与稀硫酸反应生
成硫酸亚铁和氢气,所以溶液 中的溶质是硫酸亚铁。
(5)操作 可以采用的物理方法是__________________________。
用磁铁吸引铁粉,分离出铜
[解析] 操作 是将混合物中的铁除去,可采用的物理方法是用磁铁吸引铁粉,
留下铜。
变式训练6 [2023黄冈中考] 兴趣小组的同学利用某废镍材料(含有金属
及少量 、 )回收镍,设计流程如下图所示(部分产物略去)。
请根据上述流程回答下列问题:
(1)过滤时,玻璃棒的作用是______。
引流
(2)写出“酸浸”时发生反应的化学方程式:_____________________________
_________________________________(任写一个)。
(或 )
[解析] 由滤液Ⅰ中含有 可知, 能与硫酸发生反应。
(4) 、 、 的金属活动性由强到弱的顺序为_ ____________。
、 、
[解析] 由 能与硫酸反应,可知金属活动性 ,由适量铁粉加入滤液
Ⅱ中生成镍单质,可知金属活动性 ,故金属活动性: 。
(3)过氧化氢具有氧化性,“氧化”时发生反应的化学方程式为
,则 的化学式是_____。
[解析] 根据质量守恒定律,化学反应前后原子的种类和个数均不变,结合化
学方程式可推出 为 。
(5)已知 和 开始沉淀和完全沉淀时的 如下表。“除铁”过程中
加入 溶液的目的是通过调节溶液的 使 完全沉淀而 不沉淀,
则 的范围是___(填字母序号)。
离子 开始沉淀时的 完全沉淀时的
2.7 3.2
7.2 8.7
B
A. B. C.
[解析] 由题表知 在 为2.7时开始沉淀,在 为3.2时完全沉淀,
在 为7.2时开始沉淀,要使 完全沉淀而 不沉淀, 的范围应为
。
同课章节目录
