陕西省渭南市尚德中学2023-2024学年高二上学期期中质量检测化学试卷(含答案)
文档属性
| 名称 | 陕西省渭南市尚德中学2023-2024学年高二上学期期中质量检测化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 375.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-14 00:00:00 | ||
图片预览


文档简介
尚德中学2023-2024学年高二上学期期中质量检测化 学 试 题
满分:100分 时间:75分钟
可能用到的相对原子质量:H:1 C:12 N:14 S:32 Na:23 Cu:64 Zn:65 Ag:108
第Ⅰ卷 (选择题 共42分)
一、选择题(本大题14个小题,每小题3分,计42分。每小题只有一个选项是符合题意的)
1.化学与生产、生活关系密切。下列操作或应用错误的是( )
A. 将草木灰与铵态氮肥混合施用 B. 用白醋除去热水瓶内的水垢
C. 用明矾(KAl(SO4)2 12H2O)作净水剂 D. 用活性炭去除冰箱里的异味
2.已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol。下列说法或表达正确的是( )
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石)ΔH=-1.9kJ/mol
C.ΔH1>ΔH2
D.如果石墨燃烧产物为CO(g),则放出热量大于|ΔH1|
3.下列用来表示物质变化的化学用语中,正确的是( )
A.在碱性介质中,氢氧燃料电池的负极反应式:
B.钢铁发生电化学腐蚀的负极反应式:
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:
D.电解饱和食盐水时,阴极的电极反应式为:
4. 在醋酸溶液中存在电离平衡,要使电离平衡左移且c(H+)增大,应采取的措施是( )
A. 加入NaOH(s) B.加蒸馏水 C. 通入HCl气体 D. 降低温度
5.下列事实说明是弱电解质的是( )
①溶液能和NaOH溶液反应 ②常温下的溶液的pH为2.1
③溶液滴加石蕊试液,溶液变为红色 ④常温下溶液的pH大于7
A.①② B.②④ C.①④ D.②③
6. H2与ICl的反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
A. 反应①、反应②均为吸热反应
B. 活化能:反应①<反应②
C. 反应速率;反应①>反应②
D.
7. 在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
A. 该反应的化学方程式为
B. 反应物A的平衡转化率为60%
C. 0~10s内,A的平均反应速率为
D. 在10~15s内,
8. 一定温度下,在一容积可变的密闭容器中进行反应。下列条件的改变(其他条件不变)对反应速率几乎无影响的是( )
A. 保持容积不变,增加的物质的量 B. 将容器的容积缩小一半
C. 降低温度 D. 保持容积不变,充入Ne使压强增大
9.生活中用电解氯化亚铁的方法制得氯化铁溶液,再用氯化铁溶液吸收有毒的硫化氢气体。工艺原理如图所示。下列说法中正确的是( )
A.H+从电解池右槽迁移到左槽
B.左槽中发生的反应是:2Cl--2e-=Cl2↑
C.右槽的反应式:4OH--4e-=2H2↑+2O2↑
D.FeCl3溶液可以循环利用
10. 下列反应中,属于水解反应且使溶液显酸性的是( )
A. B.
C. D.
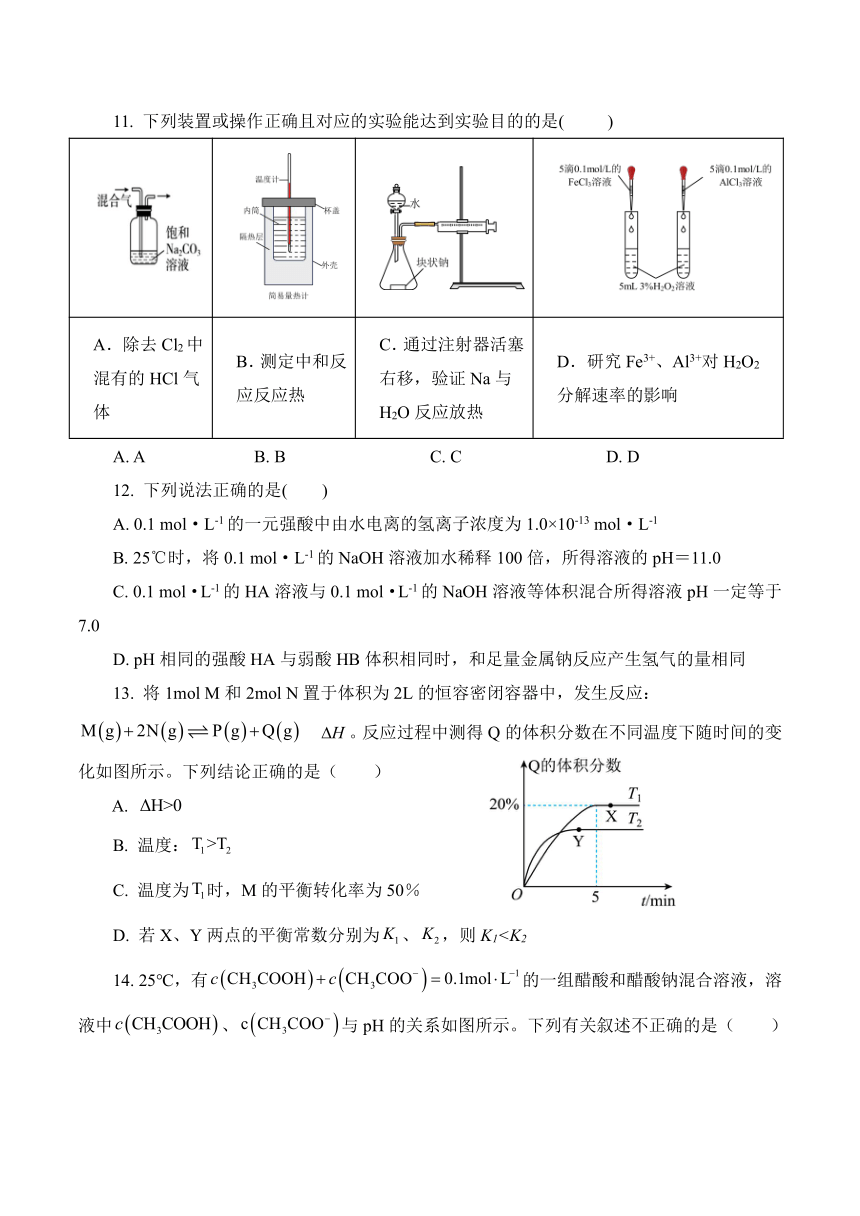
11. 下列装置或操作正确且对应的实验能达到实验目的的是( )
A.除去Cl2中混有的HCl气体 B.测定中和反应反应热 C.通过注射器活塞右移,验证Na与H2O反应放热 D.研究Fe3+、Al3+对H2O2分解速率的影响
A. A B. B C. C D. D
12. 下列说法正确的是( )
A. 0.1 mol·L-1的一元强酸中由水电离的氢离子浓度为1.0×10-13 mol·L-1
B. 25℃时,将0.1 mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
C. 0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合所得溶液pH一定等于7.0
D. pH相同的强酸HA与弱酸HB体积相同时,和足量金属钠反应产生氢气的量相同
13. 将1mol M和2mol N置于体积为2L的恒容密闭容器中,发生反应: 。反应过程中测得Q的体积分数在不同温度下随时间的变化如图所示。下列结论正确的是( )
A.
B. 温度:
C. 温度为时,M的平衡转化率为50%
D. 若X、Y两点的平衡常数分别为、,则K114. 25℃,有的一组醋酸和醋酸钠混合溶液,溶液中、与pH的关系如图所示。下列有关叙述不正确的是( )
A. 的溶液中:
B. 25℃时醋酸的电离平衡常数为
C. 的溶液中:
D. W点所表示的溶液:c(H+)+c(Na+)=c(CH3COOH)+c(OH-)
第Ⅱ卷 (填空题,共58分)
二、(本题3个小题,共58分)
15.(共24分)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的摩尔燃烧焓数据如表所示:
物质 C2H6(g) C2H4(g) H2(g)
摩尔燃烧焓ΔH/(kJ·mol-1) -1560 -1411 -286
则ΔH1= kJ·mol-1。
(2)以CH4为原料设计原电池电解下列物质,如图:
①甲池是将___能转化为___能的装置,乙装置中电极A的名称是___。(填“正极”或“负极”或“阴极”或“阳极”)。
②甲装置中通入O2的电极反应式为 ,乙装置中电极B (Ag)的电极反应式为 ,丙装置中D极的产物是(写化学式) 。
③一段时间,当C极上产生5.6L(标准状况下)气体时,电路中转移 mol电子。若要使乙池恢复电解前的状态,应向乙池中加入 (写化学式)。
16.(共10分)在体积一定的密闭容器中,反应Fe(s)+CO2(g)≒FeO(s)+CO(g)达到平衡。该反应的平衡常数K与温度的关系如下表所示:
温度/℃ 500 700 900
K 1.00 1.47 2.40
(1)该反应的化学平衡常数表达式是______________________________。
(2)该反应是______(填“吸热”或“放热”)反应。
(3)若升高温度,CO2转化率的变化是__________(填“增大”“减小”或“不变”,下同)。
(4)若降低温度,混合气体的密度________。
(5)500℃下,该反应达到化学平衡状态的标志是 (填字母)。
a.CO2和CO的体积相同 b.混合气体的密度保持不变
c.体系的压强保持不变 d.CO2和CO物质的量之和保持不变
17.(共24分)
Ⅰ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.810-5 Ka1=4.310-7 Ka2=5.610-11 Ka=3.010-8
(1)物质的量浓度均为0.1molL-1的下列四种溶液:pH由大到小排列的顺序是_______。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL1CHCOOH溶液加水稀释过程中,下列表达式的数据变小的是_______(填序号)。
A.cH+ B. C.c(H+)·c(OH-) D.
E.
(3)相同体积,pH均为3的CH3COOH和HClO溶液,中和NaOH的能力_______(填“相同”、“不相同”、“无法确定”)
(4)25℃时,将amolL-1的醋酸溶液与bmolL-1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,则溶液中c(Na+)_______c(CH3COO-)(填写“>”、“=”或“<”)。
Ⅱ.常温下,有四种溶液:①0.1mol·L-1CH3COOH溶液②0.1mol·L-1CH3COONa溶液③0.1mol·L-1NaHSO3溶液④0.1mol·L-1NaHCO3溶液。
(5)溶液②呈_______(填“酸”“碱”或“中”)性。其原因是_______(用相关离子方程式说明)。
(6)①和②两种溶液:CH3COOH溶液中c(CH3COO-)_______CH3COONa溶液中c(CH3COO-)(填写“>”、“=”或“<”)。
(7)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(SO)_______c(H2SO3)。(填写“>”、“=”或“<”)。
高二化学试题参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C B C B D C D D D D B C A
15.(共24分)
(1)+137 (3分)
(2)①化学 电 阳极 (各2分,共6分)
②O2+4e-+2H2O=4OH- Ag++e-=Ag H2和NaOH
③ 0.5 Ag2O (各3分,共15分)
16. (共10分)
(1)K=c平(CO)/c平(CO2)
(2)吸热
(3)增大
(4)增大
(5)a.b
17.(每空3分共24分)
(1)b>c>d>a
(2)A
(3)不相同
(4)=
(5) 碱 H2O +CH3COO- CH3COOH+OH-
(6)<
(7)>
满分:100分 时间:75分钟
可能用到的相对原子质量:H:1 C:12 N:14 S:32 Na:23 Cu:64 Zn:65 Ag:108
第Ⅰ卷 (选择题 共42分)
一、选择题(本大题14个小题,每小题3分,计42分。每小题只有一个选项是符合题意的)
1.化学与生产、生活关系密切。下列操作或应用错误的是( )
A. 将草木灰与铵态氮肥混合施用 B. 用白醋除去热水瓶内的水垢
C. 用明矾(KAl(SO4)2 12H2O)作净水剂 D. 用活性炭去除冰箱里的异味
2.已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol。下列说法或表达正确的是( )
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石)ΔH=-1.9kJ/mol
C.ΔH1>ΔH2
D.如果石墨燃烧产物为CO(g),则放出热量大于|ΔH1|
3.下列用来表示物质变化的化学用语中,正确的是( )
A.在碱性介质中,氢氧燃料电池的负极反应式:
B.钢铁发生电化学腐蚀的负极反应式:
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:
D.电解饱和食盐水时,阴极的电极反应式为:
4. 在醋酸溶液中存在电离平衡,要使电离平衡左移且c(H+)增大,应采取的措施是( )
A. 加入NaOH(s) B.加蒸馏水 C. 通入HCl气体 D. 降低温度
5.下列事实说明是弱电解质的是( )
①溶液能和NaOH溶液反应 ②常温下的溶液的pH为2.1
③溶液滴加石蕊试液,溶液变为红色 ④常温下溶液的pH大于7
A.①② B.②④ C.①④ D.②③
6. H2与ICl的反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
A. 反应①、反应②均为吸热反应
B. 活化能:反应①<反应②
C. 反应速率;反应①>反应②
D.
7. 在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
A. 该反应的化学方程式为
B. 反应物A的平衡转化率为60%
C. 0~10s内,A的平均反应速率为
D. 在10~15s内,
8. 一定温度下,在一容积可变的密闭容器中进行反应。下列条件的改变(其他条件不变)对反应速率几乎无影响的是( )
A. 保持容积不变,增加的物质的量 B. 将容器的容积缩小一半
C. 降低温度 D. 保持容积不变,充入Ne使压强增大
9.生活中用电解氯化亚铁的方法制得氯化铁溶液,再用氯化铁溶液吸收有毒的硫化氢气体。工艺原理如图所示。下列说法中正确的是( )
A.H+从电解池右槽迁移到左槽
B.左槽中发生的反应是:2Cl--2e-=Cl2↑
C.右槽的反应式:4OH--4e-=2H2↑+2O2↑
D.FeCl3溶液可以循环利用
10. 下列反应中,属于水解反应且使溶液显酸性的是( )
A. B.
C. D.
11. 下列装置或操作正确且对应的实验能达到实验目的的是( )
A.除去Cl2中混有的HCl气体 B.测定中和反应反应热 C.通过注射器活塞右移,验证Na与H2O反应放热 D.研究Fe3+、Al3+对H2O2分解速率的影响
A. A B. B C. C D. D
12. 下列说法正确的是( )
A. 0.1 mol·L-1的一元强酸中由水电离的氢离子浓度为1.0×10-13 mol·L-1
B. 25℃时,将0.1 mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
C. 0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合所得溶液pH一定等于7.0
D. pH相同的强酸HA与弱酸HB体积相同时,和足量金属钠反应产生氢气的量相同
13. 将1mol M和2mol N置于体积为2L的恒容密闭容器中,发生反应: 。反应过程中测得Q的体积分数在不同温度下随时间的变化如图所示。下列结论正确的是( )
A.
B. 温度:
C. 温度为时,M的平衡转化率为50%
D. 若X、Y两点的平衡常数分别为、,则K1
A. 的溶液中:
B. 25℃时醋酸的电离平衡常数为
C. 的溶液中:
D. W点所表示的溶液:c(H+)+c(Na+)=c(CH3COOH)+c(OH-)
第Ⅱ卷 (填空题,共58分)
二、(本题3个小题,共58分)
15.(共24分)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的摩尔燃烧焓数据如表所示:
物质 C2H6(g) C2H4(g) H2(g)
摩尔燃烧焓ΔH/(kJ·mol-1) -1560 -1411 -286
则ΔH1= kJ·mol-1。
(2)以CH4为原料设计原电池电解下列物质,如图:
①甲池是将___能转化为___能的装置,乙装置中电极A的名称是___。(填“正极”或“负极”或“阴极”或“阳极”)。
②甲装置中通入O2的电极反应式为 ,乙装置中电极B (Ag)的电极反应式为 ,丙装置中D极的产物是(写化学式) 。
③一段时间,当C极上产生5.6L(标准状况下)气体时,电路中转移 mol电子。若要使乙池恢复电解前的状态,应向乙池中加入 (写化学式)。
16.(共10分)在体积一定的密闭容器中,反应Fe(s)+CO2(g)≒FeO(s)+CO(g)达到平衡。该反应的平衡常数K与温度的关系如下表所示:
温度/℃ 500 700 900
K 1.00 1.47 2.40
(1)该反应的化学平衡常数表达式是______________________________。
(2)该反应是______(填“吸热”或“放热”)反应。
(3)若升高温度,CO2转化率的变化是__________(填“增大”“减小”或“不变”,下同)。
(4)若降低温度,混合气体的密度________。
(5)500℃下,该反应达到化学平衡状态的标志是 (填字母)。
a.CO2和CO的体积相同 b.混合气体的密度保持不变
c.体系的压强保持不变 d.CO2和CO物质的量之和保持不变
17.(共24分)
Ⅰ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.810-5 Ka1=4.310-7 Ka2=5.610-11 Ka=3.010-8
(1)物质的量浓度均为0.1molL-1的下列四种溶液:pH由大到小排列的顺序是_______。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL1CHCOOH溶液加水稀释过程中,下列表达式的数据变小的是_______(填序号)。
A.cH+ B. C.c(H+)·c(OH-) D.
E.
(3)相同体积,pH均为3的CH3COOH和HClO溶液,中和NaOH的能力_______(填“相同”、“不相同”、“无法确定”)
(4)25℃时,将amolL-1的醋酸溶液与bmolL-1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,则溶液中c(Na+)_______c(CH3COO-)(填写“>”、“=”或“<”)。
Ⅱ.常温下,有四种溶液:①0.1mol·L-1CH3COOH溶液②0.1mol·L-1CH3COONa溶液③0.1mol·L-1NaHSO3溶液④0.1mol·L-1NaHCO3溶液。
(5)溶液②呈_______(填“酸”“碱”或“中”)性。其原因是_______(用相关离子方程式说明)。
(6)①和②两种溶液:CH3COOH溶液中c(CH3COO-)_______CH3COONa溶液中c(CH3COO-)(填写“>”、“=”或“<”)。
(7)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(SO)_______c(H2SO3)。(填写“>”、“=”或“<”)。
高二化学试题参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C B C B D C D D D D B C A
15.(共24分)
(1)+137 (3分)
(2)①化学 电 阳极 (各2分,共6分)
②O2+4e-+2H2O=4OH- Ag++e-=Ag H2和NaOH
③ 0.5 Ag2O (各3分,共15分)
16. (共10分)
(1)K=c平(CO)/c平(CO2)
(2)吸热
(3)增大
(4)增大
(5)a.b
17.(每空3分共24分)
(1)b>c>d>a
(2)A
(3)不相同
(4)=
(5) 碱 H2O +CH3COO- CH3COOH+OH-
(6)<
(7)>
同课章节目录
