人教版高中化学选择性必修1期末综合练习(一)(含解析)
文档属性
| 名称 | 人教版高中化学选择性必修1期末综合练习(一)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 18:46:05 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
人教版高中化学选择性必修1期末综合练习(一)
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在2NO2(气体) N2O4(气体)的可逆反应中,下列状态说明该反应一定达到限度的是
A.NO2和N2O4的物质的量相等
B.NO2和N2O4的分子数之比为2∶1
C.NO2和N2O4的物质的量浓度均保持不变
D.单位时间内,消耗1 mol N2O4同时,也有1 mol NO2被消耗
2.下列电离方程式或离子方程式书写正确的是
A.HF在水溶液中的电离方程式:HF=H++F-
B.醋酸与氢氧化钠反应的离子方程式:H++OHˉH2O
C.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO
D.CuSO4在水溶液中水解的离子方程式:Cu2++2H2OCu (OH)2+2H+
3.在、下,合成氨反应的能量变化图如图所示(图中“吸”表示在催化剂表面的吸附)。下列说法中正确的是
A.图中决速步骤的反应方程式为
B.该历程中
C.合成氨工业中采用循环操作,主要目的是增大化学反应速率
D.该反应为放热反应,所以反应中温度越低越好
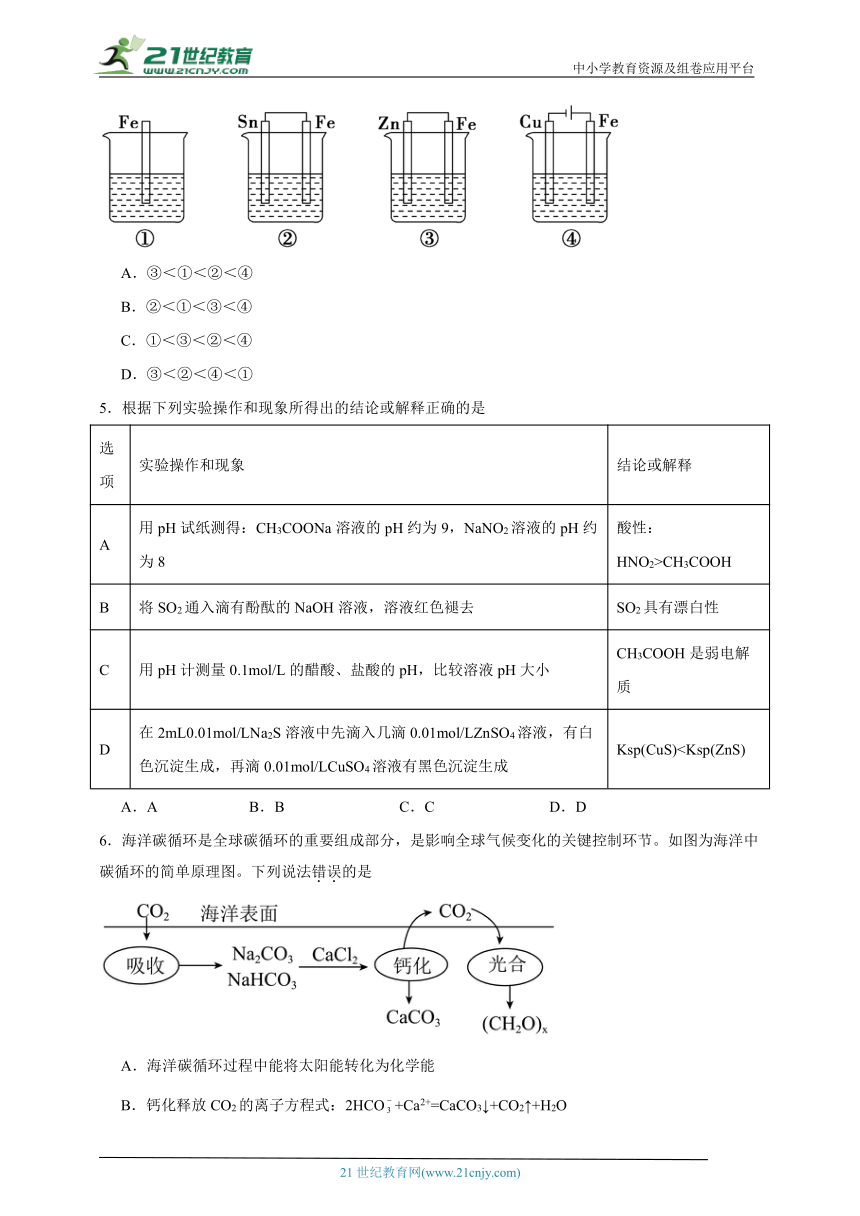
4.下面各容器中盛有海水,铁在其中被腐蚀时由慢到快的顺序是
A.③<①<②<④
B.②<①<③<④
C.①<③<②<④
D.③<②<④<①
5.根据下列实验操作和现象所得出的结论或解释正确的是
选项 实验操作和现象 结论或解释
A 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 酸性:HNO2>CH3COOH
B 将SO2通入滴有酚酞的NaOH溶液,溶液红色褪去 SO2具有漂白性
C 用pH计测量0.1mol/L的醋酸、盐酸的pH,比较溶液pH大小 CH3COOH是弱电解质
D 在2mL0.01mol/LNa2S溶液中先滴入几滴0.01mol/LZnSO4溶液,有白色沉淀生成,再滴0.01mol/LCuSO4溶液有黑色沉淀生成 Ksp(CuS)A.A B.B C.C D.D
6.海洋碳循环是全球碳循环的重要组成部分,是影响全球气候变化的关键控制环节。如图为海洋中碳循环的简单原理图。下列说法错误的是
A.海洋碳循环过程中能将太阳能转化为化学能
B.钙化释放CO2的离子方程式:2HCO+Ca2+=CaCO3↓+CO2↑+H2O
C.影响海洋碳循环的因素主要有海水的酸碱性、水温、藻类生物的分布等
D.光合作用,每生成0.1mol(CH2O)x转移电子数为0.4NA(NA表示阿伏加德罗常数)
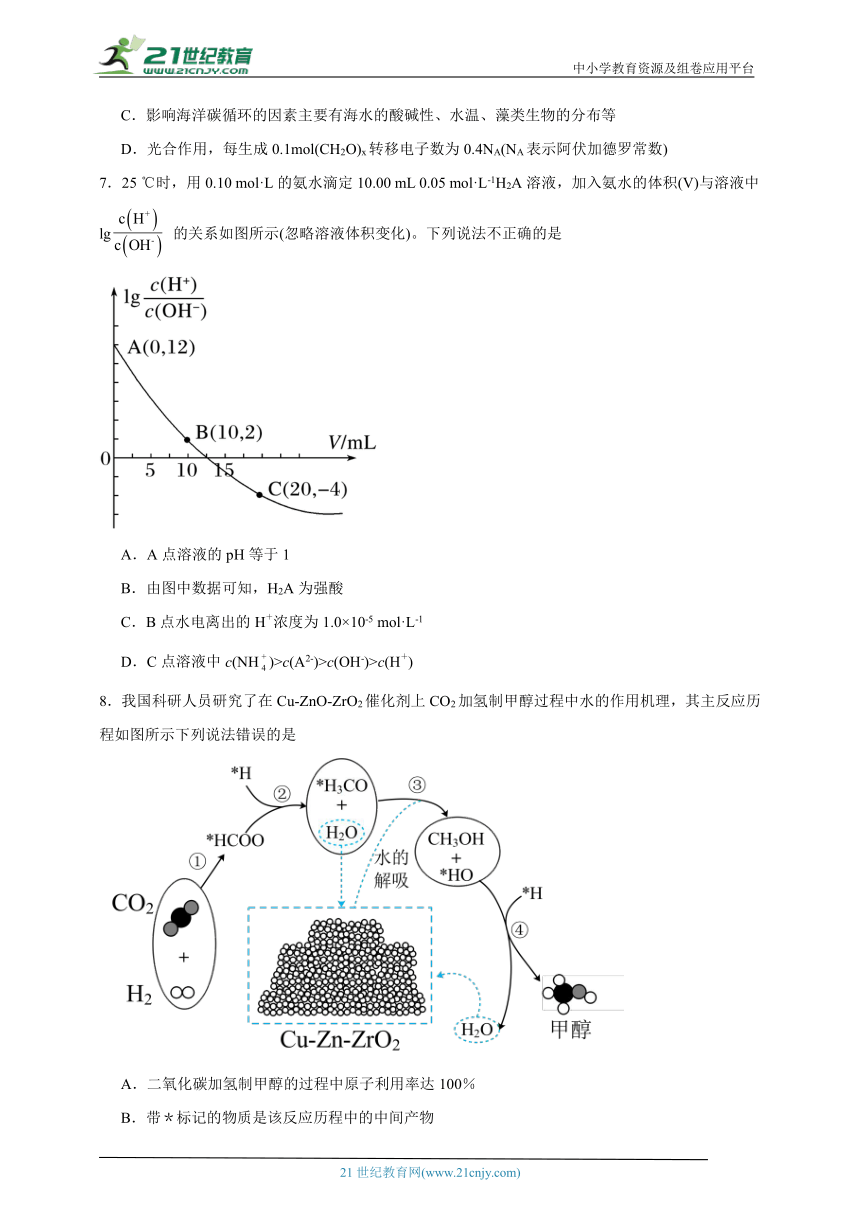
7.25 ℃时,用0.10 mol·L的氨水滴定10.00 mL 0.05 mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
A.A点溶液的pH等于1
B.由图中数据可知,H2A为强酸
C.B点水电离出的H+浓度为1.0×10-5 mol·L-1
D.C点溶液中c(NH)>c(A2-)>c(OH-)>c(H+)
8.我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示下列说法错误的是
A.二氧化碳加氢制甲醇的过程中原子利用率达100%
B.带*标记的物质是该反应历程中的中间产物
C.向该反应体系中加入少量的水能增加甲醇的产率
D.第③步的反应式为*H3CO+H2O →CH3OH+*HO
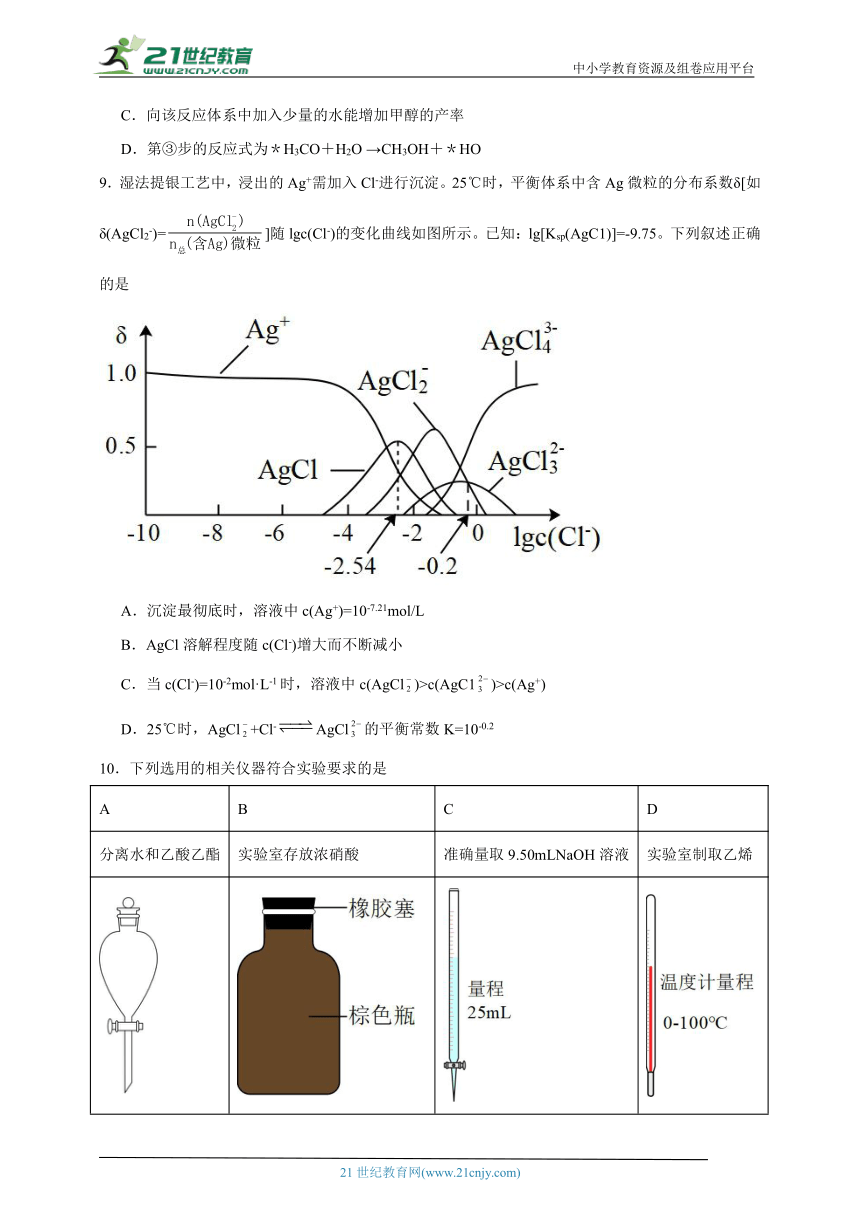
9.湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl2-)=]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
A.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol/L
B.AgCl溶解程度随c(Cl-)增大而不断减小
C.当c(Cl-)=10-2mol·L-1时,溶液中c(AgCl)>c(AgC1)>c(Ag+)
D.25℃时,AgCl+Cl-AgCl的平衡常数K=10-0.2
10.下列选用的相关仪器符合实验要求的是
A B C D
分离水和乙酸乙酯 实验室存放浓硝酸 准确量取9.50mLNaOH溶液 实验室制取乙烯
A.A B.B C.C D.D
二、填空题
11.向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c >c >c >c
②当盐酸与氨水等物质的量反应时,溶液的pH 7(填“>”或“<”或“=”,下同).
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为: n(NH3·H2O) n(HCl),溶液中c( NH4+) c(Cl﹣).
12.测定绿矾产品中含量的方法:
a.称取一定质量绿矾产品,配制成250 mL溶液;
b.量取25 mL待测溶液于锥形瓶中;
c.用硫酸酸化的 溶液滴定至终点,消耗溶液体积为20 mL,滴定时发生反应的离子方程式为。
求步骤b中所配25 mL溶液中的物质的量浓度
13.在室温下,下列五种溶液:①溶液;②溶液;③溶液;④和混合液;⑤0.1mol/LNaOH溶液,请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)。
(2)溶液②③中的大小关系是② ③。(填“>”、“<”或“=”)
(3)写出溶液④中的电荷守恒 。
(4)现用0.1000mol/L的标准盐酸滴定⑤溶液,选择酚酞做指示剂,达到滴定终点时的液面如图所示,则读数为 mL,达到滴定终点的现象为 。
14.计算题
(1)某溶液中由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW= ,若温度不变,0.005 mol·L-1的H2SO4溶液中,c(H+)= ,由水电离出的c(H+)= 。
(3)将pH=1的盐酸稀释1000倍后,pH为 。
(4)将pH=1的CH3COOH溶液稀释1000倍后,pH的范围 。
(5)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为 。
(6)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO)约为 。
15.已知常温下部分弱电解质的电离常数如下表:
化学式 HF HClO H2CO3 NH3·H2O
电离常数 Ka=6.8×10-4 Ka=4.7×10-8 Ka1=4.2×10-7 Ka2=5.6×10-11 Kb=1.7×10-5
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是 (填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为 。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) c()(填>、<或=);可使上述两种溶液pH相等的方法是 (填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为: 。
(5)常温下,计算NH4Cl溶液中,的水解常数Kh= 。
16.室温下,仅由N、H两种元素组成的某种液态燃料的质量为,在25℃、下,该液态燃料完全燃烧生成和时,放出的热量。
(1)该液态燃料的分子式为 ,属于 (填“共价”或“离子”)化合物,电子式为 。
(2)该液态燃料可用作火箭发动机的燃料,利用作氧化剂,二者反应生成和。
已知:①
②
则该液态燃料与反应的热化学方程式为 。
(3)若用该液态燃料与液态反应,反应产物为和,,下列说法正确的是 (填标号)。
A.该液态燃料完全参加反应时转移的电子数为
B.在该反应中既是氧化产物又是还原产物
C.上述反应中反应物的键能总和大于生成物的键能总和
17.(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 反应前溶液温度/℃ 金属消失的时间/s
1 0.10 丝 0.5 50 20 500
2 0.10 粉末 0.5 50 20 50
3 0.10 丝 1.0 50 20 125
4 0.10 丝 1.0 50 35 50
①对比实验1和3,表明影响化学反应速率的因素是 ;反应规律为: ,反应速率越快。
②仅表明固体反应物的表面积对化学反应速率产生影响的实验有 (填实验序号)。
③本实验中影响化学反应速率的其他因素还有 。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作 (填“负极”或“正极”),铁的电极反应式是 ,在铁电极上发生 反应(填“氧化”或“还原”)。
18.工业上制备氯化铜时,是将浓盐酸用水蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl=CuCl2+H2O,FeO+2HCl=FeCl2+H2O.
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3 4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是 。
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为 ;溶液的pH变化是 。
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 。
②要使0.2mol L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
19.燃煤烟气和汽车尾气中常含有、、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以氨气为脱硝剂时,可将还原为。
①已知:
则反应, 0(填“>”、“<”“=”)
(2)研究发现还原NO的反应历程如图1。下列说法正确的是_______(填序号)。
A.能增大总反应的活化能,提高反应速率
B.总反应为
C.该反应历程中形成了非极性键和极性键
D.该反应中的三个阶段均为氧化还原反应
(3)络合吸收法脱硝技术有2种吸收NO的方法,涉及的反应如下:
方法1.
方法2.
已知:是与某有机化合物的阴离子形成的络合物
①方法1,pH过高不利于与NO反应,用离子方程式解释原因 。
②研究温度对反应的影响,在相同时间内,测得不同温度下,NO的去除率如图2所示,解释随温度变化NO去除率变化的原因 。
(4)碱液吸收法。将氢氧化钠溶液脱硝得到的、混合液和NaOH溶液分别加到如图3所示的电解槽中进行电解,该装置中,阴离子的移动方向为 (填“B室到A室”或“A室到B室”);写出A室发生的电极反应式: 。
20.回答下列问题
(1)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时c(OH-)为 ;若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为 ,由水电离产生的c(H+)为 ,此时温度 (填“高于”“低于”或“等于”)25 ℃。
(2)已知水溶液中c(H+)和c(OH-)的关系如图所示,试回答下列问题:
①图中五点对应的KW的关系是 。
②若从A点到D点,可采用的措施是 (填序号)。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)25 ℃时,0.1 mol·L-1的HA溶液中=1010。HA是 (填“强电解质”或“弱电解质”)。
(4)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的H+浓度由大到小的顺序是 (用序号表示)。
三、实验探究题
21.中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 燃烧热(kJ/mol)
氢气 285.8
甲烷 890.3
乙烯 1411.5
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式 。
(2)在400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K= 。按化学平衡移动原理,在图中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中右端碳棒为 极,左端碳棒上的电级反应为 ,右池中的c(NaOH):c(Na2S) (填“增大”、“ 基本不变”或“减小)。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10 7,Ka2=7.0×10 15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为 。
(5)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L 1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS 浓度为1.0×10 4 mol·L 1时,Mn2+开始沉淀,则a= 。[已知:Ksp(MnS)=1.4×10 15]
22.I、用0.1mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 消耗NaOH溶液的体积/mL 待测稀盐酸的体积/mL
1 22.84 25.00
2 21.68 25.00
3 21.72 25.00
根据表格计算c(HCl)= 。(保留两位小数)
II、某化学学习小组的同学欲用KMnO4测定H2C2O4溶液的物质的量浓度实验步骤如下:
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+8H2O
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
(1)滴定时,将KMnO4标准液装在下图中的 (填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是 。
(3)计算H2C2O4溶液的物质的量浓度为 mol/L。
(4)下列滴定操作会使测得的值偏小的是 。
A.滴定终点时俯视滴定管刻度
B.滴定终点时仰视滴定管刻度
C.滴定前用待测H2C2O4溶液润洗锥形瓶
D.滴定管尖嘴内在滴定前无气泡,滴定后有气泡
23.H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组为探究H2O2的性质做了如下实验:
(1) 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据。
研究小组在设计方案时,考虑了浓度、 、 因素对过氧化氢分解速率的影响。
(2) 另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1 mol·L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小)。
(3) 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察 ,比较得出结论。
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是 。
(4) 已知 FeCl3溶液中主要含有H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是 。
完成表格验证猜想:
所需试剂 操作及现象 结论
Cl-对H2O2分解无催化作用
参考答案:
1.C
【分析】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
【详解】A. NO2和N2O4的物质的量相等,并不能说明两者的物质的量不变,故A不符;
B. NO2和N2O4的分子数之比为2∶1,并不能说明两者的物质的量不变,故B错误;
C. NO2和N2O4的物质的量浓度均保持不变,故C正确;
D. 单位时间内,消耗1 mol N2O4同时,也有2 mol NO2被消耗,说明正逆反应速率相等,反应达平衡状态,故D错误;
故选C。
2.D
【详解】A.HF是弱酸,部分电离,在水中存在电离平衡:HFH++F-,A错误;
B.醋酸是弱酸,应保留化学式,且不可逆,正确的离子方程式为CH3COOH+OHˉ=H2O+CH3COO-,B错误;
C.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO、HCO,C错误;
D.CuSO4属于强酸弱碱盐,铜离子会微弱水解,水解离子方程式为Cu2++2H2OCu (OH)2+2H+,D正确;
答案选D。
3.A
【详解】A.活化能越大反应速率越慢,慢反应决定总反应速率,正反应活化能为62,所以是决速步骤,故A正确;
B.根据图示,该历程放热,,故B错误;
C.合成氨工业中采用循环操作,主要目的是提高原料利用率,故C错误;
D.反应中温度太低,催化剂活性降低,反应速率太慢,故D错误;
选A。
4.A
【详解】铁腐蚀快慢顺序是:作电解池阳极>原电池负极>化学腐蚀>作原电池正极>作电解池阴极;
①中铁发生化学反应;
②中铁的活动性大于锡,所以铁作负极,加速被腐蚀;
③中锌的活动性大于Fe,所以锌作负极、铁作正极,被保护;
④中铁作阳极加速被腐蚀;
所以铁腐蚀慢快顺序是③<①<②<④,答案选A。
5.C
【详解】A.两种溶液浓度未知,无法判断,A错误;
B.将SO2通入滴有酚酞的NaOH溶液,溶液红色褪去,体现SO2的酸性,B错误;
C.浓度相等的盐酸pH大于醋酸,说明醋酸为弱电解质,C正确;
D.由于硫化钠过量,所以硫化钠与硫酸铜反应又出现黑色沉淀,不是沉淀的转化,所以不能证明溶度积的大小,故D错误;
故选C。
6.D
【详解】A.通过光照,该装置是太阳能转化为化学能,则光合作用能将太阳能转化为化学能,故A正确;
B.根据反应图象分析,钙化过程中HCO转化为CaCO3和CO2,所以钙化作用的离子方程式为Ca2++2HCO=CaCO3↓+CO2↑+H2O,故B正确;
C.分析流程可知,酸碱性,温度,二氧化碳浓度(藻类分布)会对反应造成影响,随之影响海洋碳循环,故C正确;
D.(CH2O)x中H为+1价,O为-2价,故C为0价,0.1x molCO2经光合作用还原生成0.1mol(CH2O)x,转移电子数为0.4xNA,故D错误;
故选D。
7.C
【详解】A.A点:根据c(H+)c(OH-)=KW=1×10-14,lg=12,计算得c(H+)=10-1mol/L,则pH=1,故不选A;
B.根据A选项分析可知,A点溶液中c(H+)=10-1mol/L,则0.05mol/LH2A完全电离,属于H2A为强酸,故不选B;
C.B点酸碱恰好完全中和生成盐(NH4)2A,lg=2,计算得c(H+)=10-6mol/L,则水电离出的H+离子浓度为1.0×10-6mol·L-1,故选C;
D.C点是(NH4)2A与氨水混合物,根据lg= -4,计算得c(H+)=10-9mol/L,则pH=9,偏碱性,考虑(NH4)2A完全电离和氨水的电离平衡,则溶液中c(NH)>c(A2-)>c(OH-)>c(H+),故不选D;
答案为C。
【点睛】对于此类图像题经常利用分析起点、恰好完全中和点、溶液呈中性点等获得所需结论。
8.A
【详解】A.根据图知,二氧化碳和氢气反应生成甲醇和水,该反应中除了生成甲醇外还生成水,所以二氧化碳加氢制甲醇的过程中原子利用率不是100%,A项错误;
B.根据图知,带*标记的物质在反应过程中最终被消耗,所以带*标记的物质是该反应历程中的中间产物,B项正确;
C.反应历程第③步需要水,所以向该反应体系中加入少量的水能增加甲醇的收率,C项正确;
D.第③步中*H3CO、H2O生成CH3OH和*HO,反应方程式为*H3CO+H2O→CH3OH+*HO,D项正确;
答案选A。
9.A
【详解】A.沉淀最彻底时即银离子以氯化银的形式存在,而且氯化银最多的时候,就是沉淀最彻底时,由图可知此时c(Cl-)=10-2.54mol/L,由lg[Ksp(AgCl)]=-9.75可知,Ksp(AgCl)=10-9.75,则此时c(Ag+)=10-7.21mol L-1,故A正确;
B.由图可知开始的时候氯化银的溶解度随着c(Cl-)增大而不断减小,但是当氯离子浓度增大的一定程度的时候,随着c(Cl-)增大溶液中的银离子和氯离子形成络离子,而溶解度增大,故B错误;
C.当c(Cl-)=10-2mol L-1时,图中横坐标为-2,由图可知,此时c(AgCl)>c(Ag+)>c(AgCl),故C错误;
D.AgCl+Cl-AgCl的平衡常数K=,则在图中横坐标为-0.2时AgCl与AgCl相交,即其浓度相等,则在常数中其比值为1,此时常数K==100.2,故D错误;
故选:A。
10.A
【详解】A.乙酸乙酯不溶于水,分层,可用分液漏斗进行分液,A正确;
B.浓硝酸见光分解,用棕色试剂瓶,有强氧化性,能氧化橡胶塞,需用玻璃塞,B错误;
C.NaOH应该使用碱式滴定管,而图示为酸式滴定管,C错误;
D.实验室用加热浓硫酸至170°C的方法制取乙烯,温度计量程为100℃无法测量和控制反应温度,D错误;
答案选A。
11. NH4+ Cl﹣ OH﹣ H+ < > =
【详解】①向20.00mL稀氨水加入10.00mL盐酸后,溶液为等物质的量浓度的氨水与氯化铵的混合液,氨水电离使呈碱性,氯化铵水解使溶液呈酸性,等物质的量浓度,电离程度大于水解程度,溶液呈碱性,即:c(OH﹣)>c(H+);根据电荷守恒有:c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),溶液呈碱性,所以,c(NH4+)>c(Cl﹣);水解程度微弱,溶液中c(Cl﹣)远远大于c(OH﹣),故溶液中各种离子浓度之间的大小关系为:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+);
②盐酸与氨水恰好反应,为氯化铵溶液,氯化铵是强酸弱碱盐,NH4+发生水解使溶液呈酸性,即pH<7;
③盐酸与氨水1:1恰好反应时溶质为为氯化铵NH4+发生水解使溶液呈酸性,若要溶液呈中性,氨水应过量,所以n(NH3·H2O)>n(HCl);根据电荷守恒:c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),由于溶液pH=7,即c(OH﹣)=c(H+),所以c(NH4+)>c(Cl﹣)。
12.0.04mol/L
【详解】用硫酸酸化的 溶液滴定至终点,消耗溶液体积为20 mL,根据反应方程式可知,n(Fe2+)=5n(MnO)=5×0.01mol/L×0.02L=0.001mol,则步骤b中所配25 mL溶液中的物质的量浓度。
13.(1) 碱
(2)>
(3)
(4) 22.80 最后一滴标准盐酸滴入时,溶液红色褪去,且半分钟内不恢复原色
【解析】(1)
①溶液是0.1mol/L CH3COONa,溶液中醋酸根离子水解溶液呈碱性,反应的离子方程式为:;
(2)
③0.1mol/L CH3COONH4溶液中醋酸根离子水解促进了铵根离子水解,其中的大小关系是②>③;
(3)
溶液④和混合液,溶液中存在电荷守恒为;
(4)
现用0.1000mol/L的标准盐酸滴定⑤0.1mol/LNaOH溶液,选择酚酞做指示剂,达到滴定终点时的液面根据图示可知,读数为22.80mL,达到滴定终点的现象为:最后一滴标准盐酸滴入时,溶液红色褪去,且半分钟内不恢复原色。
14.(1)2或者12
(2) 2.5×10-13 0.01mol/L 2.5×10-11mol/L
(3)4
(4)1<pH<4
(5)2
(6)20:1
【详解】(1)某溶液中由水电离出的c(H+)=10-12 mol·L-1则可能是强酸溶液,则此溶液中c(OH-)aq=c(OH-)水=c(H+)水=10-12 mol·L-1,c(H+)aq==10-2mol/L,或者是强碱溶液,则此溶液中c(H+)aq= c(H+)水=10-12 mol·L-1,则该溶液的pH为2或者12,故答案为:2或者12;
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=c(H+)c(OH-)=5.0×10-7×5.0×10-7=2.5×10-13,若温度不变,0.005 mol·L-1的H2SO4溶液中,c(H+)=0.005mol/L×2=0.01mol/L,由水电离出的c(H+)==2.5×10-11mol/L,故答案为:2.5×10-13;0.01mol/L;2.5×10-11mol/L;
(3)根据强酸强碱有限稀释的规律即强酸、强碱每稀释10倍,其pH值向7靠近1个单位可知,将pH=1的盐酸稀释1000倍后,pH为4,故答案为:4;
(4)由于CH3OOH是弱酸,稀释过程中能促进其电离,故将pH=1的CH3COOH溶液稀释1000倍后,pH的范围1<pH<4,故答案为:1<pH<4;
(5)25℃时,由反应2NaOH+H2SO4=Na2SO4+2H2O可知,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,硫酸过量,充分反应后溶液中的c(H+)==0.01mol/L,则所得溶液的pH为2,故答案为:2;
(6)将pH=5的H2SO4稀释1000倍后,此时c(H+)≈10-7mol/L,而c(SO)==5×10-9mol/L,则c(H+):c(SO)约为10-7:5×10-9=20:1,故答案为:20:1。
15. ④>③>②>① 106∶1 < AD ClO-+CO2+H2O=HClO+ 5.9×10-10
【详解】(1)等物质的量浓度的HF和HClO溶液,由于HClO的电离常数较小,故溶液中含有的H+浓度较小,其pH比HF稍大;等物质的量浓度的NaHCO3和NH3·H2O溶液,由于碳酸氢钠溶液呈碱性,故碳酸氢根的水解程度大于碳酸氢根的电离,碳酸氢根的水解常数Kh====2.4×10-8,与一水合氨的电离常数相比碳酸氢根的水解常数较小,故碳酸氢根水解出的OH-的浓度小于一水合氨电离出的OH-的浓度,故一水合氨的pH稍大,综上,四种物质的pH从大到小的顺序为④>③>②>①;
(2)NH4Cl为强酸弱碱盐,溶液中的H+由铵根水解而来,故pH=4的NH4Cl中水电离的c(H+)=10-4mol/L;HF为弱酸,溶液中的H+由HF电离而来,HF中水电离出的c(H+)与溶液中c(OH-)相同,故pH=4的HF中水电离出的c(H+)=10-10mol/L,综上,两溶液中水电离出的c(H+)之比为10-4:10-10=106:1;
(3)①根据电离常数可知,HClO电离常数小于H2CO3的一级电离常数,则等浓度的NaClO溶液水解程度大于NaHCO3溶液的水解程度,则0.1mol/L的NaClO溶液和0.1mol/L的NaHCO3溶液中,c(ClO-)②使上述两种溶液pH相等,必须让前者氢氧根离子浓度减小;
A选项,向NaClO溶液中加适量的水,浓度减小,氢氧根离子浓度减小,可行;
B选项,向NaClO溶液中加适量的NaOH,溶液中氢氧根离子浓度增大,不可行;
C选项,向NaHCO3溶液中加适量的水,氢氧根离子浓度减小,不可行;
D选项,向NaHCO3溶液中加适量的NaOH,溶液中氢氧根离子浓度增大,可行;
答案选AD;
(4)根据酸的电离常数和强酸制弱酸的原理可知,碳酸的一级电离常数大于次氯酸的电离常数,次氯酸的电离常数大于碳酸的二级电离常数,故二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O=HClO+HCO3-;
(5)NH4+的水解常数Kh=====5.9×10-10。
16.(1) N2H4 共价
(2)
(3)B
【分析】(1)
,依题意可知:只含、两种元素且相对分子量为32的分子式只有;该化合物由、两种非金属元素组成,所以为共价化合物,电子式为。
(2)
由①、②和③联立,可得到。
(3)
未标明标准状况下,A项错误;根据,可知,反应物的键能总和小于生成物的键能总和,C项错误。故选B。
17. 浓度 反应物浓度越大 1、2 温度 正极 Fe-2e-=Fe2+ 氧化
【详解】①对比实验1和3,其余条件均相同、只有硫酸浓度不同,3中硫酸浓度大、金属消失时间短、反应速率大,则实验1和3表明影响化学反应速率的因素是浓度;反应规律为:反应物浓度越大,反应速率越快。
②对比实验1和2,其余条件均相同、只有金属状态不同,2中金属为粉末、金属消失时间短、反应速率大,则仅表明固体反应物的表面积对化学反应速率产生影响的实验有1、2。
③对比实验1和4可以发现,本实验中影响化学反应速率的其他因素还有温度。
(2)如图原电池装置中,铜作正极,铜离子在正极上得到电子生成铜,铁作负极,铁失去电子转化为亚铁离子,铁的电极反应式是Fe-2e-=Fe2+,在铁电极上发生氧化反应。
18. 将Fe2+氧化为Fe3+,再调节溶液pH为3~4的范围 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O 增大 5 6
【详解】(1)根据题意可知Fe3+完全沉淀时Cu2+不沉淀,所以可以将Fe2+氧化为Fe3+,再调节溶液pH为3~4的范围,除去Fe元素;
(2)该工艺中利用浓盐酸浸取粗制氧化铜粉制取氯化铜,为防止Cu2+沉淀,溶液应保持酸性环境,加入NaClO后,酸性环境中ClO-将Fe2+氧化为Fe3+,自身被还原成Cl-,离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,该反应过程中消耗氢离子,所以pH增大;
(3)①Cu2+开始沉淀时c(OH-)==1×10-9mol/L,则c(H+)=1×10-5mol/L,pH=5;
②使Cu2+浓度降至原来的千分之一,即c(Cu2+)=2×10-4mol/L,此时c(OH-)==1×10-8mol/L,则c(H+)=1×10-6mol/L,pH=6。
19.(1)<
(2)CD
(3) Fe2++2OH- =Fe(OH)2↓ 温度45℃以下,升高温度,有利于加快反应速率,NO的脱除率增大,温度45℃以上,升高温度,平衡逆向移动,且NO的溶解度降低,NO的脱除率减小;
(4) A室到B室
【详解】(1)设 N2(g) + O2 (g) = 2NO (g) △H1=+180.5kJ mol-1①,4NH3(g) + 3O2(g) = 2N2(g) + 6H2O (g) △H2= -1269kJ mol-1 ②,4NH3(g) + 6NO(g) = 5N2(g) + 6H2O △H3 ③,根据盖斯定律,有③=②-①×3,则△H3=△H2-△H1×3=[ (-1269)-3×180.5]kJ mol-1<0;
(2)A.根据图1可知,为反应的催化剂,故能降低总反应的活化能,提高反应速率,A错误;
B.根据图1可知,反应物是氨气、和氧气,生成物是氮气和水,则总反应的化学方程式为,B错误;
C.该反应历程中形成了非极性键和极性键,C正确;
D.由图可知,反应中的三个阶段均有元素化合价变化,均为氧化还原反应,D正确;
故选CD;
(3)①方法l,pH过高不利于Fe2+与NO反应,原因是Fe2+与溶液中的OH-会发生反应产生Fe(OH)2沉淀,离子方程式为Fe2++2OH- =Fe(OH)2↓;
②分析图像和物质性质可知:温度变化NO去除率变化的原因是温度45℃以下,升高温度,有利于加快反应速率,NO的脱除率增大,温度45℃以上,升高温度,化学平衡逆向移动,且NO的溶解度降低,NO的脱除率减小,故答案为:温度45℃以下,升高温度,有利于加快反应速率,NO的脱除率增大,温度45℃以上,升高温度,平衡逆向移动,且NO的溶解度降低,NO的脱除率减小;
(4)该装置为电解池,由图可知电极I附近产生氮气,则该电极为阴极,则电极II为阳极,在电解池中阴离子向阳极移动,即向电极II移动,从A室到B室;由图可知,A室发生的电极反应式为。
20.(1) 2.0×10-7 mol·L-1 8.0×10-11 mol·L-1 8.0×10-11 mol·L-1 高于
(2) E=A=D<C<B bc
(3)弱电解质
(4)②>③>①
【详解】(1)某温度下纯水中的c(H+)=2×10-7 mol·L-1,由于水电离产生的c(H+)=c(OH-),则此时c(OH-)为2×10-7 mol·L-1;该温度下水的离子积常数KW= c(H+)·c(OH-)=4×10-14 mol2·L-2,若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)=;盐酸中的OH-只有H2O电离产生,由于水电离的c(H+)=c(OH-),则此溶液中由水电离产生的c(H+)=c(OH-)=8.0×10-11 mol/L;H2O是弱电解质,溶液中存在电离平衡,谁电离过程会吸收热量,升高温度,会促进水的电离,导致水电离程度增大,KW增大。在25℃时水的离子积KW=1.0×10-14,该温度下水的离子积KW=4×10-14 mol2·L-2>1.0×10-14,因此此时温度高于25℃;
(2)①水的离子积常数KW只与温度有关,温度相同,KW相同,升高温度,KW增大,则由于温度:B>C>A=D=E,所以图中五点对应的KW的关系是E=A=D<C<B;
②由于温度:A=D,溶液中c(H+): A点c(H+)=c(OH-),D点:c(H+)>c(OH-),溶液显酸性,所以从A点到D点,可使溶液显酸性。
a.升高温度,c(H+)=c(OH-),溶液显中性,不符合题意;
b.加入少量的盐酸,温度不变,c(H+)增大,导致溶液显酸性,c(H+)>c(OH-),b符合题意;
c.NH4Cl是强酸弱碱盐,水解使溶液显酸性,加入少量的NH4Cl c(H+)增大,导致溶液显酸性,c(H+)>c(OH-),b符合题意;
故合理选项是bc;
(3)25℃时KW=1.0×10-14,c(H+)·c(OH-)=1×10-14,0.1mol/LHA溶液中,解得c(H+)=10-2 mol/L<0.1 mol/L,因此HA是一元弱酸,HA属于弱电解质;
(4)对于0.1 mol/L的①H2SO4、②CH3COOH、③NaOH中,H2SO4是二元强酸,c(H+)=0.2 mol/L,CH3COOH是一元弱酸,c(H+)<0.1 mol/L,但大于10-7 mol/L,NaOH是一元强碱,c(OH-)=0.1 mol/L,电解质电离产生的离子浓度越大,对水电离抑制程度就越大,水电离产生的c(H+)就越小。故三种溶液中水电离产生的c (H+):②>③>①。
21. 2CH4(g)C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol 0.25 阳 2H2O+2e-=2OH-+H2↑ 基本不变 NaCN+H2S=HCN+NaHS 6
【分析】甲烷燃烧反应CH4+2O2点燃CO2+2H2O,乙烯燃烧反应为C2H4+3O2点燃2CO2+2H2O,故甲烷制备乙烯的反应根据盖斯定律求解;
由题可知,电解池目的为将硫化氢转化为硫单质,除杂后的气体从右侧碳棒排出,故右侧碳棒为氧化反应,作阳极;左侧碳棒发生还原反应,在氢氧化钠溶液中,反应物为水,产物为氢气;
由于硫化氢的二步电离程度小于HCN电离程度,故向NaCN溶液中通入少量的H2S气体后,产物为NaHS。
【详解】(1)甲烷燃烧反应CH4(g)+2O2(g)点燃CO2(g)+2H2O(l) H1=-890.3 kJ/mol,乙烯燃烧反应为C2H4(g)+3O2(g)点燃2CO2(g)+2H2O(l) H2=-1411.5 kJ/mol,氢气燃烧反应为2H2(g)+O2(g)点燃2H2O(l) H3=-571 kJ/mol,根据盖斯定律,2CH4(g)C2H4(g)+2H2(g) ΔH=2 H1- H2- H3=+202.5 kJ/mol;
(2)在400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,设反应产生乙烯的物质的量为xmol。
2CH4C2H4+2H2
反应前 1 0 0
反应中 2x x 2x
反应后 1-2x x 2x
测得平衡混合气体中C2H4的体积分数==20.0 %,则x=0.25。则在该温度下,其平衡常数K=。根据勒夏特列原理,反应正方向气体体积增大,故在同温环境下,增大压强,平衡逆向移动;反应为吸热反应,故在同压环境下,增大温度,平衡正向移动。
(3)工业上除去天然气中杂质气体H2S,转化为单质硫,除杂后的气体从右侧碳棒排出,故右侧碳棒为氧化反应,作阳极;左侧碳棒发生还原反应,在氢氧化钠溶液中,反应物为水,产物为氢气,2H2O+2e-=2OH-+H2↑;通电过程中,硫离子通过阴离子交换膜进入左池,不断与右池中的多余的氢氧化钠反应产生硫化钠,故c(NaOH):c(Na2S)基本不变;
(4)由于硫化氢的二步电离程度小于HCN电离程度,故向NaCN溶液中通入少量的H2S气体后,产物为NaHS,反应的化学方程式为NaCN+H2S=HCN+NaHS;
(5)由题可知,Mn2++2H2S=MnS↓+2H+,Ksp(MnS)=c(Mn2+)c(S2-)=1.4×10 15,故c(S2-)=7×10-13。H2S的电离常数Ka1=1.3×10 7,Ka2=7.0×10 15,故二步电离HS-=H++S2-,即此时当HS-浓度为1.0×10 4 mol·L 1,c(H+)==10-6mol/L,故pH=a=-lgc(H+)=6。
22. 0.09mol/L 甲 当滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色,半分钟不褪色 0.2 AD
【分析】据表分析,实验1的数据与实验2实验3 差别太大,可忽略,求出实验2和实验3 的平均值,即为所用标准液的体积,再据c(HCl)=求算;根据c(待测)=分析不当操作对V(标准)的影响,以此判断浓度的误差。
【详解】I、第一组数据误差较大,舍去,据表可知V(NaOH)==21.70mL,则c(HCl)= = =0.09mol/L;故答案为:0.09mol/L;
II、(1)滴定时,KMnO4具有强氧化性,要用酸式滴定管,将KMnO4标准液装在图中的甲(填“甲”或“乙”)滴定管中。故答案为:甲;
(2)本实验滴定达到终点的标志是当滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色,半分钟不褪色。故答案为:当滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色,半分钟不褪色;
(3)根据关系式2KMnO4 ~5H2C2O4计算,H2C2O4溶液的物质的量浓度为=0.2mol/L。故答案为:0.2;
(4)A.滴定终点时俯视滴定管刻度,导致读出的消耗的KMnO4溶液的体积偏小,使测得的值偏小,故A符合;
B.滴定终点时仰视滴定管刻度,导致读出的消耗的KMnO4溶液的体积偏大,使测得的值偏大,故B不符;
C.滴定前用待测H2C2O4溶液润洗锥形瓶,增大待测H2C2O4的物质的量,导致消耗的KMnO4溶液的体积偏大,使测得的值偏大,故C不符;
D.滴定管尖嘴内在滴定前无气泡,滴定后有气泡,导致消耗的KMnO4溶液的体积偏小,使测得的值偏小,故D符合;
故答案为:AD。
23. 温度 催化剂 反应产生气泡快慢 消除阴离子不同对实验的干扰 Cl- H2O2,盐酸 向盛有H2O2溶液的试管中加入少量盐酸,然后把带火星的木条伸入试管中,木条不复燃
【详解】分析:(1)过氧化氢在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响,设计实验方案来验证时,控制变量以确保实验结果的准确性;(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接;(3)①根据反应生成气体的快慢分析;②根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,更为合理;(4)由于双氧水溶液中有水,排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论.
(1)根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关。(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接,装置图为: ;(3)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢来判断;②H2O2催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以消除阴离子不同对实验的干扰,更为合理。(4)由于双氧水溶液中有水,则可排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论:Cl-对H2O2分解无催化作用;所需试剂:双氧水,盐酸,操作及现象:向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
人教版高中化学选择性必修1期末综合练习(一)
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在2NO2(气体) N2O4(气体)的可逆反应中,下列状态说明该反应一定达到限度的是
A.NO2和N2O4的物质的量相等
B.NO2和N2O4的分子数之比为2∶1
C.NO2和N2O4的物质的量浓度均保持不变
D.单位时间内,消耗1 mol N2O4同时,也有1 mol NO2被消耗
2.下列电离方程式或离子方程式书写正确的是
A.HF在水溶液中的电离方程式:HF=H++F-
B.醋酸与氢氧化钠反应的离子方程式:H++OHˉH2O
C.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO
D.CuSO4在水溶液中水解的离子方程式:Cu2++2H2OCu (OH)2+2H+
3.在、下,合成氨反应的能量变化图如图所示(图中“吸”表示在催化剂表面的吸附)。下列说法中正确的是
A.图中决速步骤的反应方程式为
B.该历程中
C.合成氨工业中采用循环操作,主要目的是增大化学反应速率
D.该反应为放热反应,所以反应中温度越低越好
4.下面各容器中盛有海水,铁在其中被腐蚀时由慢到快的顺序是
A.③<①<②<④
B.②<①<③<④
C.①<③<②<④
D.③<②<④<①
5.根据下列实验操作和现象所得出的结论或解释正确的是
选项 实验操作和现象 结论或解释
A 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 酸性:HNO2>CH3COOH
B 将SO2通入滴有酚酞的NaOH溶液,溶液红色褪去 SO2具有漂白性
C 用pH计测量0.1mol/L的醋酸、盐酸的pH,比较溶液pH大小 CH3COOH是弱电解质
D 在2mL0.01mol/LNa2S溶液中先滴入几滴0.01mol/LZnSO4溶液,有白色沉淀生成,再滴0.01mol/LCuSO4溶液有黑色沉淀生成 Ksp(CuS)
6.海洋碳循环是全球碳循环的重要组成部分,是影响全球气候变化的关键控制环节。如图为海洋中碳循环的简单原理图。下列说法错误的是
A.海洋碳循环过程中能将太阳能转化为化学能
B.钙化释放CO2的离子方程式:2HCO+Ca2+=CaCO3↓+CO2↑+H2O
C.影响海洋碳循环的因素主要有海水的酸碱性、水温、藻类生物的分布等
D.光合作用,每生成0.1mol(CH2O)x转移电子数为0.4NA(NA表示阿伏加德罗常数)
7.25 ℃时,用0.10 mol·L的氨水滴定10.00 mL 0.05 mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
A.A点溶液的pH等于1
B.由图中数据可知,H2A为强酸
C.B点水电离出的H+浓度为1.0×10-5 mol·L-1
D.C点溶液中c(NH)>c(A2-)>c(OH-)>c(H+)
8.我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示下列说法错误的是
A.二氧化碳加氢制甲醇的过程中原子利用率达100%
B.带*标记的物质是该反应历程中的中间产物
C.向该反应体系中加入少量的水能增加甲醇的产率
D.第③步的反应式为*H3CO+H2O →CH3OH+*HO
9.湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl2-)=]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
A.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol/L
B.AgCl溶解程度随c(Cl-)增大而不断减小
C.当c(Cl-)=10-2mol·L-1时,溶液中c(AgCl)>c(AgC1)>c(Ag+)
D.25℃时,AgCl+Cl-AgCl的平衡常数K=10-0.2
10.下列选用的相关仪器符合实验要求的是
A B C D
分离水和乙酸乙酯 实验室存放浓硝酸 准确量取9.50mLNaOH溶液 实验室制取乙烯
A.A B.B C.C D.D
二、填空题
11.向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c >c >c >c
②当盐酸与氨水等物质的量反应时,溶液的pH 7(填“>”或“<”或“=”,下同).
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为: n(NH3·H2O) n(HCl),溶液中c( NH4+) c(Cl﹣).
12.测定绿矾产品中含量的方法:
a.称取一定质量绿矾产品,配制成250 mL溶液;
b.量取25 mL待测溶液于锥形瓶中;
c.用硫酸酸化的 溶液滴定至终点,消耗溶液体积为20 mL,滴定时发生反应的离子方程式为。
求步骤b中所配25 mL溶液中的物质的量浓度
13.在室温下,下列五种溶液:①溶液;②溶液;③溶液;④和混合液;⑤0.1mol/LNaOH溶液,请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)。
(2)溶液②③中的大小关系是② ③。(填“>”、“<”或“=”)
(3)写出溶液④中的电荷守恒 。
(4)现用0.1000mol/L的标准盐酸滴定⑤溶液,选择酚酞做指示剂,达到滴定终点时的液面如图所示,则读数为 mL,达到滴定终点的现象为 。
14.计算题
(1)某溶液中由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW= ,若温度不变,0.005 mol·L-1的H2SO4溶液中,c(H+)= ,由水电离出的c(H+)= 。
(3)将pH=1的盐酸稀释1000倍后,pH为 。
(4)将pH=1的CH3COOH溶液稀释1000倍后,pH的范围 。
(5)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为 。
(6)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO)约为 。
15.已知常温下部分弱电解质的电离常数如下表:
化学式 HF HClO H2CO3 NH3·H2O
电离常数 Ka=6.8×10-4 Ka=4.7×10-8 Ka1=4.2×10-7 Ka2=5.6×10-11 Kb=1.7×10-5
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是 (填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为 。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) c()(填>、<或=);可使上述两种溶液pH相等的方法是 (填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为: 。
(5)常温下,计算NH4Cl溶液中,的水解常数Kh= 。
16.室温下,仅由N、H两种元素组成的某种液态燃料的质量为,在25℃、下,该液态燃料完全燃烧生成和时,放出的热量。
(1)该液态燃料的分子式为 ,属于 (填“共价”或“离子”)化合物,电子式为 。
(2)该液态燃料可用作火箭发动机的燃料,利用作氧化剂,二者反应生成和。
已知:①
②
则该液态燃料与反应的热化学方程式为 。
(3)若用该液态燃料与液态反应,反应产物为和,,下列说法正确的是 (填标号)。
A.该液态燃料完全参加反应时转移的电子数为
B.在该反应中既是氧化产物又是还原产物
C.上述反应中反应物的键能总和大于生成物的键能总和
17.(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 反应前溶液温度/℃ 金属消失的时间/s
1 0.10 丝 0.5 50 20 500
2 0.10 粉末 0.5 50 20 50
3 0.10 丝 1.0 50 20 125
4 0.10 丝 1.0 50 35 50
①对比实验1和3,表明影响化学反应速率的因素是 ;反应规律为: ,反应速率越快。
②仅表明固体反应物的表面积对化学反应速率产生影响的实验有 (填实验序号)。
③本实验中影响化学反应速率的其他因素还有 。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作 (填“负极”或“正极”),铁的电极反应式是 ,在铁电极上发生 反应(填“氧化”或“还原”)。
18.工业上制备氯化铜时,是将浓盐酸用水蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl=CuCl2+H2O,FeO+2HCl=FeCl2+H2O.
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3 4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是 。
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为 ;溶液的pH变化是 。
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 。
②要使0.2mol L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为 。
19.燃煤烟气和汽车尾气中常含有、、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以氨气为脱硝剂时,可将还原为。
①已知:
则反应, 0(填“>”、“<”“=”)
(2)研究发现还原NO的反应历程如图1。下列说法正确的是_______(填序号)。
A.能增大总反应的活化能,提高反应速率
B.总反应为
C.该反应历程中形成了非极性键和极性键
D.该反应中的三个阶段均为氧化还原反应
(3)络合吸收法脱硝技术有2种吸收NO的方法,涉及的反应如下:
方法1.
方法2.
已知:是与某有机化合物的阴离子形成的络合物
①方法1,pH过高不利于与NO反应,用离子方程式解释原因 。
②研究温度对反应的影响,在相同时间内,测得不同温度下,NO的去除率如图2所示,解释随温度变化NO去除率变化的原因 。
(4)碱液吸收法。将氢氧化钠溶液脱硝得到的、混合液和NaOH溶液分别加到如图3所示的电解槽中进行电解,该装置中,阴离子的移动方向为 (填“B室到A室”或“A室到B室”);写出A室发生的电极反应式: 。
20.回答下列问题
(1)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时c(OH-)为 ;若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为 ,由水电离产生的c(H+)为 ,此时温度 (填“高于”“低于”或“等于”)25 ℃。
(2)已知水溶液中c(H+)和c(OH-)的关系如图所示,试回答下列问题:
①图中五点对应的KW的关系是 。
②若从A点到D点,可采用的措施是 (填序号)。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)25 ℃时,0.1 mol·L-1的HA溶液中=1010。HA是 (填“强电解质”或“弱电解质”)。
(4)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的H+浓度由大到小的顺序是 (用序号表示)。
三、实验探究题
21.中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 燃烧热(kJ/mol)
氢气 285.8
甲烷 890.3
乙烯 1411.5
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式 。
(2)在400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K= 。按化学平衡移动原理,在图中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。
(3)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。
通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。则装置中右端碳棒为 极,左端碳棒上的电级反应为 ,右池中的c(NaOH):c(Na2S) (填“增大”、“ 基本不变”或“减小)。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10 7,Ka2=7.0×10 15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为 。
(5)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.0020 mol·L 1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS 浓度为1.0×10 4 mol·L 1时,Mn2+开始沉淀,则a= 。[已知:Ksp(MnS)=1.4×10 15]
22.I、用0.1mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 消耗NaOH溶液的体积/mL 待测稀盐酸的体积/mL
1 22.84 25.00
2 21.68 25.00
3 21.72 25.00
根据表格计算c(HCl)= 。(保留两位小数)
II、某化学学习小组的同学欲用KMnO4测定H2C2O4溶液的物质的量浓度实验步骤如下:
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+8H2O
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
(1)滴定时,将KMnO4标准液装在下图中的 (填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是 。
(3)计算H2C2O4溶液的物质的量浓度为 mol/L。
(4)下列滴定操作会使测得的值偏小的是 。
A.滴定终点时俯视滴定管刻度
B.滴定终点时仰视滴定管刻度
C.滴定前用待测H2C2O4溶液润洗锥形瓶
D.滴定管尖嘴内在滴定前无气泡,滴定后有气泡
23.H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组为探究H2O2的性质做了如下实验:
(1) 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据。
研究小组在设计方案时,考虑了浓度、 、 因素对过氧化氢分解速率的影响。
(2) 另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1 mol·L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小)。
(3) 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察 ,比较得出结论。
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是 。
(4) 已知 FeCl3溶液中主要含有H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是 。
完成表格验证猜想:
所需试剂 操作及现象 结论
Cl-对H2O2分解无催化作用
参考答案:
1.C
【分析】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
【详解】A. NO2和N2O4的物质的量相等,并不能说明两者的物质的量不变,故A不符;
B. NO2和N2O4的分子数之比为2∶1,并不能说明两者的物质的量不变,故B错误;
C. NO2和N2O4的物质的量浓度均保持不变,故C正确;
D. 单位时间内,消耗1 mol N2O4同时,也有2 mol NO2被消耗,说明正逆反应速率相等,反应达平衡状态,故D错误;
故选C。
2.D
【详解】A.HF是弱酸,部分电离,在水中存在电离平衡:HFH++F-,A错误;
B.醋酸是弱酸,应保留化学式,且不可逆,正确的离子方程式为CH3COOH+OHˉ=H2O+CH3COO-,B错误;
C.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO、HCO,C错误;
D.CuSO4属于强酸弱碱盐,铜离子会微弱水解,水解离子方程式为Cu2++2H2OCu (OH)2+2H+,D正确;
答案选D。
3.A
【详解】A.活化能越大反应速率越慢,慢反应决定总反应速率,正反应活化能为62,所以是决速步骤,故A正确;
B.根据图示,该历程放热,,故B错误;
C.合成氨工业中采用循环操作,主要目的是提高原料利用率,故C错误;
D.反应中温度太低,催化剂活性降低,反应速率太慢,故D错误;
选A。
4.A
【详解】铁腐蚀快慢顺序是:作电解池阳极>原电池负极>化学腐蚀>作原电池正极>作电解池阴极;
①中铁发生化学反应;
②中铁的活动性大于锡,所以铁作负极,加速被腐蚀;
③中锌的活动性大于Fe,所以锌作负极、铁作正极,被保护;
④中铁作阳极加速被腐蚀;
所以铁腐蚀慢快顺序是③<①<②<④,答案选A。
5.C
【详解】A.两种溶液浓度未知,无法判断,A错误;
B.将SO2通入滴有酚酞的NaOH溶液,溶液红色褪去,体现SO2的酸性,B错误;
C.浓度相等的盐酸pH大于醋酸,说明醋酸为弱电解质,C正确;
D.由于硫化钠过量,所以硫化钠与硫酸铜反应又出现黑色沉淀,不是沉淀的转化,所以不能证明溶度积的大小,故D错误;
故选C。
6.D
【详解】A.通过光照,该装置是太阳能转化为化学能,则光合作用能将太阳能转化为化学能,故A正确;
B.根据反应图象分析,钙化过程中HCO转化为CaCO3和CO2,所以钙化作用的离子方程式为Ca2++2HCO=CaCO3↓+CO2↑+H2O,故B正确;
C.分析流程可知,酸碱性,温度,二氧化碳浓度(藻类分布)会对反应造成影响,随之影响海洋碳循环,故C正确;
D.(CH2O)x中H为+1价,O为-2价,故C为0价,0.1x molCO2经光合作用还原生成0.1mol(CH2O)x,转移电子数为0.4xNA,故D错误;
故选D。
7.C
【详解】A.A点:根据c(H+)c(OH-)=KW=1×10-14,lg=12,计算得c(H+)=10-1mol/L,则pH=1,故不选A;
B.根据A选项分析可知,A点溶液中c(H+)=10-1mol/L,则0.05mol/LH2A完全电离,属于H2A为强酸,故不选B;
C.B点酸碱恰好完全中和生成盐(NH4)2A,lg=2,计算得c(H+)=10-6mol/L,则水电离出的H+离子浓度为1.0×10-6mol·L-1,故选C;
D.C点是(NH4)2A与氨水混合物,根据lg= -4,计算得c(H+)=10-9mol/L,则pH=9,偏碱性,考虑(NH4)2A完全电离和氨水的电离平衡,则溶液中c(NH)>c(A2-)>c(OH-)>c(H+),故不选D;
答案为C。
【点睛】对于此类图像题经常利用分析起点、恰好完全中和点、溶液呈中性点等获得所需结论。
8.A
【详解】A.根据图知,二氧化碳和氢气反应生成甲醇和水,该反应中除了生成甲醇外还生成水,所以二氧化碳加氢制甲醇的过程中原子利用率不是100%,A项错误;
B.根据图知,带*标记的物质在反应过程中最终被消耗,所以带*标记的物质是该反应历程中的中间产物,B项正确;
C.反应历程第③步需要水,所以向该反应体系中加入少量的水能增加甲醇的收率,C项正确;
D.第③步中*H3CO、H2O生成CH3OH和*HO,反应方程式为*H3CO+H2O→CH3OH+*HO,D项正确;
答案选A。
9.A
【详解】A.沉淀最彻底时即银离子以氯化银的形式存在,而且氯化银最多的时候,就是沉淀最彻底时,由图可知此时c(Cl-)=10-2.54mol/L,由lg[Ksp(AgCl)]=-9.75可知,Ksp(AgCl)=10-9.75,则此时c(Ag+)=10-7.21mol L-1,故A正确;
B.由图可知开始的时候氯化银的溶解度随着c(Cl-)增大而不断减小,但是当氯离子浓度增大的一定程度的时候,随着c(Cl-)增大溶液中的银离子和氯离子形成络离子,而溶解度增大,故B错误;
C.当c(Cl-)=10-2mol L-1时,图中横坐标为-2,由图可知,此时c(AgCl)>c(Ag+)>c(AgCl),故C错误;
D.AgCl+Cl-AgCl的平衡常数K=,则在图中横坐标为-0.2时AgCl与AgCl相交,即其浓度相等,则在常数中其比值为1,此时常数K==100.2,故D错误;
故选:A。
10.A
【详解】A.乙酸乙酯不溶于水,分层,可用分液漏斗进行分液,A正确;
B.浓硝酸见光分解,用棕色试剂瓶,有强氧化性,能氧化橡胶塞,需用玻璃塞,B错误;
C.NaOH应该使用碱式滴定管,而图示为酸式滴定管,C错误;
D.实验室用加热浓硫酸至170°C的方法制取乙烯,温度计量程为100℃无法测量和控制反应温度,D错误;
答案选A。
11. NH4+ Cl﹣ OH﹣ H+ < > =
【详解】①向20.00mL稀氨水加入10.00mL盐酸后,溶液为等物质的量浓度的氨水与氯化铵的混合液,氨水电离使呈碱性,氯化铵水解使溶液呈酸性,等物质的量浓度,电离程度大于水解程度,溶液呈碱性,即:c(OH﹣)>c(H+);根据电荷守恒有:c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),溶液呈碱性,所以,c(NH4+)>c(Cl﹣);水解程度微弱,溶液中c(Cl﹣)远远大于c(OH﹣),故溶液中各种离子浓度之间的大小关系为:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+);
②盐酸与氨水恰好反应,为氯化铵溶液,氯化铵是强酸弱碱盐,NH4+发生水解使溶液呈酸性,即pH<7;
③盐酸与氨水1:1恰好反应时溶质为为氯化铵NH4+发生水解使溶液呈酸性,若要溶液呈中性,氨水应过量,所以n(NH3·H2O)>n(HCl);根据电荷守恒:c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),由于溶液pH=7,即c(OH﹣)=c(H+),所以c(NH4+)>c(Cl﹣)。
12.0.04mol/L
【详解】用硫酸酸化的 溶液滴定至终点,消耗溶液体积为20 mL,根据反应方程式可知,n(Fe2+)=5n(MnO)=5×0.01mol/L×0.02L=0.001mol,则步骤b中所配25 mL溶液中的物质的量浓度。
13.(1) 碱
(2)>
(3)
(4) 22.80 最后一滴标准盐酸滴入时,溶液红色褪去,且半分钟内不恢复原色
【解析】(1)
①溶液是0.1mol/L CH3COONa,溶液中醋酸根离子水解溶液呈碱性,反应的离子方程式为:;
(2)
③0.1mol/L CH3COONH4溶液中醋酸根离子水解促进了铵根离子水解,其中的大小关系是②>③;
(3)
溶液④和混合液,溶液中存在电荷守恒为;
(4)
现用0.1000mol/L的标准盐酸滴定⑤0.1mol/LNaOH溶液,选择酚酞做指示剂,达到滴定终点时的液面根据图示可知,读数为22.80mL,达到滴定终点的现象为:最后一滴标准盐酸滴入时,溶液红色褪去,且半分钟内不恢复原色。
14.(1)2或者12
(2) 2.5×10-13 0.01mol/L 2.5×10-11mol/L
(3)4
(4)1<pH<4
(5)2
(6)20:1
【详解】(1)某溶液中由水电离出的c(H+)=10-12 mol·L-1则可能是强酸溶液,则此溶液中c(OH-)aq=c(OH-)水=c(H+)水=10-12 mol·L-1,c(H+)aq==10-2mol/L,或者是强碱溶液,则此溶液中c(H+)aq= c(H+)水=10-12 mol·L-1,则该溶液的pH为2或者12,故答案为:2或者12;
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=c(H+)c(OH-)=5.0×10-7×5.0×10-7=2.5×10-13,若温度不变,0.005 mol·L-1的H2SO4溶液中,c(H+)=0.005mol/L×2=0.01mol/L,由水电离出的c(H+)==2.5×10-11mol/L,故答案为:2.5×10-13;0.01mol/L;2.5×10-11mol/L;
(3)根据强酸强碱有限稀释的规律即强酸、强碱每稀释10倍,其pH值向7靠近1个单位可知,将pH=1的盐酸稀释1000倍后,pH为4,故答案为:4;
(4)由于CH3OOH是弱酸,稀释过程中能促进其电离,故将pH=1的CH3COOH溶液稀释1000倍后,pH的范围1<pH<4,故答案为:1<pH<4;
(5)25℃时,由反应2NaOH+H2SO4=Na2SO4+2H2O可知,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,硫酸过量,充分反应后溶液中的c(H+)==0.01mol/L,则所得溶液的pH为2,故答案为:2;
(6)将pH=5的H2SO4稀释1000倍后,此时c(H+)≈10-7mol/L,而c(SO)==5×10-9mol/L,则c(H+):c(SO)约为10-7:5×10-9=20:1,故答案为:20:1。
15. ④>③>②>① 106∶1 < AD ClO-+CO2+H2O=HClO+ 5.9×10-10
【详解】(1)等物质的量浓度的HF和HClO溶液,由于HClO的电离常数较小,故溶液中含有的H+浓度较小,其pH比HF稍大;等物质的量浓度的NaHCO3和NH3·H2O溶液,由于碳酸氢钠溶液呈碱性,故碳酸氢根的水解程度大于碳酸氢根的电离,碳酸氢根的水解常数Kh====2.4×10-8,与一水合氨的电离常数相比碳酸氢根的水解常数较小,故碳酸氢根水解出的OH-的浓度小于一水合氨电离出的OH-的浓度,故一水合氨的pH稍大,综上,四种物质的pH从大到小的顺序为④>③>②>①;
(2)NH4Cl为强酸弱碱盐,溶液中的H+由铵根水解而来,故pH=4的NH4Cl中水电离的c(H+)=10-4mol/L;HF为弱酸,溶液中的H+由HF电离而来,HF中水电离出的c(H+)与溶液中c(OH-)相同,故pH=4的HF中水电离出的c(H+)=10-10mol/L,综上,两溶液中水电离出的c(H+)之比为10-4:10-10=106:1;
(3)①根据电离常数可知,HClO电离常数小于H2CO3的一级电离常数,则等浓度的NaClO溶液水解程度大于NaHCO3溶液的水解程度,则0.1mol/L的NaClO溶液和0.1mol/L的NaHCO3溶液中,c(ClO-)
A选项,向NaClO溶液中加适量的水,浓度减小,氢氧根离子浓度减小,可行;
B选项,向NaClO溶液中加适量的NaOH,溶液中氢氧根离子浓度增大,不可行;
C选项,向NaHCO3溶液中加适量的水,氢氧根离子浓度减小,不可行;
D选项,向NaHCO3溶液中加适量的NaOH,溶液中氢氧根离子浓度增大,可行;
答案选AD;
(4)根据酸的电离常数和强酸制弱酸的原理可知,碳酸的一级电离常数大于次氯酸的电离常数,次氯酸的电离常数大于碳酸的二级电离常数,故二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O=HClO+HCO3-;
(5)NH4+的水解常数Kh=====5.9×10-10。
16.(1) N2H4 共价
(2)
(3)B
【分析】(1)
,依题意可知:只含、两种元素且相对分子量为32的分子式只有;该化合物由、两种非金属元素组成,所以为共价化合物,电子式为。
(2)
由①、②和③联立,可得到。
(3)
未标明标准状况下,A项错误;根据,可知,反应物的键能总和小于生成物的键能总和,C项错误。故选B。
17. 浓度 反应物浓度越大 1、2 温度 正极 Fe-2e-=Fe2+ 氧化
【详解】①对比实验1和3,其余条件均相同、只有硫酸浓度不同,3中硫酸浓度大、金属消失时间短、反应速率大,则实验1和3表明影响化学反应速率的因素是浓度;反应规律为:反应物浓度越大,反应速率越快。
②对比实验1和2,其余条件均相同、只有金属状态不同,2中金属为粉末、金属消失时间短、反应速率大,则仅表明固体反应物的表面积对化学反应速率产生影响的实验有1、2。
③对比实验1和4可以发现,本实验中影响化学反应速率的其他因素还有温度。
(2)如图原电池装置中,铜作正极,铜离子在正极上得到电子生成铜,铁作负极,铁失去电子转化为亚铁离子,铁的电极反应式是Fe-2e-=Fe2+,在铁电极上发生氧化反应。
18. 将Fe2+氧化为Fe3+,再调节溶液pH为3~4的范围 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O 增大 5 6
【详解】(1)根据题意可知Fe3+完全沉淀时Cu2+不沉淀,所以可以将Fe2+氧化为Fe3+,再调节溶液pH为3~4的范围,除去Fe元素;
(2)该工艺中利用浓盐酸浸取粗制氧化铜粉制取氯化铜,为防止Cu2+沉淀,溶液应保持酸性环境,加入NaClO后,酸性环境中ClO-将Fe2+氧化为Fe3+,自身被还原成Cl-,离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,该反应过程中消耗氢离子,所以pH增大;
(3)①Cu2+开始沉淀时c(OH-)==1×10-9mol/L,则c(H+)=1×10-5mol/L,pH=5;
②使Cu2+浓度降至原来的千分之一,即c(Cu2+)=2×10-4mol/L,此时c(OH-)==1×10-8mol/L,则c(H+)=1×10-6mol/L,pH=6。
19.(1)<
(2)CD
(3) Fe2++2OH- =Fe(OH)2↓ 温度45℃以下,升高温度,有利于加快反应速率,NO的脱除率增大,温度45℃以上,升高温度,平衡逆向移动,且NO的溶解度降低,NO的脱除率减小;
(4) A室到B室
【详解】(1)设 N2(g) + O2 (g) = 2NO (g) △H1=+180.5kJ mol-1①,4NH3(g) + 3O2(g) = 2N2(g) + 6H2O (g) △H2= -1269kJ mol-1 ②,4NH3(g) + 6NO(g) = 5N2(g) + 6H2O △H3 ③,根据盖斯定律,有③=②-①×3,则△H3=△H2-△H1×3=[ (-1269)-3×180.5]kJ mol-1<0;
(2)A.根据图1可知,为反应的催化剂,故能降低总反应的活化能,提高反应速率,A错误;
B.根据图1可知,反应物是氨气、和氧气,生成物是氮气和水,则总反应的化学方程式为,B错误;
C.该反应历程中形成了非极性键和极性键,C正确;
D.由图可知,反应中的三个阶段均有元素化合价变化,均为氧化还原反应,D正确;
故选CD;
(3)①方法l,pH过高不利于Fe2+与NO反应,原因是Fe2+与溶液中的OH-会发生反应产生Fe(OH)2沉淀,离子方程式为Fe2++2OH- =Fe(OH)2↓;
②分析图像和物质性质可知:温度变化NO去除率变化的原因是温度45℃以下,升高温度,有利于加快反应速率,NO的脱除率增大,温度45℃以上,升高温度,化学平衡逆向移动,且NO的溶解度降低,NO的脱除率减小,故答案为:温度45℃以下,升高温度,有利于加快反应速率,NO的脱除率增大,温度45℃以上,升高温度,平衡逆向移动,且NO的溶解度降低,NO的脱除率减小;
(4)该装置为电解池,由图可知电极I附近产生氮气,则该电极为阴极,则电极II为阳极,在电解池中阴离子向阳极移动,即向电极II移动,从A室到B室;由图可知,A室发生的电极反应式为。
20.(1) 2.0×10-7 mol·L-1 8.0×10-11 mol·L-1 8.0×10-11 mol·L-1 高于
(2) E=A=D<C<B bc
(3)弱电解质
(4)②>③>①
【详解】(1)某温度下纯水中的c(H+)=2×10-7 mol·L-1,由于水电离产生的c(H+)=c(OH-),则此时c(OH-)为2×10-7 mol·L-1;该温度下水的离子积常数KW= c(H+)·c(OH-)=4×10-14 mol2·L-2,若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)=;盐酸中的OH-只有H2O电离产生,由于水电离的c(H+)=c(OH-),则此溶液中由水电离产生的c(H+)=c(OH-)=8.0×10-11 mol/L;H2O是弱电解质,溶液中存在电离平衡,谁电离过程会吸收热量,升高温度,会促进水的电离,导致水电离程度增大,KW增大。在25℃时水的离子积KW=1.0×10-14,该温度下水的离子积KW=4×10-14 mol2·L-2>1.0×10-14,因此此时温度高于25℃;
(2)①水的离子积常数KW只与温度有关,温度相同,KW相同,升高温度,KW增大,则由于温度:B>C>A=D=E,所以图中五点对应的KW的关系是E=A=D<C<B;
②由于温度:A=D,溶液中c(H+): A点c(H+)=c(OH-),D点:c(H+)>c(OH-),溶液显酸性,所以从A点到D点,可使溶液显酸性。
a.升高温度,c(H+)=c(OH-),溶液显中性,不符合题意;
b.加入少量的盐酸,温度不变,c(H+)增大,导致溶液显酸性,c(H+)>c(OH-),b符合题意;
c.NH4Cl是强酸弱碱盐,水解使溶液显酸性,加入少量的NH4Cl c(H+)增大,导致溶液显酸性,c(H+)>c(OH-),b符合题意;
故合理选项是bc;
(3)25℃时KW=1.0×10-14,c(H+)·c(OH-)=1×10-14,0.1mol/LHA溶液中,解得c(H+)=10-2 mol/L<0.1 mol/L,因此HA是一元弱酸,HA属于弱电解质;
(4)对于0.1 mol/L的①H2SO4、②CH3COOH、③NaOH中,H2SO4是二元强酸,c(H+)=0.2 mol/L,CH3COOH是一元弱酸,c(H+)<0.1 mol/L,但大于10-7 mol/L,NaOH是一元强碱,c(OH-)=0.1 mol/L,电解质电离产生的离子浓度越大,对水电离抑制程度就越大,水电离产生的c(H+)就越小。故三种溶液中水电离产生的c (H+):②>③>①。
21. 2CH4(g)C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol 0.25 阳 2H2O+2e-=2OH-+H2↑ 基本不变 NaCN+H2S=HCN+NaHS 6
【分析】甲烷燃烧反应CH4+2O2点燃CO2+2H2O,乙烯燃烧反应为C2H4+3O2点燃2CO2+2H2O,故甲烷制备乙烯的反应根据盖斯定律求解;
由题可知,电解池目的为将硫化氢转化为硫单质,除杂后的气体从右侧碳棒排出,故右侧碳棒为氧化反应,作阳极;左侧碳棒发生还原反应,在氢氧化钠溶液中,反应物为水,产物为氢气;
由于硫化氢的二步电离程度小于HCN电离程度,故向NaCN溶液中通入少量的H2S气体后,产物为NaHS。
【详解】(1)甲烷燃烧反应CH4(g)+2O2(g)点燃CO2(g)+2H2O(l) H1=-890.3 kJ/mol,乙烯燃烧反应为C2H4(g)+3O2(g)点燃2CO2(g)+2H2O(l) H2=-1411.5 kJ/mol,氢气燃烧反应为2H2(g)+O2(g)点燃2H2O(l) H3=-571 kJ/mol,根据盖斯定律,2CH4(g)C2H4(g)+2H2(g) ΔH=2 H1- H2- H3=+202.5 kJ/mol;
(2)在400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,设反应产生乙烯的物质的量为xmol。
2CH4C2H4+2H2
反应前 1 0 0
反应中 2x x 2x
反应后 1-2x x 2x
测得平衡混合气体中C2H4的体积分数==20.0 %,则x=0.25。则在该温度下,其平衡常数K=。根据勒夏特列原理,反应正方向气体体积增大,故在同温环境下,增大压强,平衡逆向移动;反应为吸热反应,故在同压环境下,增大温度,平衡正向移动。
(3)工业上除去天然气中杂质气体H2S,转化为单质硫,除杂后的气体从右侧碳棒排出,故右侧碳棒为氧化反应,作阳极;左侧碳棒发生还原反应,在氢氧化钠溶液中,反应物为水,产物为氢气,2H2O+2e-=2OH-+H2↑;通电过程中,硫离子通过阴离子交换膜进入左池,不断与右池中的多余的氢氧化钠反应产生硫化钠,故c(NaOH):c(Na2S)基本不变;
(4)由于硫化氢的二步电离程度小于HCN电离程度,故向NaCN溶液中通入少量的H2S气体后,产物为NaHS,反应的化学方程式为NaCN+H2S=HCN+NaHS;
(5)由题可知,Mn2++2H2S=MnS↓+2H+,Ksp(MnS)=c(Mn2+)c(S2-)=1.4×10 15,故c(S2-)=7×10-13。H2S的电离常数Ka1=1.3×10 7,Ka2=7.0×10 15,故二步电离HS-=H++S2-,即此时当HS-浓度为1.0×10 4 mol·L 1,c(H+)==10-6mol/L,故pH=a=-lgc(H+)=6。
22. 0.09mol/L 甲 当滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色,半分钟不褪色 0.2 AD
【分析】据表分析,实验1的数据与实验2实验3 差别太大,可忽略,求出实验2和实验3 的平均值,即为所用标准液的体积,再据c(HCl)=求算;根据c(待测)=分析不当操作对V(标准)的影响,以此判断浓度的误差。
【详解】I、第一组数据误差较大,舍去,据表可知V(NaOH)==21.70mL,则c(HCl)= = =0.09mol/L;故答案为:0.09mol/L;
II、(1)滴定时,KMnO4具有强氧化性,要用酸式滴定管,将KMnO4标准液装在图中的甲(填“甲”或“乙”)滴定管中。故答案为:甲;
(2)本实验滴定达到终点的标志是当滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色,半分钟不褪色。故答案为:当滴入最后一滴KMnO4溶液,溶液由无色变为浅紫色,半分钟不褪色;
(3)根据关系式2KMnO4 ~5H2C2O4计算,H2C2O4溶液的物质的量浓度为=0.2mol/L。故答案为:0.2;
(4)A.滴定终点时俯视滴定管刻度,导致读出的消耗的KMnO4溶液的体积偏小,使测得的值偏小,故A符合;
B.滴定终点时仰视滴定管刻度,导致读出的消耗的KMnO4溶液的体积偏大,使测得的值偏大,故B不符;
C.滴定前用待测H2C2O4溶液润洗锥形瓶,增大待测H2C2O4的物质的量,导致消耗的KMnO4溶液的体积偏大,使测得的值偏大,故C不符;
D.滴定管尖嘴内在滴定前无气泡,滴定后有气泡,导致消耗的KMnO4溶液的体积偏小,使测得的值偏小,故D符合;
故答案为:AD。
23. 温度 催化剂 反应产生气泡快慢 消除阴离子不同对实验的干扰 Cl- H2O2,盐酸 向盛有H2O2溶液的试管中加入少量盐酸,然后把带火星的木条伸入试管中,木条不复燃
【详解】分析:(1)过氧化氢在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响,设计实验方案来验证时,控制变量以确保实验结果的准确性;(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接;(3)①根据反应生成气体的快慢分析;②根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,更为合理;(4)由于双氧水溶液中有水,排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论.
(1)根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关。(2)利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接,装置图为: ;(3)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢来判断;②H2O2催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以消除阴离子不同对实验的干扰,更为合理。(4)由于双氧水溶液中有水,则可排除水作催化剂,根据猜想1可知猜想2应是真正催化分解H2O2的是Cl-;为验证猜想2可向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃,得出结论:Cl-对H2O2分解无催化作用;所需试剂:双氧水,盐酸,操作及现象:向盛有H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中,木条不复燃。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
