鲁科版化学选修四课件:1.1 化学反应的热效应(共52张PPT)
文档属性
| 名称 | 鲁科版化学选修四课件:1.1 化学反应的热效应(共52张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-05-10 00:00:00 | ||
图片预览










文档简介
课件51张PPT。第1章 化学反应与能量转化
第1节 化学反应的热效应
第1课时 化学反应的反应热、焓变1.了解反应热的概念。
2.学习如何测定中和反应的反应热。
3.理解焓与焓变。
4.熟练掌握热化学方程式的书写特点。常见的放热反应有哪些?①所有可燃物的燃烧反应,例如H2在Cl2中燃烧;
②酸碱中和反应;
③金属与酸的反应;
④铝热反应;
⑤大部分化合反应,例如CaO+H2O====Ca(OH)2。 常见的放热反应:常见的吸热反应有哪些?①铵盐与碱的反应;
②C、H2、CO等还原金属氧化物的反应;
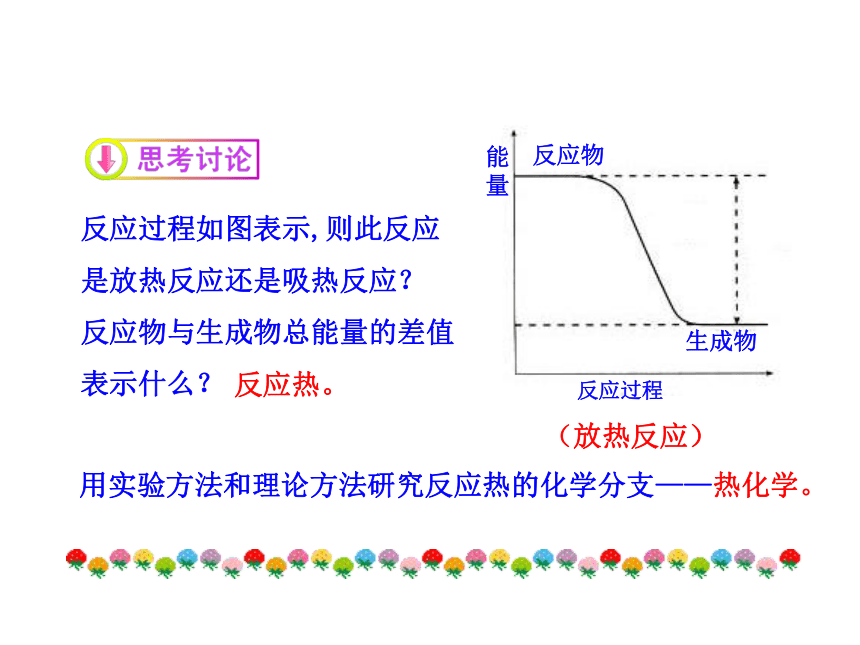
③大部分分解反应。常见的吸热反应: 反应过程如图表示,则此反应是放热反应还是吸热反应?
反应物与生成物总能量的差值表示什么?(放热反应)用实验方法和理论方法研究反应热的化学分支——热化学。反应热。为了定量描述化学反应释放或吸收的热能,
化学上规定,当化学反应在一定的温度下进行时,
反应所释放或吸收的热量称为该反应在此温度下的热效应,简称 反应热 。用Q表示一、反应热Q=-C(T2-T1)C:表示体系的热容(J·K-1)
T:表示热力学温度(K)Q= -cm(T2-T1)c:表示比热容
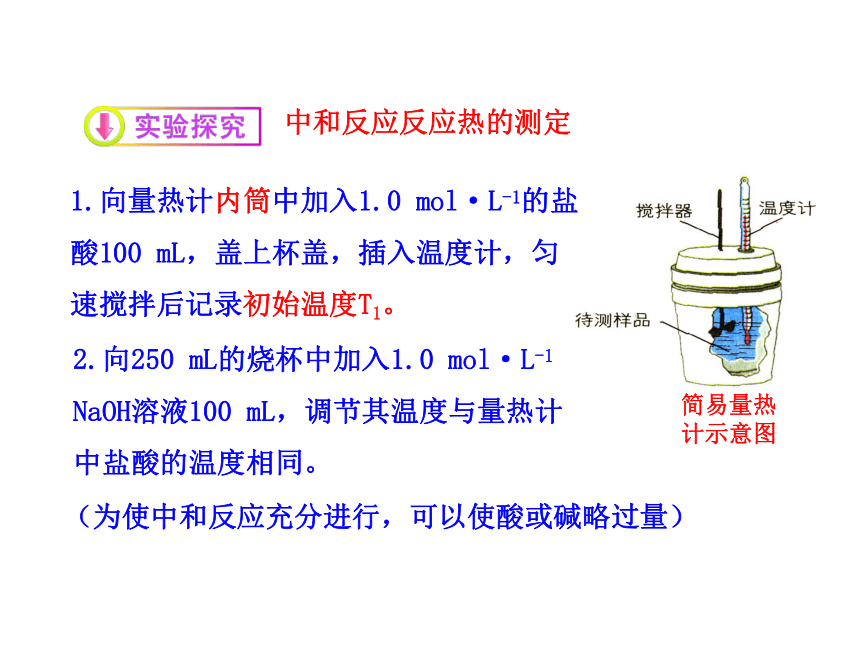
(kJ·K-1·kg-1)Q>0 吸热反应 Q<0 放热反应化学反应的热效应Q是可以测量和计算的。中和反应反应热的测定简易量热
计示意图1.向量热计内筒中加入1.0 mol·L-1的盐酸100 mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。2.向250 mL的烧杯中加入1.0 mol·L-1 NaOH溶液100 mL,调节其温度与量热计中盐酸的温度相同。(为使中和反应充分进行,可以使酸或碱略过量)已记录初始温度T1。3.快速将烧杯中的碱液倒入量热计
中,盖好杯盖,匀速搅拌,记录体
系达到的最高温度T2。4.假设 溶液的比热 等于 水的比热
(忽略量热计的热容),根据溶液温度
升高的数值,计算此中和反应的反应热。简易量热计用同样的方法测量2组与3组中的中和反应的反应热。
T2-T1相同
相同
2.所用溶液的体积相同,溶液中H+和OH-的浓度相同,即H+和OH-的量相同。1.反应的实质相同:H+ + OHˉ==== H2O。为什么三个反应的热效应相同?3.反应温度的变化值相同。1.焓(H):是与体系的内能等有关的一种物理量。二、焓与焓变焓的单位:kJ·mol-1 物质具有能量,是物质固有的性质。含义:物质具有焓的多少与物质的量的多少有关,与物质的状态和温度联系密切。 压强不变条件下的化学反应,如果不做非体积功
(即没有转化为电能、光能等其他形式的能),则该反应的反应热等于反应前后物质的焓变,即ΔH = Qp。因为 Q >0为吸热反应,Q <0为放热反应,
所以 当ΔH >0时,为吸热反应。
当ΔH <0时,为放热反应。2.焓变(ΔH):用反应物总焓、产物总焓的差值表示的反应热。单位:kJ·mol-1ΔH 0ΔH 0正吸负放<>ΔH =生成物总焓–反应物总焓 H2(g)+ O2(g)====H2O(l) ΔH(298 K)=-285.8 kJ·mol-12H2(g)+O2(g)==== 2H2O(l) ΔH(298 K)=-571.6 kJ·mol-1下列方程式属于热化学方程式: 与化学方程式相比,热化学方程式有哪些不同?2.既能表明反应中的物质变化,又能表明能量变化。 2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-571.6 kJ·mol-11.要标明物质的状态,方程式后注明能量变化。让我好好想想 H2(g)+1/2O2(g)====H2O(l) ΔH (298 K) =-285.8 kJ·mol-12.每种物质后加括号注明物质的状态。
g:气态,l:液态,s:固态,aq:水溶液中的溶质。注意事项:
1.反应方程式中各物质系数仅表示物质的量,不表示分子个数,可以是分数。三、热化学方程式的含义和书写注意事项:2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-571.6 kJ·mol-1含义:2 mol氢气和1 mol氧气充分反应生成2 mol液态水,释放能量571.6 kJ。4.ΔH数值大小与系数成正比。5.可逆反应的正反应与逆反应的ΔH数值相同,符号相反。3.ΔH后一般要用括号注明反应温度;
ΔH的单位是kJ·mol-1或J·mol-1;放热反应必须写上“-”(负号)。例.1 mol气态H2与1 mol气态Cl2反应生成2 mol气态HCl,
放出184.6 kJ的热量,请写出该反应的热化学方程式。H2(g)+Cl2(g)====2HCl(g) ?H =-184.6 kJ·mol-11.反应热:用Q表示。反应吸热,Q为正值;反应放热,Q为负值。可用Q=-C(T2-T1)计算反应热。
2.焓(H):是物质具有的能量,是物质固有的性质。3.焓变(ΔH):用反应产物总焓与反应物总焓的差值表示的反应热。
ΔH=H(反应产物)–H(反应物)ΔH:单位:kJ·mol -1 正吸负放4.物质的固有能量与焓变的关系图(1)每种物质后加括号注明物质的状态。
g:气态, l:液态,s:固态,aq:水溶液中的溶质。(2)热化学方程式中的系数不表示分子个数,可以是分数。(4)ΔH数值大小与系数成正比。5.热化学方程式书写的注意事项:(5)可逆反应的正反应与逆反应的ΔH数值相同,符号相反。(3)ΔH的单位是kJ·mol-1或J·mol-1;放热反应必须写上“-”(负号)。1.沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧
生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正
确的是( )
A.2CH4 (g)+4O2(g)====2CO2 (g)+4H2O (l)
ΔH=+890 kJ·mol-1
B.CH4+2O2====CO2+H2O ΔH =-890 kJ·mol-1
C.CH4(g)+2O2 (g)==== CO2 (g)+2H2O(l)
ΔH=-890 kJ·mol-1
D.1/2CH4 (g)+O2(g) ====1/2CO2(g)+H2O(l)
ΔH=-890 kJ·mol-1C2.已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气
放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)====H2(g)+1/2O2(g) ΔH(298 K)=+242 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-484 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH(298 K)=+242 kJ·mol-1
D.2H2(g)+O2(g)====2H2O(g) ΔH(298 K)=+484 kJ·mol-1 A3.相同温度时,下列两个反应的反应热分别用ΔH1、ΔH2
表示,其关系正确的是( )
①H2(g)+ O2(g)====H2O(g) ΔH1= -Q1 kJ·mol-1
②2H2O(g)====2H2(g)+O2(g) ΔH2=+Q2 kJ·mol-1
A.Q1>Q2 B.Q1=Q2
C.2Q1和1 mol H2,需吸收131.5 kJ的热量。写出此反应的热化学方程式。
C(s)+H2O(g)====H2(g)+CO(g)
ΔH (298 K)=+131.5 kJ·mol-15.在一定条件下,氢气和甲烷燃烧的热化学方程式为:
2H2(g)+O2(g)====2H2O(l) ΔH=–572 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
由1 mol 氢气和2 mol甲烷组成的混合气体在上述条件下完全燃烧时放出的热量为多少?2066 kJ29 第2课时 反应焓变的计算301.掌握盖斯定律的内容;
2.能用盖斯定律进行有关反应热的简单计算。31已知以下3个热化学方程式,体会反应热的关系:
①C(s)+O2(g)====CO2(g) ΔH1=-393.5 kJ·mol-1
②CO(g)+1/2O2(g)====CO2(g) ΔH2=-283.0 kJ·mol-1
③C(s)+1/2O2(g)====CO(g) ΔH3= ? ΔH3=ΔH1-ΔH232①C(s)+O2(g)====CO2(g) ΔH1=-393.5 kJ·mol-1
②CO(g)+1/2O2(g)==== CO2(g) ΔH2=-283.0 kJ·mol-1
③C(s)+1/2O2(g)====CO(g) ΔH3= ? ΔH3 =ΔH1-ΔH2=-393.5 kJ·mol-1+ 283.0 kJ·mol-1-110.5 kJ·mol-1=-110.5 kJ·mol-1【答案】33如图,由A转化成B,可以一步完成,也可以通过C,两步完成。虽然转化的途径不同,但是反应的反应热(焓变)相同。ΔH= ΔH1+ ΔH2341.不管化学反应是一步完成还是分几步完成,其反应焓变是相同的。
2.化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关。一、盖斯定律的内容35有些化学反应的反应热很难直接测得,可通过盖斯定律计算其反应热数据。3.盖斯定律应用的过程方法:
(1)写出目标方程式确定“过渡物质”(要消去的物质);
(2)乘以适当的系数,通过加减逐一消去“过渡物质”;
(3)导出目标方程式ΔH 的“运算式”。36例题:C(s)+ 1/2O2(g)====CO(g) ΔH 2=?
因为C燃烧时不可能完全生成CO,总有一部分CO2生成,
因此这个反应的ΔH无法直接测得。我们就可以借助盖斯定律设计方案计算该反应的ΔH。已知:
(1)C(s)+O2(g)====CO2(g) ΔH1=–393.5 kJ·mol-1
(2)CO(g)+1/2O2(g)====CO2(g) ΔH3=–283.0 kJ·mol-137△H2= △H1-△H3
=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)
=-110.5 kJ·mol-1ΔH1= ΔH2+ΔH3 【答案】C(s)+1/2O2(g)====CO(g) △H=-110.5 kJ·mol-138二、常见反应热计算的题型
1.根据热化学方程式的系数直接计算
【例1】25 ℃、101 kPa时,使1.0 g钠与足量的氯气反
应,生成氯化钠晶体并放出17.87 kJ的热量,求生成
1 mol氯化钠的反应热。39【解析】2Na(s)+Cl2(g)====2NaCl(s) △H=-a kJ·mol-1
46 g 2 mol a kJ a =17.87 × 46 kJ =822.02 kJ 1.0 g 17.87 kJ生成1 mol氯化钠的△H=-a/2 kJ·mol-1=-411.01 kJ·mol-140【例2】
已知:N2(g)+2O2(g)====2NO2(g) ΔH1=68 kJ·mol-1
N2H4(l)+O2(g)====N2(g)+2H2O(l) ΔH2=-622 kJ·mol-1
火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2(g)和H2O(l),写出该反应的热化学方程式。2.应用盖斯定律,进行热化学方程式计算41N2H4(l)+NO2(g)====3/2N2(g)+2H2O(l) △H =-656 kJ·mol-1①N2H4(l)+O2(g)====N2(g)+2H2O(l) ΔH2=-622 kJ·mol-1目标方程式为:
N2H4(l)+NO2(g)====3/2N2(g)+2H2O(l) ΔH = ?②2NO2(g)====N2(g)+2O2(g) ΔH1 =-68 kJ·mol-1【答案】ΔH=-622 kJ·mol-1+(-68 kJ·mol-1)/2=
-656 kJ·mol-1【解析】要消去的物质为O2,将方程式整理为:42【例3】已知下列反应的反应热为
⑴CH3COOH(l)+2O2(g)==== 2CO2(g)+ 2H2O(l)
ΔH1=-870.3 kJ·mol-1
⑵C(s)+O2(g)====CO2(g) ΔH2=-393.5 kJ·mol-1
⑶H2(g)+1/2O2(g)====H2O(l) ΔH3=-285.8 kJ·mol-1
试计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)====CH3COOH(l) 43【解析】由题意可知2[(2)+(3)]-(1)即得目标方程式。
即:ΔH=2[ΔH 2+ΔH3] -ΔH1ΔH =2×[(-393.5 kJ·mol-1)+(-285.8 kJ·mol-1)]
-(-870.3 kJ·mol-1)
=-488.3 kJ·mol-1443.应用盖斯定律,比较反应热的大小【例4】已知:
(l)H2(g)+1/2O2(g)====H2O(g) ΔH1=a kJ·mol-1
(2)H2(g)+1/2O2(g)====H2O(l) ΔH2=b kJ·mol-1
试判断a、b的大小关系。a 不管化学反应是一步完成还是分几步完成,其反应焓变是相同的。
换句话说:化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关。46二、应用盖斯定律的两种重要题型
1.加减消元法计算
(1)写出目标方程式确定“过渡物质”(要消去的物质);
(2)乘以适当的系数,通过加减逐一消去“过渡物质”;
(3)导出目标方程式ΔH的“运算式”。2.“三角法”比较反应热的大小ΔH=ΔH1 +ΔH2471.已知:
①2C(s)+O2(g)====2CO(g) ΔH=-221.0 kJ·mol-1,
②2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1
则制水煤气的反应C(s)+H2O(g)====CO(g)+H2(g)的ΔH为
( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352 kJ·mol-1 D.+131.3 kJ·mol-1D 482.使18 g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积。已知:
C(s)+1/2O2(g)====CO(g) ΔH=-Q1 kJ·mol-1,
CO(g)+1/2O2(g)====CO2(g) ΔH=-Q2 kJ·mol-1
与这些焦炭完全燃烧相比较,损失的热量是( )
A.1/3Q1 kJ B.1/3Q2 kJ
C.1/3(Q1+Q2) kJ D.1/2Q2 kJD493.已知热化学方程式
2H2(g)+O2(g)====2H2O(l) ΔH1=-571.6 kJ·mol-1,
则关于2H2O(l)====2H2(g)+O2(g)ΔH2=?的说法中
正确的是( )
A.化学计量数表示分子数?
B.ΔH2大于零?
C.ΔH2=-571.6 kJ·mol-1?
D.该反应可表示18 g水分解的热效应B504.下列各组热化学方程式中,化学反应的ΔH前者大于后者的
是( )
①C(s)+O2(g)====CO2(g) ΔH1
C(s)+1/2O2(g)====CO(g) ΔH2
②S(s)+O2(g)====SO2(g) ΔH3
S(g)+O2(g)====SO2(g) ΔH4
③H2(g)+1/2O2(g)==== H2O(l) ΔH5
2H2(g)+O2(g)====2H2O(l) ΔH6
④CaCO3(s)====CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)====Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③C515.已知:
①CO(g)+1/2O2(g)====CO2(g) ΔH1=-283.0 kJ·mol-1
②H2(g)+1/2 O2(g)====H2O(l) ΔH2=-285.8 kJ·mol-1
③C2H5OH(l)+3O2(g)====2CO2(g)+3H2O(l)
ΔH3=-1370 kJ·mol-1 试计算④2CO(g)+4H2(g)====H2O(l)+C2H5OH(l) ΔH=?
【解析】根据盖斯定律①×2+②×4-③=④ 所以ΔH=ΔH1×2+ΔH2×4-ΔH3
【答案】ΔH =-339.2 kJ·mol-1
第1节 化学反应的热效应
第1课时 化学反应的反应热、焓变1.了解反应热的概念。
2.学习如何测定中和反应的反应热。
3.理解焓与焓变。
4.熟练掌握热化学方程式的书写特点。常见的放热反应有哪些?①所有可燃物的燃烧反应,例如H2在Cl2中燃烧;
②酸碱中和反应;
③金属与酸的反应;
④铝热反应;
⑤大部分化合反应,例如CaO+H2O====Ca(OH)2。 常见的放热反应:常见的吸热反应有哪些?①铵盐与碱的反应;
②C、H2、CO等还原金属氧化物的反应;
③大部分分解反应。常见的吸热反应: 反应过程如图表示,则此反应是放热反应还是吸热反应?
反应物与生成物总能量的差值表示什么?(放热反应)用实验方法和理论方法研究反应热的化学分支——热化学。反应热。为了定量描述化学反应释放或吸收的热能,
化学上规定,当化学反应在一定的温度下进行时,
反应所释放或吸收的热量称为该反应在此温度下的热效应,简称 反应热 。用Q表示一、反应热Q=-C(T2-T1)C:表示体系的热容(J·K-1)
T:表示热力学温度(K)Q= -cm(T2-T1)c:表示比热容
(kJ·K-1·kg-1)Q>0 吸热反应 Q<0 放热反应化学反应的热效应Q是可以测量和计算的。中和反应反应热的测定简易量热
计示意图1.向量热计内筒中加入1.0 mol·L-1的盐酸100 mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。2.向250 mL的烧杯中加入1.0 mol·L-1 NaOH溶液100 mL,调节其温度与量热计中盐酸的温度相同。(为使中和反应充分进行,可以使酸或碱略过量)已记录初始温度T1。3.快速将烧杯中的碱液倒入量热计
中,盖好杯盖,匀速搅拌,记录体
系达到的最高温度T2。4.假设 溶液的比热 等于 水的比热
(忽略量热计的热容),根据溶液温度
升高的数值,计算此中和反应的反应热。简易量热计用同样的方法测量2组与3组中的中和反应的反应热。
T2-T1相同
相同
2.所用溶液的体积相同,溶液中H+和OH-的浓度相同,即H+和OH-的量相同。1.反应的实质相同:H+ + OHˉ==== H2O。为什么三个反应的热效应相同?3.反应温度的变化值相同。1.焓(H):是与体系的内能等有关的一种物理量。二、焓与焓变焓的单位:kJ·mol-1 物质具有能量,是物质固有的性质。含义:物质具有焓的多少与物质的量的多少有关,与物质的状态和温度联系密切。 压强不变条件下的化学反应,如果不做非体积功
(即没有转化为电能、光能等其他形式的能),则该反应的反应热等于反应前后物质的焓变,即ΔH = Qp。因为 Q >0为吸热反应,Q <0为放热反应,
所以 当ΔH >0时,为吸热反应。
当ΔH <0时,为放热反应。2.焓变(ΔH):用反应物总焓、产物总焓的差值表示的反应热。单位:kJ·mol-1ΔH 0ΔH 0正吸负放<>ΔH =生成物总焓–反应物总焓 H2(g)+ O2(g)====H2O(l) ΔH(298 K)=-285.8 kJ·mol-12H2(g)+O2(g)==== 2H2O(l) ΔH(298 K)=-571.6 kJ·mol-1下列方程式属于热化学方程式: 与化学方程式相比,热化学方程式有哪些不同?2.既能表明反应中的物质变化,又能表明能量变化。 2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-571.6 kJ·mol-11.要标明物质的状态,方程式后注明能量变化。让我好好想想 H2(g)+1/2O2(g)====H2O(l) ΔH (298 K) =-285.8 kJ·mol-12.每种物质后加括号注明物质的状态。
g:气态,l:液态,s:固态,aq:水溶液中的溶质。注意事项:
1.反应方程式中各物质系数仅表示物质的量,不表示分子个数,可以是分数。三、热化学方程式的含义和书写注意事项:2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-571.6 kJ·mol-1含义:2 mol氢气和1 mol氧气充分反应生成2 mol液态水,释放能量571.6 kJ。4.ΔH数值大小与系数成正比。5.可逆反应的正反应与逆反应的ΔH数值相同,符号相反。3.ΔH后一般要用括号注明反应温度;
ΔH的单位是kJ·mol-1或J·mol-1;放热反应必须写上“-”(负号)。例.1 mol气态H2与1 mol气态Cl2反应生成2 mol气态HCl,
放出184.6 kJ的热量,请写出该反应的热化学方程式。H2(g)+Cl2(g)====2HCl(g) ?H =-184.6 kJ·mol-11.反应热:用Q表示。反应吸热,Q为正值;反应放热,Q为负值。可用Q=-C(T2-T1)计算反应热。
2.焓(H):是物质具有的能量,是物质固有的性质。3.焓变(ΔH):用反应产物总焓与反应物总焓的差值表示的反应热。
ΔH=H(反应产物)–H(反应物)ΔH:单位:kJ·mol -1 正吸负放4.物质的固有能量与焓变的关系图(1)每种物质后加括号注明物质的状态。
g:气态, l:液态,s:固态,aq:水溶液中的溶质。(2)热化学方程式中的系数不表示分子个数,可以是分数。(4)ΔH数值大小与系数成正比。5.热化学方程式书写的注意事项:(5)可逆反应的正反应与逆反应的ΔH数值相同,符号相反。(3)ΔH的单位是kJ·mol-1或J·mol-1;放热反应必须写上“-”(负号)。1.沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧
生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正
确的是( )
A.2CH4 (g)+4O2(g)====2CO2 (g)+4H2O (l)
ΔH=+890 kJ·mol-1
B.CH4+2O2====CO2+H2O ΔH =-890 kJ·mol-1
C.CH4(g)+2O2 (g)==== CO2 (g)+2H2O(l)
ΔH=-890 kJ·mol-1
D.1/2CH4 (g)+O2(g) ====1/2CO2(g)+H2O(l)
ΔH=-890 kJ·mol-1C2.已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气
放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)====H2(g)+1/2O2(g) ΔH(298 K)=+242 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-484 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH(298 K)=+242 kJ·mol-1
D.2H2(g)+O2(g)====2H2O(g) ΔH(298 K)=+484 kJ·mol-1 A3.相同温度时,下列两个反应的反应热分别用ΔH1、ΔH2
表示,其关系正确的是( )
①H2(g)+ O2(g)====H2O(g) ΔH1= -Q1 kJ·mol-1
②2H2O(g)====2H2(g)+O2(g) ΔH2=+Q2 kJ·mol-1
A.Q1>Q2 B.Q1=Q2
C.2Q1
C(s)+H2O(g)====H2(g)+CO(g)
ΔH (298 K)=+131.5 kJ·mol-15.在一定条件下,氢气和甲烷燃烧的热化学方程式为:
2H2(g)+O2(g)====2H2O(l) ΔH=–572 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
由1 mol 氢气和2 mol甲烷组成的混合气体在上述条件下完全燃烧时放出的热量为多少?2066 kJ29 第2课时 反应焓变的计算301.掌握盖斯定律的内容;
2.能用盖斯定律进行有关反应热的简单计算。31已知以下3个热化学方程式,体会反应热的关系:
①C(s)+O2(g)====CO2(g) ΔH1=-393.5 kJ·mol-1
②CO(g)+1/2O2(g)====CO2(g) ΔH2=-283.0 kJ·mol-1
③C(s)+1/2O2(g)====CO(g) ΔH3= ? ΔH3=ΔH1-ΔH232①C(s)+O2(g)====CO2(g) ΔH1=-393.5 kJ·mol-1
②CO(g)+1/2O2(g)==== CO2(g) ΔH2=-283.0 kJ·mol-1
③C(s)+1/2O2(g)====CO(g) ΔH3= ? ΔH3 =ΔH1-ΔH2=-393.5 kJ·mol-1+ 283.0 kJ·mol-1-110.5 kJ·mol-1=-110.5 kJ·mol-1【答案】33如图,由A转化成B,可以一步完成,也可以通过C,两步完成。虽然转化的途径不同,但是反应的反应热(焓变)相同。ΔH= ΔH1+ ΔH2341.不管化学反应是一步完成还是分几步完成,其反应焓变是相同的。
2.化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关。一、盖斯定律的内容35有些化学反应的反应热很难直接测得,可通过盖斯定律计算其反应热数据。3.盖斯定律应用的过程方法:
(1)写出目标方程式确定“过渡物质”(要消去的物质);
(2)乘以适当的系数,通过加减逐一消去“过渡物质”;
(3)导出目标方程式ΔH 的“运算式”。36例题:C(s)+ 1/2O2(g)====CO(g) ΔH 2=?
因为C燃烧时不可能完全生成CO,总有一部分CO2生成,
因此这个反应的ΔH无法直接测得。我们就可以借助盖斯定律设计方案计算该反应的ΔH。已知:
(1)C(s)+O2(g)====CO2(g) ΔH1=–393.5 kJ·mol-1
(2)CO(g)+1/2O2(g)====CO2(g) ΔH3=–283.0 kJ·mol-137△H2= △H1-△H3
=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)
=-110.5 kJ·mol-1ΔH1= ΔH2+ΔH3 【答案】C(s)+1/2O2(g)====CO(g) △H=-110.5 kJ·mol-138二、常见反应热计算的题型
1.根据热化学方程式的系数直接计算
【例1】25 ℃、101 kPa时,使1.0 g钠与足量的氯气反
应,生成氯化钠晶体并放出17.87 kJ的热量,求生成
1 mol氯化钠的反应热。39【解析】2Na(s)+Cl2(g)====2NaCl(s) △H=-a kJ·mol-1
46 g 2 mol a kJ a =17.87 × 46 kJ =822.02 kJ 1.0 g 17.87 kJ生成1 mol氯化钠的△H=-a/2 kJ·mol-1=-411.01 kJ·mol-140【例2】
已知:N2(g)+2O2(g)====2NO2(g) ΔH1=68 kJ·mol-1
N2H4(l)+O2(g)====N2(g)+2H2O(l) ΔH2=-622 kJ·mol-1
火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2(g)和H2O(l),写出该反应的热化学方程式。2.应用盖斯定律,进行热化学方程式计算41N2H4(l)+NO2(g)====3/2N2(g)+2H2O(l) △H =-656 kJ·mol-1①N2H4(l)+O2(g)====N2(g)+2H2O(l) ΔH2=-622 kJ·mol-1目标方程式为:
N2H4(l)+NO2(g)====3/2N2(g)+2H2O(l) ΔH = ?②2NO2(g)====N2(g)+2O2(g) ΔH1 =-68 kJ·mol-1【答案】ΔH=-622 kJ·mol-1+(-68 kJ·mol-1)/2=
-656 kJ·mol-1【解析】要消去的物质为O2,将方程式整理为:42【例3】已知下列反应的反应热为
⑴CH3COOH(l)+2O2(g)==== 2CO2(g)+ 2H2O(l)
ΔH1=-870.3 kJ·mol-1
⑵C(s)+O2(g)====CO2(g) ΔH2=-393.5 kJ·mol-1
⑶H2(g)+1/2O2(g)====H2O(l) ΔH3=-285.8 kJ·mol-1
试计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)====CH3COOH(l) 43【解析】由题意可知2[(2)+(3)]-(1)即得目标方程式。
即:ΔH=2[ΔH 2+ΔH3] -ΔH1ΔH =2×[(-393.5 kJ·mol-1)+(-285.8 kJ·mol-1)]
-(-870.3 kJ·mol-1)
=-488.3 kJ·mol-1443.应用盖斯定律,比较反应热的大小【例4】已知:
(l)H2(g)+1/2O2(g)====H2O(g) ΔH1=a kJ·mol-1
(2)H2(g)+1/2O2(g)====H2O(l) ΔH2=b kJ·mol-1
试判断a、b的大小关系。a
换句话说:化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关。46二、应用盖斯定律的两种重要题型
1.加减消元法计算
(1)写出目标方程式确定“过渡物质”(要消去的物质);
(2)乘以适当的系数,通过加减逐一消去“过渡物质”;
(3)导出目标方程式ΔH的“运算式”。2.“三角法”比较反应热的大小ΔH=ΔH1 +ΔH2471.已知:
①2C(s)+O2(g)====2CO(g) ΔH=-221.0 kJ·mol-1,
②2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1
则制水煤气的反应C(s)+H2O(g)====CO(g)+H2(g)的ΔH为
( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352 kJ·mol-1 D.+131.3 kJ·mol-1D 482.使18 g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积。已知:
C(s)+1/2O2(g)====CO(g) ΔH=-Q1 kJ·mol-1,
CO(g)+1/2O2(g)====CO2(g) ΔH=-Q2 kJ·mol-1
与这些焦炭完全燃烧相比较,损失的热量是( )
A.1/3Q1 kJ B.1/3Q2 kJ
C.1/3(Q1+Q2) kJ D.1/2Q2 kJD493.已知热化学方程式
2H2(g)+O2(g)====2H2O(l) ΔH1=-571.6 kJ·mol-1,
则关于2H2O(l)====2H2(g)+O2(g)ΔH2=?的说法中
正确的是( )
A.化学计量数表示分子数?
B.ΔH2大于零?
C.ΔH2=-571.6 kJ·mol-1?
D.该反应可表示18 g水分解的热效应B504.下列各组热化学方程式中,化学反应的ΔH前者大于后者的
是( )
①C(s)+O2(g)====CO2(g) ΔH1
C(s)+1/2O2(g)====CO(g) ΔH2
②S(s)+O2(g)====SO2(g) ΔH3
S(g)+O2(g)====SO2(g) ΔH4
③H2(g)+1/2O2(g)==== H2O(l) ΔH5
2H2(g)+O2(g)====2H2O(l) ΔH6
④CaCO3(s)====CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)====Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③C515.已知:
①CO(g)+1/2O2(g)====CO2(g) ΔH1=-283.0 kJ·mol-1
②H2(g)+1/2 O2(g)====H2O(l) ΔH2=-285.8 kJ·mol-1
③C2H5OH(l)+3O2(g)====2CO2(g)+3H2O(l)
ΔH3=-1370 kJ·mol-1 试计算④2CO(g)+4H2(g)====H2O(l)+C2H5OH(l) ΔH=?
【解析】根据盖斯定律①×2+②×4-③=④ 所以ΔH=ΔH1×2+ΔH2×4-ΔH3
【答案】ΔH =-339.2 kJ·mol-1
