高中必修第二册《第三节 乙醇与乙酸》教学设计
文档属性
| 名称 | 高中必修第二册《第三节 乙醇与乙酸》教学设计 |

|
|
| 格式 | docx | ||
| 文件大小 | 572.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 00:00:00 | ||
图片预览



文档简介
乙醇与乙酸
【教学目标】
知识与技能:
1.知道官能团的概念;
2.了解乙醇的物理性质,掌握乙醇的结构和化学性质;
3.知道乙酸的物理性质,乙酸的分子组成和结构,了解乙酸的化学性质;
4.了解酯化反应的概念,了解酯化反应实验的装罝特点并能够独立完成该实验。
过程与方法:
1.通过建立乙醇、乙酸分子的立体结构模型来学习“结构-性质-用途”研究烃的衍生物的程序和方法;
2.通过学习乙酸的性质,使学生体会利用比较、归纳、概括等方法得到科学结论的过程;
3.通过乙醇的分子结构与化学性质的学习,充分理解官能团对性质的影响,学会通过事物的表象分析事物本质的方法。
情感态度与价值观:
1.知道乙醇在日常生活、工业生产中的广泛应用,形成运用知识解决实际问题的意识;
2.通过新旧知识的联系,激发学生学习的兴趣和求知欲望;
3.通过学生实验,培养学生求实、严谨的优良品质;
4.对学生进行“本质决定现象”,“由个别到一般”的辩证唯物主义思维方法的训练。
【教学重难点】
重点:
1.官能团的概念、乙醇、乙酸的组成;
2.乙醇的取代反应与氧化反应;
3.乙酸的酸性和酯化反应。
难点:使学生建立乙醇和乙酸分子的立体结构模型,并能从结构角度初步认识乙醇的氧化、乙酸的酯化两个重要反应。
【教学过程】
知识点一:乙醇
基础:自主落实
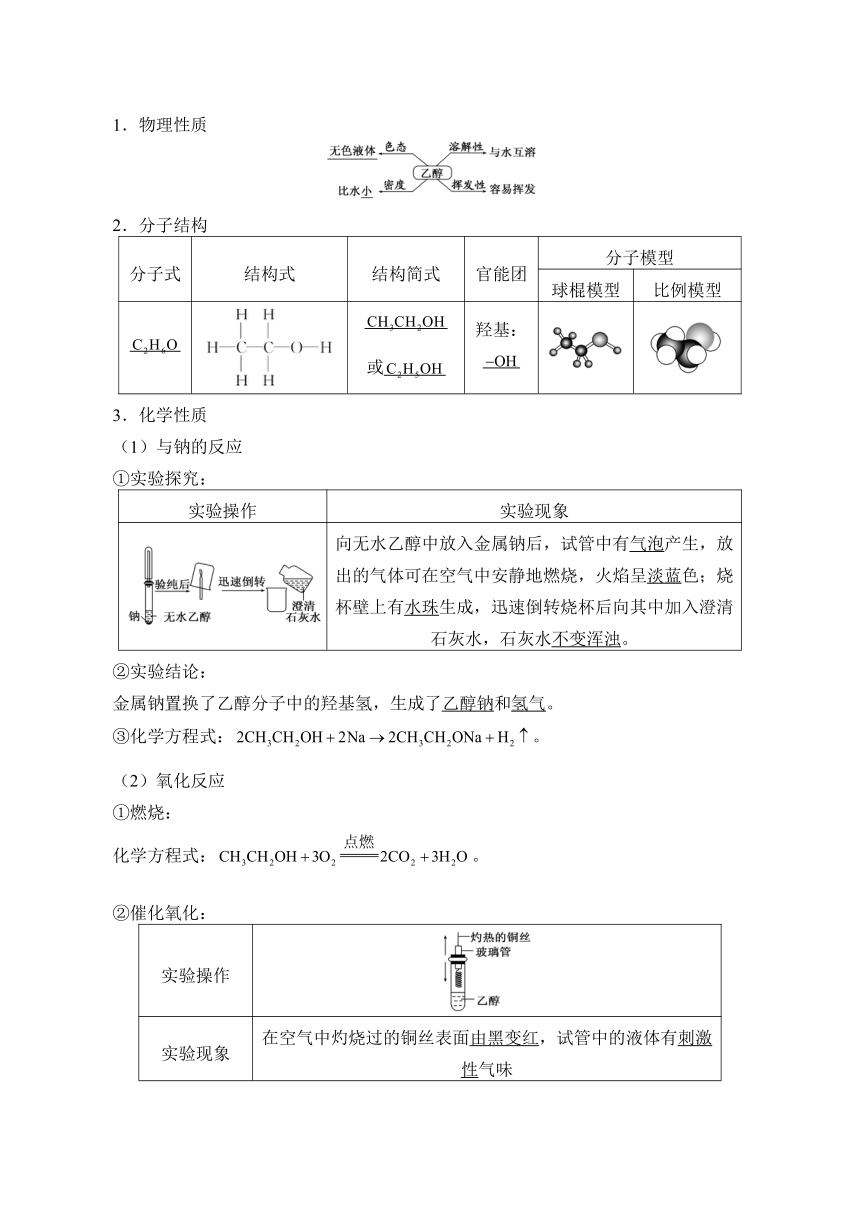
1.物理性质
2.分子结构
分子式 结构式 结构简式 官能团 分子模型
球棍模型 比例模型
或 羟基:
3.化学性质
(1)与钠的反应
①实验探究:
实验操作 实验现象
向无水乙醇中放入金属钠后,试管中有气泡产生,放出的气体可在空气中安静地燃烧,火焰呈淡蓝色;烧杯壁上有水珠生成,迅速倒转烧杯后向其中加入澄清石灰水,石灰水不变浑浊。
②实验结论:
金属钠置换了乙醇分子中的羟基氢,生成了乙醇钠和氢气。
③化学方程式:。
(2)氧化反应
①燃烧:
化学方程式:。
②催化氧化:
实验操作
实验现象 在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
化学方程式
③乙醇与酸性溶液或酸性重铬酸钾溶液反应直接氧化成乙酸。
[特别提醒]
钠(或其他活泼金属)只能置换羟基上的氢,不能置换其他氢。
探究:思考发现
1.已知乙醇的分子式为,某同学根据各原子的成键特点写出如下两种可能的结构式:
(1)若乙醇的结构式是甲式,则乙醇与钠发生反应时生成的氢气与乙醇的消耗量的物质的量之比可能有几种情况?
提示:由甲式可知,该物质中有3种氢原子,个数比为,即与羟基碳原子相连的碳上的三个氢原子为一种,羟基碳上的两个氢原子是一种,羟基氢是一种,若与钠反应,生成的氢气与消耗的乙醇的物质的量之比有3种情况,①只有羟基氢原子反应,为;②只有烃基上的氢原子反应,为;③所有氢原子均可反应,为。
(2)若乙醇的结构式是乙式,则乙醇与钠发生反应时生成的氢气与乙醇的消耗量的物质的量之比可能有几种情况?
提示:由乙式可知,该物质中的氢原子只有一种,若能与钠反应,则被钠置换生成的氢气与消耗乙醇的物质的量之比只有一种,为。
(3)如何证明一个乙醇分子中含有一个羟基?
提示:根据乙醇与足量金属钠反应产生氢气,即可证明一个乙醇分子中含有一个羟基。
2.乙醇催化氧化反应实验中铜丝是否参与反应?铜丝的作用是什么?
提示:铜丝参与化学反应,铜丝先被氧化成CuO,后又被乙醇还原为Cu,铜丝在反应中起催化剂的作用。
生成:系统认知
1.乙醇反应时的断键情况
(1)断键位置与性质
乙醇的性质 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
(2)注意
①乙醇与钠的反应比水与钠的反应要缓和得多,这说明乙醇分子羟基中的氢原子不如水分子羟基中的氢原子活泼。
②乙醇与足量钠反应,产生,该关系可延伸为羟基()跟足量钠反应产生。
2.乙醇催化氧化的实质
总反应的化学方程式为,反应中Cu作催化剂。
演练:应用体验
1.判断正误(正确的打“√”,错误的打“×”)。
(1)乙醇结构中有,所以乙醇溶解于水,可以电离出而显碱性(×)
(2)乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性(×)
(3)乙醇与钠反应可以产生氢气,所以乙醇显酸性(×)
(4)乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中羟基上的氢原子活泼(√)
2.下列说法中,不正确的是( )
A.乙醇与金属钠反应时,是乙醇分子中羟基中的键断裂
B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水
C.乙醇在一定条件下可氧化成
D.甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物
解析:选D。与金属钠反应生成乙醇钠,是乙醇分子中羟基中的键断裂;检验乙醇中是否含有水可用无水硫酸铜作检验试剂,若变蓝则表明乙醇中含水;乙醇在酸性溶液中可氧化成乙酸;甲烷、乙烯、苯都不溶于水,但乙醇却能与水以任意比例混溶。
知识点二:乙酸
基础:自主落实
1.分子结构
分子式 结构式 结构简式 官能团 比例模型
羧基:
2.物理性质
俗名 颜色 状态 气味 溶解性 挥发性
醋酸 无色 液体 强烈刺激性气味 易溶于水 易挥发
当温度低于时,乙酸凝结成像冰一样的晶体,故又称冰醋酸。
3.化学性质
(1)断键位置与性质
(2)弱酸性
乙酸是一元弱酸,具有酸的通性。在水中部分电离,电离方程式为,其酸性比碳酸的酸性强。
根据如下转化关系,写出相应的化学方程式
①;
②;
③;
④。
(3)酯化反应
概念 酸和醇反应生成酯和水的反应
反应特点 反应可逆且比较缓慢
化学方程式(以乙醇 与乙酸反应为例)
反应现象 把反应混合物用导管通到饱和碳酸钠溶液的液面上,液面上有透明的油状液体,且能闻到香味
[特别提醒]
是一种常见的有机弱酸,其酸性强于,可通过向溶液中滴加醋酸溶液,能产生使澄清石灰水变浑浊的气体的方法进行验证。
探究:思考发现
1.乙酸具有什么结构特点?其官能团是什么?
提示:乙酸可认为是甲烷分子中的一个氢原子被羧基取代后的产物,其官能团是羧基
()。
2.分别与、发生反应,分子中的断键部位相同吗?乙酸表现的性质是否相同?
提示:不同,,与反应断键部位是①,表现酸性;与乙醇反应断键部位是②,表现其能发生酯化反应的性质。
3.酯化反应中哪些措施可以提高乙酸的转化率?
提示:增加乙醇的量,加热使生成的乙酸乙酯及时蒸出,使用浓硫酸吸水都可以提高乙酸的转化率。
生成:系统认知
1.乙酸、碳酸、水和乙醇中羟基氢原子的活泼性比较
(1)理论分析:乙酸、碳酸、水、乙醇的分子组成中,均含有羟基氢,它们有相似的性质,如易溶于水、能与活泼金属反应产生氢气等。但由于与羟基相连的原子或原子团的不同,它们也呈现不同的性质,其羟基氢原子的活泼性顺序为乙酸>碳酸>水>乙醇。
(2)实验验证
将4种物质分置于4支试管中,并编号
①,②,
③
Ⅰ.实验过程:
操作 现象 结论(—OH中氢原子活泼性顺序)
四种物质各取少量于试管中,各加入紫色石蕊溶液两滴 ③、④变红,其他不变红 ③、④>①、②
在③、④试管中,各加入少量碳酸钠溶液 ④中产生气体 ④>③
在①、②中各加入少量金属钠 ①产生气体,反应迅速,②产生气体,反应缓慢 ①>②
Ⅱ.实验结论:
羟基氢的活泼性:乙醇<水<碳酸<乙酸。
2.酯化反应实验
(1)实验装置
(2)导气管末端未伸入液面以下的目的是为了防止倒吸。
(3)饱和溶液的作用
①与挥发出来的乙酸发生反应,生成可溶于水的乙酸钠,便于闻乙酸乙酯的香味。
②溶解挥发出来的乙醇。
③减小乙酸乙酯在水中的溶解度,使液体分层,便于得到酯。
(4)酯化反应实验中的四个注意问题
①注意防暴沸:反应试管中常加入几片碎瓷片或沸石防暴沸。
②注意浓硫酸的作用:催化剂、吸水剂。
③注意试剂的添加顺序:不能先加浓硫酸,以防止液体飞溅;通常的顺序是乙醇→浓硫酸→乙酸。
④注意酯的分离:对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。
演练:应用体验
1.分别将一小块钠投入下列物质中,能生成氢气,但生成氢气的速率最慢的是( )
A.乙酸 B.碳酸
C.乙醇 D.水
解析:选C。四种物质均能与钠反应生成氢气,但四种物质的分子中,羟基H最不活泼的是乙醇,所以生成氢气速率最慢的是乙醇。
2.制取乙酸乙酯的装置正确的是( )
解析:选A。玻璃导管不能插入到液面以下,以防止倒吸,不能用溶液,应用溶液。
知识点三:
生成:系统认知
1.含义
有机酸与醇脱水而成的有机物,简写为,结构简式:,官能团为。
2.物理性质
低级酯(如乙酸乙酯)密度比水小,不溶于水,易溶于有机溶剂,具有芳香气味。
3.用途
(1)用作香料,如作饮料、香水等中的香料。
(2)作溶剂,如作指甲油、胶水的溶剂等。
演练:题组冲关
1.在3支试管中分别放有:①乙酸乙酯和水 ②溴苯和水 ③乙酸和水。下图中3支试管从左到右的排列顺序为( )
A.①②③ B.①③②
C.②①③ D.②③①
解析:选D。几种液体的密度:,溶解性:溴苯和乙酸乙酯不溶于水,而乙酸与水混溶,可知三支试管的排列顺序为②③①。
2.酯类物质广泛存在于香蕉、梨等水果中。某实验小组从梨中分离出一种酯,然后将分离出的酯水解,得到乙酸和另一种分子式为的物质。下列分析不正确的是( )
A.分子中含有羟基
B.实验小组分离出的酯可表示为
C.可与金属钠发生反应
D.这种酯易溶于水
解析:选D。低级酯(含碳原子数较少)难溶于水,D项不正确。
【教学目标】
知识与技能:
1.知道官能团的概念;
2.了解乙醇的物理性质,掌握乙醇的结构和化学性质;
3.知道乙酸的物理性质,乙酸的分子组成和结构,了解乙酸的化学性质;
4.了解酯化反应的概念,了解酯化反应实验的装罝特点并能够独立完成该实验。
过程与方法:
1.通过建立乙醇、乙酸分子的立体结构模型来学习“结构-性质-用途”研究烃的衍生物的程序和方法;
2.通过学习乙酸的性质,使学生体会利用比较、归纳、概括等方法得到科学结论的过程;
3.通过乙醇的分子结构与化学性质的学习,充分理解官能团对性质的影响,学会通过事物的表象分析事物本质的方法。
情感态度与价值观:
1.知道乙醇在日常生活、工业生产中的广泛应用,形成运用知识解决实际问题的意识;
2.通过新旧知识的联系,激发学生学习的兴趣和求知欲望;
3.通过学生实验,培养学生求实、严谨的优良品质;
4.对学生进行“本质决定现象”,“由个别到一般”的辩证唯物主义思维方法的训练。
【教学重难点】
重点:
1.官能团的概念、乙醇、乙酸的组成;
2.乙醇的取代反应与氧化反应;
3.乙酸的酸性和酯化反应。
难点:使学生建立乙醇和乙酸分子的立体结构模型,并能从结构角度初步认识乙醇的氧化、乙酸的酯化两个重要反应。
【教学过程】
知识点一:乙醇
基础:自主落实
1.物理性质
2.分子结构
分子式 结构式 结构简式 官能团 分子模型
球棍模型 比例模型
或 羟基:
3.化学性质
(1)与钠的反应
①实验探究:
实验操作 实验现象
向无水乙醇中放入金属钠后,试管中有气泡产生,放出的气体可在空气中安静地燃烧,火焰呈淡蓝色;烧杯壁上有水珠生成,迅速倒转烧杯后向其中加入澄清石灰水,石灰水不变浑浊。
②实验结论:
金属钠置换了乙醇分子中的羟基氢,生成了乙醇钠和氢气。
③化学方程式:。
(2)氧化反应
①燃烧:
化学方程式:。
②催化氧化:
实验操作
实验现象 在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
化学方程式
③乙醇与酸性溶液或酸性重铬酸钾溶液反应直接氧化成乙酸。
[特别提醒]
钠(或其他活泼金属)只能置换羟基上的氢,不能置换其他氢。
探究:思考发现
1.已知乙醇的分子式为,某同学根据各原子的成键特点写出如下两种可能的结构式:
(1)若乙醇的结构式是甲式,则乙醇与钠发生反应时生成的氢气与乙醇的消耗量的物质的量之比可能有几种情况?
提示:由甲式可知,该物质中有3种氢原子,个数比为,即与羟基碳原子相连的碳上的三个氢原子为一种,羟基碳上的两个氢原子是一种,羟基氢是一种,若与钠反应,生成的氢气与消耗的乙醇的物质的量之比有3种情况,①只有羟基氢原子反应,为;②只有烃基上的氢原子反应,为;③所有氢原子均可反应,为。
(2)若乙醇的结构式是乙式,则乙醇与钠发生反应时生成的氢气与乙醇的消耗量的物质的量之比可能有几种情况?
提示:由乙式可知,该物质中的氢原子只有一种,若能与钠反应,则被钠置换生成的氢气与消耗乙醇的物质的量之比只有一种,为。
(3)如何证明一个乙醇分子中含有一个羟基?
提示:根据乙醇与足量金属钠反应产生氢气,即可证明一个乙醇分子中含有一个羟基。
2.乙醇催化氧化反应实验中铜丝是否参与反应?铜丝的作用是什么?
提示:铜丝参与化学反应,铜丝先被氧化成CuO,后又被乙醇还原为Cu,铜丝在反应中起催化剂的作用。
生成:系统认知
1.乙醇反应时的断键情况
(1)断键位置与性质
乙醇的性质 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
(2)注意
①乙醇与钠的反应比水与钠的反应要缓和得多,这说明乙醇分子羟基中的氢原子不如水分子羟基中的氢原子活泼。
②乙醇与足量钠反应,产生,该关系可延伸为羟基()跟足量钠反应产生。
2.乙醇催化氧化的实质
总反应的化学方程式为,反应中Cu作催化剂。
演练:应用体验
1.判断正误(正确的打“√”,错误的打“×”)。
(1)乙醇结构中有,所以乙醇溶解于水,可以电离出而显碱性(×)
(2)乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性(×)
(3)乙醇与钠反应可以产生氢气,所以乙醇显酸性(×)
(4)乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中羟基上的氢原子活泼(√)
2.下列说法中,不正确的是( )
A.乙醇与金属钠反应时,是乙醇分子中羟基中的键断裂
B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水
C.乙醇在一定条件下可氧化成
D.甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物
解析:选D。与金属钠反应生成乙醇钠,是乙醇分子中羟基中的键断裂;检验乙醇中是否含有水可用无水硫酸铜作检验试剂,若变蓝则表明乙醇中含水;乙醇在酸性溶液中可氧化成乙酸;甲烷、乙烯、苯都不溶于水,但乙醇却能与水以任意比例混溶。
知识点二:乙酸
基础:自主落实
1.分子结构
分子式 结构式 结构简式 官能团 比例模型
羧基:
2.物理性质
俗名 颜色 状态 气味 溶解性 挥发性
醋酸 无色 液体 强烈刺激性气味 易溶于水 易挥发
当温度低于时,乙酸凝结成像冰一样的晶体,故又称冰醋酸。
3.化学性质
(1)断键位置与性质
(2)弱酸性
乙酸是一元弱酸,具有酸的通性。在水中部分电离,电离方程式为,其酸性比碳酸的酸性强。
根据如下转化关系,写出相应的化学方程式
①;
②;
③;
④。
(3)酯化反应
概念 酸和醇反应生成酯和水的反应
反应特点 反应可逆且比较缓慢
化学方程式(以乙醇 与乙酸反应为例)
反应现象 把反应混合物用导管通到饱和碳酸钠溶液的液面上,液面上有透明的油状液体,且能闻到香味
[特别提醒]
是一种常见的有机弱酸,其酸性强于,可通过向溶液中滴加醋酸溶液,能产生使澄清石灰水变浑浊的气体的方法进行验证。
探究:思考发现
1.乙酸具有什么结构特点?其官能团是什么?
提示:乙酸可认为是甲烷分子中的一个氢原子被羧基取代后的产物,其官能团是羧基
()。
2.分别与、发生反应,分子中的断键部位相同吗?乙酸表现的性质是否相同?
提示:不同,,与反应断键部位是①,表现酸性;与乙醇反应断键部位是②,表现其能发生酯化反应的性质。
3.酯化反应中哪些措施可以提高乙酸的转化率?
提示:增加乙醇的量,加热使生成的乙酸乙酯及时蒸出,使用浓硫酸吸水都可以提高乙酸的转化率。
生成:系统认知
1.乙酸、碳酸、水和乙醇中羟基氢原子的活泼性比较
(1)理论分析:乙酸、碳酸、水、乙醇的分子组成中,均含有羟基氢,它们有相似的性质,如易溶于水、能与活泼金属反应产生氢气等。但由于与羟基相连的原子或原子团的不同,它们也呈现不同的性质,其羟基氢原子的活泼性顺序为乙酸>碳酸>水>乙醇。
(2)实验验证
将4种物质分置于4支试管中,并编号
①,②,
③
Ⅰ.实验过程:
操作 现象 结论(—OH中氢原子活泼性顺序)
四种物质各取少量于试管中,各加入紫色石蕊溶液两滴 ③、④变红,其他不变红 ③、④>①、②
在③、④试管中,各加入少量碳酸钠溶液 ④中产生气体 ④>③
在①、②中各加入少量金属钠 ①产生气体,反应迅速,②产生气体,反应缓慢 ①>②
Ⅱ.实验结论:
羟基氢的活泼性:乙醇<水<碳酸<乙酸。
2.酯化反应实验
(1)实验装置
(2)导气管末端未伸入液面以下的目的是为了防止倒吸。
(3)饱和溶液的作用
①与挥发出来的乙酸发生反应,生成可溶于水的乙酸钠,便于闻乙酸乙酯的香味。
②溶解挥发出来的乙醇。
③减小乙酸乙酯在水中的溶解度,使液体分层,便于得到酯。
(4)酯化反应实验中的四个注意问题
①注意防暴沸:反应试管中常加入几片碎瓷片或沸石防暴沸。
②注意浓硫酸的作用:催化剂、吸水剂。
③注意试剂的添加顺序:不能先加浓硫酸,以防止液体飞溅;通常的顺序是乙醇→浓硫酸→乙酸。
④注意酯的分离:对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。
演练:应用体验
1.分别将一小块钠投入下列物质中,能生成氢气,但生成氢气的速率最慢的是( )
A.乙酸 B.碳酸
C.乙醇 D.水
解析:选C。四种物质均能与钠反应生成氢气,但四种物质的分子中,羟基H最不活泼的是乙醇,所以生成氢气速率最慢的是乙醇。
2.制取乙酸乙酯的装置正确的是( )
解析:选A。玻璃导管不能插入到液面以下,以防止倒吸,不能用溶液,应用溶液。
知识点三:
生成:系统认知
1.含义
有机酸与醇脱水而成的有机物,简写为,结构简式:,官能团为。
2.物理性质
低级酯(如乙酸乙酯)密度比水小,不溶于水,易溶于有机溶剂,具有芳香气味。
3.用途
(1)用作香料,如作饮料、香水等中的香料。
(2)作溶剂,如作指甲油、胶水的溶剂等。
演练:题组冲关
1.在3支试管中分别放有:①乙酸乙酯和水 ②溴苯和水 ③乙酸和水。下图中3支试管从左到右的排列顺序为( )
A.①②③ B.①③②
C.②①③ D.②③①
解析:选D。几种液体的密度:,溶解性:溴苯和乙酸乙酯不溶于水,而乙酸与水混溶,可知三支试管的排列顺序为②③①。
2.酯类物质广泛存在于香蕉、梨等水果中。某实验小组从梨中分离出一种酯,然后将分离出的酯水解,得到乙酸和另一种分子式为的物质。下列分析不正确的是( )
A.分子中含有羟基
B.实验小组分离出的酯可表示为
C.可与金属钠发生反应
D.这种酯易溶于水
解析:选D。低级酯(含碳原子数较少)难溶于水,D项不正确。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
