第三章铁金属材料(共61张PPT)2023-2024学年高一化学上学期期末(人教版2019必修第一册)
文档属性
| 名称 | 第三章铁金属材料(共61张PPT)2023-2024学年高一化学上学期期末(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-15 00:00:00 | ||
图片预览







文档简介
(共61张PPT)
单元考点串讲
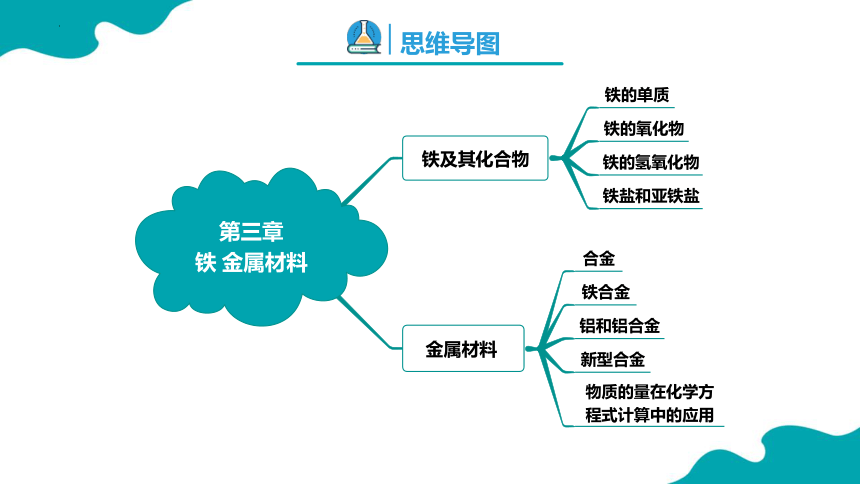
第三章 铁 金属材料
第三章
铁 金属材料
铁及其化合物
金属材料
铁的单质
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
合金
铁合金
铝和铝合金
新型合金
物质的量在化学方程式计算中的应用
考点一
铁及其化合物
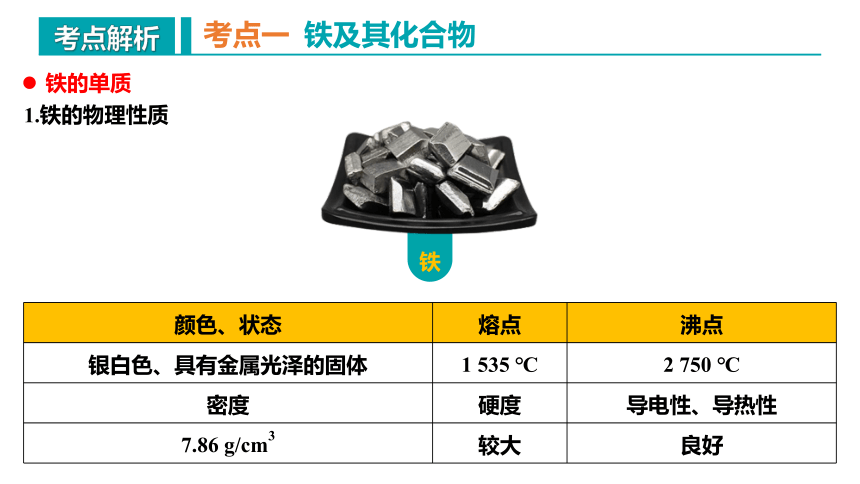
颜色、状态 熔点 沸点
银白色、具有金属光泽的固体 1 535 ℃ 2 750 ℃
密度 硬度 导电性、导热性
7.86 g/cm3 较大 良好
考点一 铁及其化合物
1.铁的物理性质
铁的单质
铁
铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价
考点一 铁及其化合物
2.铁的化学性质
铁的单质
Fe与非金属单质反应
2Fe+3Cl2 2FeCl3
加热
3Fe+2O2 Fe3O4
点燃
Fe+S FeS
加热
Fe与非氧化性酸反应
Fe+H2SO4 === FeSO4+H2↑
Fe与盐溶液反应
Fe+CuSO4 === Cu+FeSO4
铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价
考点一 铁及其化合物
2.铁的化学性质
铁的单质
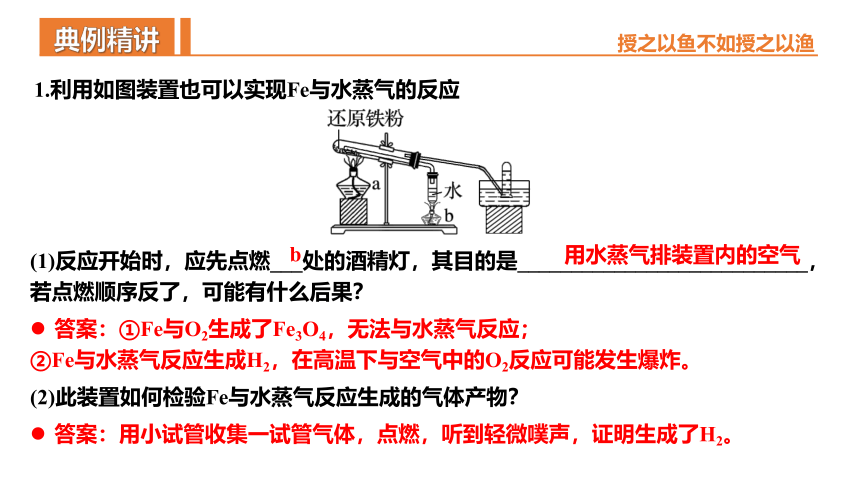
铁粉与水蒸气反应
3Fe+4H2O(g) Fe3O4+4H2
高温
(1)反应开始时,应先点燃___处的酒精灯,其目的是___________________________,若点燃顺序反了,可能有什么后果?
1.利用如图装置也可以实现Fe与水蒸气的反应
b
用水蒸气排装置内的空气
答案:①Fe与O2生成了Fe3O4,无法与水蒸气反应;
②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸。
(2)此装置如何检验Fe与水蒸气反应生成的气体产物?
答案:用小试管收集一试管气体,点燃,听到轻微噗声,证明生成了H2。
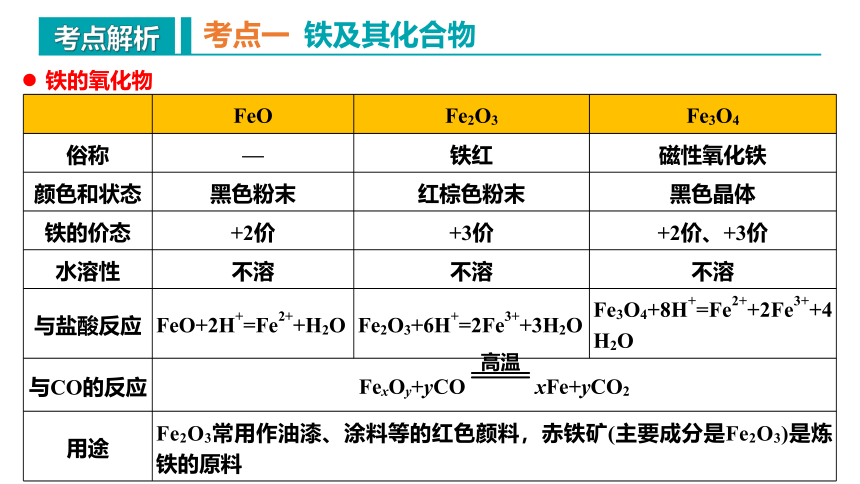
FeO Fe2O3 Fe3O4
俗称 — 铁红 磁性氧化铁
颜色和状态 黑色粉末 红棕色粉末 黑色晶体
铁的价态 +2价 +3价 +2价、+3价
水溶性 不溶 不溶 不溶
与盐酸反应 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O Fe3O4+8H+=Fe2++2Fe3++4H2O
与CO的反应 FexOy+yCO xFe+yCO2
用途 Fe2O3常用作油漆、涂料等的红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料
考点一 铁及其化合物
铁的氧化物
高温
2.(2023上·河北石家庄·高三石家庄精英中学阶段练习)铁元素化合物种类繁多,下列说法正确的是
A.FeCl3溶液中通入少量H2S气体可得到Fe2+
B.FeO不稳定,在空气里受热,能迅速被氧化成Fe2O3
C.若待测液中滴加2滴KSCN溶液出现红色沉淀,则待测液中含有Fe3+离子
D.Fe3O4可改写为FeO Fe2O3从分类角度来看Fe3O4属于混合物
【答案】A
【详解】A. Fe3+与硫离子发生氧化还原反应,Fe3+作氧化剂,生成Fe2+,故A正确;
B. FeO不稳定,在空气里受热,能被氧化成Fe3O4,故B错误;
C. Fe3+离子与KSCN溶液反应现象为溶液变为血红色,不会出现红色沉淀,故C错误;
D. Fe3O4属于氧化物,故D错误;
故选A。
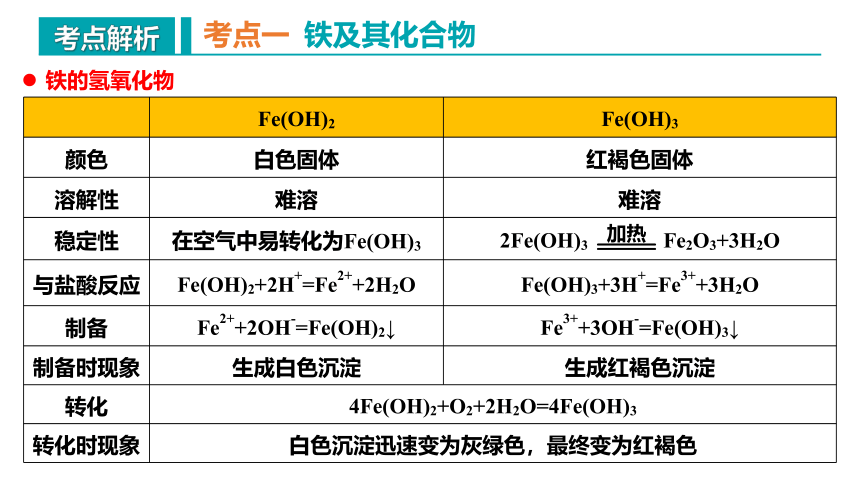
Fe(OH)2 Fe(OH)3
颜色 白色固体 红褐色固体
溶解性 难溶 难溶
稳定性 在空气中易转化为Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O
与盐酸反应 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
制备 Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓
制备时现象 生成白色沉淀 生成红褐色沉淀
转化 4Fe(OH)2+O2+2H2O=4Fe(OH)3
转化时现象 白色沉淀迅速变为灰绿色,最终变为红褐色
考点一 铁及其化合物
铁的氢氧化物
加热
3.(2023上·河北邢台·高一邢台市第二中学校联考阶段练习)某化学兴趣小组按如图装置进行实验,反应开始时打开弹簧夹,当点燃从a口出来的气体无爆鸣声时关闭弹簧夹,此时剩余少量的钠,下列说法错误的是
A.橡皮管能起到平衡气压的作用
B.关闭弹簧夹后,打开分液漏斗活塞,剩余的少量钠能置换出单质铁
C.关闭弹簧夹后,打开分液漏斗活塞,锥形瓶内能观察到白色絮状沉淀
D.反应结束后,打开锥形瓶的橡胶塞,能观察到有红褐色沉淀产生
【答案】B
【详解】A.钠与水反应生成氢气,造成锥形瓶内压强过大,为了维持压强平衡,连接橡皮管,A正确;
B.钠与水反应生成氢氧化钠和氢气,生成的氢氧化钠与氯化亚铁反应生成氢氧化亚铁沉淀,B错误;
C.钠与水反应生成氢氧化钠和氢气,生成的氢氧化钠与氯化亚铁反应生成氢氧化亚铁为白色絮状物,C正确;
D.白色氢氧化亚铁不稳定,遇到空气与空气中氧气结合生成氢氧化铁红褐色沉淀,D正确;
考点一 铁及其化合物
Fe(OH)2的制备
1.制备原理
(1)可溶性亚铁盐(如FeSO4)与强碱(如NaOH)溶液反应:Fe2++2OH-=Fe(OH)2↓。
(2)白色沉淀Fe(OH)2很容易被O2氧化为红褐色的Fe(OH)3。因此实验过程中一定要防止生成的Fe(OH)2被氧化,应与O2隔绝。
2.防止Fe(OH)2被氧化的措施
(1)将用于配制溶液的蒸馏水煮沸,使O2逸出。
(2)将盛有NaOH溶液的胶头滴管尖嘴插入试管中亚铁盐溶液底部(不接触试管底),并慢慢挤出NaOH溶液。
(3)在试管中亚铁盐溶液的上方充入保护气,如H2、N2、稀有气体等。
(4)在试管中亚铁盐溶液上面加保护层,如苯(密度小于水,与水不互溶)、植物油等。
3.常见实验装置
考点一 铁及其化合物
Fe(OH)2的制备
4.(2022上·山西太原·高一统考期末)在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是
A. B. C. D.
【答案】C
【详解】A.NaOH溶液加入时会带入氧气,会氧化氢氧化亚铁变为氢氧化铁,不能成功得到氢氧化亚铁,故A不符合题意;
B.氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,不能得到氢氧化亚铁沉淀,故B不符合题意;
C.装置是利用铁和稀硫酸现制FeSO4,并用产生的H2赶走试管和溶液中的氧气,故C符合题意;
D.氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁沉淀,胶头滴管伸入到液面以下,暂时隔绝氧气,但是不能较长时间保存Fe(OH)2,故D不符合题意。
1.Fe2+、Fe3+的检验方法
考点一 铁及其化合物
铁盐和亚铁盐
Fe3+的检验方法
Fe2+的检验方法
产生红褐色沉淀
含有Fe3+
溶液呈红色
NaOH溶液
KSCN溶液
未知
溶液
产生白色沉淀,然后迅速变成灰绿色,最后变成红褐色
含有Fe2+
溶液不变红
NaOH溶液
KSCN溶液
未知
溶液
K3[Fe(CN)6]溶液
氯水
溶液呈红色
有蓝色沉淀生成
1.Fe2+、Fe3+的检验方法
考点一 铁及其化合物
铁盐和亚铁盐
同时含有Fe2+、Fe3+的检验方法
溶液变红色
含有Fe3+
溶液紫色褪去
KSCN溶液
酸性高锰酸钾溶液
未知
溶液
K3[Fe(CN)6]溶液
有蓝色沉淀生成
含有Fe2+
含有Fe2+
注意Cl-的干扰
5.(2022上·江苏无锡·高一统考期末)一定条件下,将一定量Fe3O4溶于过量盐酸生成FeCl2和FeCl3, 分别取少量反应后的溶液进行以下实验,有关实验描述正确的是
A.滴加KSCN溶液,若溶液变红色证明溶液中含有Fe3+
B.加入5.6g铁粉恰好完全反应,则Fe3O4的质量为23.2g
C.用溶液在铜片上写字,一段时间后洗去溶液,观察到铜片表面无明显现象
D.先向溶液中通入氯气,再滴加KSCN溶液,若变红色证明溶液中含有Fe2+
【答案】A
【详解】A.三价铁遇到硫氰化钾后溶液会变成红色,故滴加KSCN溶液,若溶液变红色证明溶液中含有Fe3+,A正确;
B.原溶液中盐酸有剩余,加入铁粉后会和盐酸反应,故无法通过铁的量计算四氧化三铁的量,B错误;;
C.溶液中有三价铁离子,可以和铜单质反应,故用溶液在铜片上写字,一段时间后洗去溶液,会发现有铜被溶解,C错误;
D.溶液变红也可能是原来溶液中就有三价铁而使溶液变红,D错误;
2.Fe2+与Fe3+的转化
实验操作
现象 溶液由棕黄色变为浅绿色 溶液无明显变化 溶液变成红色
离子反应 2Fe3++Fe=3Fe2+,2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3
结论 Fe3+ Fe2+
考点一 铁及其化合物
铁盐和亚铁盐
KSCN溶液
氯水
6.(2021上·河南濮阳·高一范县第一中学校考阶段练习)某同学进行下列实验,其中X、Y可能为
A.氯水、铜粉
B.过氧化氢溶液、铁粉
C.高锰酸钾溶液、氢气
D.氢氧化钠溶液、硫氢化钾溶液
实验编号 实验目的 选用试剂
1 除去FeCl3溶液中的FeCl2杂质 试剂X
2 除去FeCl2溶液中的FeCl3杂质 试剂Y
【答案】B
【详解】A.铜与氯化铁反应生成氯化亚铁和氯化铜,会引入氯化铜杂质,A错误;
B.过氧化氢溶液能将氯化亚铁氧化为氯化铁,铁能与氯化铁反应生成氯化亚铁,B正确;
C.高锰酸钾溶液能将亚铁离子氧化为铁离子,但引入了锰离子、钾离子,且氢气不能与氯化铁反应,C错误;
D.氢氧化钠溶液能与氯化亚铁反应生成氢氧化亚铁沉淀、能与氯化铁反应生成氢氧化铁沉淀,硫氰化钾溶液常用于检验铁离子的存在,不做除杂试剂,D错误;
从类别角度分析,Fe属于金属单质,具有金属单质的通性;
从价态角度分析,Fe处于最低价态,只有还原性,可以被氧化剂氧化为Fe2+、Fe3+。
考点一 铁及其化合物
利用“价类二维图”理解铁及其化合物之间的转化
单质
氧化物
碱
盐
Fe3O4
Fe2O3
FeO
铁元素化合价
物质类别
Fe
0
+2
+3
Fe(OH)3
Fe2+
Fe3+
Fe(OH)2
7.(2022上·四川内江·高一四川省内江市第六中学校考阶段练习)图为铁及其化合物的“价—类”二维图。利用如图可以从不同角度研究含铁物质的性质及其转化关系。下列分析结果不正确的是
A.二维图缺失的类别①应填“单质”,化学式②应填“Fe(OH)3”
B.从物质类别分析,Fe2O3属于碱性氧化物,可以与稀HCl反应
C.从化合价角度分析,FeCl2具有还原性,可以使酸性高锰酸钾溶液褪色
D.从物质转化角度分析,Fe2O3和FeCl3都可以通过一步反应直接转化成②
【答案】D
【详解】A.铁单质的化合价为0,二维图缺失的类别①单质;三价铁形成的氢氧化物是氢氧化铁,则化学式②Fe(OH)3,故A正确;
B.从物质类别分析,Fe2O3属于碱性氧化物,可以与稀HCl反应生成氯化铁和水,故B正确;
C.从化合价角度分析,FeCl2具有还原性,可以使酸性高锰酸钾溶液褪色发生氧化还原反应,故C正确;
D.氧化铁是碱性氧化物,不溶于水不能一步反应生成氢氧化铁,FeCl3可以通过一步反应和氢氧化钠溶液反应,直接转化成氢氧化铁,故D错误;
故选:D。
考点二
金属材料
考点二 金属材料
合金
在金属中加热熔合某些金属或非金属制得的具有金属特征的混合物。
物理变化
故合金中各成分保持各自原有的化学性质
1.定义
2.性能
硬度
合金的硬度一般大于成分金属
熔点
合金的熔点多数低于成分金属
其他
性质
合金的性能并不是各成分金属性能的总和,合金具有许多优良的物理、化学及机械性能
考点二 金属材料
几种重要的合金
1.铁合金
生铁
铁、碳(含碳量2%~4.3%)
韧性好,强度低
碳素钢
强度高,韧性及加工性好
硬而脆,热处理后弹性好
钢
低碳钢
中碳钢
高碳钢
合金钢
不锈钢是最常见的一种合金钢
含碳量降低
化学成分
在碳素钢中加入铬、锰、钨、镍、钼、钴、硅等元素(种类多,性能差别大)
8.(2023下·河北保定·高二校联考期末)《天工开物》中记载:“凡治地生物,用锄、镈之属,熟铁锻成,熔化生铁淋口,入水淬健,即成刚劲。每锹、锄重一斤者,淋生铁三钱为率。少则不坚,多则过刚而折。”下列说法错误的是
A.熟铁是含碳的铁合金
B.熟铁的硬度比生铁低
C.生铁质地较硬但是韧性较差
D.生铁的熔点比熟铁的高
【答案】D
【详解】A.熟铁是含碳的铁合金,故A正确;
B.生铁含碳量较高,熟铁含碳量较低,硬度比生铁低,故B正确;
C.生铁含碳量较高,质地较硬但是韧性较差,故C正确;
D.生铁含碳量较高,熟铁含碳量较低,生铁的熔点比熟铁的低,故D错误;
分类 主要组成元素 主要特性 主要用途
硬铝 Al、Mg、Cu、Si、Mn
等(Mg 0.5%、Cu 4%、
Si 0.7%、Mn 0.5%) 密度小,强度高,具有较强的抗腐蚀能力 用于汽车、飞机、火
箭、轮船等制造业
镁铝 合金 Mg、Al 强度和硬度都比纯铝
和纯镁的大 用于火箭、飞机、轮
船等制造业
考点二 金属材料
几种重要的合金
2.铝合金
考点二 金属材料
几种重要的合金
3.新型合金
能够大量吸收氢气,并与氢气结合成金属氢化物
储氢合金
钛合金
航空航天、生物工程、电子工业
耐热合金
形状记忆合金
储氢量大,金属氢化物既容易形成,稍稍加热又容易分解,室温下吸氢、放氢速率快
作用
要求
应用
9.(2023·广东·高三学业考试)2022年10月,长征五号B运载火箭成功将“梦天”实验舱送入预定轨道。该火箭用到大量铝合金材料,下列性质与铝合金材料的航天应用无关的是
A.低密度 B.耐酸蚀 C.耐磨损 D.强韧性
【答案】B
【详解】A.铝合金材料的密度比较小,用于航天应用可以减少能源的使用,因此与其低密度的性质有关,A不符合题意;
B.铝合金与空气及酸接触时,会在金属表面产生一层致密的氧化物保护膜,阻止金属的进一步氧化,因此具有一定的抗腐蚀能力,其用于制航天器与其耐酸蚀的性质无关,B符合题意;
C.铝合金材料比其成分金属具有强的抗腐蚀能力,因此该耐磨损的性质可用于航天事业,C不符合题意;
D.铝合金材料具有一定的韧性,抗应变能力强,其强韧性可应用于作航天器,D不符合题意;
故合理选项是B。
1.铝与O2反应
在常温下Al能与空气中的O2发生反应:4Al+3O2=2Al2O3
2.铝与酸、碱的反应
考点二 金属材料
铝和氧化铝
2Al + 6H+ 2Al3+ + 3H2↑
2Al+2NaOH+6H2O=== 2Na[Al(OH)4]+3H2↑
铝与盐酸反应
铝与氢氧化钠溶液反应
Al和NaOH溶液的反应中,Al是还原剂,H2O是氧化剂,其电子转移可表示为:
10.(2023下·上海黄浦·高一上海市大同中学校考期末)按图所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列两种情况:
①用铝箔包住钠、②用铜箔包住钠。则收集产生的气体在相同条件下体积的关系是
A.二者收集气体一样多
B.①收集气体体积较大
C.②收集气体体积较大
D.无法确定
【答案】B
【详解】Na 和H2O 反应2Na+2H2O=2NaOH+H2↑,产生H2的同时产生NaOH ,NaOH可以和A1发生反应: ,故用铝箔包住Na 时产生H2的体积较大,因此①收集气体体积较大,故选B。
考点二 金属材料
铝和氧化铝
3.铝与酸、碱反应生成H2的量的关系
①等量的铝分别与足量的盐酸和NaOH溶液反应,产生H2的量相等,此时消耗HCl与NaOH的物质的量之比为3∶1
(1)量的关系
定量关系
②足量的铝分别与等物质的量的HCl和NaOH反应,产生H2的物质的量之比为1∶3,此时消耗铝的物质的量之比也为1∶3
③一定量的铝分别与一定量的盐酸和NaOH溶液反应,若 < <1,则必定有:铝与盐酸反应时,铝过量而盐酸不足;铝与NaOH溶液反应时,铝不足而NaOH过量
11.(2023上·河北张家口·高一统考期末)在航空航天领域,有“一代飞机、一代材料”的说法,新材料的应用是航空技术发展和进步的最重要推动力之一、国产C919飞机上,我国首次大范围使用第三代铝锂合金,助力C919综合减重7%。足量的铝分别与等物质的量浓度的盐酸和氢氧化钠溶液反应,放出的氢气在同温同压下体积之比为1∶2,则消耗盐酸与氢氧化钠溶液的体积比为
A.1∶3 B.1∶1 C.2∶3 D.3∶2
【答案】D
【详解】由化学方程式:2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2AlO2-+3H2↑,足量的铝分别与等物质的量浓度的盐酸和氢氧化钠溶液反应,放出的氢气在同温同压下体积之比为1∶2,则消耗盐酸和氢氧化钠的物质的量之比为3∶2,由于二者浓度相等,故消耗等物质的量浓度的盐酸和氢氧化钠溶液的体积比为3∶2,故选D。
(1)两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物
(2)Al2O3与酸、碱的反应 (典型的两性氧化物)
3.氧化铝
考点二 金属材料
铝和氧化铝
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-+3H2O===2[Al(OH)4]-
氧化铝与盐酸反应
氧化铝与氢氧化钠溶液反应
铝的生产原理
金属铝的冶炼
示意图
铝土矿
提纯
氧化铝
萤石
制备
冰晶石
石油焦
沥青焦
制备
碳素电极
电解
液态铝
铝锭
氧化铝的熔点高(2050℃),加入冰晶石(Na3AlF6)能够溶解氧化铝而又能降低其熔点,而且冰晶石在电解温度下不被分解,并有足够的流动性,有利于进行电解。
考点二 金属材料
铝土矿中提取铝工艺路线
途径一
Al2O3
Fe2O3
SiO2
Al3+、Fe3+
Fe(OH)3
AlO2-
Al(OH)3
加HCl后过
滤
SiO2
Al2O3
加NaOH后过
滤
过量
CO2
灼烧
电解
Al
Al2O3+6HCl=
2AlCl3+3H2O
AlCl3+4NaOH=
NaAlO2+3NaCl+2H2O
FeCl3+3NaOH=
Fe(OH)3↓+3NaCl
HCl+NaOH=NaCl+H2O
Fe2O3+6HCl=
2FeCl3+3H2O
Na[Al(OH)4]+CO2=Al(OH)3↓+NaHCO3
NaOH+CO2=NaHCO3
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
考点二 金属材料
金属铝的冶炼
铝土矿中提取铝工艺路线
途径一
问题探讨
不是NaHCO3而是Na2CO3。
不能,原因是Al3+与过量氨水反应生成Al(OH)3沉淀,达不到分离Al3+、Fe3+的目的。
能否用氨水代替NaOH 溶液
探讨一
探讨二
若将CO 的量改为“少量”,得到的产物还是NaHCO3吗
考点二 金属材料
金属铝的冶炼
铝土矿中提取铝工艺路线
途径二
Al2O3
Fe2O3
SiO2
AlO2-、SiO3-
H2SiO3
Al3+
Al(OH)3
NH3 H2O
加NaOH后过
滤
Fe2O3
Al2O3
加HCl后过
滤
灼烧
电解
Al
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
SiO2+2NaOH
=NaSiO3+H2O
Na2SiO3+2HCl
=H2SiO3↓+2NaCl
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
NaOH+HCl=NaCl+H2O
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
HCl+NH3·H2O=NH4Cl+H O
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
考点二 金属材料
金属铝的冶炼
铝土矿中提取铝工艺路线
途径一
问题探讨
不合适,因为Al(OH)3能溶于NaOH。
不合适,因为过量CO2与Na[Al(OH)4]、Na2SiO3反应生成Al(OH)3和H2SiO3沉淀,达不到分离SiO2和Al2O3的目的。
能否将将盐酸改为CO2
探讨一
探讨二
将氨水改为“NaOH溶液”合适吗
AlCl3是共价化合物,其熔融状态不导电,不能电解制铝。
探讨三
冶炼金属铝能否用氯化铝代替氧化铝
考点二 金属材料
金属铝的冶炼
12.(2023上·广东中山·高一中山市华侨中学校考阶段练习)某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、Al2O3、CuO和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al、绿矾等。回答下列问题:
【已知:焙烧主要除去可燃性有机物】
(1)灼烧需要的主要仪器有 。操作Ⅲ的名称是 。
(2)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是 。
(3)碱浸时发生反应的化学方程式为 、 。
【详解】(1)灼烧需要的主要仪器有坩埚(酒精灯、三脚架、泥三角、坩埚钳)。操作Ⅲ为从溶液得到晶体,名称是蒸发浓缩、冷却结晶、过滤。
(2)操作Ⅰ、Ⅱ为过滤,使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是漏斗。
(3)铝、氧化铝均可以和氢氧化钠反应,则碱浸时发生反应的化学方程式为
12.(2023上·广东中山·高一中山市华侨中学校考阶段练习)某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、Al2O3、CuO和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al、绿矾等。回答下列问题:
(4)滤液Ⅰ与试剂b发生反应的化学方程式为 。
(5)制取的绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体8.22g溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测晶体中n(Fe2+)/ n(Fe3+) 。
(4)滤液Ⅰ与试剂b为偏铝酸根离子和二氧化碳的反应,发生反应的化学方程式为
2Na + 2H2O === 2NaOH + H2↑
物质的量在化学方程式计算中的应用
化学方程式中化学计量数与相关物理量的关系
2
∶
∶
∶
2
2
1
化学计量数之比:
2 mol
物质的量之比:
∶
∶
∶
2 mol
2 mol
1 mol
2 NA
扩大NA倍:
∶
∶
∶
2 NA
2 NA
1 NA
∶
∶
∶
扩大6.02×1023倍:
2×6.02×1023
2×6.02×1023
2×6.02×1023
1×6.02×1023
2 mol
STP气体体积之比:
∶
∶
∶
2 mol
2 mol
1 mol
考点二 金属材料
化学方程式中各物质的化学计量数之比等于其_________之比,等于其__________之比。
粒子数目
物质的量
体积
物质的量在化学方程式计算中的应用
化学方程式中化学计量数与相关物理量的关系
对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其_____之比。
结论
考点二 金属材料
物质的量在化学方程式计算中的应用
物质的量应用于化学方程式计算的基本步骤
NO.1
NO.2
NO.3
NO.4
设未知量,统一规定符号,如物质的量(n)
写出反应的化学方程式或离子方程式,注意配平
找出已知量与未知量的关系,并写在对应物质的正下方
列比例式,求解
NO.5
检查无误后,写出简明答案
考点二 金属材料
【例1】5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况的体积是多少?
设:生成标准状况下氢气的物质的量为n(H2)
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 3
0.2 mol n(H2)
n(H2)=0.3 mol
答:生成标准状况下氢气的体积是6.72 L。
V(H2)=n(H2)·Vm
=0.3 mol×22.4 L·mol-1
=6.72 L
题型一 已知量、未知量均以物质的量计算
【例2】医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成氧化铁,则需要消耗标况下氧气的体积为多少?
设:需要消耗标况下氧气的体积为V(O2)
由反应方程式
4Fe + 3O2===2Fe2O3
4×56 g 3×22.4 L
56 g V(O2)
答:需要消耗标况下氧气的体积为16.8 L。
题型二 已知量、未知量单位不一致的计算
设未知量时不带单位,已知量和未知量单位统一;
化学方程式要书写正确。要注意配平、化学方程式的完整(注明反应条件、气体和沉淀的符号);
相对分子质量要计算正确,且需乘化学式前面的系数;
已知量和未知量的位置要写对。
解题步骤规范,过程完整。
注意事项
物质的量在化学方程式计算中的应用
考点二 金属材料
方法一:关系式法——解答连续反应类型计算题的捷径
化学计算中的常用方法
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
根据化学方程式确定关系式
根据原子守恒确定关系式
考点二 金属材料
【例3】把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,那么参加反应的CO的质量是 g。
2.8
解析 (1)根据化学方程式确定关系:
CO2+Ca(OH)2===CaCO3↓+H2O
则关系式为3CO~3CO2~3CaCO3
即CO~CaCO3
(2)利用关系式进行计算
CO ~ CaCO3
28 100
m(CO) 10 g
m(CO)=2.8 g
常用方法一 关系式法
方法二:守恒法——质量守恒、电荷守恒、电子守恒
化学计算中的常用方法
A
反应前后元素种类、质量、原子个数不变
B
还原剂失电子总数=氧化剂得电子总数
考点二 金属材料
【例4】 4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
10.6
解析 钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
常用方法二 守恒法
【例5】用1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-2 mol的XO4-还原,已知氧化产物为SO42-,则元素X在还原产物中的化合价为 ___。
+4
解析 氧化还原反应中得失电子总数相等,设元素X在还原产物中的化合价为x,则有:
1 mol·L-1×0.03 L×(6-4)=2×10-2 mol×(7-x),
解得x=+4。
常用方法二 守恒法
方法三:差量法——质量差值法、体积差值法
化学计算中的常用方法
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。差量法就是借助这种比例关系求解的方法。
Δm
Δn
ΔV
考点二 金属材料
【例6】把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
28 g
解析 Fe+CuSO4===FeSO4+Cu Δm
56 g 64 g 64 g-56 g=8 g
m(Fe) 4 g
常用方法三 差量法
方法四:方程组法——两个已知量求解混合物中两种物质的未知量
化学计算中的常用方法
一般方程组法用于解决两种物质的混合物计算,一般读题时能找到两个已知量时,均可以利用二元一次方程组进行求算未知量。
考点二 金属材料
【例7】把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。
消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol
(2)该混合物中铝、铁的物质的量。
设Al、Fe的物质的量分别为x、y。
2Al + 6HCl===2AlCl3+3H2↑
2 6
x 3x
解得:x=0.02 mol,y=0.01 mol
即n(Al)=0.02 mol;n(Fe)=0.01 mol
Fe + 2HCl===FeCl2+H2↑
1 2
y 2y
常用方法三 方程组法
THANKS
单元考点串讲
第三章 铁 金属材料
第三章
铁 金属材料
铁及其化合物
金属材料
铁的单质
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
合金
铁合金
铝和铝合金
新型合金
物质的量在化学方程式计算中的应用
考点一
铁及其化合物
颜色、状态 熔点 沸点
银白色、具有金属光泽的固体 1 535 ℃ 2 750 ℃
密度 硬度 导电性、导热性
7.86 g/cm3 较大 良好
考点一 铁及其化合物
1.铁的物理性质
铁的单质
铁
铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价
考点一 铁及其化合物
2.铁的化学性质
铁的单质
Fe与非金属单质反应
2Fe+3Cl2 2FeCl3
加热
3Fe+2O2 Fe3O4
点燃
Fe+S FeS
加热
Fe与非氧化性酸反应
Fe+H2SO4 === FeSO4+H2↑
Fe与盐溶液反应
Fe+CuSO4 === Cu+FeSO4
铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价
考点一 铁及其化合物
2.铁的化学性质
铁的单质
铁粉与水蒸气反应
3Fe+4H2O(g) Fe3O4+4H2
高温
(1)反应开始时,应先点燃___处的酒精灯,其目的是___________________________,若点燃顺序反了,可能有什么后果?
1.利用如图装置也可以实现Fe与水蒸气的反应
b
用水蒸气排装置内的空气
答案:①Fe与O2生成了Fe3O4,无法与水蒸气反应;
②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸。
(2)此装置如何检验Fe与水蒸气反应生成的气体产物?
答案:用小试管收集一试管气体,点燃,听到轻微噗声,证明生成了H2。
FeO Fe2O3 Fe3O4
俗称 — 铁红 磁性氧化铁
颜色和状态 黑色粉末 红棕色粉末 黑色晶体
铁的价态 +2价 +3价 +2价、+3价
水溶性 不溶 不溶 不溶
与盐酸反应 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O Fe3O4+8H+=Fe2++2Fe3++4H2O
与CO的反应 FexOy+yCO xFe+yCO2
用途 Fe2O3常用作油漆、涂料等的红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料
考点一 铁及其化合物
铁的氧化物
高温
2.(2023上·河北石家庄·高三石家庄精英中学阶段练习)铁元素化合物种类繁多,下列说法正确的是
A.FeCl3溶液中通入少量H2S气体可得到Fe2+
B.FeO不稳定,在空气里受热,能迅速被氧化成Fe2O3
C.若待测液中滴加2滴KSCN溶液出现红色沉淀,则待测液中含有Fe3+离子
D.Fe3O4可改写为FeO Fe2O3从分类角度来看Fe3O4属于混合物
【答案】A
【详解】A. Fe3+与硫离子发生氧化还原反应,Fe3+作氧化剂,生成Fe2+,故A正确;
B. FeO不稳定,在空气里受热,能被氧化成Fe3O4,故B错误;
C. Fe3+离子与KSCN溶液反应现象为溶液变为血红色,不会出现红色沉淀,故C错误;
D. Fe3O4属于氧化物,故D错误;
故选A。
Fe(OH)2 Fe(OH)3
颜色 白色固体 红褐色固体
溶解性 难溶 难溶
稳定性 在空气中易转化为Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O
与盐酸反应 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
制备 Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓
制备时现象 生成白色沉淀 生成红褐色沉淀
转化 4Fe(OH)2+O2+2H2O=4Fe(OH)3
转化时现象 白色沉淀迅速变为灰绿色,最终变为红褐色
考点一 铁及其化合物
铁的氢氧化物
加热
3.(2023上·河北邢台·高一邢台市第二中学校联考阶段练习)某化学兴趣小组按如图装置进行实验,反应开始时打开弹簧夹,当点燃从a口出来的气体无爆鸣声时关闭弹簧夹,此时剩余少量的钠,下列说法错误的是
A.橡皮管能起到平衡气压的作用
B.关闭弹簧夹后,打开分液漏斗活塞,剩余的少量钠能置换出单质铁
C.关闭弹簧夹后,打开分液漏斗活塞,锥形瓶内能观察到白色絮状沉淀
D.反应结束后,打开锥形瓶的橡胶塞,能观察到有红褐色沉淀产生
【答案】B
【详解】A.钠与水反应生成氢气,造成锥形瓶内压强过大,为了维持压强平衡,连接橡皮管,A正确;
B.钠与水反应生成氢氧化钠和氢气,生成的氢氧化钠与氯化亚铁反应生成氢氧化亚铁沉淀,B错误;
C.钠与水反应生成氢氧化钠和氢气,生成的氢氧化钠与氯化亚铁反应生成氢氧化亚铁为白色絮状物,C正确;
D.白色氢氧化亚铁不稳定,遇到空气与空气中氧气结合生成氢氧化铁红褐色沉淀,D正确;
考点一 铁及其化合物
Fe(OH)2的制备
1.制备原理
(1)可溶性亚铁盐(如FeSO4)与强碱(如NaOH)溶液反应:Fe2++2OH-=Fe(OH)2↓。
(2)白色沉淀Fe(OH)2很容易被O2氧化为红褐色的Fe(OH)3。因此实验过程中一定要防止生成的Fe(OH)2被氧化,应与O2隔绝。
2.防止Fe(OH)2被氧化的措施
(1)将用于配制溶液的蒸馏水煮沸,使O2逸出。
(2)将盛有NaOH溶液的胶头滴管尖嘴插入试管中亚铁盐溶液底部(不接触试管底),并慢慢挤出NaOH溶液。
(3)在试管中亚铁盐溶液的上方充入保护气,如H2、N2、稀有气体等。
(4)在试管中亚铁盐溶液上面加保护层,如苯(密度小于水,与水不互溶)、植物油等。
3.常见实验装置
考点一 铁及其化合物
Fe(OH)2的制备
4.(2022上·山西太原·高一统考期末)在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是
A. B. C. D.
【答案】C
【详解】A.NaOH溶液加入时会带入氧气,会氧化氢氧化亚铁变为氢氧化铁,不能成功得到氢氧化亚铁,故A不符合题意;
B.氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,不能得到氢氧化亚铁沉淀,故B不符合题意;
C.装置是利用铁和稀硫酸现制FeSO4,并用产生的H2赶走试管和溶液中的氧气,故C符合题意;
D.氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁沉淀,胶头滴管伸入到液面以下,暂时隔绝氧气,但是不能较长时间保存Fe(OH)2,故D不符合题意。
1.Fe2+、Fe3+的检验方法
考点一 铁及其化合物
铁盐和亚铁盐
Fe3+的检验方法
Fe2+的检验方法
产生红褐色沉淀
含有Fe3+
溶液呈红色
NaOH溶液
KSCN溶液
未知
溶液
产生白色沉淀,然后迅速变成灰绿色,最后变成红褐色
含有Fe2+
溶液不变红
NaOH溶液
KSCN溶液
未知
溶液
K3[Fe(CN)6]溶液
氯水
溶液呈红色
有蓝色沉淀生成
1.Fe2+、Fe3+的检验方法
考点一 铁及其化合物
铁盐和亚铁盐
同时含有Fe2+、Fe3+的检验方法
溶液变红色
含有Fe3+
溶液紫色褪去
KSCN溶液
酸性高锰酸钾溶液
未知
溶液
K3[Fe(CN)6]溶液
有蓝色沉淀生成
含有Fe2+
含有Fe2+
注意Cl-的干扰
5.(2022上·江苏无锡·高一统考期末)一定条件下,将一定量Fe3O4溶于过量盐酸生成FeCl2和FeCl3, 分别取少量反应后的溶液进行以下实验,有关实验描述正确的是
A.滴加KSCN溶液,若溶液变红色证明溶液中含有Fe3+
B.加入5.6g铁粉恰好完全反应,则Fe3O4的质量为23.2g
C.用溶液在铜片上写字,一段时间后洗去溶液,观察到铜片表面无明显现象
D.先向溶液中通入氯气,再滴加KSCN溶液,若变红色证明溶液中含有Fe2+
【答案】A
【详解】A.三价铁遇到硫氰化钾后溶液会变成红色,故滴加KSCN溶液,若溶液变红色证明溶液中含有Fe3+,A正确;
B.原溶液中盐酸有剩余,加入铁粉后会和盐酸反应,故无法通过铁的量计算四氧化三铁的量,B错误;;
C.溶液中有三价铁离子,可以和铜单质反应,故用溶液在铜片上写字,一段时间后洗去溶液,会发现有铜被溶解,C错误;
D.溶液变红也可能是原来溶液中就有三价铁而使溶液变红,D错误;
2.Fe2+与Fe3+的转化
实验操作
现象 溶液由棕黄色变为浅绿色 溶液无明显变化 溶液变成红色
离子反应 2Fe3++Fe=3Fe2+,2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3
结论 Fe3+ Fe2+
考点一 铁及其化合物
铁盐和亚铁盐
KSCN溶液
氯水
6.(2021上·河南濮阳·高一范县第一中学校考阶段练习)某同学进行下列实验,其中X、Y可能为
A.氯水、铜粉
B.过氧化氢溶液、铁粉
C.高锰酸钾溶液、氢气
D.氢氧化钠溶液、硫氢化钾溶液
实验编号 实验目的 选用试剂
1 除去FeCl3溶液中的FeCl2杂质 试剂X
2 除去FeCl2溶液中的FeCl3杂质 试剂Y
【答案】B
【详解】A.铜与氯化铁反应生成氯化亚铁和氯化铜,会引入氯化铜杂质,A错误;
B.过氧化氢溶液能将氯化亚铁氧化为氯化铁,铁能与氯化铁反应生成氯化亚铁,B正确;
C.高锰酸钾溶液能将亚铁离子氧化为铁离子,但引入了锰离子、钾离子,且氢气不能与氯化铁反应,C错误;
D.氢氧化钠溶液能与氯化亚铁反应生成氢氧化亚铁沉淀、能与氯化铁反应生成氢氧化铁沉淀,硫氰化钾溶液常用于检验铁离子的存在,不做除杂试剂,D错误;
从类别角度分析,Fe属于金属单质,具有金属单质的通性;
从价态角度分析,Fe处于最低价态,只有还原性,可以被氧化剂氧化为Fe2+、Fe3+。
考点一 铁及其化合物
利用“价类二维图”理解铁及其化合物之间的转化
单质
氧化物
碱
盐
Fe3O4
Fe2O3
FeO
铁元素化合价
物质类别
Fe
0
+2
+3
Fe(OH)3
Fe2+
Fe3+
Fe(OH)2
7.(2022上·四川内江·高一四川省内江市第六中学校考阶段练习)图为铁及其化合物的“价—类”二维图。利用如图可以从不同角度研究含铁物质的性质及其转化关系。下列分析结果不正确的是
A.二维图缺失的类别①应填“单质”,化学式②应填“Fe(OH)3”
B.从物质类别分析,Fe2O3属于碱性氧化物,可以与稀HCl反应
C.从化合价角度分析,FeCl2具有还原性,可以使酸性高锰酸钾溶液褪色
D.从物质转化角度分析,Fe2O3和FeCl3都可以通过一步反应直接转化成②
【答案】D
【详解】A.铁单质的化合价为0,二维图缺失的类别①单质;三价铁形成的氢氧化物是氢氧化铁,则化学式②Fe(OH)3,故A正确;
B.从物质类别分析,Fe2O3属于碱性氧化物,可以与稀HCl反应生成氯化铁和水,故B正确;
C.从化合价角度分析,FeCl2具有还原性,可以使酸性高锰酸钾溶液褪色发生氧化还原反应,故C正确;
D.氧化铁是碱性氧化物,不溶于水不能一步反应生成氢氧化铁,FeCl3可以通过一步反应和氢氧化钠溶液反应,直接转化成氢氧化铁,故D错误;
故选:D。
考点二
金属材料
考点二 金属材料
合金
在金属中加热熔合某些金属或非金属制得的具有金属特征的混合物。
物理变化
故合金中各成分保持各自原有的化学性质
1.定义
2.性能
硬度
合金的硬度一般大于成分金属
熔点
合金的熔点多数低于成分金属
其他
性质
合金的性能并不是各成分金属性能的总和,合金具有许多优良的物理、化学及机械性能
考点二 金属材料
几种重要的合金
1.铁合金
生铁
铁、碳(含碳量2%~4.3%)
韧性好,强度低
碳素钢
强度高,韧性及加工性好
硬而脆,热处理后弹性好
钢
低碳钢
中碳钢
高碳钢
合金钢
不锈钢是最常见的一种合金钢
含碳量降低
化学成分
在碳素钢中加入铬、锰、钨、镍、钼、钴、硅等元素(种类多,性能差别大)
8.(2023下·河北保定·高二校联考期末)《天工开物》中记载:“凡治地生物,用锄、镈之属,熟铁锻成,熔化生铁淋口,入水淬健,即成刚劲。每锹、锄重一斤者,淋生铁三钱为率。少则不坚,多则过刚而折。”下列说法错误的是
A.熟铁是含碳的铁合金
B.熟铁的硬度比生铁低
C.生铁质地较硬但是韧性较差
D.生铁的熔点比熟铁的高
【答案】D
【详解】A.熟铁是含碳的铁合金,故A正确;
B.生铁含碳量较高,熟铁含碳量较低,硬度比生铁低,故B正确;
C.生铁含碳量较高,质地较硬但是韧性较差,故C正确;
D.生铁含碳量较高,熟铁含碳量较低,生铁的熔点比熟铁的低,故D错误;
分类 主要组成元素 主要特性 主要用途
硬铝 Al、Mg、Cu、Si、Mn
等(Mg 0.5%、Cu 4%、
Si 0.7%、Mn 0.5%) 密度小,强度高,具有较强的抗腐蚀能力 用于汽车、飞机、火
箭、轮船等制造业
镁铝 合金 Mg、Al 强度和硬度都比纯铝
和纯镁的大 用于火箭、飞机、轮
船等制造业
考点二 金属材料
几种重要的合金
2.铝合金
考点二 金属材料
几种重要的合金
3.新型合金
能够大量吸收氢气,并与氢气结合成金属氢化物
储氢合金
钛合金
航空航天、生物工程、电子工业
耐热合金
形状记忆合金
储氢量大,金属氢化物既容易形成,稍稍加热又容易分解,室温下吸氢、放氢速率快
作用
要求
应用
9.(2023·广东·高三学业考试)2022年10月,长征五号B运载火箭成功将“梦天”实验舱送入预定轨道。该火箭用到大量铝合金材料,下列性质与铝合金材料的航天应用无关的是
A.低密度 B.耐酸蚀 C.耐磨损 D.强韧性
【答案】B
【详解】A.铝合金材料的密度比较小,用于航天应用可以减少能源的使用,因此与其低密度的性质有关,A不符合题意;
B.铝合金与空气及酸接触时,会在金属表面产生一层致密的氧化物保护膜,阻止金属的进一步氧化,因此具有一定的抗腐蚀能力,其用于制航天器与其耐酸蚀的性质无关,B符合题意;
C.铝合金材料比其成分金属具有强的抗腐蚀能力,因此该耐磨损的性质可用于航天事业,C不符合题意;
D.铝合金材料具有一定的韧性,抗应变能力强,其强韧性可应用于作航天器,D不符合题意;
故合理选项是B。
1.铝与O2反应
在常温下Al能与空气中的O2发生反应:4Al+3O2=2Al2O3
2.铝与酸、碱的反应
考点二 金属材料
铝和氧化铝
2Al + 6H+ 2Al3+ + 3H2↑
2Al+2NaOH+6H2O=== 2Na[Al(OH)4]+3H2↑
铝与盐酸反应
铝与氢氧化钠溶液反应
Al和NaOH溶液的反应中,Al是还原剂,H2O是氧化剂,其电子转移可表示为:
10.(2023下·上海黄浦·高一上海市大同中学校考期末)按图所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列两种情况:
①用铝箔包住钠、②用铜箔包住钠。则收集产生的气体在相同条件下体积的关系是
A.二者收集气体一样多
B.①收集气体体积较大
C.②收集气体体积较大
D.无法确定
【答案】B
【详解】Na 和H2O 反应2Na+2H2O=2NaOH+H2↑,产生H2的同时产生NaOH ,NaOH可以和A1发生反应: ,故用铝箔包住Na 时产生H2的体积较大,因此①收集气体体积较大,故选B。
考点二 金属材料
铝和氧化铝
3.铝与酸、碱反应生成H2的量的关系
①等量的铝分别与足量的盐酸和NaOH溶液反应,产生H2的量相等,此时消耗HCl与NaOH的物质的量之比为3∶1
(1)量的关系
定量关系
②足量的铝分别与等物质的量的HCl和NaOH反应,产生H2的物质的量之比为1∶3,此时消耗铝的物质的量之比也为1∶3
③一定量的铝分别与一定量的盐酸和NaOH溶液反应,若 < <1,则必定有:铝与盐酸反应时,铝过量而盐酸不足;铝与NaOH溶液反应时,铝不足而NaOH过量
11.(2023上·河北张家口·高一统考期末)在航空航天领域,有“一代飞机、一代材料”的说法,新材料的应用是航空技术发展和进步的最重要推动力之一、国产C919飞机上,我国首次大范围使用第三代铝锂合金,助力C919综合减重7%。足量的铝分别与等物质的量浓度的盐酸和氢氧化钠溶液反应,放出的氢气在同温同压下体积之比为1∶2,则消耗盐酸与氢氧化钠溶液的体积比为
A.1∶3 B.1∶1 C.2∶3 D.3∶2
【答案】D
【详解】由化学方程式:2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2AlO2-+3H2↑,足量的铝分别与等物质的量浓度的盐酸和氢氧化钠溶液反应,放出的氢气在同温同压下体积之比为1∶2,则消耗盐酸和氢氧化钠的物质的量之比为3∶2,由于二者浓度相等,故消耗等物质的量浓度的盐酸和氢氧化钠溶液的体积比为3∶2,故选D。
(1)两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物
(2)Al2O3与酸、碱的反应 (典型的两性氧化物)
3.氧化铝
考点二 金属材料
铝和氧化铝
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-+3H2O===2[Al(OH)4]-
氧化铝与盐酸反应
氧化铝与氢氧化钠溶液反应
铝的生产原理
金属铝的冶炼
示意图
铝土矿
提纯
氧化铝
萤石
制备
冰晶石
石油焦
沥青焦
制备
碳素电极
电解
液态铝
铝锭
氧化铝的熔点高(2050℃),加入冰晶石(Na3AlF6)能够溶解氧化铝而又能降低其熔点,而且冰晶石在电解温度下不被分解,并有足够的流动性,有利于进行电解。
考点二 金属材料
铝土矿中提取铝工艺路线
途径一
Al2O3
Fe2O3
SiO2
Al3+、Fe3+
Fe(OH)3
AlO2-
Al(OH)3
加HCl后过
滤
SiO2
Al2O3
加NaOH后过
滤
过量
CO2
灼烧
电解
Al
Al2O3+6HCl=
2AlCl3+3H2O
AlCl3+4NaOH=
NaAlO2+3NaCl+2H2O
FeCl3+3NaOH=
Fe(OH)3↓+3NaCl
HCl+NaOH=NaCl+H2O
Fe2O3+6HCl=
2FeCl3+3H2O
Na[Al(OH)4]+CO2=Al(OH)3↓+NaHCO3
NaOH+CO2=NaHCO3
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
考点二 金属材料
金属铝的冶炼
铝土矿中提取铝工艺路线
途径一
问题探讨
不是NaHCO3而是Na2CO3。
不能,原因是Al3+与过量氨水反应生成Al(OH)3沉淀,达不到分离Al3+、Fe3+的目的。
能否用氨水代替NaOH 溶液
探讨一
探讨二
若将CO 的量改为“少量”,得到的产物还是NaHCO3吗
考点二 金属材料
金属铝的冶炼
铝土矿中提取铝工艺路线
途径二
Al2O3
Fe2O3
SiO2
AlO2-、SiO3-
H2SiO3
Al3+
Al(OH)3
NH3 H2O
加NaOH后过
滤
Fe2O3
Al2O3
加HCl后过
滤
灼烧
电解
Al
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
SiO2+2NaOH
=NaSiO3+H2O
Na2SiO3+2HCl
=H2SiO3↓+2NaCl
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
NaOH+HCl=NaCl+H2O
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
HCl+NH3·H2O=NH4Cl+H O
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
考点二 金属材料
金属铝的冶炼
铝土矿中提取铝工艺路线
途径一
问题探讨
不合适,因为Al(OH)3能溶于NaOH。
不合适,因为过量CO2与Na[Al(OH)4]、Na2SiO3反应生成Al(OH)3和H2SiO3沉淀,达不到分离SiO2和Al2O3的目的。
能否将将盐酸改为CO2
探讨一
探讨二
将氨水改为“NaOH溶液”合适吗
AlCl3是共价化合物,其熔融状态不导电,不能电解制铝。
探讨三
冶炼金属铝能否用氯化铝代替氧化铝
考点二 金属材料
金属铝的冶炼
12.(2023上·广东中山·高一中山市华侨中学校考阶段练习)某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、Al2O3、CuO和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al、绿矾等。回答下列问题:
【已知:焙烧主要除去可燃性有机物】
(1)灼烧需要的主要仪器有 。操作Ⅲ的名称是 。
(2)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是 。
(3)碱浸时发生反应的化学方程式为 、 。
【详解】(1)灼烧需要的主要仪器有坩埚(酒精灯、三脚架、泥三角、坩埚钳)。操作Ⅲ为从溶液得到晶体,名称是蒸发浓缩、冷却结晶、过滤。
(2)操作Ⅰ、Ⅱ为过滤,使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是漏斗。
(3)铝、氧化铝均可以和氢氧化钠反应,则碱浸时发生反应的化学方程式为
12.(2023上·广东中山·高一中山市华侨中学校考阶段练习)某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、Al2O3、CuO和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al、绿矾等。回答下列问题:
(4)滤液Ⅰ与试剂b发生反应的化学方程式为 。
(5)制取的绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体8.22g溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测晶体中n(Fe2+)/ n(Fe3+) 。
(4)滤液Ⅰ与试剂b为偏铝酸根离子和二氧化碳的反应,发生反应的化学方程式为
2Na + 2H2O === 2NaOH + H2↑
物质的量在化学方程式计算中的应用
化学方程式中化学计量数与相关物理量的关系
2
∶
∶
∶
2
2
1
化学计量数之比:
2 mol
物质的量之比:
∶
∶
∶
2 mol
2 mol
1 mol
2 NA
扩大NA倍:
∶
∶
∶
2 NA
2 NA
1 NA
∶
∶
∶
扩大6.02×1023倍:
2×6.02×1023
2×6.02×1023
2×6.02×1023
1×6.02×1023
2 mol
STP气体体积之比:
∶
∶
∶
2 mol
2 mol
1 mol
考点二 金属材料
化学方程式中各物质的化学计量数之比等于其_________之比,等于其__________之比。
粒子数目
物质的量
体积
物质的量在化学方程式计算中的应用
化学方程式中化学计量数与相关物理量的关系
对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其_____之比。
结论
考点二 金属材料
物质的量在化学方程式计算中的应用
物质的量应用于化学方程式计算的基本步骤
NO.1
NO.2
NO.3
NO.4
设未知量,统一规定符号,如物质的量(n)
写出反应的化学方程式或离子方程式,注意配平
找出已知量与未知量的关系,并写在对应物质的正下方
列比例式,求解
NO.5
检查无误后,写出简明答案
考点二 金属材料
【例1】5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况的体积是多少?
设:生成标准状况下氢气的物质的量为n(H2)
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 3
0.2 mol n(H2)
n(H2)=0.3 mol
答:生成标准状况下氢气的体积是6.72 L。
V(H2)=n(H2)·Vm
=0.3 mol×22.4 L·mol-1
=6.72 L
题型一 已知量、未知量均以物质的量计算
【例2】医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成氧化铁,则需要消耗标况下氧气的体积为多少?
设:需要消耗标况下氧气的体积为V(O2)
由反应方程式
4Fe + 3O2===2Fe2O3
4×56 g 3×22.4 L
56 g V(O2)
答:需要消耗标况下氧气的体积为16.8 L。
题型二 已知量、未知量单位不一致的计算
设未知量时不带单位,已知量和未知量单位统一;
化学方程式要书写正确。要注意配平、化学方程式的完整(注明反应条件、气体和沉淀的符号);
相对分子质量要计算正确,且需乘化学式前面的系数;
已知量和未知量的位置要写对。
解题步骤规范,过程完整。
注意事项
物质的量在化学方程式计算中的应用
考点二 金属材料
方法一:关系式法——解答连续反应类型计算题的捷径
化学计算中的常用方法
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
根据化学方程式确定关系式
根据原子守恒确定关系式
考点二 金属材料
【例3】把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,那么参加反应的CO的质量是 g。
2.8
解析 (1)根据化学方程式确定关系:
CO2+Ca(OH)2===CaCO3↓+H2O
则关系式为3CO~3CO2~3CaCO3
即CO~CaCO3
(2)利用关系式进行计算
CO ~ CaCO3
28 100
m(CO) 10 g
m(CO)=2.8 g
常用方法一 关系式法
方法二:守恒法——质量守恒、电荷守恒、电子守恒
化学计算中的常用方法
A
反应前后元素种类、质量、原子个数不变
B
还原剂失电子总数=氧化剂得电子总数
考点二 金属材料
【例4】 4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
10.6
解析 钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
常用方法二 守恒法
【例5】用1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-2 mol的XO4-还原,已知氧化产物为SO42-,则元素X在还原产物中的化合价为 ___。
+4
解析 氧化还原反应中得失电子总数相等,设元素X在还原产物中的化合价为x,则有:
1 mol·L-1×0.03 L×(6-4)=2×10-2 mol×(7-x),
解得x=+4。
常用方法二 守恒法
方法三:差量法——质量差值法、体积差值法
化学计算中的常用方法
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。差量法就是借助这种比例关系求解的方法。
Δm
Δn
ΔV
考点二 金属材料
【例6】把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
28 g
解析 Fe+CuSO4===FeSO4+Cu Δm
56 g 64 g 64 g-56 g=8 g
m(Fe) 4 g
常用方法三 差量法
方法四:方程组法——两个已知量求解混合物中两种物质的未知量
化学计算中的常用方法
一般方程组法用于解决两种物质的混合物计算,一般读题时能找到两个已知量时,均可以利用二元一次方程组进行求算未知量。
考点二 金属材料
【例7】把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。
消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol
(2)该混合物中铝、铁的物质的量。
设Al、Fe的物质的量分别为x、y。
2Al + 6HCl===2AlCl3+3H2↑
2 6
x 3x
解得:x=0.02 mol,y=0.01 mol
即n(Al)=0.02 mol;n(Fe)=0.01 mol
Fe + 2HCl===FeCl2+H2↑
1 2
y 2y
常用方法三 方程组法
THANKS
